Что такое паллиативная операция при раке желудка

После удаления новообразования на пораженные раковыми клетками участки оказывают воздействие посредством химиотерапии. Паллиативные операции особенно актуальны в тех случаях, когда опухоль неоперабельна и возможно только сокращение ее массы и объема, а также при наличии большого количества метастазов или невозможности удаления источника заболевания. Паллиативная операция при раке желудка является вынужденной мерой, которую рекомендуют для сохранения жизнедеятельности пациента и для создания для него максимально комфортных условий.
Симптомы, при которых рекомендуют паллиативную операцию
Паллиативное хирургическое вмешательство выполняется в том случае, когда удалить новообразование или орган не представляется возможным. Это может быть связано с огромными размерами опухоли, распространением метастазов или тяжёлым общим состоянием пациента. В некоторых случаях паллиативные операции необходимы для того, чтобы обеспечить жизнедеятельность организма.
Чаще всего к процедурам такого рода прибегают, когда прогноз лечения оказывается неутешительным, а болезнь продолжает прогрессировать. Онколог делает вывод о необходимости паллиативного вмешательства при раке желудка, когда новообразование поражает близлежащие лимфоузлы, ткани и органы, и в них прорастают метастазы. При таких условиях хирургическое вмешательство проводится во избежание ситуаций, которые могут угрожать жизни пациента:
перфорации желудочной стенки;
при поражении печени и желчевыводящих путей.
Необходимость паллиативной операции при раке желудка становится очевидной, когда пациент начинает переживать мучительные боли, открывается кровотечение или происходит перфорация желудка, начинается рвота или пища не проходит в двенадцатиперстную кишку.
Паллиативные операции в зависимости от характера вмешательства можно разделить на три категории:
гастроэнтероанастомоз – процедура, при которой соединяется здоровая часть желудка и тонкая кишка и таким образом восстанавливается деятельность пищеварительной системы;
гастростомия, в ходе которой хирург открывает желудочную стенку и создает отверстие для проведения питания.
В реальности невозможно предсказать, насколько эффективной окажется паллиативное лечение. Оно может сократить страдания больного и воздействие опухоли на организм, но точно сказать, насколько будут отсрочены негативные последствия в случае прогрессирования заболевания, невозможно. Примером такой ситуации становятся случаи, когда опухоль имеет достаточно крупные размеры и метастазы распространились в отдаленные ткани.
Подготовка к паллиативному лечению и реабилитационный период
Паллиативная операция требует отдельного подхода, особенной сосредоточенности и концентрации внимания врачей не только из-за сложности, но и ввиду того, что она проводится на одной из последних и серьезных стадиях заболевания. В таких ситуациях любое неверное движение может привести к летальному исходу.
Паллиативная операция при раке желудка - крайне серьезная процедура, независимо от того, какова ее цель. Как и любое другое хирургическое вмешательство в деятельность организма, эта операция требует психологической поддержки и полного обладания всей информацией, касающейся ее выполнения. Очень важно, чтобы хирург не просто рассказал об алгоритме действия, но тактично объяснили пациенту важность операции, ее влияние на ход заболевания и озвучил возможные последствия.
В качестве физиологической подготовки проводится общеукрепляющее лечение, в которое включает насыщение организма белком, солевыми и коллоидными растворами, а также витаминами. Пациентам также вводятся вещества с высокой энергетической ценностью. Существуют специальные методики физиологической подготовки, которые позволяют снизить потерю крови при операции. В качестве подготовительных мероприятий может применяться химическая или лучевая терапия для уменьшения размеров опухоли.
Учитывая, что после операции пациент на несколько дней лишается возможности питания орально, чтобы дать тканям возможность восстановиться, необходимую организму жидкость и питание доставляют путем капельниц. Паллиативные операции по длительности могут занимать от одного до нескольких часов в зависимости от степени сложности. При их проведении используется общая анестезия. Особенного внимания при паллиативной операции на желудке требует состояние пациента при погружении в сон и при выходе из него, так как ослабленный организм может неожиданно среагировать на анестезию.
В ходе хирургического вмешательства врач делает разрез передней брюшной стенки, исследует пораженные ткани, изымает часть опухоли, ее целиком или удаляет орган в зависимости от целей процедуры и согласия пациента и его родственников. Хирург обследует брюшную полость на предмет наличия метастазов в отдаленных органах и тканях, по наличию которых он может сделать те или иные прогнозы. Паллиативная операция при раке желудка необходима не для того, чтобы вылечить пациента, так как на той стадии заболевания, на которой к ней прибегают, это почти невозможно, а для того, чтобы облегчить его состояние и создать необходимые условия для жизнедеятельности организма.
По завершении операции хирург обрабатывает рану, накладывает швы синтетическими нитями, и закрепляет ткани для скорейшего выздоровления. Для восстановления после лечения и исключения возможных инфекционных заболеваний пациенту прописывают кислород, антибиотики и кардиологические препараты. После операции многие люди испытывают проблемы с дыханием, так как травмированные ткани не позволяют пациенту полноценно дышать или чихать. Для того чтобы снять этот дискомфорт, врачи рекомендуют дыхательную гимнастику.
Пациентам, пережившим операцию при раке желудка, назначают особую диету, которая основана на балансе продуктов и содержащихся в них веществ. Питание должно происходить небольшими порциями, состоять из предписанной пищи и контролироваться по времени. После паллиативной операции при раке желудка пациенту следует выполнять некоторые рекомендации:
Носить абдоминальный бандаж. Пациенту показано ношение специального пояса из эластичной ткани, который позволит поддержать мышцы живота.
Отказ от физических нагрузок, которые могут привести к появлению грыжи.
По возможности отказ от чихания и кашля, которые также могут привести к послеоперационной грыже.
Пациенту рекомендуют внимательно следить за деятельностью кишечника и регулярностью стула. Необходимо избегать возможных запоров и при и малейшем подозрении обратиться к врачу. Запоры вызывают сильную нагрузку области живота и также способствуют формированию грыжи. Они также могут вызывать развитие рефлюкс-реакции вроде гастрита, воспаления слизистой и обратных забросов переработанной пищи.
После удаления желудка или части опухоли проводится химио- или лучевая терапия, которая позволит сократить риски рецидива и обострения онкологического заболевания.
Пациентам категорически запрещаются солнечные ванны, физиотерапевтические процедуры , а также баня и сауна.
Строжайшая диета подбирается онкологом совместно с диетологом и должна тщательно соблюдаться. Это поможет пищеварительной системе чувствовать себя комфортно и постепенно восстанавливать свою работу.
Эффективность лечения злокачественных заболеваний желудка зависит от стадии течения заболевания, гистологической структуры опухоли, ее распространения и своевременности начатого лечения.
В случае лечения злокачественной опухоли на ранних стадиях выживаемость пациентов колеблется в пределах 90%, десятилетняя – 75%. К сожалению, в 50 % случаев рак желудка диагностируют уже на поздних стадиях. Вследствие чего радикальная операция показана лишь в 30-40 % всех случаев заболевания.
В случае неоперабельных опухолей желудка врачи применяют паллиативную операцию, направленную не на лечение новообразования и его метастазов, а на улучшение качества жизни больного. Паллиативная операция позволяет стабилизировать состояние пациента и продлить ему жизнь.
Как правило, паллиативные операции при раке желудка позволяют уменьшить токсическое влияние на организм опухоли и снизить массу новообразования. Кроме того, в ходе проведения операции устраняются кровотечения и непроходимости, позволяющие пациенту жить с метастазами.
В большинстве случаев паллиативная операция желудка является единственным способом улучшить качество жизни пациента.
Паллиативные операции рака желудка: показания
Проведение подобных операций рекомендовано при следующих состояниях:
- поздней IV стадии рака желудка, в случае которой наблюдается поражение соседних органов, лимфатических узлов, а также имеются отдаленные метастазы в ткани и органы;
- при желтухе, возникающей при поражении печени и желчевыводящих путей;
- при перфорации стенок желудка, кровотечениях из опухоли, стенозе, невозможности нормального процесса питания;
- в случае сдавливания метастазами сосудов и протоков.
1. Операции, направленные на улучшение общего состояния больного без удаления очагов поражения, а также нацеленные на улучшение питания. К первому типу операций относят:
- гастростомию;
- гастроэнтероанастомоз;
- еюностомию.
2. Ко второму типу относят операции, проводимые с целью удаления метастазов и первичных очагов новообразований. К ним относят:
- паллиативную гастрэктомию;
- паллиативную резекцию;
- удаление метастазов.
Паллиативная операция желудка: виды
- Гастроэнтеростомия. Целью операции является создание соустья между желудком и тощей кишкой, путем наложения желудочно-кишечного анастомоза. Чаще выполняют позадиободочную гастроэнтеростомию, в редких случаях – переднюю впередиободочную. Такой вид оперативного вмешательства применяют в случае неоперабельной опухоли выходного отдела желудка.
- Гастростомия. Проводят при неоперабельном раке проксимального отдела пищевода и желудка, сопровождаемом нарушением проходимости пищи. В большинстве случаев проводят гастростомию по Витцелю и Кадеру.
- Энтеростомия. Проводят наложение кишечного свища с целью обеспечения проходимости пищи по пищеварительному тракту. Также операцию проводят в случае невозможности наложения гастростомы и обширном поражении желудка. В подавляющем большинстве случаев свищ создают в начальном отделе кишечника.
Паллиативные операции при раке желудка: подготовка и послеоперационный период
Перед проведением паллиативных операций при раке желудка пациенты находятся в тяжелом состоянии. В обязательном порядке требуется проведение предоперационной подготовки. Она включает в себя:
- курс общеукрепляющей терапии;
- инфузионную терапию коллоидными и солевыми растворами, а также белковыми препаратами.
В первое время после проведения операции больному следует отказаться от приема воды и пищи. Необходимое количество питательных веществ и жидкости вводят пациенту внутривенно. Также назначается кислород, прием антибиотиков, сердечных препаратов и обезболивающих.
Паллиативные операции при раке желудка включают в себя симптоматические операции, временно облегчающие состояние пациентов, и направленные на устранение тех или иных тяжелых или опасных для жизни симптомов онкологического заболевания, а также циторедуктивные операции, которые существенно уменьшают размер первичной опухоли и метастазов, уменьшая степень опухолевой интоксикации.
В каких ситуациях проводятся паллиативные операции при раке желудка?
В лечении рака желудка главная роль до сих пор принадлежит хирургическому методу, однако, на поздних стадиях рака желудка при распространенных поражениях окружающих тканей с вовлечением регионарных лимфатических узлов и наличием отдалённых метастазов, тяжелом состоянии пациента, проведение радикальных операций невозможно. Радикальные операции при раке желудка (субтотальная резекция желудка, гастрэктомия, проксимальная резекция) – это всегда обширные операции, которые помимо вмешательства собственно на желудке сопровождаются удалением большого и малого сальника, а во время комбинированных операций одновременно удаляют полностью или частично пораженные раковым процессом соседние органы (поджелудочную железу, печень, поперечно-ободочную кишку, селезенку).
Радикальная операция при раке желудка является серьезным хирургическим вмешательством, которое требует существенной компенсации функций организма. Многим больным отказывают в операции из-за высокой степени операционного риска. Между тем при раке желудка на 4-й стадии на фоне специфической терапии 5-летняя выживаемость достигает 15-20%, а с развитием высокотехнологичных методов лечения можно рассчитывать и на большее продление жизни пациентов. Поэтому сейчас активно разрабатываются хирургические методики, позволяющие облегчить состояние и значительно улучшить качество жизни пациентов с раком желудка, радикальная операция у которых невозможна.
Выполнение паллиативных операций у пациентов с раком желудка делают возможным проведение лучевой и химиотерапии, введение индивидуальных противоопухолевых вакцин и моноклональных антител (SU11248), что позволяет добиться стойкой стабилизации течения заболевания и увеличить ожидаемую продолжительность жизни.
Когда необходимо паллиативное хирургическое вмешательство?
Диагноз 4 стадии рака желудка устанавливается при инвазивном поражении опухолью соседних органов, близлежащих лимфатических узлов, или при наличии метастазов в отдаленные органы и ткани. Хирургическое лечение в таких ситуациях применяется преимущественно для лечения жизнеугрожающих состояний – кровотечения из опухоли, прободения (перфорации) стенки желудка, стенозе желудка с развитием тяжелых водно-электролитных расстройств и невозможностью питания, желтухе при поражении опухолью печени и желчевыводящих путей.
В хирургическом стационаре лечение начинают с попытки остановки кровотечения с помощью кровоостанавливающих средств и установке зонда Блэкмора для прекращения желудочного кровотечения. Одновременно начинается инфузия препаратов плазмы крови с целью профилактики ДВС-синдрома, а при массивной кровопотере также проводится переливание эритроцитарной массы. Малоинвазивные вмешательства выполняются с целью поиска источника кровотечения и точечной ликвидации кровотечения, для чего проводится эндоскопическое вмешательство, позволяющее выполнить клипирование и прошивание кровоточащего сосуда, провести электро- или плазменную коагуляцию. Все эти методики остановки желудных кровотечений при раке желудка и других осложнениях онкологических заболеваний используются в Европейской онкологической клинике.
При неэффективности предпринятых мер по устранению желудочного кровотечения проводится экстренная хирургическая операция.
Желтуха - прямое противопоказание для проведения плановых химио- и лучевой терапии. Единственным радиальным методом снижения высокого уровня билирубина является восстановления оттока желчи из печени путем проведения рентгенохирургического вмешательства. Дренирование позволяет наладить временный отток наружу на поверхность кожи (наружный дренаж) или как наружу, так и в естественном направлении в кишечник (наружно-внутренний дренаж). В некоторых случаях, когда опухолевое сдавление изолирует несколько разных сегментов желчного дерева, например, как левую, так и правую доли печени, может потребоваться установка нескольких дренажей.
После снижения уровня билирубина до нормальных величин и уменьшения явлений холангита дренаж заменяется на стент или стенты – специальные эндопротезы, которые поддерживают желчный проток в открытом состоянии. Выполнение одномоментного дренирования и стентирования проводится только по строгим медицинским показаниям, чаще всего эти операции разделены по времени. В целом, дренирование и стентирование желчных протоков существенно улучшает качество жизни больных.

У 10-15% пациентов раком желудка развивается требующий хирургического вмешательства стеноз (сужение просвета) кардиального или пилорического отдела желудка. Симптомами этого состояния служат затруднение при проглатывании пищи при поражении верхних (кардиальных) отделов, тяжесть, чувство переполнения и рвота давно съеденной пищей при вовлечении перехода из желудка в 12-перстную кишку(пилоростеноз).
Стеноз при раке желудка чреват развитием опасных для жизни водно-электролитных расстройств и усугублением кахексии (истощения). Для восстановления прохождения пищи по желудочно-кишечному тракту, коррекции и профилактики водно-электролитных нарушений при иноперабельном раке желудка со стенозом пилорического отдела проводят операцию гастроэнтеростомии, т.е. наложение соустья между желудком и тощей кишкой.
C целью коррекции стеноза при неоперабельном раке проксимального (кардиального) отдела желудка c переходом на пищевод при нарушении прохождения пищи может использоваться стентирование желудка – установка специальных стентов, которые восстанавливают нормальное прохождение пищи через желудок в кишечник. Альтернативным способом хирургического лечения является наложение гастростомы – гастростомия - формирование отверстия в желудке и передней брюшной стенке, для обеспечения питания больного через зонд. В результате уменьшаются симптомы интоксикации и обеспечение питание больного.
Операции раке с метастазами
Рак желудка в большинстве случаев довольно рано дает метастазы. Из числа наиболее часто поражаемых метастазами органов следует указать печень, поджелудочную железу, легкие, яичники (метастаз Крукенберга), а также брюшину, которая покрывается множественными раковыми узелками, что сопровождается выпотом жидкости в брюшную полость (асцитом). Помимо того, что метастазы могут приводить к развитию острых осложнений, требующие экстренной хирургической помощи (сдавление нижней полой вены), они существенно нарушают функционирование пораженных органов, значительно ухудшают общее состояние, нередко сопровождаясь нестерпимыми болями, требующими постоянного обезболивания.
Как в ведущих, в т.ч. зарубежных клиниках, так и в Европейской онкологической клинике для лечения метастазов рака желудка, в частности в печень, используется чрескожная чреспеченочная радиочастотная абляция (РЧА) – методика, вызывающая контролируемый асептический некроз метастатического очага, без повреждения окружающих тканей. Результатом такого некроза становится полная гибель опухолевых клеток метастаза. При ее выполнении, которое проводится под общим обезболиванием, под ультразвуковым контролем сквозь кожу вводится монополярный радиоволновой электрод, разогревающий именно нужный участок печени и вызывающий локальный некроз метастаза. РЧА может также проводится во время открытой операции на желудке и органах брюшной полости. РЧА метастазов печени дает возможность надолго продлить жизнь пациента без возникновения рецидивов. У нас накоплен опыт неодократного проведения РЧА для полного устранения множества мелких метастазов печени, а также в случае появления новых метастатических очагов.
В отделении интервенционной онкологии и эндоваскулярной хирургии Европейской онкологической клиники выполняется химиоэмболизация артерий, питающих крупные метастазы, преимущественно в печени, с целью уменьшения негативного влияния метастазов рака на организм пациента. Прекращение кровотока в опухоли уже само по себе оказывает лечебное воздействие. Одновременная доставка в ткань опухоли химиопрепаратов разрушает ее изнутри, избавляя пациента от токсического действия лекарства на весь организм в целом.
В мире используется также такая методика лечения метастазов печени, как радиоэмболизация метастазов рака желудка в печень. Она проводится под контролем ангиографа с помощью внутрисосудистой селективной катеризации сосудов печени. В сосуд, питающий опухоль, вводятся эмболизирующие частицы с радиоактивным изотопом иттрий-90, которые в последующие после операции 64 часа продолжают изнутри воздействовать на опухоль. К сожалению, в нашей стране данная методика не доступна. Для этих целей мы направляем пациентов в клиники Израиля и Германии.
Малотравматичные резекции печени, включая радиочастотную аблацию метастазов рака в печень, в нашей клинике проводятся учеником профессора, д.м.н. Юрия Ивановича Патютко, заместителем главного врача клиники, к.м.н. Андреем Львовичем Пылёвым. Кроме того, наиболее сложные операции выполняются самим Юрием Ивановичем Патютко, руководителем хирургического отделения опухолей печени РОНЦ им. Н. Н. Блохина.
При распространении опухолевого процесса – диссеминации метастазов опухоли желудка по брюшине (т.н. канцероматоз брюшины) может происходить накопление жидкости в брюшной полости. Это состояние называется асцит, оно довольно мучительно для пациента. В основном, оно обусловлено механическим препятствием обратному всасыванию жидкости из брюшной полости, в норме происходящему очень интенсивно (до 1,5 л в сутки) и закупоркой лимфатических сосудов. При метастатическом поражении паренхимы печени, в основе развития асцита лежит, кроме того, препятствие венозному оттоку крови.
Когда жидкости становится больше 5 л и больше сдавление внутренних органов, нарушение экскурсии диафрагмы, повышение внутрибрюшного давления приводят к смещению органов вверх, в грудную полость, вызывают дыхательную недостаточность и нарушение нормального крово- и лимфотока. При этом создаются благоприятные условия для быстрого и обширного метастазирования опухоли. Однако одномоментное удаление большого количества асцитической жидкости может привести к возникновению тяжелых осложнений, поэтому в Европейской онкологической клинике для дренирования асцитов применяются современные методики лапароцентеза с использованием специальных помп для постепенного и дозированного удаления серозной жидкости.
Параллельно проводится инфузионная терапия для коррекции водно-электролитных нарушений, инфузии альбумина, коллоидов и объёмо-замещающих растворов. Для предотвращения возникновения асцита, после первичной эвакуации асцитической жидкости, мы активно используем цитостатические препараты, т.е. лекарственные вещества, способствующие уменьшению объема выпота и более медленному накоплению жидкости, в том числе внутриполостное введение лекарственных препаратов. Внутриполостная химиотерапия эффективна в 40-60% случаев и позволяет сохранить положительный эффект брюшинной пункции на срок более 2 месяцев. Лапароцентез производится под ультразвуковой навигацией и при необходимости завершается установкой дренажа для длительной эвакуации жидкости.
Применяемые в нашей клинике катетеры не ограничивают естественную двигательную активность и обеспечивают возможность возвращения пациента к привычной деятельности. При рефрактерных и массивных асцитах возможно проведение паллиативных операций (установка перитонеовенозного шунта, частичная деперитонизация стенок брюшной полости, оментогепатофренопексия и другие). При таком комплексном подходе процедуру лапароцентеза требуется делать в 2-3 раза реже, чем при классическом проведении пункции брюшинной полости.
Насколько оправданы вмешательства в 4 стадии рака желудка, ведь они не приводят к излечению?
Философия оказания медицинской помощи в Европейской онкологической клинике заключается в том, что пациенту надо стараться помочь всегда. Человеческая жизнь бесценна, и ее нужно продлить на максимально больший срок при поддержании максимально возможного качества жизни. Вмешательства на поздней стадии онкологического заболевания, включая 4-ю стадию рака желудка, должны предприниматься, поскольку они позволяют существенно улучшить качество жизни пациентов, уменьшить интоксикацию и выраженность болевого синдрома, продлить жизнь и возможность общения с родными и близкими на существенный срок. Например, проведение перитонэктомии в сочетании с гипертермической внутрибрюшной химиотерапией у больных с канцероматозом брюшины при раке желудка позволяет увеличить продолжительность жизни до 18 месяцев. При единичных изолированных метастазах рака желудка в печень ее резекция позволяет достичь 5-летней выживемости у 18–34% больных.
Для лечения 4 стадии рака желудка в отделении паллиативной и симптоматической терапии используются все возможные варианты лечения онкологических больных: все виды химиотерапии, лучевая терапия, которая позволяет уменьшать болевой синдром, а также выполняются паллиативные операции. С целью облегчения введения препаратов возможна имплантация венозных и артериальных инфузионных порт-систем для химиотерапии, проводится регионарная интраартериальная инфузия химиопрепаратов, местная терапия.
— Необходима ли какая-либо особая подготовка для проведения паллиативных операций?
Безусловно, из-за тяжести болезни наши пациенты требуют особенно тщательной подготовки и ведения послеоперационного периода. Обычно предоперационная подготовка заключается в общеукрепляющем лечении, инфузионной терапии белковыми препаратами, солевыми и коллоидными растворами, витаминами, в применении тонизирующих средств. Существуют методики предоперационной инфузионной подготовки, позволяющие уменьшить кровопотерю в процессе операции, они активно используются в нашей клинике. Как правило больные нуждаются в гипералиментации – введении питательных веществ высокой энергетической ценности.
В послеоперационном периоде на несколько дней исключают прием пищи и воды через рот. Необходимые количества жидкости и питательных веществ восполняют путём внутривенных вливаний питательных растворов с инсулином, витаминами, а также крови и белковых препаратов. Пациенту назначают антибиотики, сердечные средства, наркотики и кислород. Важным компонентом является тщательный уход, дыхательная гимнастика, внимательное наблюдение за течением послеоперационного периода. В дальнейшем огромное значение имеет правильное сбалансированное дробное питание, приём необходимых препаратов и уход за больным.
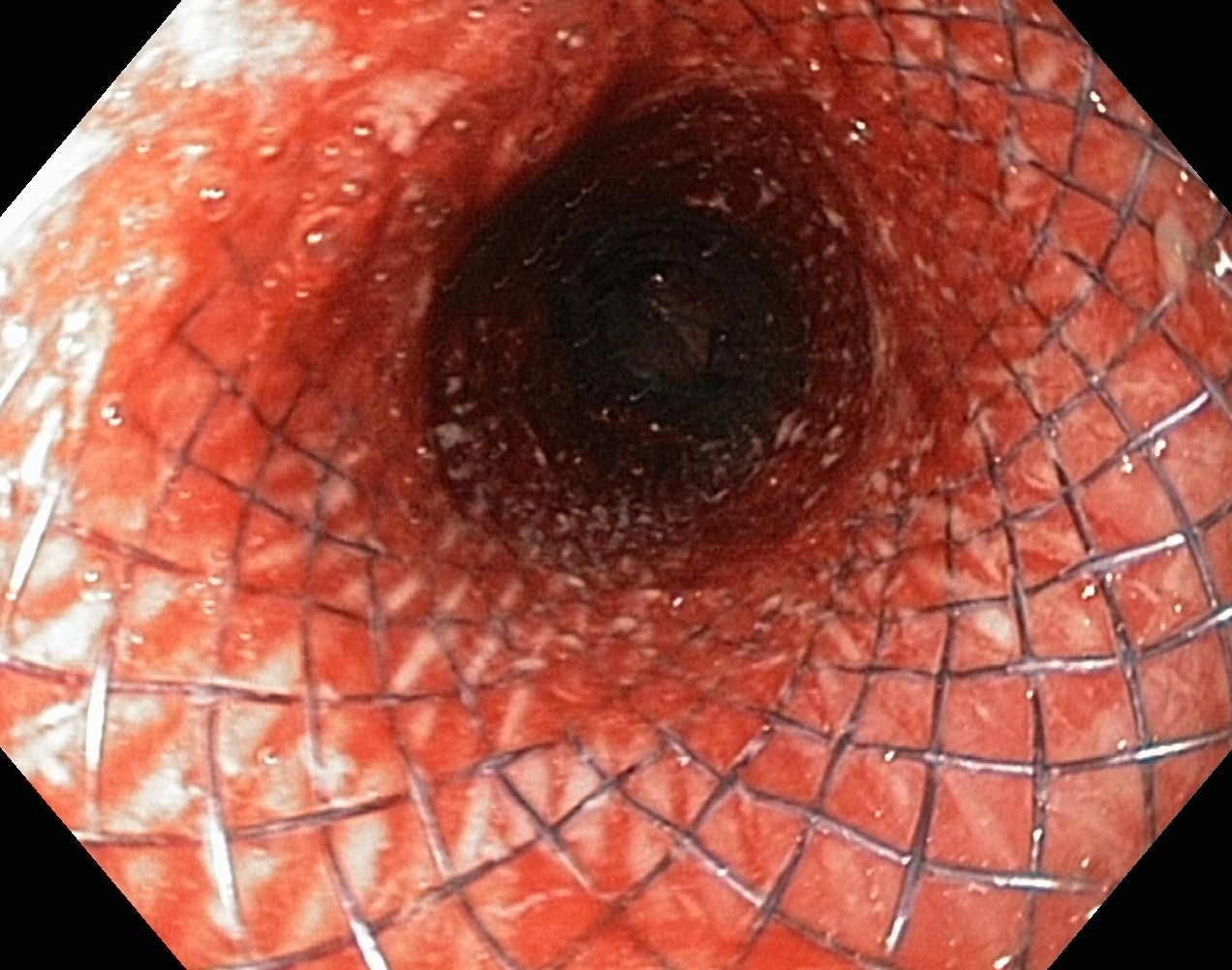
Спорим, вы не угадаете, что это? Это стент в просвете пищевода
Не каждый из тех, кто кашляет весной 2020 – болен COVID-19. Есть пациенты, кому еще хуже: они задыхаются, и им не помогут 2 недели в инфекционной больнице. У них рак. Рак легких, или молочной железы, или яичников, или, возможно, лимфома.
При многих опухолях частое осложнение – скопление жидкости в плевральной полости (вокруг легких). Ее бывает много, до нескольких литров (!) – и она сдавливает легкие, мешая им работать. Это называется гидроторакс.
Заметьте, хирург позволяет человеку жить дальше, хотя не действует на главную причину беды: злокачественную опухоль. Это один из примеров паллиативной хирургии.
Паллиативная хирургия – это такая, которая не устранит главную проблему – раковую опухоль, не вылечит человека полностью. Но паллиативная операция, вероятно, продлит ему жизнь и заметно повысит ее качество: он сохранит способность к самообслуживанию и социальную адекватность, сможет сам передвигаться, есть или ходить в туалет, перестанет мучиться от боли.
Почему бывает нельзя просто вырезать опухоль?
Хирургическое лечение в онкологии многие считают только радикальным: когда все очаги поражения можно просто иссечь. А иначе ведь – зачем и связываться с травматичными вмешательствами и вообще впустую размахивать скальпелем? Это распространенный стереотип.
Если, например, кроме опухоли в молочной железе у женщины метастазы в печени, легких и позвоночнике – придется удалять слишком много тканей из разных органов сразу, и риск умереть от такой операции у нее будет выше, чем от прогрессирования болезни.

Органы, куда чаще всего метастазирует рак молочной железы
Но это не значит, что таким людям ничем нельзя помочь! Паллиативная помощь может значительно облегчить состояние пациента и улучшить качество его жизни, а иногда и продлить ее – не прибегая к радикальному лечению.
Паллиативная медицина чаще всего использует химио- и лучевую терапию. К сожалению, это отложилось в головах у многих российских врачей слишком плотно: они не готовы применять хирургию, когда заранее понимают, что оставят опухоль или часть ее внутри пациента. Хотя в онкологических отделениях по миру до 20% всех операций – паллиативные.
И их становится больше. Показания к хирургическому лечению на любой стадии рака – даже при распространённом процессе – расширяются. Появляются новые малоинвазивные способы вмешательства – они снижают риски для пациента и после них легче восстановиться.
Паллиативная хирургия становится частью комплексного лечения. У нас этому очень помогает налаженное междисциплинарное взаимодействие. Когда хирург, онколог, химиотерапевт, врач лучевой терапии и реаниматолог собираются вместе, они не тянут одеяло на себя (как вы могли подумать), а находят оптимальную лечебную тактику, чтобы избавить пациента от мучительных симптомов максимально безопасно, и насколько возможно долго.
На сегодня успехи таковы. С помощью паллиативной операции можно:
- Уменьшить размер опухоли, чтобы появилась возможность действовать на нее химиотерапевтическими методами.
- Снизить опухолевую интоксикацию.
- Убрать тягостные симптомы.
- Остановить/предотвратить внутреннее кровотечение.
- Уменьшить боли.
- Реконструировать поврежденную часть тела и помочь реабилитации после радикальных методов лечения.
Не можем удалить – уменьшим. Циторедуктивные операции
а) продлить пациенту жизнь,
б) убрать тягостные симптомы,
в) предотвратить жизнеугрожающие состояния.
Часто опухолевые очаги нельзя удалить целиком. Например, опухоль слишком крупная – вместе с ней пришлось бы удалять жизненно важный орган или очень большой его участок. Или поражены слишком много систем организма – множественные отдаленные метастазы. Или очаги метастазирования мелкие, до микроскопического размера, зато их тысяча – как при канцероматозе брюшины.
Хотя в таких случаях часто есть возможность удалить не всю, но максимально возможную часть опухоли. Это уменьшит тяжелые симптомы, вызванные жизнедеятельностью раковых клеток. А главное – не остановит, но замедлит распространение злокачественного процесса, позволит пациенту выиграть время, даст больше шансов на то, что химио- и лучевая терапия подействуют – они работают тем эффективнее, чем меньше объем опухолевой ткани в организме.
Циторедуктивные операции становятся частью комплексного лечения. Мы уже рассказывали про HIPEC, гипертермическую внутрибрюшинную терапию, которая помогает пациентам на последних стадиях рака яичников, желудка, различных отделов кишечника, печени. Циторедуктивная операция занимает в процедуре HIPEC первое место: сначала хирург удалит все очаги, которые сможет найти, а затем брюшную полость пациента обработают горячим химиопрепаратом. После такой операции люди могут жить годы вместо месяцев, а в некоторых случаев – добиться ремиссии.
На этом видео можно посмотреть, как проходит циторедуктивная операция при канцероматозе брюшины. Осторожнее, если вы не любите заглядывать людям слишком глубоко внутрь!
Одна из наших пациенток, которой удаляли аденокарциному яичников, выполняет циторедуктивную операцию в сочетании с HIPEC уже 5-й раз подряд – и это 5 лет жизни.
Кроме рака яичников, циторедуктивные операции, как один из этапов лечения, показывают улучшение показателей по выживаемости при колоректальном раке, раке желудка, аденокарциноме аппендикса, саркомах мягких тканей – даже на тех стадиях, когда опухоль уже начала метастазировать.
Циторедуктивная операция нередко оказывается способом избежать худшего в ситуации, когда пациенту угрожают серьезные, опасные осложнения. Например, такое вмешательство помогает предотвратить перфорацию кишечника или сильное кровотечение из-за распада опухоли.
Эти меры, хотя и являются паллиативными – не дают пациенту уйти из жизни раньше времени.
Поэтому мы стараемся всегда найти максимум возможных вариантов лечения и следить за прогрессированием, даже когда невозможно выполнить радикальное вмешательство или опухоль плохо реагирует на химиотерапию.
Не можем удалить причину – режем следствия. Симптоматические операции
Симптоматические паллиативные хирургические вмешательства вообще не затрагивают опухоль, в отличие от циторедуктивных операций, но борются с опасными последствиями для пациента, которые вызывает рост злокачественного новообразования.
Например, про торакоцентез при скоплении жидкости в грудной клетке мы описали в самом начале статьи. Но не реже происходит скопление жидкости в брюшной полости – асцит. Это обычное осложнение при раке желудка, яичников, колоректальном раке и др.
При асците (скоплении жидкости в брюшной полости) объем жидкости может достигать 10 и более литров. Пациент чувствует себя очень плохо: одышка, нарушение в работе ЖКТ и внутренних органов. Чтобы облегчить это состояние, выполняют лапароцентез – прокол в стенке брюшной полости, чтобы вывести жидкость. Если жидкость скапливается быстро, устанавливают дренаж – он выводит излишки непрерывно.
Однако чаще всего симптоматические операции нужны, чтобы организм, по сути, продолжал производить с окружающей средой обмен, который всем нам так привычен и воспринимается здоровыми людьми как должное.
Для обеспечения функционирования пищеварительной системы
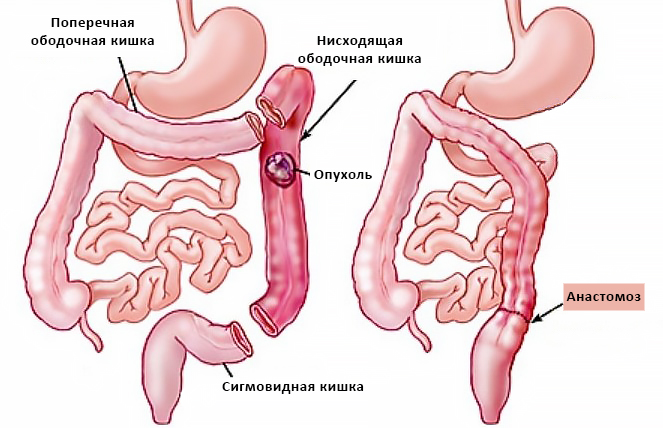
Удаление части ободочной кишки и формирование анастомоза
Однако, анастомоз наложить удается не всегда: например, пищевод или кишечник может быть слишком сильно поврежден опухолью. Существует еще ряд ситуаций, когда возникает необходимость создать прямое сообщение между полостью любого органа и окружающей средой.
На этот случай существуют стомы – отверстия, хирургическим путем сформированные на коже, к которым подшивают края нужной полости, в зависимости от локализации неоперабельной опухоли, которая закрывает просвет.
Например, гастростома – если не удается задействовать для питания пищевод: желудок подшивают к стенке брюшной полости и формируют отверстие на коже, через которое вводят полужидкую пищу.
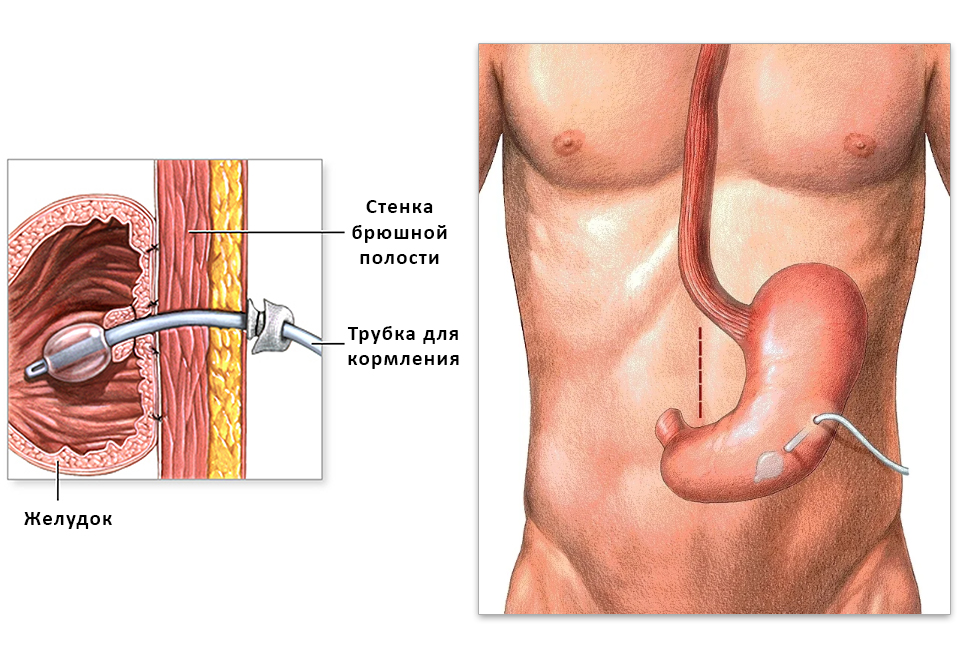
Устройство гастростомы
Колостома и илеостома. Если предыдущее отверстие было предназначено для питания пациента, то это – наоборот. При колостомии на кожу живота выводят отверстие из ободочной кишки, при илеостомии – подвздошной кишки. Через коло- или илеостому в специальный мешок-калоприемник отходят продукты жизнедеятельности.

Резекция толстой кишки с выведением колостомы
Обеспечение функции дыхания
Трахеостома. При опухолях гортани, чтобы не допустить удушья, проводят трахеостомию — на кожу выводят отверстие из трахеи, через которое человек может дышать.
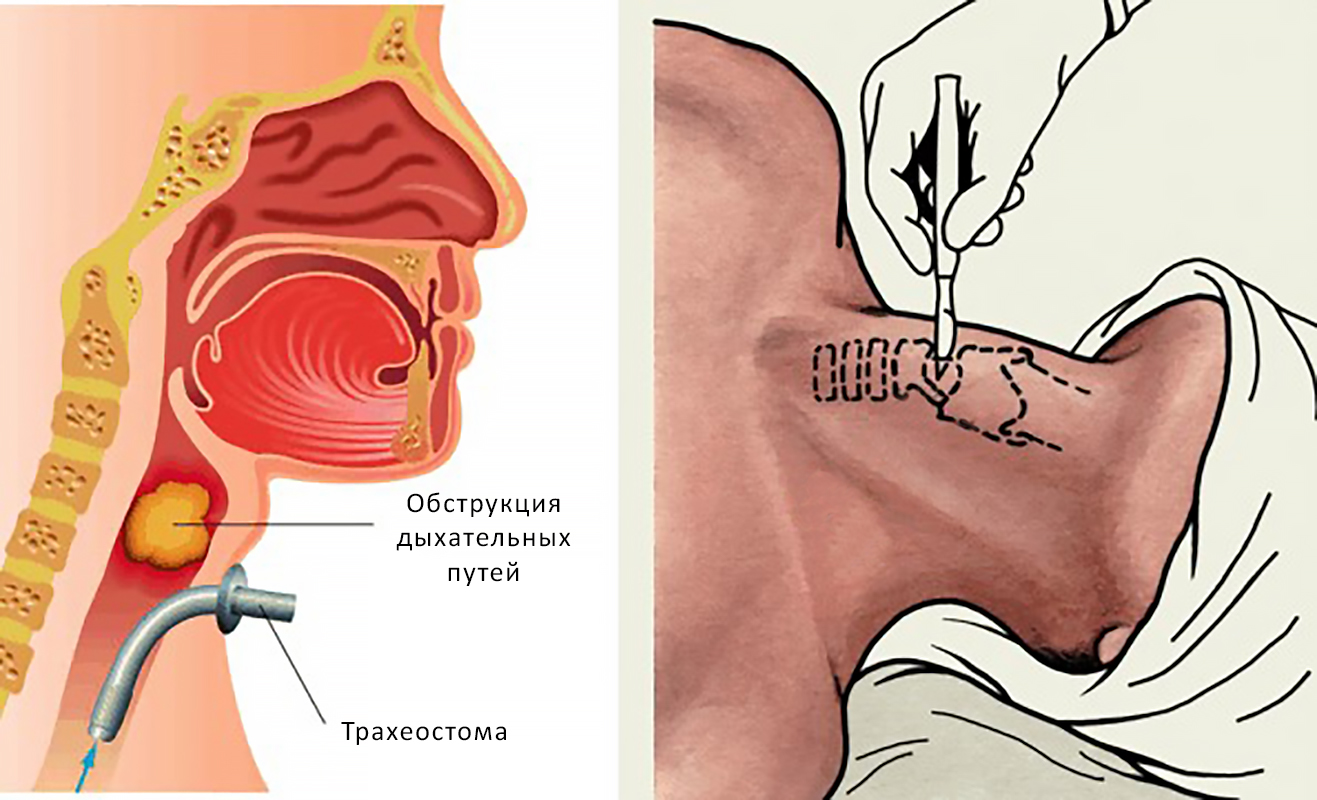
Трахеостома и проведение процедуры трахеостомии
Обеспечение мочевыделения
Нефростома – специальная полая трубка, которая выполняет функцию дренирования при нарушениях оттока мочи. Ее устанавливают в почечную лоханку через прокол на коже под контролем УЗИ.

Нефростома
Когда возможно – не режем, а используем эндоскоп
Когда опухоль разрастается и вовлекает какой-либо полый орган (пищевод, желудок, желчный проток, мочеточник, и т.д.), это может приводить к сдавливанию стенок органа, сужению просвета и полной непроходимости.
Зачастую в таких случаях есть возможность установить стент — металлический или полимерный сетчатый цилиндр-расширитель, который автоматически расправляется внутри полости органа и создает каркас, чтобы поддерживать достаточный просвет и проходимость.
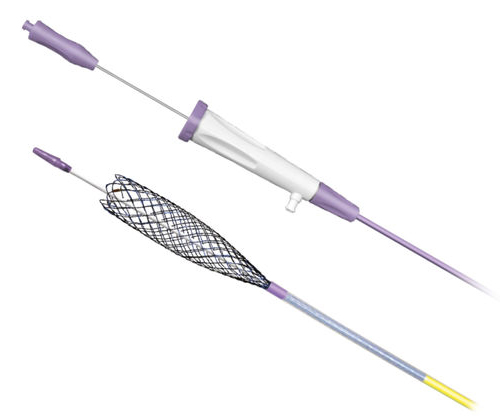
Билиарный стент (для желчного протока)
С помощью стентирования у нас получается сохранить физиологические функции многих органов даже на поздних стадиях опухолевого процесса.
Нормальное отведение желчи и лечение механической желтухи. Стентирование желчных протоков восстанавливает беспрепятственный отток желчи из печени в двенадцатиперстную кишку. Во-первых, пациент избавится от опасного состояния: механической желтухи. Она вызывается нарушением оттока желчи, провоцирует повышение уровня билирубина в крови и токсическое действие на ЦНС. Во-вторых, пациенту не придется ходить с выходящими наружу дренажами. В-третьих, естественный ток желчи сохранит нормальную работу кишечника. Так одна малоинвазивная операция делает очень много для сохранения качества жизни.

Стентирование желчного протока с помощью эндоскопа
Обеспечение работы пищевода и возможности самостоятельно питаться. Мы можем стентировать пищевод и желудок в случаях, когда опухоль находится в самом органе, или разрастается, придавливая его снаружи, или сужение просвета стало результатом более ранних вмешательств или иных повреждений (рубцов от химического ожога, например).
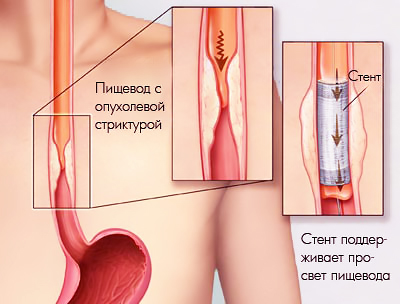
Работа стента в пищеводе, сдавленном опухолью
Судите сами: пациента привезли на реанимобиле с механической желтухой и стенозом пищевода, а выписали через 10 дней в состоянии, когда он может самостоятельно принимать пищу через рот и нормально ее переваривать.
Удалить всё и восстановить красоту. Санационные операции и реконструктивные
Когда опухоль не оперировали, и не слишком успешно лечили иными методами, она продолжает расти, а потом начинает распадаться. Эта опухолевая ткань может инфицироваться, вызывать массивные кровотечения, некрозы, оказывать токсическое действие на организм пациента, и сильно ухудшает его состояние.
Чтобы не допустить этого, нужно удалить как можно большее количество инфицированной опухолевой ткани. Такие паллиативные операции в онкологии называются санационными. Их выполняют, например, при раке молочной железы. Необходимость в таких операциях возникает у 30-40% женщин на III-IV стадиях. Также такие операции проводятся при угрозе распада и нагноения опухолей других органов: например, печени, ободочной кишки.
Часто после объемных оперативных вмешательств с полным удалением пораженного органа требуется последующая реконструкция. Например, молочной железы, частей лица или части кишечника, мочевого пузыря – для восстановления жизнедеятельности организма.
Это крайне важно и для психоэмоционального настроя пациента – чтобы он снова чувствовал себя нормальным человеком, с симметричными молочными железами и способностью ходить в туалет без дренажей и мочеприемников. От этого в большой мере зависит, будет ли человек находить радость в жизни и мотивацию для продолжения лечения.
Этой статьей мы хотим, во-первых, напомнить в нынешнее тревожное время, как счастливы те из нас, чей организм не нуждается в поддержке хирургов, чтобы есть или дышать.
А во-вторых, показать: даже в запущенных и тяжелых случаях все еще остается довольно много возможностей помочь онкологическому пациенту, продлить жизнь, убрать или облегчить мучительные симптомы. Даже если по прогнозам, жизни осталось совсем немного – есть очень большая разница в том, как ее прожить. В качестве, а не только в количестве. Паллиативная медицина – и паллиативная хирургия в частности, сегодня могут многое сделать для качества.
Читайте также:

