Восстановление после лучевой терапии при раке предстательной железы
Один из способов контроля над онкологическим процессом — лечение с помощью ионизирующего излучения. Побочные последствия лучевой терапии при раке предстательной железы развиваются часто, радиотерапия относится к инвазивным способам лечения.
Реабилитация после облучения рака простаты занимает длительный период и зависит от многих факторов:
• способа лучевого воздействия;
• стадии распространения опухоли;
• развившихся осложнений;
• суммарной очаговой дозы;
• сопутствующей патологии и пр.
На сегодняшний день операции постепенно вытесняются радиотерапией, ведутся работы в этом направлении: доказано, что процент осложнений после воздействия радиации меньше, чем после хирургического вмешательства, а качество жизни лучше.
Лучевая терапия относится к радикальным методам лечения локализованного рака, ее часто комбинируют с назначением гормональных препаратов.
К преимуществам лучевой терапии специалисты относят:
• возможность полного излечения;
• отсутствие необходимости в госпитализации;
• меньший риск рецидивов.
Радиотерапию при раке предстательной железы используют в качестве единственной меры или как компонент комплексного лечения, до операции, вместо или после.
Показания к проведению:
• рак предстательной железы;
• рецидив опухоли простаты после операции.
При выборе учитывают следующие аспекты:
• индекс по шкале Глисона;
• уровень простатспецифического антигена;
• ожидаемую продолжительность жизни;
• стадию онкопроцесса;
• вероятность развития неблагоприятных последствий, перекрывающих эффект от облучения.
Метод радиологического воздействия выбирается коллегиально, на онкоконсилиуме врачей.
Механизм действия
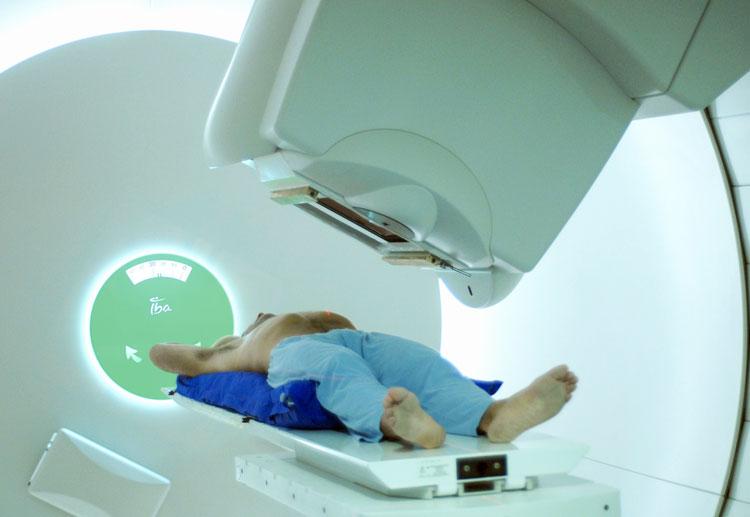
Представление об эффекте от лечения можно получить, если разобраться, что такое облучение при раке предстательной железы. Перед лучевой терапией обязательно выполняют МРТ (магнитно-резонансную томографию) и определяют объем ткани, на который будет приходиться основной лучевой удар.
Механизм воздействия ионизирующего излучения на простату обуславливается образованием свободных радикалов и пероксида водорода. Происходит разрушение нуклеиновых кислот (ДНК) и целостности клеточных мембран. Действие оказывается не только на атипичные клетки, но и здоровые. Это основная причина неприятных последствий облучения простаты.
Длительность сеанса облучения при раке простаты — 10 минут, с модулированием интенсивности — 20 минут. Курс — от 5 до 8 недель, 5 процедур, 2 дня перерыв.
Облучение выполняют волновым и корпускулярным способом. Доза облучения подбирается индивидуально, чтобы минимизировать отрицательные эффекты на близлежащие ткани.
Варианты лучевой терапии при раке простаты
Дистанционное облучение — часто используемый способ для лечения онкологических заболеваний. Выделяют фотонную, корпускулярную и внутритканевую радиотерапию. Воздействие осуществляется с помощью аппарата, концентрированный поток радиоизлучения направлен на область, максимально близкую к простате.
Противопоказания:
• острое воспаление в кишечнике;
• уремия;
• эпизод облучения органов малого таза в анамнезе;
• выраженное ожирение;
• функционирующий уретральный катетер.
При микроцисте (уменьшение объема мочевого пузыря), диарее, язвенном колите в стадии ремиссии и инфравезикальной обструкции вопрос о проведении решается в индивидуальном порядке.
К положительным аспектам относят:
• относительную малотравматичность;
• быструю реабилитацию;
• отсутствие необходимости в длительной госпитализации;
• меньший риск осложнений.
• длительность (до 2 месяцев);
• невозможность точно установить стадию онкопроцесса;
• возможные осложнения;
• отсутствие эффекта у некоторых пациентов.
В качестве наружного метода радиологи могут использовать конформную лучевую терапию, с 3-х мерной съемкой простаты, мочевого пузыря и прямой кишки.
Клинический объем излучения соответствует границам и форме простаты.
Лучевая нагрузка при 3D конформном облучении на мочевой пузырь и прямую кишку существенно меньше.
Брахитерапия
Брахитерапия (контактная терапия, внутренняя лучевая терапия) — одна из новых разработок, негативное воздействие на соседние структуры сведено к минимуму. В предстательную железу внедряют специальные источники радиоизлучения. Для лечения рака простаты применяют низкодозную постоянную и высокодозную временную брахитерапию.
Подходит в качестве альтернативного лечения рака простаты на начальных стадиях, без метастазирования. Кроме этого, уровень ПСА должен не превышать 10 нг/мл, дифференцировка по шкале Глисона менее 7 баллов, а объем простаты – не более 50 см куб.
После прохождения брахитерапии более 80% пациентов живут дольше 10 лет.
К положительным сторонам относят:
• однократность амбулаторной процедуры;
• хорошие результаты;
• меньший риск осложнений;
• возможность сохранения эректильной функции.
У пациентов с местнораспространенным раком простаты перед брахитерапией проводят дистанционное облучение.
Радиотерапия может различаться по форме воздействия:
• с модулированием интенсивности (поток частиц разделяется на несколько разнонаправленных пучков с помощью компьютера);
• протонная терапия с щадящим воздействием (малые дозы) на окружающие ткани, так как облучение атипичных клеток происходит на молекулярном уровне;
• нейтронная терапия — наиболее травматична, ее проводят, если отсутствует эффект от воздействия протонов или гамма-лучей.
В крупных онкологических центрах доступны все виды радиолечения.
Нежелательные последствия лучевой терапии при раке простаты

При облучении страдают не только органы урогенитального тракта, которые граничат с простатой, но и кишечник, кожные покровы.
Пациенты обращаются на прием со следующими жалобами:
• дизурические расстройства: рези, боли при мочеиспускании, ослабление струи мочи, ноктурия; императивные позывы, неудержание/недержание мочи;
• изнурительный зуд в области мочеиспускательного канала, усиленные выделения;
• нарушение эректильной функции;
• запоры или частый жидкий стул при вовлечении в зону облучения части кишечника;
• боли в нижних отделах живота;
• сухость слизистых, жажда;
• обострение геморроя;
• кожные проявления в месте воздействия лучей: покраснение, мацерация, образование язв;
• слабость, астенический синдром;
• тошнота, потеря аппетита;
• депрессия;
• задержка мочеиспускания;
• появление крови в моче, стуле;
• выпадение волос.
У каждого пациента реакции индивидуальны, состояние может улучшиться в течение нескольких дней после окончания курса, но может занять и более длительный период.
Гарантировать, что осложнений после лучевой терапии не будет, не в состоянии ни одна методика.
Самые частые осложнения лучевой терапии:
Общие рекомендации для пациента, получающего лечение лучами

Иногда негативные последствия от лучевой терапии проходят самостоятельно, но чаще для достижения эффекта необходимы слаженные действия и пациента, и врача.
После облучения организм ослаблен, и ему требуются силы не только на восстановление, но и на борьбу с раковой опухолью. Если следовать простым советам, процессы реабилитации пойдут быстрее.
В первое время стоит отказаться от значительных физических нагрузок, но исключать полностью двигательную активность не стоит: полезны пешие прогулки на свежем воздухе, без прямого воздействия солнечных лучей.
Важно питаться правильно. Согласно рекомендациям по диете при раке предстательной железы, суточную калорийность ограничивают до 2800 кал. Исключение — прохождение химио- или лучевой терапии, средний калораж рациона 3800 кал.
В меню необходимо включить больше овощей и фруктов. Красное мясо (говядина, свинина, баранина) – не лучший выбор, вместо этого полезна рыба, богатая селеном, белком и жирными омега-кислотами.
Вполне допускается диетическое мясо: крольчатина, индюшатина, куриные грудки.
Все вещества, обладающие раздражающим действием, исключают.
Полезны отвары трав с мочегонным эффектом (брусничный лист, хвощ полевой, толокнянка, семена укропа и пр.). Все блюда готовятся с максимально щадящей обработкой.
Отказ от вредных привычек — шаг навстречу к выздоровлению или к ремиссии рака предстательной железы.
Все проблемы необходимо сразу обсуждать с врачом, своевременно сдавать анализы и принимать лекарства. Как правило, для профилактики негативного воздействия на органы мочеиспускания, назначают уросептики, фитопрепараты, усиленный питьевой режим. Данная мера помогает предотвратить воспаление и изменения в анализах мочи: выраженная лейкоцитурия, протеинурия могут потребовать приостановить лучевую терапию.
Для нормализации струи мочи используют альфа-адреноблокаторы.
При лучевом ректите рекомендуют максимально щадящую диету, антигистаминные препараты, при сильном воспалении — антибиотики и гормоны.
Боль и дискомфорт снимают масляные микроклизмы и свечи с Метилурацилом, ванночки с раствором слабо-розовой марганцовки.
Принимать витаминные комплексы можно в разумных количествах, от пищевых добавок с непонятным составом, гарантирующим полное выздоровление, лучше отказаться.
Некоторые последствия лучевой терапии при раке предстательной железы можно уменьшить с помощью народных способов: заживлению лучевого проктита способствуют донник и облепиховое масло, а при постлучевом цистите регулярный прием клюквенного морса способствует уменьшению воспаления.
Лучевая терапия при раке простаты — применение ионизирующего излучения в медицинских целях для замедления прогрессирования или искоренения злокачественного новообразования. Выделяют три основных варианта радиотерапии: чрескожную, низкодозную и высокодозную брахитерапию. Последствия лучевой терапии при раке предстательной железы зависят от опыта врача и состояния здоровья пациента.
Содержание
Механизм действия лучевой терапии
Основная цель радиотерапии — повреждение малигнизированных клеток ионизирующим излучением с минимальным влиянием на здоровые окружающие ткани. В клинической практике используют различные типы излучения от различных источников, например рентгеновское и гамма. Место опухоли визуализируется в виде трехмерной компьютерной модели из результатов компьютерной или магнитно-резонансной томографии. Распределение лучей можно спланировать таким образом, чтобы минимальная доза (для рака простаты 74–80 Гр) достигалась во всей малигнизированной ткани с минимальным влиянием на чувствительные к радиации органы — мочевой пузырь и кишечник. Различают терапевтическую и паллиативную лучевую терапию. Последняя используется для облегчения симптомов, возникающих на терминальных стадиях. При раке простаты терапевтическая форма применяется в качестве альтернативы хирургии — радикальной простатэктомии.

Чрескожная лучевая терапия
Это основной вариант лечения локально-ограниченного рака предстательной железы всех групп риска. Облучение через кожу также называется внешней лучевой терапией и проводится амбулаторно без анестезии.
Конформная. При конформной чрескожной радиотерапии проводится трехмерное планирование выбранного объема облучения, что уменьшает риск развития поздних осложнений. Местоположение и объем радиации постоянно измеряются и корректируются при необходимости. Чтобы больше повредить опухоль и защитить здоровые ткани, общая доза также делится на несколько отдельных доз (фракций). Обычно используется 1,8–2,0 Гр пять дней в неделю, или 70 Гр — за 7–8 недель.
ДС модуляцией интенсивности. Другой вариант — радиотерапия с модуляцией интенсивности излучения, которая позволяет использовать более высокую разовую дозу. Она может применяться для сокращения продолжительности лечения (например, 74–80 Гр в 28 дозах по 2,5 Гр каждая) или при неэффективности предыдущей лучевой терапии. Преимущество метода заключается в более высокой дозе облучения с уменьшенными побочными эффектами. Облучение должно происходить с использованием методов визуализации.
Низкодозная и высокодозная брахитерапия
Брахитерапия — это контактная радиотерапия, при которой радионуклид (радиоактивный химический элемент) вводится непосредственно в предстательную железу. Введение радиоактивного вещества проводится во время амбулаторного или кратковременного пребывания в стационаре под спинальной анестезией — с помощью полых игл, которые проталкиваются в предстательную железу из промежности под контролем трансректального ультразвукового исследования.
Низкодозная
При низкодозной брахитерапии небольшие штифты, содержащие йод-125 или палладий-103, имплантируются в предстательную железу в качестве источника излучения. Возможна комбинация с чрескожной лучевой терапией. Наиболее частое показание — слабо увеличенная простата (максимально 60 мл) и незначительные симптомы (до 8 баллов по шкале IPSS). После трансуретральной резекции простаты низкодозная брахитерапия связана с более высоким риском развития последующего недержания мочи. Поэтому у пациентов из этой группы рекомендовано рассмотреть другие варианты терапии.
Высокодозная
При высокодозной брахитерапии применяется иридий-192, который вводится в предстательную железу с помощью игл. Чаще всего процедура комбинируется с чрескожной. Протонная терапия, использовавшаяся в недавнем прошлом, не является рутинной процедурой и в настоящее время не дает значимых для пациента преимуществ. Высокодозная брахитерапия в сочетании с чрескожной — основной вариант лечения для пациентов с локально ограниченным раком предстательной железы среднего и высокого профиля риска.
Лучевая терапия при локализованном раке простаты
Низкий риск
Чрескожная лучевая терапия — вариант для первичного лечения клинически локализованного рака простаты. Пациентов с такой опухолью следует облучать чрескожно с дозой не менее 70–72 Гр. Брахитерапия как единственная терапия рекомендуется для первичного лечения клинически локализованного рака простаты с низким профилем риском.
Средний риск
У таких пациентов рекомендуется сочетать чрескожную радиотерапию и гормональную терапию, но надежные научные данные отсутствуют. Пациенты должны получать более высокую дозу облучения (74–80 Гр). Также можно использовать неоадъювантную или адъювантную гормональную терапию, которую рекомендовано назначать краткосрочно — за 3 месяца до начала облучения плюс 3 месяца после процедуры.
Высокий риск
У пациентов с опухолью высокого риска неоадъювантную (за 6 месяцев до начала лучевой терапии) или адъювантную гормональную терапию следует проводить в течение не менее 2 лет в дополнение к облучению, что продлевает выживаемость. Пациенты с опухолью высокого риска не должны получать только брахитерапию: комбинация с чрескожной или гормональной должна проводиться только в рамках исследований.
Лучевая терапия при местно распространенном раке предстательной железы
В сочетании с гормональной терапией чрескожная — вариант первичного лечения местно распространенного рака предстательной железы. Комбинация превосходит монотерапию. Пациентов следует подробно информировать о преимуществах и недостатках этой комбинированной терапии, а также радикальной простатэктомии с лимфаденэктомией. Пациентов с местно распространенным раком предстательной железы необходимо чрескожно облучать не менее 74–80 Гр. В дополнение к чрескожной радиотерапии рекомендуется назначить гормональную терапию — адъювантную или неоадъювантную. Неоадъювантная гормональная терапия должна проводиться в течение 2–3 месяцев, адъювантная — не менее 2 лет; общая продолжительность должна быть не менее 2, лучше 3 года. Эффективность облучения лимфатических путей в малом тазе в дополнение к локальному облучению простаты при локально ограниченном раке предстательной железы со средним и высоким профилем риска еще не может быть окончательно оценена.

Осложнения радиотерапии
При правильном использовании ионизированные лучи и гамма-лучи обеспечивают эффективный и щадящий способ лечения рака. Излучение разрушает ядро раковой клетки, поэтому оно теряет способность делиться. В отличие от здоровых клеток раковые неспособны регенерировать сами, поэтому рост опухоли прекращается. Большое преимущество радиотерапии — местное применение. Ионизирующее излучение действует только там, где есть опухоли или метастазы. Затрагиваются только небольшие участки тела, что снижает риск развития серьезных побочных эффектов. Повреждение тканей при облучении может привести к осложнениям, частота которых, как и при радикальной простатэктомии (РПЭ), уменьшается с опытом лечащего врача и улучшенными методиками. В настоящее время не существует профилактического лечения с помощью медикаментозных средств.
Острые осложнения (в течение трех месяцев). Они встречаются редко. Исключение — брахитерапия, из-за которой у многих пациентов возникают временные проблемы с мочеиспусканием из-за вмешательства на предстательной железе. Тошнота — другой распространенный побочный эффект, с которым можно бороться с помощью сухого хлеба или хлебцев. Проснувшись, можно съесть кусочек поджаренного хлеба. Рекомендуется избегать неприятных запахов пищи и регулярно проветривать помещение, есть медленно и тщательно пережевывать пищу. Если в результате лечения возникает воспаление слизистой оболочки полости рта, можно отказаться от кислой, острой или горькой пищи и газированных напитков. При возникновении запора или диареи рекомендовано употреблять достаточное количество клетчатки и небольшое количество свежих фруктов. Эксперты советуют не употреблять витаминные препараты и пищевые добавки, поскольку большинство полезных веществ можно получить из сбалансированного рациона.
Поздние осложнения. Они встречаются чаще и из-за замедленного действия радиации все еще возможны через несколько лет:
- воспаление мочевого пузыря (цистит);
- примесь крови в моче (гематурия);
- недержание (как правило, позывы из-за раздражения мочевого пузыря);
- рубцевание;
- проктит (воспаление прямой кишки);
- диарея;
- появление крови в стуле;
- отек ног;
- синдром хронической тазовой боли.
Даже если нет видимых изменений после процедур, облученная область тела может оставаться более чувствительной в долгосрочной перспективе. Рекомендуется учитывать возможные перемены при личной гигиене и работе с возможными раздражителями — солнцем, химическими веществами или механическими нагрузками. Особая форма питания не нужна. Рекомендуется избегать жирных и сладких продуктов, поскольку они часто вызывают дискомфорт, а также трудноусвояемых продуктов — фруктов с твердыми скорлупами, газообразующих овощей и мюсли.
Возможные последствия
Серьезные последствия лучевой терапии при раке простаты:
- эректильная дисфункция: поражает примерно одинаковое количество пациентов через год после чрескожной лучевой терапии, брахитерапии и радикальной простатэктомии. В дополнение к повреждению нервов причиной также может быть психика (например, депрессивное настроение);
- вторичные опухоли: радиационное воздействие на окружающие здоровые ткани также увеличивает риск развития вторичной злокачественной опухоли, особенно при раке прямой кишки и мочевого пузыря.
Как диагностируется рецидив
Радиотерапия при рецидиве
Если прогрессирование простатического специфического антигена, скорее всего, не связано с метастазами, спасательная простатэктомия (СПЭ) является вариантом лечения. Опухоль низкого риска, повышение уровня ПСА через 3 с лишним года и высокий уровень более 12 месяцев — показания для простатэктомии. Результаты СПЭ в отношении эректильной дисфункции и недержания мочи, однако, сравнительно хуже, чем при радикальной без предшествующей лучевой терапии. Спасательную простатэктомию следует проводить как можно раньше, и в связи с радиационными изменениями в ткани выполняться она должна только урологом, имеющим многолетний опыт.

Лучевая терапия при раке предстательной железы является одним из наиболее эффективных консервативных методов лечения. На ионизирующее излучение активнее всего реагируют быстро делящиеся клетки, к которым и относятся раковые. При облучении поражаются их ядра, в частности, ДНК, нарушаются обменные процессы, что приводит к гибели. На этом принципе и основана лучевая терапия. Радиационное дозированное облучение применяют для лечения локализованной (очаговый рак) и местнораспространенной (проросший сквозь капсулу, но без метастазов) форм заболевания. Технология, объем лучевого воздействия и суммарная доза подбираются индивидуально для каждого пациента, поэтому облучение здоровых тканей минимально.
Показания и противопоказания
Лучевая терапия является альтернативой радикальной простатэктомии, если речь идет о раке простаты на ранней стадии. Облучение опухоли позволяет контролировать ее разрастание, когда операция невозможна. При метастазирующем раке метод применяют для улучшения качества жизни, часто сочетают с гормональной терапией.
Если опухоль очень крупная, то ее распад после гибели клеток приведет к сильной интоксикации организма, поэтому облучение в таких случаях сочетают с хирургическими методами (простатэктомией).
Лучше всего реагируют на лучевую терапию неблагополучные с гистологической точки зрения опухоли – низкодифференцированные, клетки которых сильно отличаются от нормальных и быстро делятся. Высокодифференцированный медленно растущий рак поддается такому лечению гораздо хуже. Повысить чувствительность таких клеток можно при помощи медикаментов, насыщения опухоли кислородом, повышением ее температуры (локальная гипертермия), снижением уровня pH. Все эти меры продумываются на этапе планирования.
Противопоказания к лучевой терапии:
- Пиелонефрит, хроническая почечная недостаточность.
- Цистит.
- Истощение.
- Большой объем остаточной мочи.
- Возраст после 70 лет. В старческом возрасте отдают предпочтение медикаментозным паллиативным методам лечения.
В настоящее время благодаря новым методам предварительного планирования лучевая терапия становится безопаснее простатэктомии.
Виды лучевой терапии
Тип лучевой терапии подбирают в зависимости от вида рака. Каждая методика имеет свои показания, без учета которых воздействие может быть не только неэффективным, но и опасным. Существует два принципиально разных типа лучевой терапии: дистанционная и внутритканевая (контактная, или брахитерапия). Для повышения эффективности лечения их сочетают с ультразвуком, лазером, электрическими и магнитными полями, химио- и иммунотерапией.

Дистанционная (внешняя) лучевая терапия является наиболее распространенным видом облучения. Показана при раке, локализованном в капсуле простаты, на стадии Т1а-Т2с N0M0, а также при местнораспространенном на стадии Т3-Т4 N0M0 совместно с гормональной терапией.
- Ранее произведенное облучение малого таза;
- Острое воспаление прямой кишки;
- Установленный уретральный катетер;
- Ожирение 4 степени.
Относительными противопоказаниями к дистанционной лучевой терапии являются хроническая диарея, малый объем мочевого пузыря, нарушение проходимости уретры, язвенный колит.
Преимущества: возможность полного излечения без хирургического вмешательства, нет необходимости ложиться в стационар. Из минусов: долгое лечение (1,5-2 месяца), сопутствующая доброкачественная гиперплазия останется.
По технике облучения выделяют конвекционное и 3D-конформное. Первый метод подразумевает использование простых прямоугольных полей воздействия. Во втором случае создается трехмерная модель опухоли, он более точный, снижает нагрузку на жизненно важные органы.

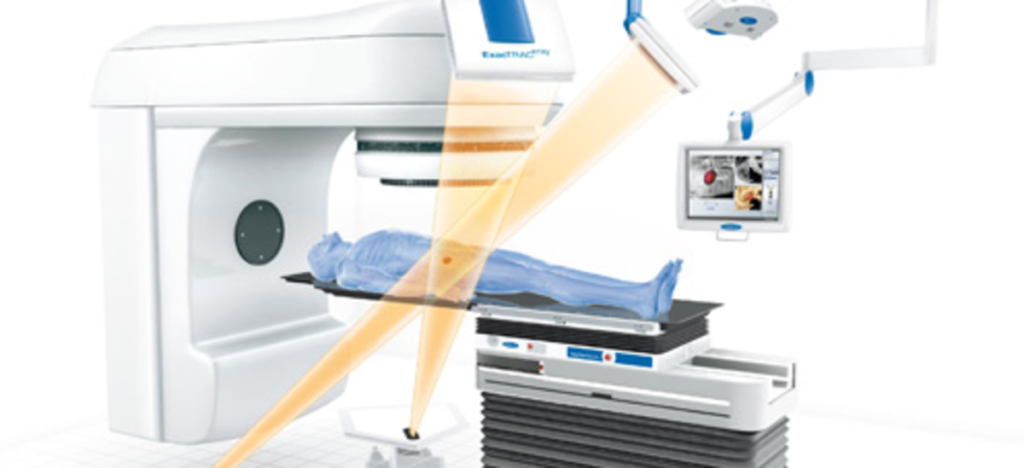
Установка для облучения 
Оборудование для проведения лучевой терапии
Целью радиотерапевта при проведении дистанционной лучевой терапии является точечное направление потока излучения с захватом небольшого объема здоровой ткани во избежание рецидива. Эту задачу упрощают более современные методики.
Протонная терапия подразумевает воздействие протонами, разогнанными до больших энергий при помощи циклотрона. Пучки протонов распределяются в мишени таким образом, что полностью исключается их рассеивание за нее. Энергия протонного луча больше, чем радиационного. Длительность воздействия составляет 10-15 минут. В среднем на курс требуется 18 процедур.

Установка для протонной терапии ProBeam
IMRT – дистанционная лучевая терапия с модуляцией интенсивности, возможна только на специальных линейных ускорителях. Аппарат производит пространственное сканирование опухоли (3D) для направления радиационного луча под различным углом. В каждом положении система подбирает оптимальную интенсивность излучения и форму пучка облучающих частиц. Луч можно разбить на несколько сегментов. Таким образом основная лучевая нагрузка приходится на центр опухоли, а здоровые ткани подвергаются минимальному повреждению. 3D-модель простаты предварительно составляется при помощи МРТ или КТ.

Схема облучения
Если сразу дать высокую дозу радиации в режиме повышенной точности, то есть шанс убить рак без операции за 1-5 сеансов и существенно продлить жизнь больному, ранее считавшемуся неизлечимым. Такой инновационный метод лучевой терапии называется стереотаксической гипофракционной радиотерапией.
Облучение продолжается от 15 секунд до 2 минут. Опухолевые клетки погибают, некротизируются, на месте рака остается стабильный рубец. Данный процесс занимает некоторое время, поэтому результат будет не сразу. Лечение длится всего 2 недели: одна на подготовку, вторая на облучение.
Данный метод лучевой терапии больше всего подходит для лечения рака на начальной стадии, а также при наличии небольшого количества некрупных метастазов. Если опухоль крупная, а количество метастаз более 10, то SBRT не применяют.
Из осложнений чаще всего развивается лучевое воспаление кожи. Через 1-3 недели симптом пройдет, но в течение этого времени необходима защита от ультрафиолета (ткань, крем).
IGRT – лучевая 3D-терапия под визуальным контролем. Опухоли после каждого облучения меняют свои очертания, простата смещается при различной наполненности мочевого пузыря, аппарат фиксирует эти изменения, что дает возможность оказывать более точное воздействие. Программное обеспечение позволяет сопоставить снимки КТ и реальное изображение опухоли. Благодаря этому можно скорректировать положение пациента и направление потока излучения. Все параметры опухоли вводятся в систему. Если луч выйдет за обозначенные границы, установка отключится, после корректировки сеанс продолжается.
Это инновационная технология дистанционной лучевой терапии, позволяющая сократить сеанс лечения и повысить его эффективность за счет высокой вариабельности положений пациента и параметров установки. Аппарат поддерживает 360 позиций, в каждой из которых доступны дополнительные опции регулирования дозировки и мощности излучения. Методика Gated RapidArc обеспечивает корректировку потока, синхронизируя его направление с дыханием пациента. Само облучение длится пару минут, но точная укладка больного потребует не менее получаса.

Технология облучения VMAT RapidArc
В ходе облучения охватывается весь объем опухоли, обеспечивая идеальную схему лечения. На сегодняшний день это самый эффективный и безопасный метод лучевой терапии.
SDRT – это однофракционная экстракраниальная радиотерапия. Во время сеанса железу фиксируют ректальными баллонами и подвергают облучению в 8 Гр. Курс длится 5 дней. Как и во время IGRT, врач видит простату на экране. Подготовка и укладка пациента занимают полчаса, а само облучение длится несколько минут.
Фиксация помогает избежать осложнения со стороны мочеполовой системы. В основном негативные последствия ограничиваются учащенным дискомфортным мочеиспусканием, которое нормализуется в течение 3 недель.
Госпитализация не требуется. Данный метод лучевой терапии подходит для пожилых людей, а также страдающих сахарным диабетом, патологиями кровеносной системы. Если опухоль распространилась за пределы капсулы, то SDRT не применяют. Невозможность введения уретрального катетера и ректальных баллонов также является противопоказанием.
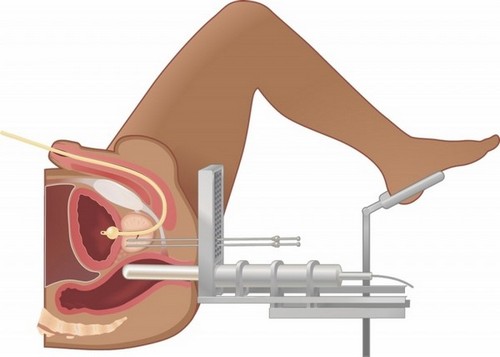
Брахитерапия
Брахитерапия подразумевает введение радиоактивного вещества на специальном носителе непосредственно в ткань опухоли. Основные типы контактной лучевой терапии: низкодозная и высокодозная. В первом случае при помощи специальных игл в опухоль вживляют радиационные зерна, которые остаются в ней навсегда. Излучение будет продолжаться некоторое время, потом прекратится. Во втором случае в иглы подводят источник радиации, выжидают несколько минут для воздействия и извлекают их из железы.

Примеры распределения лучевой нагрузки на простату методом фокальной брахитерапии: а – таргетная (ультрафокальная) схема; б – гемиаблативная (облучается одна доля простаты); в – фокусированная на видимый очаг; г – фокусированная на периферическую зону
Системная терапия
Одним из видов контактной радиотерапии является системная, при которой радиоактивные вещества вводят в кровоток (таблетки или инъекции в вену), после чего они распределяются по организму. Применяют в случае распространения метастаз по костной системе.

Сравнение эффективности различных видов лучевой терапии
Как проводится лучевая терапия при раке простаты
Сначала пациента консультирует онколог-радиолог (радиотерапевт). Специалист в соответствии с показаниями выбирает методику и обсуждает с больным дополнительные виды лечения.
Расстояние смещения опухоли при дыхании фиксируется рентгеном. Это важно для расчета облучающего объема. На симуляторе проверяют фокусировку луча. Он должен попасть четко в центр опухоли. Во время облучения пациент не испытывает никаких ощущений.
Последствия, осложнения, прогноз продолжительности жизни
Вероятность осложнений лучевой терапии напрямую зависит от дозы облучения и радиочувствительности окружающих тканей. Острые реакции возникают непосредственно во время курса лечения. В течение 2-6 недель эти симптомы проходят. Более поздние осложнения развиваются в срок от месяца до года после завершения облучения. Это лимфостаз нижних конечностей, эректильная дисфункция.

Ближайшие и отдаленные осложнения лучевой терапии (в %) 
Зависимость трехлетней безрецидивной выживаемости от уровня ПСА и дозы облучения
Минимизировать последствия лучевой терапии помогут профилактические меры:
- Исключить из рациона острую и соленую пищу, алкоголь.
- Тщательная гигиена половых органов и области промежности.
- При наличии цистита или пиелонефрита предварительно сделать бакпосев мочи с определением чувствительности к антибиотикам, пройти курс соответствующего лечения.
- Если наблюдается выраженное затруднение мочеиспускания, то лучевой терапии должна предшествовать гормональная либо ежедневная доза облучения должна начинаться с 0,5 Гр.
- Не проводить лучевую терапию после инструментальных вмешательств на уретре, не ранее, чем через 4-5 недель после трансуретральной резекции.
- У ослабленных больных следует делить курс облучения паузами в 2-3 недели, общая доза – не более 40-45 Гр.
Если есть предпосылки к развитию лучевого ректита (воспаление слизистой прямой кишки с отторжением выстилающей клетчатки), необходимо использовать свечи с белладонной, метилурацилом, анестезином, масляные.
ПСА после лучевой терапии рака простаты
После лучевой терапии уровень ПСА падает медленнее, чем после простатэктомии. Для достижения минимального уровня (0,5 нг/мл) может потребоваться 3 года и более. Были случаи, когда для снижения уровня ПСА после лучевой терапии потребовалось 5 лет. После брахитерапии первый анализ на ПСА сдают не раньше, чем через 3 месяца, затем контроль проводят раз в квартал.
У 30% пациентов после лучевой терапии наблюдается несущественный скачок ПСА, связанный с тем, что железа продолжает продуцировать антиген.

Рецидив рака простаты после лучевой терапии
Рецидив рака после лучевой терапии можно предсказать по времени увеличения уровня ПСА вдвое. Если срок составляет 13 месяцев, то диагностируется рост единичной опухоли (местный рецидив). Для системного рецидива (рост метастатических очагов) характерно быстрое время удвоения – 3 месяца.
Увеличение уровня ПСА является показанием для назначения других методов диагностики: МРТ, ПЭТ-КТ, остеосцинтиграфия (для определения метастазов в костях).
Реабилитация после лучевой терапии
После дистанционной лучевой терапии на коже может появиться ожог, как от солнца. Это место нельзя тереть мочалкой и подвергать другим механическим воздействиям.
После лучевой терапии важно полноценно питаться. Особенной диеты нет, но следует исключить копчености, соленья, маринады, алкоголь, острые блюда. В рацион обязательно должны входить фрукты (кроме кислых), овощи, крупы, жирная рыба, постное мясо, кисломолочные продукты. Если нет аппетита, то рекомендуется по утрам натощак рассасывать под языком чайную ложку перги (пчелиная пыльца). Полезен настой на пчелином подморе.

Желательно пить больше жидкости и двигаться. Лучевая терапия влечет за собой серьезную интоксикацию организма продуктами распада опухоли, которые необходимо выводить.
Секс не противопоказан. Чем быстрее начнется половая жизнь, тем больше шансов на восстановление эрекции. На начальном этапе можно стимулировать либидо при помощи БАДов, а эрекцию – приемом ингибиторов ФДЭ-5 (силденафил, тадалафил). Следует учесть, что после полного облучения и рубцевания простаты эякуляции не будет. Если мужчина планирует иметь детей, то ему следует заранее сдать сперму в криобанк.

Цены на лучевую терапию сильно колеблются в зависимости от типа учреждения, установки, программы подготовки. Высокоточные системы в РФ пока в единичных количествах. Лечение рака простаты лучевой терапией на скоростной установке TrueBeam можно пройти в Центре лучевой терапии в Москве. Протонная терапия доступна на установке ProBeam в центре протонной терапии (МИБС) в Санкт-Петербурге. Цена в МИБС:
- Подготовка и планирование – 200 тыс. руб.;
- Стереотаксическая лучевая терапия в режиме гипофракционирования – 180 тыс. руб.;
- Консультация радиотерапевта – 2500 руб.
В НИИ онкологии им. Петрова сеанс дистанционной лучевой терапии обойдется в 3460 руб., в Российском центре радиологии им. Гранова (СПб) сеанс стереотаксической терапии стоит 30000 руб., конформное облучение IMRT – 18000 руб.
Отзывы
Заключение
Лучевая терапия, по сути, является таким же радикальным методом лечения рака простаты, как и простатэктомия, но считается более щадящим, с точки зрения побочных эффектов. Последнее особенно актуально для инновационных высокоточных методик. На ранних стадиях большинство врачей рекомендуют простатэктомию, поскольку после нее остается широкий выбор других способов лечения. После лучевой терапии могут произойти изменения в структуре тканей, которые не дадут возможности для оперативного вмешательства.
Читайте также:

