Визуализация для лечения опухолей
Увидеть, чтобы вылечить, найти, чтобы удалить. Визуализация опухоли – это использование оптимальных методов диагностики для обнаружения злокачественного новообразования на ранних сроках формирования и роста. Современные медицинские технологии помогают выявлять рак в любом месте организма: главное – сделать это вовремя и с применением эффективных методик.
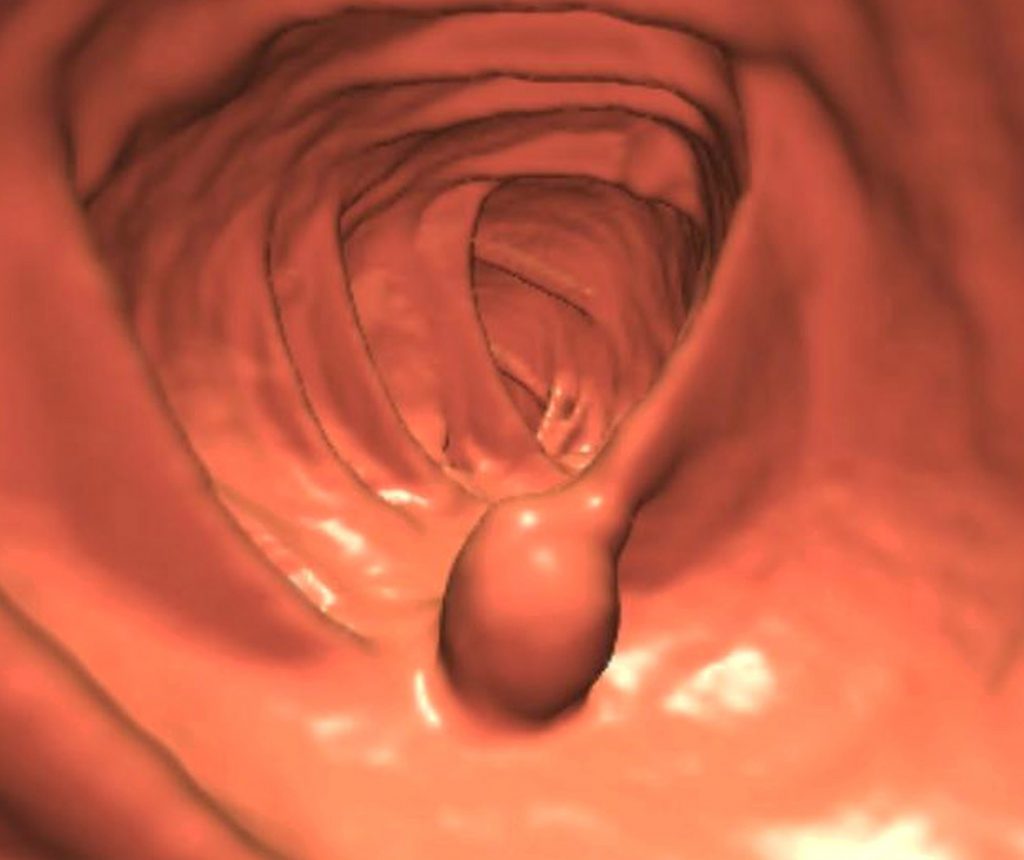
Оптимальная визуализация опухоли при эндоскопии
Визуализация опухоли
Злокачественная опухоль коварно, безжалостно и исподволь растет и распространяется, начав с небольшой группы раковых клеток и заканчивая множественными отдаленными метастазами. Основная задача успешной диагностики рака – найти первичный очаг: место в организме, откуда началось неумолимое распространение опухолевой ткани. Визуализация опухоли – это важный элемент диагностического поиска, помогающий доктору за короткий промежуток времени поставить точный диагноз и выбрать оптимальную тактику лечения. Увидеть скрытно и тихо пробравшегося противника – это первый реальный успех в борьбе с раком.
Основные методы диагностики
Часть злокачественных новообразований можно выявить при обычном врачебном осмотре. Визуализация опухоли внутренних органов требует применения специальных процедур. Чаще всего в онкологии применяются следующие методы:
- Ультразвуковое исследование (УЗИ);
- Рентгеновские методики;
- Эндоскопия;
- Томография.
Врачебный осмотр является основой первичной диагностики – опытный специалист оценит жалобы, сможет обнаружить наружные формы рака или направит на дополнительные исследования, выбрав эффективный алгоритм онкологического поиска.
Эхография – широко распространенный метод диагностики, используемый при большинстве заболеваний. К несомненным достоинствам УЗИ относятся:
- простота и доступность процедуры;
- безопасность;
- быстрое получение результата;
- эффективность при некоторых видах рака.
УЗИ – это первый этап диагностического поиска, который часто применяется на профилактических осмотрах. Успешная УЗ визуализация рака возможна в следующих органах:
- Щитовидная железа;
- Печень и желчные пути;
- Молочная железа;
- Почки и мочевой пузырь;
- Поджелудочная железа;
- Простата;
- Женские половые органы.
Проще и доступнее начать поиски врага с простой и доступной ультразвуковой методики, но не надо успокаиваться, если на УЗИ ничего не нашли. Основной недостаток эхографии – невозможность гарантировать 100% результат диагностики.
Лучевая диагностика в медицине применяется давно. Главный недостаток любой рентгеновской методики – вредность для организма, поэтому в диагностическом поиске рака надо использовать оптимальные процедуры со строгим учетом лучевой нагрузки. В типичных ситуациях врач назначит следующие методы:
- Рентгенография (стандартные снимки в нескольких проекциях);
- Ренгеноскопия (осмотр в реальном времени);
- Компьютерная томография (множество срезов-картинок, формирующих объемное изображение);
- Ангиография (исследование сосудистого русла с применением рентгена и контрастного вещества).
Оценка опухоли с помощью рентгена применяются в диагностике подавляющего большинства заболеваний. Иногда достаточно простых снимков для обнаружения опухоли в кости или для выявления рака в легких. Маммография поможет обнаружить рак в груди, ирригоскопия – новообразования в желудочно-кишечном тракте. Томография незаменима при визуализации объемных образований в голове или в малом тазу. В каждом конкретном случае врач направит на диагностику, учитывая необходимость метода при учете общей лучевой нагрузки на организм пациента.
Эндоскопическая визуализация опухоли является эффективной методикой, особенно в тех случаях, когда, кроме осмотра, врач может взять биопсию опухолевых тканей. Частыми вариантами лечебно-диагностического поиска при раке являются следующие процедуры:
- бронхоскопия (диагностика рака горла, бронхов и легких);
- фиброгастродуоденоскопия (выявление опухолей пищевода, желудка и тонкого кишечника);
- колоноскопия (для обнаружения рака толстой кишки);
- ректороманоскопия (опухоли прямой и сигмовидной кишки);
- цистоскопия (при метастазах или раке мочевого пузыря);
- кольпоскопия (при раке влагалища, шейки матки и вульвы);
- гистероскопия (новообразования в маточной полости);
- лапароскопия (осмотр и визуализация опухоли брюшной полости).
Эндоскопическая методика – это практически всегда малоинвазивная операция, предполагающая хирургическое вторжение во внутренние полости организма.
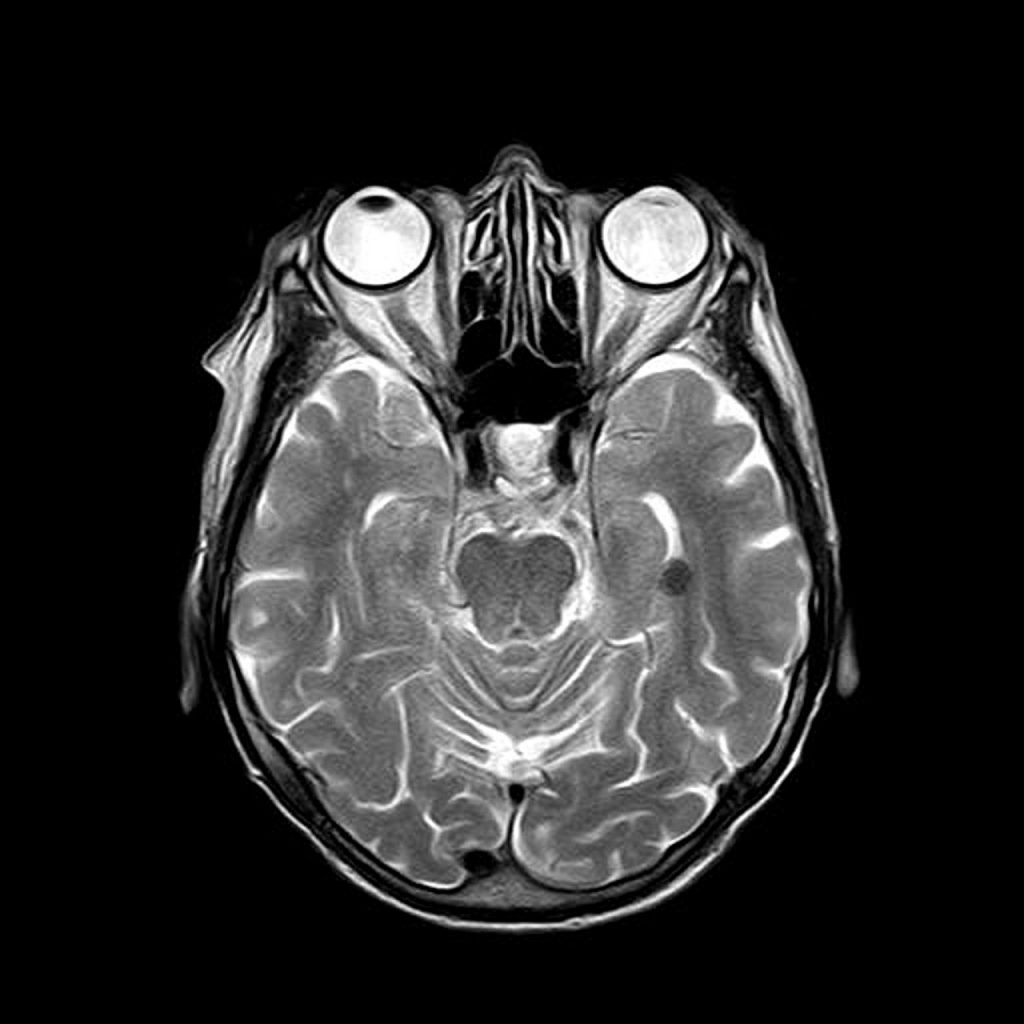
Эффективное выявление опухолей мозга при МРТ
Отсутствие лучевой нагрузки и получение объемного изображения высокого качества – несомненные достоинства МРТ. Основной недостаток – высокая стоимость исследования, поэтому МР томография не используется при массовых осмотрах. Оптимально применять процедуру в следующих случаях:
- При подозрении на рак головного мозга;
- Для выявления опухолей в костях и суставах;
- В диагностике новообразований малого таза;
- При любых сомнениях в наличии рака внутренних органов;
- При раке мягких тканей.
Основной принцип поиска заболевания – от простого к сложному: за короткий промежуток времени врачу надо провести обследование при подозрении на рак и найти первичный очаг, используя доступные и безопасные методики. Визуализация опухоли – это применение всего арсенала аппаратуры для обнаружения противника с обязательным учетом безопасности, эффективности и возможности взятия биопсии опухоли.

Смертность и заболеваемость раком в мире уже несколько десятилетий весьма высокая и эти показатели имеют тенденцию к увеличению. Наиболее распространенными подходами в лечении рака являются методы поли-химио-радиотерапии и хирургические методы. Как правило, методы химиотерапии обеспечивают неспецифическую доставку противоопухолевых агентов с кровотоком, неадекватную концентрацию лечебных препаратов в ткани опухоли и ограниченные возможности для слежения за результатами лечебных процедур. Низкая эффективность доставки лечебных агентов к мишени (опухолевому очагу) приводит нередко к значительным осложнениям, например, лекарственной устойчивости. Более высокая избирательность и лучшая эффективность доставки лекарственных средств к патологическому очагу – вот два основных направления поиска и разработки новых терапевтических агентов и контрастных веществ для успешной терапии и неинвазивной визуализации опухолей. Наиболее эффективный путь – это коньюгация лекарственных агентов с моноклональными антителами или другими лигандами, селективно взаимодействующими с антигенами или рецепторами на поверхности опухолевых клеток. Такой подход является частным случаем важнейшего принципа гуморальной регуляции физиологических функций – направленного транспорта веществ в организме. Уже разработаны и с успехом применяются в клинической практике некоторые технологии, использующие этот принцип – например конструирование иммунотоксинов, радиофармпрепаратов на основе антител, иммуноконьюгаты лекарств с антителами 2. Хотя такие композитные лекарственные и диагностические препараты обещают высокую эффективность, остаются некоторые проблемы с их внедрением в клиническую практику [31, 61, 84].
В настоящее время для диагностики опухолевых заболеваний с успехом применяются новейшие неинвазивные технологии, такие как рентгеновская компьютерная томография (РКТ), позитрон-эмиссионная томография (ПЭТ), однофотонная эмиссионная компьютерная томография (ОФЭКТ), визуализация с помощью магнитно-резонансной томографии (МРТ) [49, 53, 69]. Разработка опухоле-специфичных контрастных веществ на основе нанотехнологий и наноматериалов может увеличить специфичность и чувствительность методов неинвазивной визуализации опухолей в клинической практике в сравнении с традиционными методами визуализации. Успехи в области нанотехнологий дают надежды на разработку персональной тактики в диагностике и терапии онкологических заболеваний на основе знаний о молекулярном профиле конкретных пациентов.
Наночастицы для направленного транспорта лечебно-диагностических препа-ратов в опухоль. НЧ могут состоять из разных компонентов, таких как полимеры, металлы, керамика. В зависимости от методов изготовления они могут иметь различную конфигурацию, размеры и свойства. Многие из НЧ находятся на различных стадиях внедрения в качестве средств доставки лекарств, такие как липосомы (далее – Л) и другие носители на основе липидов (например – липидные эмульсии, комплексы липидов с лекарствами), коньюгаты лекарств с полимерами, микросферы из полимеров, мицеллы, иммуноконьюгаты [57, 62, 70].
Липосомы и другие липидные НЧ. Липосомы (далее – Л) – наиболее популярный наноматериал для направленного транспорта лекарств в организме. Сейчас разработано немало противоопухолевых препаратов на основе Л. Такая популярность Л объясняется их способностью улучшать фармакокинетику и фармакодинамику связанных с ними препаратов ([1]. Некоторые противоопухолевые препараты на основе Л –липосомальный доксорубицин (Доксил), липосомальный даунорубицин, с успехом используются в терапии метастазирующего рака молочных желез и саркомы Капоши [21, 31, 32, 66]. Первые Л имели немодифицированную фосфолипидную поверхность, связывающую белки плазмы крови. Эти белки способствовали процессам распознавания и поглощения Л мононуклеарными клетками, что в свою очередь приводило к быстрому клиренсу Л из циркуляции. Это препятствовало накоплению Л и содержащихся в них препаратов в ткани опухоли или других местах действия лекартсв. В последующем эти неудовлетворительные свойства Л были сняты с помощью модификации их поверхности гидрофильными карбогидратами или полимерами; такими как полиэтиленгликоль (ПЭГ) [10, 78, 84, 94 ]. Одна из стратегий для достижения направленного опухоле-специфического транспорта Л состоит в их коньюгации с агентами, взаимодействующими с рецепторами клеток органа-мишени или ткани-мишени [9, 10, 78]. К примеру, иммунолипосомы состоят из антител (далее – АТ) или их фрагментов, коньюгированных с терминальной группировкой ПЭГ на поверхности Л. Применение таких Л свидетельствует об их повышенной терапевтической эффективности в сравнении с обычными [79, 91]. Исследования ин витро с использованием Л, нагруженных доксорубицином и имеющих на поверхности антитела против антигена СД44 показали, что культивируемые клетки меланомы В16F10 поглощали противоопухолевый антибиотик более эффективно, чем свободный доксорубицин. При этом, усиленное внутриклеточное поглощение коррелировало с повышенной цитотоксичностью препарата [29].
Инкапсулированный в Л цисплатин, не обладающий противоопухолевой активностью в таком состоянии, приобретал ее в случае включения в состав иммунолипосом, направленных против цитоплазматического антигена опухолевых клеток [11, 94]. Недавно были получены удовлетворительные результаты 1-й фазы клинических испытаний иммунолипосом МСС-465, представляющих собой обработанные полиэтилен-глико-лем (ПЭГ) (пэгилированные) Л, нагруженные доксорубицином и коньюгированные с F (ab)2-фрагментами человеческих моноклональных антител (далее – монАТ) у пациентов с метастазирующим раком желудка [46, 66].
Полимерные наночастицы Для того чтобы достичь мишеневых тканей, НЧ должны оставаться в кровотоке достаточно длительное время. НЧ с немодифицированной поверхностью обычно захватываются клетками ретикуло-эндотелиальной системы печени и селезенки в процессе их циркуляции в зависимости от размеров и характеристики поверхности. Для преодоления этой проблемы НЧ могут покрываться гидрофильными полимерами. Такое покрытие эффективно защищает НЧ от захвата макрофагами [40, 58, 71]. Повышение гидратации также способствует увеличению растворимости НЧ и меньшей их чувствительности к ферментативной деградации, улучшая т. обр. биосовместимость (50). Недавно был испытан нанокомплекс paclitaxel с альбуми-ном (торговая марка Abraxane илиABI-007) для лечения метастазирующего рака молочных желез [41, 42]. На 3-й фазе клинических испытаний ABI-007оказал поразительную эффективность. В настоящее время более 10 противоопухолевых препаратов на основе полимерных НЧ включены в клинические исследования. Например, препарат HPMA-DOX показал в 4-5 раз меньшую токсичность для пациентов в сравнении с препаратом (антибиотиком) антрациклином [18, 27]. Препарат обладает существенной противоопухо-левой активностью у пациентов, нечувствительных к стандартной химиотерапии [27]. Недавно стало известно, что один из противоопухолевых препаратов на основе НЧ–paclitaxel poliglumex (Xyotax) обладает еще и радиосенсибилизирующим действием [42].
Направленный транспорт лекарственных нанопрепаратов. Пассивный направленный транспорт. Пассивный транспорт лекарств в организме осуществляется за счет таких характеристик, как размер НЧ и уникальные свойства кровоснабжения опухолевой ткани – усиленная проницаемость сосудистой стенки и эффект задержки (накопления) в опухоли [34, 50]. Эти свойства могут усилить эффектив-ность действия лекарств.
Усиленная проницаемость и эффект задержки. Ангиогенез является важным фактором прогрессивного роста опухоли. Ангиогенные кровеносные сосуды в опухолевой ткани, в отличие от нормальных тканей, имеют щели между близлежащими эндотелиальными клетками размером 600-800 нм [8, 30]. Такая дефектная сосудистая архитектоника, в совокупности со слабым лимфатическим дренажом и создает условия для реализации эффекта задержки, обеспечивая экстравазацию НЧ через межклеточные щели в опухолевую ткань. Эффект усиленной проницаемости и задержки в 10 и более раз увеличивает накопление лекарственного препарата в составе НЧ в опухоли в сравнении с содержанием свободного препарата [75]. Однако локализация НЧ в опухолевой ткани неравномерная. По-видимому, здесь играют роль размер НЧ, их поверхностные характеристики, время циркуляции НЧ в кровотоке, уровень ангиогенеза в опухоли. Обычно, слабое накопление НЧ присходит в пре-ангиогенных или некротизированных опухолях [8]. Длительно циркулирующие НЧ пассивно накапливаются в ткани опухоли за счет процессов увеличенной проницаемости и задержки.
Микроокружение в опухоли. Опухолевые клетки с высокой пролиферативной активностью обладают повышенным действием на факторы микроокружения. В частности, опухоли могут адаптироваться к гипоксии за счет активации гликолиза (81). Опухолевые клетки в повышенном количестве продуцируют и высвобождают некоторые ферменты, способствующие миграции клеток, метастазированию. Например, такие как металлопротеиназы [28]. Если некоторые рН-чувствительные молекулы инкорпорировать в липосомы вместе с лекарством, то его высвобождение из Л будет происходить при изменении рН среды (91). При этом, рН-чувствительные Л сохраняют стабильность в физиологических условиях (рН 7. 2), но распадаются в закисленной (гипоксичной) среде в опухолевой ткани. Таким же образом, термолабильные Л могут быть активированы для высвобождения инкапсулированного в них лекарства путем локальной гипертермии [54].
Активный направленный транспорт. Морфо-функциональные особенности опухолевой ткани, создающие условия для реализации пассивного накопления лекарств в ней, не решают всех проблем селективной доставки лекарства и его накопления в опухоли. Существенно большей селективности удается добиться при коньюгации НЧ с мишеневым лигандом или с антителами против опухолевых антигенов. Один из таких носителей –N- (2-гидроксипропил)метакриламид (ГПМА) – кополимер доксорубицин – галактозамина, связывается с асиало-гликопротеиновым рецептором гепатоцитов [27, 86]. На 1-2 стадиях предклинических испытаний эти направленные НЧ в 12-50 раз больше накапливались в ткани гепатоцеллюлярного рака печени, чем свободный доксорубицин (DОХ). При этом у пациентов отмечался явный противоопухолевый эффект. Покрытая опухоле-специфическими лигандами или антителами НЧ c лекарством внутри связывалась с поверхностными рецепторами и поглощалась опухолевыми клетками. Попадая в кислую среду клеточных эндосом, лекарство высвобождалось из НЧ в цитоплазму.
Поиски лигандов для направленного транспорта Поиск транспортных молекул для доставки лекарств к тканям-мишеням – воистину важнейшая задача. При этом весьма желательно, чтобы такая молекула индуцировала бы опосредованный рецепторами эндоцитоз. Сейчас уже имеется целый спектр таких молекул – это прежде всего антитела, ростовые факторы, цитокины [43, 44, 54, 65]. Недавние достижения в молекулярной биологии и генетической инженерии позволили создать модифицированные антитела для еще большей селективности доставки лекарств к мишеневым тканям. Моноклональные антитела (далее – монАТ) или их F (ab)2-фрагменты в последние годы активно исследуются на предмет селективных носителей для направленного транспорта лекартсв и достижения значительного терапевтического эффекта. Использование F (ab)2-фрагментов в качестве специфических транспортных молекул предпочтительно перед полными монАТ еще и потому, что фрагменты антител обладают намного меньшей иммуногенностью. Это значительно улучшает фармакокинетику коньюгированных с ними НЧ с лекарством [84, 85]. Такая стратегия улучшила терапевтическое действие иммунолипосом с доксорубицином направленных против антигенов серии СД19 на клетках человеческой В-клеточной лимфомы, трансплантированной животным [84, 85].
Мульти-функциональные наночастицы для визуализации опухолей. Традиционные технологии визуализации, такие как компьютерная томография (КТ) и магнитно-резонансная томография (МРТ), фокусируют внимание на морфологических характеристиках опухолей. –топографии, плотности и размерах, в зависимости от уровня разрешения аппаратуры и контрастных свойств тканей. Однако, при использовании неспецифических контрастных веществ, как это происходит в традиционных методах КТ и МРТ, чувствительность и информативность в значительной степени ограничены, снижая тем самым раннюю диагностику и возможности мониторинга лечебного процесса.
Совсем недавно были сконструированы КТ, испускающие световые сигналы в ближней инфракрасной области спектра [22, 88]. Свет этой длины волны проникает более глубоко в ткани в сравнении с видимой флуоресценцией и позволяет таким образом получать световой сигнал из глубоких областей тела экспериментальных животных. Основное преимущество КТ инфракрасной области – возможность получения четкого изображения с большой разницей между сигналом и фоном [95]. Уже удается получать четкое изображение лимфатических узлов у больших экспериментальных животных в реальном времени [22]. Т. обр, КТ стали прекрасными нанопробами для выявления специфичности опухолевых лигандов у животных и в культуре клеток ин витро. С их помощью возможно также изучение тканевого распределения специфичных КТ в режиме реального времени с использованием систем визуализации в ближнем инфракрасном диапазоне. Однако, существует проблема токсичности многих КТ из-за присутствия в них кадмия.
Для решения задач направленного транспорта к клеткам-мишеням важнейшим является активация поверхностных свойств НЧ и коньюгация с биомолекулами. Большая площадь поверхности НЧ на основе ОЖ и низкая токсичность стали поводом для их использования в качестве наноконтейнеров для направленного транспорта противоопухолевых агентов. Был сконструирован нанокомплекс, пригодный одновременно для получения изображения методом МРТ и доставки противоопухолевого антибиотика доксорубицина в опухоль [73]. Он представлял собой полимерные мицеллы, покрытые снаружи антителами против альфа-бета-гамма-интегринов и содержащие внутри доксорубицин. Недавние работы позволили создать ультра-чувствительные магнитные нанопробы для визуализации опухолей. Lee et al [60] сконструировали НЧ, коньюгированные с мон АТ против HER-2 антигена. Эти НЧ обладали улучшенными характеристиками для МРТ экспериментальных опухолей в сравнении с обычными НЧ на основе ОЖ.
Наноматериалы и нанотехнологии для радиотерапии онкозаболеваний. Радиоиммунотерапия (РИТ) – это перспективное направление, сочетающее достижения современной ядерной медицины, иммунологии и биотехнологии. Она основана на таргетной терапии с использованием терапевтических монАТ, соединенных с радиоактивными веществами (радионуклидами). Антитела специфически связываются с антигенными детерминантами на опухолевых или других клетках, а радионуклид уничтожает эти клетки путем локального облучения. РИТ более эффективна применительно к небольшой опухолевой массе или для лечения минимальной остаточной болезни. Именно в этих случаях меченные мон АТ способны связаться с клеточными мишенями и оказать тумороцидный эффект за счет доставленной дозы радиации [55, 62, 74]. Радиоиммунотерапия стала активно изучаться почти 50 лет назад, но прошло около 25 лет, прежде чем теоретические знания нашли свое клиническое применение.
В настоящее время более 20 моноклональных антител (CD20, CD22, CD25, CD37, CD71, HLA-DR и др. ) отобраны в развитых странах для клинического применения и уже многие из них используются для диагностики и лечения различных онкологических и других заболеваний, в том числе и методами РИТ. В зависимости от основных свойств радиоизотопа, он может быть более полезен для диагностики и/или для радиотерапии. Например, радиоиммунотерапия использует преимущества специфического взаимодействия антитела с антигеном, чтобы осуществить направленный транспорт радиофармпрепарата для локального облучения патологического очага. В России первые исследования с использованием меченных радионуклидами противоопухолевых антител для диагностики и терапии опухолей были проведены группой Анохина Ю.Н. в 1984-1988 годах [1, 2]. Результаты экспериментальных работ на животных с трансплантатами солидных опухолей были обнадеживающими и показали высокую специфичность взаимодействия меченных 131I противоопухолевых антител с мишеневыми антигенами в сравнение с неспецифическими иммуноглобулинами, меченными 125I [2]. Концентрация противоопухолевых антител в ткани опухоли превышала в 7-10 раз содержание этих антител в нормальных тканях.
Выбор радионуклида. Терапевтическая эффективность РИТ напрямую зависит от выбора радионуклида. Выбор радионуклидов с оптимальными ядерно-физическими характеристиками и носителей для селективной доставки радионуклидов к очагу опухолевого или неопухолевого поражения является основой для создания эффективных и безопасных радиофармпрепаратов. Обычно использующиеся агенты, как правило, основаны на радиоактивных галогенсоединениях на основе изотопов йода. Однако эти агенты имеют ряд ограничений. Например, использование изотопов йода в значительной степени ограничено высокой скоростью разрушения связи углерод-йод in vivo. Другое ограничение относится к не идеальным характеристикам фармакокинетики и ядерно-физическим характеристикам (периодам полураспада) радионуклидов йода. В соответствии с этим были сделаны попытки разработки новых агентов для обнаружения опухолевых клеток, чтобы преодолеть недостатки радиоактивных агентов для мечения на основе галогенов. Бета-частицы 131I и 90Y наиболее часто используются для радиоиммунотерапии (таблица). Радиоизотопы 186Re и 177Lu стали применяться относительно недавно. Физические характеристики этих четырех радионуклидов значительно отличаются по периоду полураспада, присутствию гамма-лучей, энергии бета-излучения и глубине проникновения бета-частиц в биологические ткани. В качестве дополнительных радионуклидов используют 125I, 188Rh (γ-излучение), 67Co (β-излучение), 213Bi, 211At, 225Ac (α-излучение) и др. Конъюгированные с радионуклидами антитела открыли возможность избирательного облучения опухолевой ткани без значимого воздействия на окружающие нормальные ткани. Антитела выполняют ключевую роль в целенаправленной доставке радиоизотопа к опухолевым клеткам-мишеням.
Некоторые радионуклиды, пригодные для радиоиммунотерапии
Один из важных этапов в обследовании онкологических больных занимают методы визуализации (выявления) новообразований различных органов и систем (особенно внутренней локализации).
Они позволяют также уточнить локализацию и характер опухолевого процесса, оценить состояние окружающих опухоль тканей, наличие или отсутствие регионарных и/или отдаленных метастазов.
Кроме этого, методами визуализации можно осуществлять мониторинг патологического процесса, а также оценивать эффективность специальных методов лечения опухолевых и предопухолевых заболеваний.
Такая информация может быть получена при эндоскопическом исследовании или при изучении пропускаемого или испускаемого ионизирующего или отраженного неионизирующего излучения либо механической вибрации (ультразвук). Все эти методы, за исключением ультразвукового, основаны на электромагнитном излучении (ЭМ) в различных областях энергетического спектра.
По историческим причинам различные участки ЭМ-спектра имеют различные названия, но реально они относятся к одному и тому же явлению — электромагнитному излучению. Ультразвуковая визуализация основана на улавливании колебаний, генерируемых пьезоэлектрическим кристаллом.
Методы визуализации
Методы визуализации основываются на различных физических принципах формирования изображения.
Рентгеновские исследования представляют собой визуализацию теней. Рентгеновское излучение возникают из-за изменений в электронных оболочках. Различные ткани пропускают разное количество квантов, которые затем на обратной стороне пациента проецируются на плоскость (экран-пленка, усилитель изображения, блок компьютерной томографии (КТ)) для показа изображения.
При обычном рентгеновском исследовании отображается весь объем ткани, а на пленке затемненность различных органов суммируется и формируется контрастный рисунок. Традиционная томография является методом, при котором изображения объектов вне избранной плоскости размываются посредством комбинации синхронного движения рентгеновской трубки и экрана/пленки.
Компьютерная томография — метод изолированного изображения поперечного (аксиального) слоя тканей. При этом излучение направляется только на тонкий слой тканей, для отображения которых в цифровой форме используется компьютер. Главным преимуществом данного метода является хорошее контрастное разрешение.
Магнитно-резонансная томография (МРТ) — радиочастотное излучение возникает при возбуждении радиоволнами непарных ядер атомов в сильном внешнем магнитном поле из-за изменений в ядерной орбите, изменений спина и т.п. Визуализация изображения производится по срезам.
Ультразвуковое исследование (УЗИ) — высокочастотные лучи направленных ультразвуковых волн отражаются обратно в направлении датчика и формируют изображение исследуемого объекта.
Радионуклидная визуализация — изотопы, концентрируясь в определенных тканях, испускают гамма-излучение, которое регистрируется в виде сцинтиграммы Перечисленные виды излучений (рентгеновское, гамма-, бета- и альфа-излучение) обладают способностью ионизировать атомы и разлагать молекулы, что может вызывать повреждения на биологическом уровне.
Использование неионизирующих методов, таких как ультразвук или магнитный резонанс, более предпочтительно из-за присущей им безопасности, не говоря о других их преимуществах. Основные характеристики всех 5 видов визуализации сопоставлены в таблице 8.3.
Таблица 8.3. Основные характеристики методов визуализации [Шотемор Ш.Ш., 2001]. 
Угляница К.Н., Луд Н.Г., Угляница Н.К.

Во-первых, они вычислили, что детям с родителями болеть было выгодно. Родители водили возле больных хороводы и задаривали подарками и вниманием. И многие дети понимали, что как только они выздоровеют – эта красота закончится, нужно будет ходить в школу и сполна получать разные наказания за невыученные уроки и плохое поведение. Так называемая вторичная выгода от болезни.
А вот через сколько лет после этих йоговских методик ученые почти создали лекарство, которое будет давать мозгу такую же команду о выздоровлении. А если без лекарства-посредника попробовать? Получится? Конечно!
Можно практически любую процедуру выполнять в мозгу.
При проблемах позвоночника, помимо действий на физическом плане (специальные упражнения для развития и укрепления мышц спины) также очень помогает визуализация. Найдите картинку с хорошим изображением здорового позвоночника и изучите ее, чтобы знать, что визуализировать. Мысленно раскладываем позвоночник на плоскости (боком кверху), слегка растягиваем и очень осторожно выпрямляем. Действия похожи на мягкое разглаживание выпуклости и равнение к плоскости стола. Одновременно дышим через область, которую визуализируем.
Вдох – здоровая энергия наполняет орган. Выдох – проблемы выходят. Если воображение хорошее – можете представлять зеленоватый цвет на входе (он считается более оздоровляющим), а на выдохе вы будете видеть более серую массу. С улучшением состояния на выдохе будет такой же цвет, как и на вдохе – цвет здоровья.
Во всех видах мысленного лечения ОБЯЗАТЕЛЬНО представлять сам процесс изменений состояния или, в крайнем случае, – конечный результат работы. В данном случае вы, работая с позвоночником, представляете прямой красивый позвоночник и самого себя с прекрасной осанкой. И чем ярче представление – видение, тем быстрее идёт лечение. Лечение очень простое, но длительное. Несколько минут в день, перед засыпанием или после пробуждения.
Способы лечения воспалений:
– работа с живой и мёртвой водой. Чистим ранку мёртвой водой, промываем чистой и затем омываем живой. В общем, как в сказке.
– энергетический. Чистим ранку энергетическим вихрем против часовой стрелки (или применяем «спец. пылесос\”), затем промываем голубой энергией и после этого омываем энергетическим вихрем по часовой стрелке.
Разглаживание утолщённой ткани (шрама) на месте бывшего воспаления (если уж он появился, так как вы еще не знали, что даже очень глубокие раны заживают практически без шрамов при применении турмерика:
– сказочный – мысленно поливаем живой водой
– энергетический – работаем энергетическим вихрем
Во всех методах есть главное – надо очень чётко себе представить цель работы, т.е. в процессе работы представлять, как утолщённая ткань становится тоньше и превращается в здоровую и эластичную.
С внутренним воспалениями немного сложнее, так что не буду описывать, чтобы вы себе не навредили.
Лёгкие можно мысленно развернуть на плоскости и все каверны (воспалительные очаги) подставить солнцу, при этом представляем, что каверны испаряются и замещаются здоровой тканью. На физическом уровне можно дополнительно греть руки до локтя в горячей воде.
Яркий рассказ избавления от проблемы при аюрведическом стиле жизни, и использование визуализации (в комплексе мер):
Читайте также:

