В лечении остеогенной саркомы лучевая терапия используется
14) ОПУХОЛИ МЯГКИХ ТКАНЕЙ И КОСТЕЙ
001.В основе дифференциальной диагностики первичных опухолей костей лежит
002.Первичные злокачественные опухоли костей необходимо дифференцировать
а)с фиброзной дисплазией
б)с хроническим остеомиелитом
в)с костно-хрящевым экзостозом
(+) г)все ответы верные
003.Остеогенные саркомы чаще всего встречаются в возрасте
б)от 30 до 40 лет
в)от 40 до 50 лет
004.Саркомы Юинга наиболее часто встречаются в возрасте
б)от 30 до 40 лет
в)от 40 до 50 лет
005.Хондросаркомы наиболее часто встречаются
а)в детском возрасте
б)в юношеском возрасте
(+) в)у людей старше 40 лет
г)в любом возрасте
006.К факторам, влияющим на развитие первичных опухолей костей, относятся
а)нарушение внутриутробного развития
б)влияние физических факторов
в)влияние химических факторов
(+) д)все ответы верные
007.К костно-мозговым саркомам относятся
008.Для остеогенной саркомы характерны следующие рентгенологические признаки
а)наличие "треугольника" (козырька) Кодмана
в)оссификация внекостного компонента
(+) г)все ответы верные
010.Остеогенная саркома, как правило, метастазирует
г)все ответы верные
011.При лечении саркомы Юинга ведущая роль отводится
(+) а)лучевой терапии + химиотерапии
в)хирургическому лечению с последующей послеоперационной химиотерапией
г)все ответы верные
012.Хондросаркома чаще возникает
б)в длинных трубчатых костях
в)в плоских костях
г)в мелких костях стопы и кисти
013.Для хондросаркомы высокой степени морфологической зрелости свойственно
(+) а)медленное развитие с малой выраженностью симптомов
в)наличие сильных постоянных болей
г)частые патологические переломы
014.Лучшие отдаленные результаты после хирургического лечения первичной хондросаркомы получены
(+) а)при I степени злокачественности
б)при II степени злокачественности
в)при III степени злокачественности
г)степень злокачественности значения не имеет
015.У больной 48 лет выявлена хондросаркома бедренной кости II степени злокачественности. Наиболее целесообразно проведение
(+) б)только хирургического лечения
016.Применение комплексного лечения при остеогенной саркоме нижних конечностей позволяют получить 5-летнюю выживаемость
017.Первичной саркомой Юинга могут поражаться
а)только длинные трубчатые кости
б)только плоские кости
(+) в)длинные трубчатые и плоские кости
018.Морфологическая верификация первичной саркомы костей необходима
а)для уточнения диагноза
б)для выбора метода лечения
в)для решения вопроса об объеме хирургического вмешательства
(+) г)все ответы верные
019.Гигантоклеточные опухоли чаще всего локализуются
а)в диафизе длинных трубчатых костей
(+) б)в метаэпифизе длинных трубчатых костей
в)в плоских костях
г)все ответы верные
020.Гигантоклеточные опухоли могут развиваться
а)как доброкачественные опухоли
б)как первичные злокачественные опухоли
в)как вторичные злокачественные опухоли
(+) г)все ответы верные
021.Для злокачественной остеобластокластомы характерны
б)локализация в метаэпифизарных отделах длинных трубчатых костей
в)умеренные боли локального характера
(+) г)все ответы верные
022.Рентгенологическая картина остеобластокластомы характеризуется
а)крупным литическим очагом в эпифизе кости, иногда с остатками ячеистой структуры
б)нарушением кортикального слоя
в)экстраоссальным компонентом, не содержащим дополнительных включений
г)периостальной реакцией в виде "козырька"
(+) д)все ответы верные
023.Прогноз при хондросаркоме зависит 1)от формы опухоли (первичной или вторичной) 2)от степени морфологической зрелости 3)от возраста больного 4)от адекватного объема хирургического вмешательства 5)от дозы лучевой терапии 6)от методики послеоперационной химиотерапии
а)все ответы правильные
(+) б)правильные 1, 2, 3 и 4
в)правильные 3, 4, 5 и 6
г)правильные 1, 2 и 3
д)правильные 4, 5 и 6
024.При лечении сарком Юинга основным методом является
(+) д)правильные ответы б) и в)
025.При выборе уровня ампутации нижней конечности целесообразно учитывать следующие моменты
б)морфологическое строение опухоли
в)получение наиболее функциональной культи для протезирования
г)верные ответы а) и в)
(+) д)все ответы верные
026.Лучевая терапия может быть адекватным методом лечения
в)при саркоме Юинга
(+) д)правильные ответы б) и в)
027.Суммарная лечебная очаговая доза при лучевой терапии гемангиомы костей должна составлять
028.Суммарная лечебная очаговая доза при X-гистиоцитозе костей должна составлять
029.Лучевая терапия нецелесообразная
б)при гигантоклеточной опухоли
в)при эозинофильной гранулеме
г)правильные ответы а) и б)
д)правильного ответа нет
030.Наиболее радиочувствительной является
031.В лечении остеогенной саркомы лучевая терапия используется
а)как возможный компонент радикального лечения
б)как один из элементов комплексного лечения
в)как паллиативный метод при неоперабельных опухолях
г)лучевая терапия нецелесообразна
(+) д)правильные ответы б) и в)
032.При лечении метастазов остеогенной саркомы в легкие лучевая терапия
б)целесообразна только в комбинации с химиотерапией
г)правильные ответы а) и б)
033.Лучевая терапия является ведущим методом лечения
(+) в)при опухоли Юинга
г)все ответы правильные
д)правильного ответа нет
034.При лучевой терапии саркомы Юинга лечебными дозами принято считать
035.В лечение ретикулосаркомы костей лучевая терапия используется
а)как основной метод лечения
б)как паллиативный метод лечения
в)в качестве предоперационного курса
(+) г)правильные ответы а) и б)
д)правильные ответы б) и в)
036.При лучевой терапии ретикулосаркомы кости наиболее целесообразно подведение СОД
037.К радиочувствительным может быть отнесена
г)правильные ответы а) и б)
(+) д)правильного ответа нет
038.При лечении злокачественных опухолей мягких тканей применение лучевой терапии наиболее целесообразно
а)как самостоятельный метод лечения
б)в предоперационном периоде
в)в послеоперационном периоде
г)правильные ответы а) и б)
(+) д)правильные ответы б) и в)
039.Злокачественные опухоли мягких тканей могут развиваться из следующих исходных тканей
(+) д)все ответы верные
040.Функция конечностей при саркоме мягких тканей нарушается
(+) б)как правило, при запущенных процессах
041.Постоянным признаком, который наблюдается у больных саркомами мягкими тканей, является
(+) а)ограничение подвижности опухоли
г)нарушение функции конечности
042.Для диагностики злокачественной опухоли мягких тканей могут быть применены следующие рентгенологические методы исследования
б)ангиография и флебография
043.К метастазирующим опухолям мягких тканей относятся
045.Метастазировать в кости может
а)рак молочной железы
г)правильные ответы а) и б)
(+) д)все ответы верные
046.К доброкачественным костеобразующим опухолям относятся
(+) в)все ответы верные
047.К костно-мозговым опухолям относятся
048.К доброкачественным опухолям из хрящевой ткани относятся
(+) г)все ответы верные
049.Злокачественные опухоли костей относятся к соединительнотканным
(+) в)все ответы верные
050.К опухолям мягких тканей из фиброзной ткани относятся
(+) г)все ответы верные
051.Опухоли мягких тканей могут развиваться
а)из фиброзной ткани
б)из жировой ткани
в)из мышечной ткани
г)из синовиальной ткани
(+) д)все ответы верные
052.Опухоли из синовиальных тканей могут быть
(+) в)все ответы верные
053.Феохромоцитома и хемодектома относятся к опухолям
Остеосаркома — это злокачественная опухоль, произрастающая из клеток костной ткани. Это очень редкий вид новообразования, большинство видов которого характеризуется быстрым ростом и агрессивным течением. Остеосаркому не надо путать с метастазами в кости, поскольку те являются результатом распространения новообразований, первично развившихся в других органах.
Главной особенностью остеосаркомы является то, что ее клетки способны производить костную ткань, но она является незрелой. Из нее не может образовываться основное костное вещество, и в ней не происходит кальцинирования. Эта черта отличает остеосаркомы от других злокачественных и доброкачественных опухолей костей.
- Причины возникновения
- Симптомы
- Диагностика
- Лечение
- Осложнения
- Прогноз при остеосаркомах
- Профилактика
Что касается эпидемиологии, то частота заболеваемости составляет 10-26 случаев на 1 млн человек в год. Чаще страдает мужское население. Соотношение мужчин и женщин 1,36/1. Имеется два пика подъема заболеваемости. Первый приходится на возраст 10-14 лет, а второй на возраст старше 40 лет. Очень редко новообразование регистрируется у детей младше 5 лет.
Остеосаркомы плоских костей чаще наблюдаются у людей старшей возрастной группы. При этом, в основном страдает кость нижней челюсти и кости таза. Могут поражаться и позвонки.
Причины возникновения
Причины возникновения саркомы костей пока изучены недостаточно. Раньше считалось, что спровоцировать развитие опухоли могут травмы, но на сегодняшний день многие врачи склоняются к мнению, что травма только способствует скорейшему росту уже образованной остеосаркомы, но не ее возникновению.
Возможными предрасполагающими факторами являются:
- Воздействие ионизирующего излучения. Например, прохождение лучевой терапии. В этом случае остеосаркомы могут развиваться через несколько лет от момента завершения терапии.
- Наличие инородных тел в кости — импланты, ортопедические конструкции.
- Есть данные, что риски развития остеосаркомы выше у детей, у которых масса тела при рождении превышала 4046г, а также у людей с ростом выше среднего.
- Наличие генетических синдромов — врожденная ретинобластома, синдром Ротмунда-Томпсона, синдром Ли-Фраумени и др.
- Наличие доброкачественных новообразований костей — фиброзная дисплазия, костные кисты.
Однако чаще всего опухоль возникает de novo, без каких-либо предрасполагающих факторов.
Симптомы
Нарастание симптоматики при саркоме происходит постепенно. Сначала пациенты отмечают боль в области локализации опухоли. Она может быть сходна с болью при артритах, миозитах и миалгиях, усиливается по ночам или после физических нагрузок. Но в отличие от вышеперечисленных заболеваний, она со временем не ослабевает, а наоборот, усиливается.
Постепенно размеры новообразования увеличиваются, и в процесс вовлекаются мягкие ткани. Над местом поражения возникает припухлость. Кожа в этой области может быть покрасневшей, с усиленным венозным рисунком. В запущенных стадиях на ней образуются изъязвления.
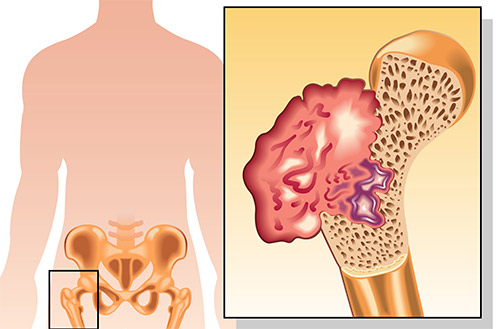
При возрастании объема поражения, развиваются ограничения объема движения в пораженном сегменте скелета. Кроме того, может образовываться внутрисуставной выпот, патологические переломы (которые возникают без существенных нагрузок). На последних стадиях заболевания присоединяется потеря массы тела, вплоть до кахексии.
Диагностика
Для диагностики остеосаркомы используются следующие методы обследования:
- Клинический осмотр и сбор анамнеза.
- Рентгенологические исследования.
- Лабораторные исследования.
Во время осмотра доктор обращает внимание на локализацию боли, на изменения конфигурации пораженного сегмента, кожной гиперемии и венозного рисунка. Также отмечают наличие или отсутствие ограничений движения в пораженных конечностях.
Далее пациента направляют на рентгенологическое исследование. Это может быть простой рентген или компьютерная томография. В пользу остеосаркомы говорят следующие признаки:
С помощью компьютерной томографии более точно оценивают размеры новообразования, место его локализации и вовлеченность соседних мягких тканей (мышц, сухожилий, синовиальных оболочек). Также с ее помощью можно обнаружить скип-метастазы — близкорасположенные или прыгающие метастазы. С помощью МРТ оценивается вовлеченность в процесс костного мозга.

Для окончательной постановки диагноза и определения вида остеосаркомы, необходимо провести морфологическое исследование. Для этого с помощью биопсии берут небольшой фрагмент новообразования и направляют его в лабораторию для специального исследования.
Также в рамках диагностики осуществляют поиск отдаленных метастазов. Как правило, ограничиваются костями, легкими и головным мозгом, поскольку изолированное метастазирвание в другие органы встречается крайне редко. Для обследования легких и головного мозга проводят спиральную КТ. Для поиска метастазов в других костях скелета применяют сцинтиграфию или ПЭТ.
Лечение
Как правило, остеосаркома требует комплексного подхода в лечении, и с этой целью применяется хирургия, химиотерапия и лучевая терапия. Хирургия, как самостоятельный метод лечения, применяется только при низкозлокачественных остеосаркомах, например, при хондросаркоме. Если же опухоль высокозлокачественная, помимо операции потребуется длительный курс химиотерапии, чтобы уничтожить возможные метастазы и предотвратить их возникновение.
Как мы уже говорили, операция является краеугольным камнем в лечении большинства видов остеосарком. Стандартом является радикальное иссечение опухоли в пределах здоровых тканей. С этой целью проводят вмешательства в следующих объемах:
- Ампутации — полное удаление пораженной конечности или фрагмента скелета.
- Экзартикуляция — вычленение пораженного сегмента по линии суставной щели. При этом опиливание костей не производится.
- Органосохраняющие вмешательства.
На сегодняшний день, по возможности, стараются провести органосохраняющее лечение, например, удаление пораженного фрагмента кости с последующей костной пластикой или эндопротезированием сустава. В качестве костной пластики используются либо синтетические материалы, либо собственные костные ткани пациента, взятые из другого отдела скелета. При лечении детей используют растущие эндопротезы.
К сожалению, органосохраняющее лечение удается провести не всегда. Противопоказанием к нему служат:
- Наличие патологических переломов с сильным болевым синдромом.
- Обширное вовлечение в процесс мягких тканей, в частности мышц.
- Распад опухоли.
- Вовлечение в процесс кровеносных сосудов и нервных стволов на большом протяжении.
- Кровотечение из вовлеченных кровеносных сосудов.
- Наличие инфекционных осложнений со стороны опухоли.
- Наличие массивного обсеменения злокачественными клетками костных тканей.
- Выраженные симптомы интоксикации.
При обнаружении одиночных метастазов, также проводят их хирургическое удаление. Если имеются одиночные очаги в легких, проводят торакотомию, однако во время операции требуется тщательная пальпация обоих легких, поскольку есть высокая вероятность обнаружения большего количества метастазов, чем те, которые были выявлены лучевыми методами диагностики.
Некоторые остеосаркомы (саркома Юинга) являются радиочувствительными. При их лечении можно избежать операции и ограничиться облучением и химиотерапией. Но большинство костных опухолей резистентны к лучевому воздействию, поэтому данное лечение применяется только на распространенных стадиях для уменьшения болевого синдрома.
Химиотерапия имеет большое значение при лечении высокозлокачественных остеосарком. Ее назначают в неоадъювантных и адъювантных режимах, и у большинства пациентов продолжительность лечения может достигать 12 месяцев.
Неоадъювантная химиотерапия проводится в течение нескольких недель перед операцией. Ее целью является уменьшение размеров опухоли, создание условий для радикальной операции и определение индивидуальной химиочувствительности остеосаркомы. Последний момент является очень важным для определения прогноза заболевания.
Послеоперационная химиотерапия проводится в течение нескольких месяцев после удаления опухоли. Используются полихимиотерапевтические схемы, включающие в себя адриамицин, метотрексат в высоких дозах совместно с фолиевой кислотой, цисплатин и фосфамид. При выборе схемы послеоперационной ХТ основываются на ответе опухоли на неоадъювантную химиотерапию. Если ответ был неудовлетворительным, используют особые схемы лечения, которые называют постоперационной терапией спасения.
Осложнения
Остеосаркома может привести к развитию следующих осложнений:
- Патологические переломы — это переломы, которые возникают без воздействия травмирующего фактора. Дело в том, что остеосаркома приводит к нарушению остеогенеза, в месте локализации опухоли костная ткань не является достаточно прочной и не может выдержать обычную нагрузку, что приводит к образованию перелома от малейшего воздействия.
- При поражении ростовой пластинки трубчатых костей может нарушаться синхронный рост конечностей.
- При лечении заболевания может потребоваться обширная операция или ампутация конечностей, что приводит к инвалидизации пациента.
Прогноз при остеосаркомах
Прогноз заболевания будет зависеть от многих факторов, например:
- Место локализации опухоли. Наиболее неблагоприятно протекает остеосаркома, локализующаяся в области метафиза трубчатых костей, а, например, остеосаркома, которая располагается в области свода черепа, отличается более медленным течением и редко дает метастазы, даже если это высокозлокачественный тип опухоли.
- Размер первичного очага. Чем больше новообразование, тем хуже прогноз.
- Возраст и общее состояние пациента. Более благоприятно протекает остеосаркома у детей. Хуже обстоят дела у людей пожилого и старческого возраста ввиду изначально ослабленного здоровья и ограничений в проведении агрессивных курсов химиотерапии.
- Чувствительность новообразования к проводимому химиотерапевтическому лечению.
- Возможность проведения радикальной операции.
Раньше остеосаркома считалась агрессивной опухолью, и результаты ее лечения были неудовлетворительными даже после проведения обширных радикальных операций. Пятилетний рубеж переживало около 10% больных. На сегодняшний день с введением новых химиотерапевтических схем результаты лечения стали намного лучше. Пятилетняя выживаемость при локализованной опухоли составляет более 70%, а при хорошей химиочувствительности — 80%.
Профилактика
На сегодняшний день эффективных методов профилактики остеосаркомы нет, тем не менее может быть рекомендовано соблюдение общих принципов здорового питания и физической активности, борьба с вредными привычками.
Злокачественные опухоли костей в структуре заболеваемости злокачественными новообразованиями занимают менее 1 % у взрослых и 7-10% у детей.
Наиболее часто встречаются саркомы семейства Юинга, остеосаркома, хондросаркома, злокачественная фиброзная гистиоцитома кости.
Первичная опухоль (Т)
ТХ — первичная опухоль не оценена.
Т0 — первичная опухоль отсутствует.
Т1 — опухоль 8 см и менее.
Т2 — опухоль 8 см и более.
ТЗ — первичные множественные опухоли кости.
Регионарные лимфоузлы (N)
NX — лимфоузлы не оценены.
N0 — отсутствие метастазов в регионарных лимфоузлах.
N1 — метастазы в регионарных лимфоузлах.
Отдаленные метастазы (М)
MX — недостаточно данных для оценки отдаленных метастазов.
М0 — нет отдаленных метастазов.
M1 — отдаленные метастазы.
M1а — легкое.
M1b — другие локализации.
Степень дифференцировки (G)
GX — не может быть оценена.
G1 — высокодифференцированная (низкая степень злокачественности).
G2 — умеренно дифференцированная (низкая степень злокачественности).
G3 — низкодифференцированная (высокая степень злокачественности). G4 — недифференцированная (высокая степень злокачественности).
Внимание: саркома Юинга и примитивные нейроэктодермальные опухоли (PNET) всегда G4.
В табл. 9.46 приводится группировка опухолей костей по стадиям.
Таблица 9.46. Группировка злокачественных опухолей костей по стадиям

Остеосаркома
Регистрируется около 700-900 новых случаев в год, отмечается бимодальный пик во зторой-третьей и шестой декадах жизни, встречается в 2 раза чаще у лиц мужского пола и составляет 45 % всех первичных злокачественных опухолей костей.
Локализуется преимущественно в метафизах трубчатых костей — дистальная часть бедренной кости, проксимальная часть большеберцовой кости и проксимальная часть плечевой кости (три наиболее часто встречающиеся локализации, расположены по мере убывания частоты встречаемости), в 90% случаев характеризуется выраженным чягкотканным компонентом.
Первичная причина неизвестна, более чем в 90% отмечается делеция гена Rb, из вторичных необходимо отметить экспозицию радием, предшествующую лучевую терапию, болезнь Педжета, другие доброкачественные опухоли костей.
Для классификации и стадирования используется система, общая для злокачественных опухолей костей, — AJCC (TNM) и MSTS (Enneking).
Диагностика остеосаркомы проводится по следующим характеристикам.
Клинические признаки — возраст, локализация, анамнез и данные объективного осмотра (болевой синдром, горячая, твердая — каменистой плотности опухолевая масса и, редко, патологические переломы).
Рентгенологическая оценка: на этапе обследования целесообразно выполнить рентгенографию пораженной кости, сцинтиграфию костей скелета для выявления костных метастазов, компьютерная томография (КТ) зоны первичной опухоли (для детальной визуализации костных структур), магнитно-резонансная томография (МРТ) для визуализации мягкотканного компонента и костномозговых структур, рентгенографию и КТ грудной клетки для исключения метастатического поражения легких.
Ангиография не используется в качестве метода диагностики, но очень информативна для оценки степени ответа опухоли на предоперационную химиотерапию (XT).
Патоморфологическая верификация: в большинстве случаев толсто игольная биопсия позволяет поставить патоморфологический диагноз, в редких случаях используется трепан- или открытая биопсия. Биопсия должна выполняться в специализированных учреждениях, в которых есть группа по лечению сарком, и в идеале тем же хирургом-ортопедом, который будет впоследствии выполнять хирургический этап лечения. Зона биопсии должна быть удалена вместе с первичной опухолью, что крайне важно и критически влияет на отдаленные результаты всего комплексного лечения.
Ранее 2-летняя выживаемость больных с остеосаркомой, получивших только хирургическое лечение, составляла 5-20%, что связано с очень высоким процентом метастазирования в легкие и кости. Эти данные стимулировали проведение рандомизированных исследований с использованием адъювантной XT, которые показали значительное преимущество по всем онкологическим показателям по сравнению с только хирургическим подходом.
В настоящее время стандартом лечения считается комплексный подход с использованием предоперационной (неоадъювантной) химиотерапии, хирургического лечения и адъювантной химиотерапии. Использование предоперационной XT дает возможность выполнять органосохраняющие операции в 80-90% случаев, при этом можно оценить эффективность режима XT in vivo для правильного выбора схемы адъювантной терапии, что позволяет в 50-80% случаев добиться полного излечения пациентов в результате комплексного лечения.
Xимиотерапию используется на пред- и послеоперационном этапах. При достижении IV степени лечебного патоморфоза (более 90% некротизированных клеток) удается значительно увеличить показатели общей выживаемости. Предоперационная XT проводится, как правило, в течение 3-4 мес. перед хирургическим лечением. Выбор режима послеоперационной XT проводится по данным гистологического исследования удаленного материала.
К наиболее эффективным препаратам относятся цисплатин, доксорубицин, ифосфамид, метотрексат в высоких дозах.
Для лечения остеосарком используются комбинированные режимы химиотерапии или монохимиотерапия в высоких дозах (ифосфамид 14 г/м2).
1. Проведение 3-4 курсов предоперационной XT с использованием следующих режимов. Доксорубицин — 90 мг/м2 96-часовая инфузия по 22,5 мг/м2 в сутки в 1-4-й день. Цисплатин — 120 мг/м2 внутриартериально (только при первичной опухоли) или в/в в 6-й день. Интервал между курсами 28 дней.
2. Через 1 мес. после завершения предоперационной XT выполняется оперативное вмешательство.
3. Оценка степени лечебного патоморфоза и послеоперационная химиотерапия.
Если количество некротизированных клеток в операционном материале составляет 90% и более, рекомендуется проведение еще 3-6 курсов (зависит от достижения кумулятивной дозы доксорубицина 800 мг/м2 при использовании инфузионного варианта введения) послеоперационной XT по прежней схеме. При невозможности дальнейшего использования цисплатина рекомендуется переход на схему: доксорубицин 75 мг/м2 72-часовая инфузия + ифосфамид 2,5 г/м2 3-часовая инфузия в 1-4-й день на фоне месны.
Если количество некротизированных клеток в операционном материале составляет менее 90%, рекомендуется переход на альтернативный режим XT. Альтернирующий режим по следующей схеме.
Высокодозный метотрексат — 12 г/м2 в/в с лейковорином 1 раз в 2 нед. в течение 8 нед. Данный режим введения должен использоваться в соответствии со специально разработанным протоколом введения в специализированныхучреждениях.
Далее через 3 нед. после окончания 2-го курса по схеме:
Ифосфамид — 2 г/м2 3-часовая инфузия + месна 100% по схеме в 1-5-й день.
Доксорубицин — 75 мг/м2 72-часовая инфузия.
Колониестимулирующий фактор (КСФ) (филграстим и т.п.) — 5 мкг/кг п/к в 6-16-й день.
Интервал между курсами 3 нед.
Далее повторение всего цикла (4 курса метотрексата, 2 курса ифосфамида с доксорубицином) и в завершение 4 курса метотрексата.
Проведение этого высокоэффективного комплексного лечения возможно только в специализированных медицинских учреждениях.
Подходы к лечению метастатического процесса существенно отличаются при метастатическом поражении легких и костей. Проявление болезни в костях свидетельствует о крайне плохом прогнозе. При наличии первичной опухоли и метастатического поражения легких у пациентов, ранее не получавших специфического лечения, должна применяться тактика, направленная на излечение, а не с паллиативной целью.
Так, при хорошем ответе на предоперационную химиотерапию возможно выполнение полной метастазэктомии, при этом безрецидивная и общая выживаемость могут составлять более 30%. Таким пациентам должно проводиться комплексное лечение, как и при локализованных формах.
При появлении симптомов болезни более чем через 6 мес. после комплексного лечения возможно повторное использование ранее применявшихся схем.
Большинство пациентов после комбинированного лечения уже получали 4 наиболее эффективных схемы XT, стандартов в лечении диссеминированного процесса нет.
Наилучшие результаты показала схема IE:
Ифосфамид — 1800 мг/м2 в/в 3-часовая инфузия в 1-5-й день + месна 120% по схеме.
Этопозид — 100 мг/м2 в/в в 1-5-й день.
КСФ — 5 мкг/кг п/к в 6-16-й день.
Интервал между курсами 3 нед.
В настоящее время продолжают изучать эффективность комбинации гемцитабина и доцетаксела при диссеминированных остеогенных саркомах. По данным II фазы исследования, эффективность этого режима составляет до 30%.
Гемцитабин — 675 мг/м2 в/в 90-минутная инфузия в 1-й и 8-й дни.
Доцетаксел — 75 мг/м2 в 8-й день.
КСФ — 5 мкг/кг п/к в 9-19-й день.
Интервал между курсами 3 нед. (каждые 21 день).
Хондросаркома
Хондросаркома — вторая по частоте саркома костей.
Большинство пациентов старше 40 лет, только 4% пациентов моложе 20 лет.
Локализация: таз — 30%, бедро — 20% и плечевой пояс — 15%. Хондросаркома — наиболее частая злокачественная опухоль лопатки и грудины.
Основная симптоматика появляется за счет механического сдавления окружающих тканей. При жалобах пациента на болевые ощущения в области образования, которое выглядит как энхондрома, следует предполагать наличие хондросаркомы.
Выделяют три основных подтипа:
Классическая хондросаркома (G1-3)
Классические хондросаркомы химиорезистентны, и единственным методом лечения является хирургический. Они представлены в основном образованиями I-II степени злокачественности. Классические хондросаркомы III степени злокачественности метастазируют в 75 % случаев. В настоящее время эффективных режимов XT для лечения классических хондросарком не существует.
Мезенхимальная хондросаркома
Мезенхимальная хондросаркома характеризуется мелкоклеточным компонентом, химиочувствительна, является редкой, высокозлокачественной опухолью, в основном наблюдается у молодых пациентов, поражает плоские кости, 10-летняя выживаемость составляет 28%. Тактика лечения своеобразная — хирургическое удаление и послеоперационная химиотерапия (режимы, как при саркоме Юинга/PNET). Может отвечать на лучевую терапию.
Дедифференцированная хондросаркома
Дедифференцированная хондросаркома химиочувствительна. Дедифференцированный компонент, как правило, представлен остеосаркомой или злокачественной фиброзной гистиоцитомой, для лечения используются соответствующие режимы полихимиотерапии (ПХТ). Отмечается 100%-е метастазирование в течение 12 мес. после постановки диагноза и практически 100%-я летальность в течение 24 мес. При использовании адъювантной ПХТ 5-летний безрецидивный период, по данным разных авторов, составляет до 45%.
Злокачественная фиброзная гистиоцитома кости
Данный гистологический подтип выделен отдельно в начале 1970-х годов. Нередко является компонентом дедифференцированной хондросаркомы и очень часто компонентом остеосаркомы. Этот подтип относится к высокозлокачественным опухолям костей, и тактика лечения не отличается от остеосарком. При этом более чем в 50% случаев удается добиться некроза опухолевых клеток более 90% после проведения предоперационной XT (медиана выживаемости составляет 66 мес).
Режимы XT при остеосаркоме, мезенхимальной дедифференцированной хондро-саркоме и злокачественной фиброзной гистиоцитоме кости следующие.
Доксорубицин — 90 мг/м2 в/в 96-часовая инфузия по 22,5 мг/м2 в сутки в 1-4-й день.
Цисплатин — 120 мг/м2 внутриартериально (только при первичной опухоли) или в/в в 6-й день.
Интервал между курсами 3 нед.
Высокодозный метотрексат 12 г/м2 в/в с лейковорином 1 раз в 2 нед. в течение 8 нед. Данный режим введения должен использоваться в соответствии со специально разработанным протоколом введения в специализированных учреждениях.
Ифосфамид — 2 г/м2 3-часовая инфузия + месна 120% по схеме в 1-5-й день.
Доксорубицин — 75 мг/м2 72-часовая инфузия.
КСФ (филграстим и т. п.) — 5 мкг/кг п/к в 6-16-й день.
Интервал между курсами 3 нед. (начало следующего курса на 21-й день).
Ифосфамид — 1800 мг/м2 в/в в 1-5-й день + месна 100% по схеме.
Этопозид — 100 мг/м2 в/в в 1-5-й день.
КСФ — п/к в 6-16-й день.
Интервал между курсами 3 нед. (начало следующего курса на 21-й день).
Гемцитабин — 675 мг/м2 в/в 90-минутная инфузия в 1-й и 8-й дни.
Доцетаксел — 75 мг/м2 в 8-й день.
КСФ — п/к в 9-19-й день.
Интервал между курсами 3 нед. (начало следующего курса на 21-й день).
Саркома Юинга и примитивные нейроэктодермальные опухоли
Саркома Юинга — высокозлокачественная мелкокруглоклеточная опухоль костей, составляет 15-20% всех первичных опухолей скелета. Чаще всего наблюдается во второй декаде жизни.
Локализация: таз/крестец — 20%; проксимальные конечности: бедренная кость — 21 %, плечевая кость — 10%; дистальные конечности: большеберцовая кость — 11 %. локтевая кость — 14%; другие локализации: ребра — 7%, позвонки — 5%, лопатка — 4%, другие кости — менее 2%.
До начала эры химиотерапии 5-летняя выживаемость составляла менее 10 % и летальность в течение первого года после постановки диагноза — более 50%.
По определению, это высокозлокачественное (G4) системное заболевание, т.к. в 100% случаев, даже при наличии только первичной опухоли, есть отдаленные микрометастазы.
Классифицируется и стадируется стандартно, по AJCC, хотя для саркомы Юинга аудирование используется редко, при этом выделяется IVA стадия при метастазах в легких и 1VB — при поражении других костей, что связано с гораздо худшим прогнозом. Редко встречаются экстраоссальные формы саркомы Юинга, тактика их лечения не отличается от классических.
Клинически наиболее часто представляет собой мягкотканное образование пораженной зоны, и, как правило, пациенты жалуются на непродолжительный болевой синдром. Часто наблюдается слабость, потеря массы тела, лихорадка (чаще у пациентов с диссеминированным процессом), лейкоцитоз. Диссеминированная стадия встречается в 15-50% случаев на момент обращения.
Диагностические исследования необходимо начинать с рентгенографии грудной клетки для исключения метастатического поражения, рентгенографии первичной опухоли, а также КТ/МРТ первичной опухоли и грудной клетки. Сцинтиграфия костей скелета необходима для исключения костных поражений. Для исключения метастатического поражения костного мозга можно выполнить МРТ позвоночника, т.к. наиболее часто метастазы в костном мозге определяются в телах позвонков.
Положительные факторы прогноза:
■ возраст менее 16 лет;
■ преобладание костного компонента: 5-летняя выживаемость до 87 %, а при преобладании мягкотканного — всего 20%;
■ первичная опухоль дистальных конечностей (длинных трубчатых костей);
■ нормальная активность лактатдегидрогеназы (ЛДГ) в сыворотке крови;
■ отсутствие видимого метастатического поражения; я полный ответ на XT.
В настоящее время используется комплексный подход в лечении этой группы сарком. Один хирургический метод дает не более 10% отдаленных результатов, что связано с исходным наличием микрометастазов. В прошлом десятилетии активно использовалась комбинация лучевой терапии (суммарная очаговая доза (СОД) 50 Гр, выживаемость 16-25% при непосредственной эффективности 44-86%) и XT (непосредственная эффективность 80% при поражении дистальных отделов конечностей, 60-80% — проксимальных отделов и таза).
Сейчас лучевая терапия активно заменяется органосохраняющими операциями, которые в ряде случаев позволяют добиться лучших результатов в комбинации с химиотерапией. Лечение должно проводиться в специализированных лечебных учреждениях, занимающихся лечением данной группы заболеваний, т.к. только при комплексном подходе можно добиться излечения 60-70% пациентов.
У большинства пациентов с метастатическим поражением удается достичь полного ответа, однако практически у всех, и в особенности с наличием костных метастазов, возникнет рецидив заболевания и быстрый смертельный исход. При отсутствии видимого исходно метастатического поражения и первичной локализации опухоли в длинных трубчатых костях удается добиться излечения в 60-70% случаев.
Эффективные препараты в лечении саркомы Юинга (при использовании в монотерапии): циклофосфамид — 50%, доксорубицин — 40%, ифосфамид — 32%, винкристин — 30%, дактиномицин — 33%, этопозид — 30%, цисплатин — 7%.
Наиболее эффективны режимы XT с включением винкристина, доксорубицина и ифосфамида (VAI) или циклофосфамида (VArdiaC) с добавлением дакарбазина (CyVADIC) или без него.
В качестве индукционной (предоперационной) XT используется альтернирующий режим химиотерапии:
Ифосфамид — 1800 мг/м2 в/в в 1-5-й день + месна по схеме.
Этопозид — 100 мг/м2 в/в в 1-5-й день.
Далее через 3 нед. переход на схему:
Циклофосфамид — 1200 мг/м2 в/в в 1-й день.
Доксорубицин — 75 мг/м2 в/в в 1-й день.
Винкристин — 2 мг ЕД в/в в 1-й день.
Интервал 3 нед. и далее снова режим с ифосфамидом.
На предоперационном этапе проводится 4-6 курсов XT по указанной схеме; затем, после оперативного вмешательства, при хорошем лечебном патоморфозе проводится адъювантная XT по этой же схеме. Общая продолжительность лечения составляет до 12 мес.
Режимы химиотерапии при саркоме Юинга/PNET (для нелеченных пациентов)
Ифосфамид — 2,5 г/м2 3-часовая инфузия в 1-4-й день + месна 100% по схеме.
Доксорубицин — 75 мг/м2 72-часовая инфузия.
Винкристин — 2 мг ЕД в/в в 1-й день.
КСФ (филграстим и т. п.) — в 5-15-й день.
Интервал между курсами 3 нед.
Циклофосфамид — 600 мг/м2 в/в в 1-й день.
Винкристин — 1,4 мг/м2 (максимальная доза 2 мг) в/в еженедельно в течение 6 нед., далее в 1-й день каждого цикла.
Доксорубицин — 60 мг/м2 в/в 96-часовая инфузия через центральный венозный катетер (15 мг/м2 в сутки) в 1-4-й день.
Дакарбазин — 1000 мг/м2 в/в 96-часовая инфузия вместе с доксорубицином в одном флаконе (250 мг/м2 в сутки) в 1-4-й день.
Дозы должны быть разделены на четыре 24-часовые инфузии, это связано со стабильностью разведенных растворов. Интервал между курсами 3-4 нед.
Ифосфамид — 1800 мг/м2 в/в в 1-5-й день + месна 100% по схеме.
Этопозид — 100 мг/м2 в/в в 1-5-й день, далее через 3 нед. переход на альтернирующую схему:
Циклофосфамид — 1200 мг/м2 в/в в 1-й день.
Доксорубицин — 75 мг/м2 в/в в 1-й день.
Винкристин — 2 мг ЕД в/в в 1-й день.
Интервал 3 нед., далее снова режим с ифосфамидом.
Режимы XT при саркоме Юинга/PNET (при прогрессировании после комплексного лечения)
При позднем прогрессировании (более 12 мес.) возможно повторное использование ранее применявшихся режимов. Некоторую эффективность показали ингибиторы топоизомеразы I, этопозид, алкилирующие агенты, производные нитрозомочевины и цисплатин.
Также возможно применение доксорубицина в высоких дозах (90 мг/м2) в виде 96-часовой инфузии или ифосфамида 2000 мг/м2 3-часовая инфузия в 1 -7-й день, общая доза 14 г/м2, на фоне месны у пациентов, получавших ранее эти препараты в стандартных дозах, и если не выбрана кумулятивная доза доксорубицина. Однако повторные ответы на XT крайне редки, а продолжительность жизни после рецидива заболевания измеряется неделями.
Читайте также:

