Таргетная терапия при раке поджелудочной железы препараты
Когда заходит речь о перспективных способах борьбы со злокачественными новообразованиями, на первое место выступает таргетная терапия. Таргетное, или молекулярное биологическое лечение рака, является прорывом в медицине на сегодняшний день. Основным отличием от традиционной (цитотоксической) химиотерапии является то, что таргетные препараты не вмешиваются в деятельность здоровых клеток организма, а блокируют процессы, необходимые для канцерогенеза. Эффективной, хотя и менее безопасной, является комбинация в одном препарате как традиционных цитостатиков, так и таргетных молекул.
Таргетная терапия в онкологии в Москве проводится лишь в нескольких клиниках, и одна из них - Юсуповская больница, одна из ведущих клиник России, использующих инновационные технологии борьбы с онкологией. Специалисты Юсуповской больницы достигают высоких результатов, применяя самые эффективные и современные методы диагностики и лечения. В распоряжении онкологов имеется десяток препаратов таргетного лечения, лицензированных на территории России, ещё несколько десятков проходят клинические испытания и поступят в клиники в ближайшие годы. Таргетная терапия даёт надежду на выздоровление пациентам, ещё недавно считавшимся неизлечимо больными. Препараты, полученные в результате генно-молекулярной инженерии, могут оказать эффект даже при позднем выявлении рака, при диагностировании трудно поддающихся терапии опухолей (медуллярный рак щитовидной железы, рак почки, толстого кишечника, поджелудочной железы и т.д.).
Что такое таргетная терапия в онкологии, что она даёт пациентам?
Большим преимуществом таргетных препаратов является то, что выпускаются они в основном в виде таблеток, которые пациент может принимать дома. Больше нет необходимости длительного лечения в стационаре, трудной и обессиливающей реабилитации – ведь таргетные препараты не оказывают влияния на функционирование здоровых клеток, поэтому они практически не имеют побочных эффектов, и таргетная терапия проходит незаметно для пациента. Стоимость таргетной терапии рака очень высокая, однако, этот вид лечения даёт надежду на выздоровление многим людям, которые считают себя неизлечимо больными.
Таргетная терапия метастатического рака лёгких (немелкоклеточного)
Использование моноклональных антител либо других молекулярных препаратов в лечении рака лёгких возможно только при соблюдении определённых условий. Главное из них – выявление определённых генных мутаций, которые называются драйверными (дефекты гена, которые "маскируют" раковые клетки от лимфоцитов). Именно эти дефектные гены служат мишенью для таргетного препарата, без них лечение будет абсолютно неэффективным. Для включения в программу таргетной терапии (либо клинических испытаний) Юсуповской клиники у пациента с раком лёгких должна быть подтверждена одна из перечисленных мутаций генома:
- EGFR (чаще всего встречается у некурящих, азиатов и американцев) – чувствительна к афатинибу, эрлотинибу, гефтинибу;
- ALK, ROS1 (у молодых и некурящих пациентов) – используется кризотиниб;
- RAS (KRAS, NRAS и HRAS) – в зависимости от выявленного подвида мутации могут использоваться селуметиниб, траметиниб, комбинация эрлотиниб+тивантиниб, ридафоролимус;
- HER2 (чаще у женщин и некурящих) – частичный терапевтический эффект при использовании комбинации трастузумаба и цитостатика, афатиниба, нератиниба, темсиролимуса;
- BRAF (у курильщиков) – дабрафениб;
- FGFR1 (у курильщиков) – данная мутация ассоциируется с неблагоприятным исходом заболевания; используется препарат BGJ398.
Эффективность таргетной терапии при выявлении других мутаций пока не доказана, проводятся дальнейшие исследования.
Таргетная терапия при меланоме
Как и в случае рака лёгких, для включения в программу таргетной терапии меланомы у пациента должны быть выявлены определённые мутации в генах (BRAF, C-KIT), которые указывают на чувствительность раковых клеток к таргетным препаратам. При меланоме используются такие препараты и их комбинации: траметиниб+дабрафениб, нилотиниб, иматиниб, ингибитор MEK162. Следует отметить, что таргетные препараты при меланоме позволяют не только вылечить больного, но и предотвратить появление указанных мутаций в будущем.
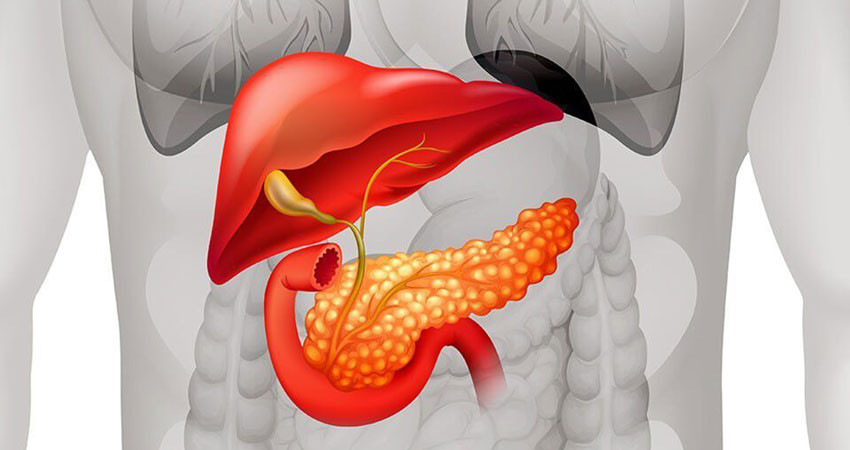
Таргетная терапия при раке поджелудочной железы
Рак поджелудочной железы является фатальным заболеванием с крайне низкой выживаемостью. Ещё недавно лишь каждому десятому пациенту с этим диагнозом предлагалась операция, а выживаемость составляла не более нескольких месяцев. На сегодняшний день в таргетной программе лечения панкреатического рака фигурирует лишь один препарат – эрлотиниб. Его применение не гарантирует положительного исхода заболевания, однако значительно увеличивает продолжительность жизни. А тем временем проходят клинические испытания десятки других препаратов, и возможно уже завтра будет найден таргетный препарат, который обеспечит полное выздоровление.
Что значит таргетная терапия колоректального рака, таргетная терапия рака желудка
Наиболее перспективными целями для таргетных препаратов при раке толстого кишечника являются мутации генов EGFR и VEGF. В данной ситуации наибольшую эффективность имеют цетуксимаб, бевацизумаб, панитумумаб. С раком желудка ассоциируются мутации HER2 (индикатор агрессивного течения), EGFR. Для лечения наиболее часто используют такие препараты таргетной терапии: трастузумаб, лапатиниб, бевацизумаб.
Таргетная терапия рака почки
Почка является органом с очень хорошим кровоснабжением, что благоприятствует развитию раковых опухолей. Именно поэтому основным направлением таргетной терапии при раке почки является использование ангиогенных препаратов (воздействующих на сосуды): сунитиниб, пазопаниб, авастин, темсиролимус, сорафениб, эверолимус. Данные препараты используются у пациентов с метастатическим раком, неоперабельными опухолями, для профилактики рецидива после проведенной терапии.
Учёными всего мира ведутся успешные разработки таргетных препаратов для лечения рака молочной железы, хронического миелолейкоза, рака лёгких, печени, яичников. На данный момент в мире лицензированы такие моноклональные таргетные препараты: ипилимумаб, алемтузумаб, бевацизумаб (применяется при опухолях ЦНС, толстой кишки, молочной железы, лёгкого; исследуется его воздействие на саркому), ритуксимаб (при неходжкиновских лимфомах), цетуксимаб (некоторые виды рака толстого кишечника и лёгких), трастузумаб (опухоли молочной железы) и др.
Узнать подробности проведения таргетной терапии в Юсуповской больнице, записаться на приём для назначения соответствующего лечения можно по телефону.
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Рак поджелудочной железы относится к онкологическим заболеваниям, с которыми сложно бороться, и которые характеризуются относительно низкой выживаемостью. В течение 5 лет с момента установления диагноза в живых остаются лишь 9% больных. Рак поджелудочной железы нередко диагностируют в запущенной стадии, потому что не существует эффективного рекомендованного скрининга, злокачественная опухоль может долго не вызывать симптомов.
Тем не менее, пациенту можно помочь, даже если заболевание диагностировано на поздней стадии. В случаях, когда невозможно добиться ремиссии, врачи могут продлить жизнь пациента и избавить его от мучительных симптомов. Эффективное лечение можно получить в клинике Медицина 24/7.
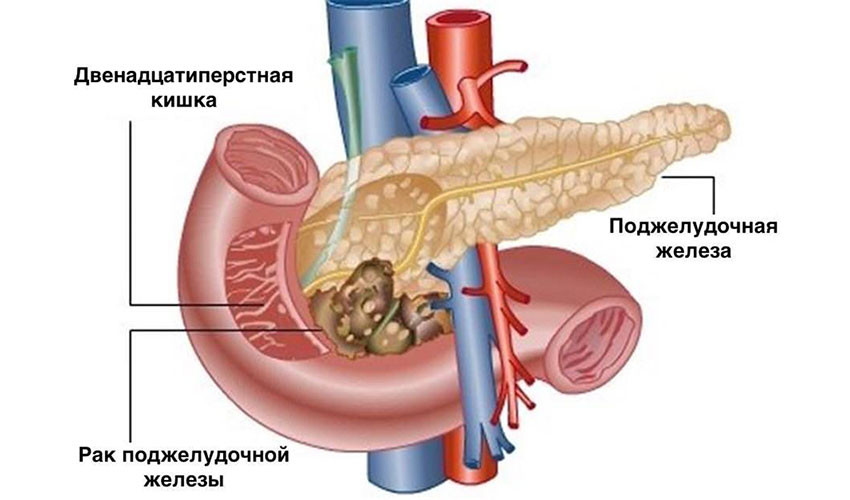
Хирургическое лечение
Хирургическое удаление опухоли — самый эффективный метод лечения рака поджелудочной железы. Это единственная реальная возможность достичь ремиссии. К сожалению, на момент постановки диагноза только у одного из пяти пациентов опухоль не успела распространиться за пределы поджелудочной железы, и лишь у некоторых из них рак можно полностью удалить. Обычно это узлы в головке органа: через неё проходит желчный проток, при его сдавлении развивается механическая желтуха, и эта симптоматика помогает рано диагностировать опухоль.
Операцию проводят, если хирург уверен, что он сможет удалить рак полностью. Циторедуктивные вмешательства, направленные на частичное удаление как можно большего количества опухолевой ткани, не проводятся, так как нет доказательств того, что они помогают продлевать жизнь пациентов.
При раке головки поджелудочной железы чаще всего выполняют операцию Уиппла. Во время нее удаляют головку органа, иногда вместе с телом, и часть окружающих органов: тонкой кишки, желчного протока, ближайшие лимфатические узлы, желчный пузырь, иногда часть желудка.
При резектабельном раке хвоста поджелудочной железы проводят дистальную панкреатэктомию: удаляют хвост поджелудочной железы, иногда вместе с телом, и селезенку.
В редких случаях встречаются ситуации, когда злокачественная опухоль распространилась по всей поджелудочной железе, но все еще является операбельной. При этом может быть выполнена тотальная панкреатэктомия: поджелудочную железу удаляют полностью, вместе с ней — желчный пузырь, часть желудка и тонкой кишки.

Паллиативные операции
Во время паллиативных операций не удаляют рак, их цель — избавить больного от симптомов, вызванных злокачественной опухолью. При раке головки поджелудочной железы нередко развивается механическая желтуха — состояние, вызванное сдавлением желчного протока и нарушением оттока желчи. У больного окрашиваются в желтый цвет кожа, слизистые оболочки и белки глаз, беспокоит кожный зуд, ухудшается общее состояние, прогноз.
С этим осложнением можно справиться тремя способами:
- Дренирование. Во время эндоскопической ретроградной холангиопанкреатографии (РХПГ) или чрескожной чреспеченочной холангиографии в желчные протоки устанавливают дренажную трубку. По ней желчь может оттекать наружу, в просвет двенадцатиперстной кишки или сразу в обоих направлениях. Это достаточно эффективно, но не очень удобно: дренажная трубка постоянно мешается, может случайно сместиться, выпасть.
- Стентирование — более современное решение. Эндоскопически, с помощью катетера, заведенного в желчные протоки из двенадцатиперстной кишки, в заблокированном участке устанавливают стент — трубку с сетчатой стенкой из полимера или металла. Он расширяет просвет протока и обеспечивает свободный отток желчи. Стентирование — быстрая и относительно безопасная процедура, ее выполняют без разрезов.
- Шунтирование — операция, во время которой хирург создает обходной путь для оттока желчи. По сравнению со стентированием, хирургическое вмешательство несет более высокий риск осложнений, его могут перенести не все больные. Но иногда оно позволяет более эффективно, надолго восстановить отток желчи. Во время операции можно перерезать нервы, которых беспокоят мучительные боли.
Насколько эффективна химиотерапия при раке поджелудочной железы?
Химиопрепараты довольно часто применяют при злокачественных опухолях поджелудочной железы. Они могут быть назначены с разными целями:
- Адъювантная химиотерапия проводится до операции, чтобы уменьшить объем опухоли.
- Неоадъювантная химиотерапия проводится после операции, чтобы снизить риск рецидива.
- Химиотерапия как основной метод лечения применяется при неоперабельных опухолях. Цель лечения в таком случае — не достичь ремиссии, а как можно дольше держать болезнь под контролем.
Чаще всего применяют такие химиопрепараты, как гемцитабин (Гемзар), оксалиплатин (Элоксатин), иринотекан (Камптозар), , цисплатин, капецитабин (Кселода). Обычно назначают комбинации из двух препаратов с разными механизмами действия, это помогает повысить эффективность лечения. Ослабленным пациентам назначают только один препарат риска серьезных побочных эффектов.
Эффективность лучевой терапии
Лучевую терапию при раке поджелудочной железы зачастую применяют вместе с химиопрепаратами. Такое лечение называется химиолучевой терапией. Ее назначают после операции, при неоперабельном раке.
Если опухоль находится в пограничном состоянии между резектабельной и нерезектабельной, после курса неоадъювантной лучевой терапии ее размеры могут уменьшиться так, что ее получится удалить хирургическим путем.
Также лучевую терапию при раке поджелудочной железы применяют в качестве симптоматического лечения, например, если беспокоят мучительные боли, и пациенту противопоказано хирургическое вмешательство.
Таргетная терапия
На поверхности раковых клеток в поджелудочной железе нередко увеличено количество молекул EGFR. Активируясь, он заставляет клетки быстро размножаться. Его можно заблокировать с помощью таргетного препарата эрлотиниб (Тарцева). Его часто назначают в сочетании с химиопрепаратом гемцитабином. Эффективность этой комбинации различается у разных онкологических больных.
Помогает ли иммунотерапия при раке поджелудочной железы?
Иммунная система человека должна не только атаковать чужеродные агенты, но и знать, когда пора остановиться, чтобы не навредить собственным тканям организма. Для этого в ней есть специальные сигнальные молекулы, подавляющие активность иммунных клеток. При раке эти молекулы начинают мешать. Они не дают иммунитету эффективно распознавать и уничтожать опухолевые клетки. Существуют препараты, которые могут заблокировать эти молекулы, они называются ингибиторами контрольных точек.
При раке поджелудочной железы ингибиторы контрольных точек могут быть полезны для пациентов, у которых выявлены определенные генетические отклонения: высокий уровень микросателлитной нестабильности, мутации в генах восстановления несоответствия (MMR).
В клинике Медицина 24/7 при многих типах рака можно пройти исследование, которое помогает выявить мишени для лекарственных препаратов, имеющиеся в раковых клетках пациента, и назначить оптимальную, персонализированную терапию.

Процент пятилетней ремиссии при лечении рака поджелудочной железы в Израиле на втором месте в мире, после Южной Кореи.
- Таргетная терапия
Традиционные средства лечения рака, включая химиотерапевтические препараты и радиацию, не отличают раковые клетки от здоровых. Соответственно, в процессе такого лечения повреждается множество здоровых клеток – именно поэтому пациент впоследствии страдает от побочных эффектов. Химиотерапия разрушает быстро делящиеся клетки, так как быстрое деление – это типичное свойство злокачественных клеток. Однако в результате лечения химиотерапевтическими препаратами повреждаются и здоровые клетки, которым тоже свойственно быстрое деление. Это кровяные тельца, а также клетки, выстилающие ротовую полость и пищеварительный тракт. Прогресс в науках и технологиях привел к разработке нескольких различных типов таргетной терапии, которые в настоящее время тестируются в клинических исследованиях.
Герцептин (трастузумаб) – это моноклональное антитело. Оно связывается с рецептором HER2 – белка, присутствующего на поверхности злокачественных клеток примерно у 20% больных раком поджелудочной железы. Связывание обеспечивает противораковое действие препарата за счет двух отдельных процессов. Во-первых, Герцептин, связанный с рецептором, не дает факторам роста присоединиться к белку HER2 и тем самым предупреждает стимулирование роста раковой опухоли. Во-вторых, действие Герцептина побуждает иммунную систему атаковать и уничтожать те злокачественные клетки, к которым присоединилось это моноклональное антитело.
Исследователи обнаружили, что метастатический рак поджелудочной железы со сверхэкспрессией HER2 следует лечить комбинацией Гемзара с Герцептином, а не одним только Гемзаром. Комбинированный подход доказанно продлевает выживаемость. Приблизительно 72% пациентов, лечившихся Гемзаром и Герцептином, отреагировали на терапию; примерно 24% переступили однолетний порог выживаемости.
Эрбитукс (цетуксимаб) – это препарат таргетной терапии, моноклональное антитело, связывающееся с рецепторами эпидермального фактора роста (EGFR) и тем самым подавляющее рост и распространение опухоли. В феврале 2004 года Эрбитукс получил одобрение Управления США по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA). С тех пор препарат применяется в лечении рака толстой кишки в разных странах мира. В настоящее время ученые анализируют его эффективность в борьбе с другими онкологическими заболеваниями, включая рак поджелудочной железы.
Исследователи сообщили, что добавление Эрбитукса к Гемзару потенциально может повысить выживаемость больных метастатическим раком поджелудочной железы. Они провели клиническое испытание, в котором приняли участие 40 пациентов с раком поджелудочной железы на поздних стадиях. Все пациенты предварительно прошли обследование, по результатам которого у них выявили сверхэкспрессию EGFR. По итогам клинического испытания можно судить о том, что у пациентов, лечившихся комбинацией Гемзара и Эрбитукса, выживаемость без прогрессирования и общая выживаемость оказались выше, чем у больных, принимавших только Гемзар (см. таблицу 2).
Таблица 2: Гемзар в комбинации с Эрбитуксом и Гемзар как препарат однокомпонентной терапии
| Гемзар/Эрбитукс | Гемзар как препарат однокомпонентной терапии (ранее) | |
| Однолетняя выживаемость | 32,5% | 18-20% |
| Выживаемость без прогрессирования | 4 месяца | 2 месяца |
Не так давно итальянские ученые предприняли попытку добавить Эрбитукс к комбинации Гемзара и Платинола в рамках лечения пациентов с метастатическим раком поджелудочной железы. У пациентов, лечившихся 3 препаратами (Эрбитукс, Гемзар, Платинол), наблюдались те же результаты, что и у больных, принимавших только Гемзар и Платинол. Тем не менее ученые продолжают изучать свойства и действие Эрбитукса в лечении рака поджелудочной железы.
- Неоадъювантная терапия
Неоадъювантная терапия – это лечение, проводимое перед хирургической операцией. При борьбе с раком поджелудочной железы на ранних стадиях цель неоадъювантной терапии состоит в уменьшении объема раковых тканей и облегчении удаления опухоли хирургическим методом. В настоящее время проводятся клинические исследования, в рамках которых ученые изучают эффективность неоадъювантной терапии в сравнении с комбинацией неоадъювантной и адъювантной терапии. Результаты некоторых научных работ указывают на потенциальную возможность продлить выживаемость пациентов за счет применения средств неоадъювантной терапии.
- Блокирование RAS
Врачи проанализировали целесообразность применения специфической пептидной вакцины против мутировавшего гена Ras в качестве средства адъювантной иммунотерапии рака поджелудочной железы и колоректального рака. В исследовании участвовали 12 пациентов без признаков патологии по результатам хирургической операции. 5 пациентов болели раком поджелудочной железы, 7 – колоректальным раком. Всем пациентам под кожу вводили 13-мерный пептид с компонентами мутировавшего гена Ras в соответствии с особенностями мутации опухолевых клеток. Вакцинация производилась 1 раз в 4 недели; всего пациенты получили до 6 доз вакцины. Тяжелых побочных эффектов не зафиксировано. 5 из 12 пациентов продемонстрировали положительный иммунный ответ. Средняя общая выживаемость 5 больных раком поджелудочной железы составила 44 месяца, 7 больных колоректальным раком – свыше 41 месяца.
- Биологическая терапия
Средства биологической терапии – это природные или синтезированные вещества, которые направляют, облегчают или усиливают нормальную иммунную реакцию организма. К препаратам биологической терапии относятся:
- интерлейкины,
- интерферон,
- моноклональные антитела,
- вакцины и другие комплексные медикаменты.
Вакцины помогают иммунной системе пациента уничтожить раковую опухоль за счет активации иммунных клеток. Вакцины производятся из самых разнообразных веществ; некоторые препараты создаются на основе настоящих раковых клеток, извлеченных из организма пациента. Сложность приготовления вакцины состоит в том, что раковые клетки необходимо обработать в срочном порядке, то есть сразу же после операции. Пациенту и хирургу следует заранее предпринять меры по обеспечению должного обращения с извлеченными злокачественными клетками. В настоящее время вакцины исследуются в клинических испытаниях.
В исследовании участвовали 56 пациентов, перенесших хирургическую операцию по удалению опухоли. Первую вакцинацию произвели через 8 недель после операции. Через месяц пациенты начали лечиться стандартной химиотерапией и лучевой терапией. После традиционного лечения они прошли еще 3 ревакцинации за 3 месяца. Последнюю ревакцинацию произвели через 6 месяцев после химиотерапии/лучевой терапии.
Средние показатели за 32 месяца:
- однолетняя выживаемость составила 88%;
- двухлетняя выживаемость составила 76%.
Исследователи пришли к выводу, что добавление противораковой вакцины к стандартной химиотерапии и лучевой терапии можно считать целесообразным – особенно при сравнении достигнутых показателей однолетней и двухлетней выживаемости с предыдущей статистикой лечения пациентов с операбельным раком поджелудочной железы.
Вирулизин – это препарат биологической терапии, способный активировать собственный иммунный ответ организма и побуждать иммунную систему уничтожать злокачественные клетки. Точный механизм его действия пока не определен. Тем не менее ученые предполагают, что этот препарат вызывает апоптоз — смерть раковых клеток за счет стимулирования выработки фактора некроза опухоли и активации макрофагов – иммунных клеток, очищающих организм от вредных веществ.
По результатам клинического испытания ранней фазы видно, что 58% больных раком поджелудочной железы, прошедших терапию Вирулизином, прожили 6 месяцев или дольше. Средняя выживаемость пациентов составила 6,8 месяцев. Больные хорошо перенесли лечение Вирулизином. Затем ученые организовали клиническое испытание третьей фазы и добавили Вирулизин к Гемзару. Средняя общая выживаемость пациентов, лечившихся комбинацией препаратов, составила 6,8 месяцев; однолетняя выживаемость составила 27,2%. При этом средняя общая выживаемость больных, принимавших только Гемзар, составила 6 месяцев; однолетняя выживаемость – 16,8%. Вирулизин пока не получил одобрения Управления США по санитарному надзору за качеством пищевых продуктов и медикаментов и официально не разрешен к применению в лечении рака поджелудочной железы.
- Новые техники лучевой терапии
Трехмерная конформная лучевая терапия (3D-CRT): 3D-CRT позволяет с максимальной точностью направлять пучки излучения на участки поражения раком. За счет использования данной техники пациенты меньше страдают от побочных эффектов, связанных с облучением здоровых органов – таких, как печень, желудок и почки. Так как у многих больных метастатическим раком поджелудочной железы патология рано или поздно поражает печень, врачи назначают пациентам низкодозную лучевую терапию всей печени с целью уничтожения злокачественных клеток.
- Фотодинамическая терапия
Фотодинамическая терапия – это инновационный метод лечения, который до сих пор изучают и совершенствуют в клинических испытаниях и лабораторных исследованиях. Суть фотодинамической терапии заключается в применении фотосенсибилизирующего вещества и света. За пару часов до хирургического вмешательства пациент получает внутривенную инъекцию фотосенсибилизирующего препарата. Этот препарат выбирает быстро делящиеся клетки (как правило, раковые) и накапливается в них. Во время операции хирург использует специальный ручной прибор, излучающий определенную световую волну, чтобы обработать светом пораженный участок и соседние ткани. Энергия света активирует фотосенсибилизирующее вещество, которое, в свою очередь, стимулирует выработку токсина, накапливающегося в раковых клетках. В конечном итоге токсин разрушает злокачественные ткани.
Исследователи сообщили, что фотодинамическая терапия представляет собой безопасный и эффективный метод лечения некоторых пациентов с неоперабельным раком поджелудочной железы. В проведенном ими клиническом испытании приняли участие 16 пациентов. Все больные получили внутривенную инъекцию фотосенсибилизирующего вещества мета-тетра(гидроксифенил)-хлорина. Три дня спустя участки, пораженные раком, обработали светом под контролем компьютерной томографии (КТ). 14 пациентов смогли выписаться из больницы в течение 10 дней. Средняя выживаемость составила 9,5 месяцев, однолетняя выживаемость достигла 44%. Большинство пациентов хорошо перенесли лечение; у 2 человек открылось кровотечение, для остановки которого потребовалось хирургическое вмешательство. У 3 пациентов возникла обструкция толстого кишечника.

- Преимущества таргетной терапии
- Препараты для таргетной терапии
- При каких онкозаболеваниях применяют таргетную терапию?
- Таргетная терапия в лечении рака молочной железы
- Таргетная терапия при метастатическом раке легкого
- Таргетная терапия при меланоме
- Таргетная терапия при раке поджелудочной железы
- Таргетная терапия при колоректальном раке
- Таргетная терапия при раке желудка
- Таргетная терапия при раке почки
- Отзыв пациента Европейской клиники о таргетной терапии
- Цены
Сегодня поиск лекарственных средств идёт целенаправленно и в клинической практике уже используются три варианта таргетного воздействия:
- Действие на определённые клеточные мишени, в числе которых рецепторы половых гормонов, гены и внутриклеточные ферменты.
- Повреждение обеспечивающих нормальную жизнедеятельность раковой опухоли внеклеточных структур, например, питающих опухоль сосудов.
- Выключение передачи внутриклеточных биохимических сигналов, которые позволяют раку жить и размножаться, в цепочке биохимических реакций — сигнального пути.
Таргетная терапия входит в лекарственное противоопухолевое лечение, но постепенно отделяется от понятия химиотерапии, поскольку механизм действия иной, но результат общий — уничтожение рака. Лекарства эти применяются только вместе с цитостатиками и усиливают их эффективность.
Преимущества таргетной терапии
Можно выделить следующие преимущества таргетных препаратов:
Препараты для таргетной терапии
В настоящее время существует довольно много разных таргетных препаратов. Одни уже давно внедрены в клиническую практику, другие недавно закончили или все еще проходят испытания. В зависимости от эффектов, их можно разделить, на несколько групп:
- В каждой клетке человека работают так называемые сигнальные пути — каскады химических реакций, итогом которых является то или иное событие. Таргетные препараты могут блокировать звенья в сигнальных путях, отвечающих за размножение клеток.
- Некоторые препараты изменяют важные белки таким образом, что клетка погибает.
- Злокачественная опухоль активно растет и распространяется по организму, поэтому ей нужно много кислорода и питательных веществ. Раковые клетки выделяют вещества, которые стимулируют ангиогенез — рост новых сосудов. Существуют антиангиогенные таргетные препараты, которые могут их заблокировать.
- Воздействуя на некоторые молекулы, можно активировать иммунитет, заставить его распознавать и убивать раковые клетки.
- Есть таргетные препараты, которые вводят в раковые клетки токсины (при этом не затрагивая здоровые клетки), уничтожающие их.
При каких онкозаболеваниях применяют таргетную терапию?
Таргетная терапия в лечении рака молочной железы
Гормональные препараты, созданные для лечения рака молочной железы, весьма похожи на настоящие гормоны, но несут в себе не программу жизни рака, а программу его смерти, и гормональный рецептор активно выбирает не родной гормон, а лекарство. Сегодня наряду с тамоксифеном используются антиэстрогены торемифен (фарестон) и фульвестрант (фазлодекс).
Вторую группу таргетных гормональных средств составляют ингибиторы фермента ароматазы, превращающего один вид полового гормона в другой. Ароматаза находится в жировой клетчатке и синтезируется яичниками, выключение её с помощью лекарственного препарата нарушает синтез гормона, в котором нуждаются раковые клетки.
Чувствительность к химиотерапии можно предсказать по наличию специфического гена HER2-neu — гена множественной лекарственной резистентности. Обнаружение этого гена говорит о том, что опухоль может не реагировать на присутствие лекарства-убийцы.
Раковая клетка пытается избежать гибели несколькими способами, одновременно включая механизмы:
- быстрого выведения химиопрепаратов в межклеточное пространство;
- обезвреживая цитостатик специальными белками;
- быстро восстанавливая повреждения;
- изменяя мишень для препарата, предлагая ему похожий белок, не имеющий принципиального значения для дальнейшей жизнедеятельности;
- изменяя роль ключевых генов, контролирующих клеточный апоптоз (гибель), которые больше не могут запустить фатальные изменения.
Найден ключевой ген рака молочной железы, получивший название HER 2, и заставляющий рецепторы на клеточной поверхности избыточно активно захватывать факторы клеточного роста, что приводит к неуправляемому делению. В некоторых случаях ген амплифицируется, то есть образует в ДНК не одну, а целый пучок генетических копий.
Помогает работе герцептина ещё один таргетный препарат перьета (пертузумаб) — белок, синтезируемый иммунными клетками, или моноклональное антитело. Перьета на поверхности раковой клетки соединяется с определённым рецептором, не позволяя фактору роста проникнуть внутрь и активировать ген HER2. Перьета вводится вместе с герцептином и химиопрепаратом доцетакселом.
Аналогично герцептину работает лапатиниб (тайверб), применяемый во второй очереди после герцептина с перьетой.

Таргетная терапия при метастатическом раке легкого
Таргетные препараты при немелкоклеточном раке легкого могут применяться в сочетании с химиопрепаратами или самостоятельно. Применяются препараты, которые блокируют ангиогенез (рамицирумаб, бевацизумаб), мутантные белки, заставляющие раковые клетки размножаться: EGFR (афатиниб, эрлотиниб, гефитиниб), ALK (бригатиниб, алектиниб, церитиниб, кризотиниб), BRAF (траметиниб, дабрафениб).
Таргетная терапия при меланоме
Исследования показывают, что примерно в половине всех меланом клетки имеют мутацию в гене BRAF. Из-за этого в них образуется одноименный мутантный белок, и они быстро размножаются. В таких случаях эффективны таргетные препараты из группы ингибиторов BRAF: дабрафениб, вемурафениб.
В тандеме с геном BRAF работает ген MEK. Если в нем обнаружена мутация, врач может назначить ингибиторы MEK: кобиметиниб и траметиниб.
Некоторые меланомы (на участках кожи, на которые постоянно воздействуют солнечные лучи, на ладонях и подошвах, слизистых оболочках, под ногтями) имеют мутацию в гене C-KIT. При этом могут помочь препараты иматиниб и нилотиниб.
Таргетная терапия при раке поджелудочной железы
На поздних стадиях рака поджелудочной железы некоторым пациентам назначают химиотерапию в сочетании с эрлотинибом, таргетным препаратом, который блокирует рецептор эпидермального фактора роста (EGRF).
Таргетная терапия при колоректальном раке
При раке толстой и прямой кишки применяются три группы таргетных препаратов:
- Ингибиторы фактор роста эндотелия сосудов (VEGF), белка, который вырабатывается раковыми клетками и стимулирует ангиогенез: рамуцирумаб, бевацизумаб.
- Ингибиторы рецепторов эпидермального фактора роста, которые находятся на поверхности раковых клеток и, находясь в активном состоянии, заставляют их размножаться: панитумумаб, цетуксимаб.
- Ингибиторы киназы — белка-фермента, который выполняет разные функции, в том числе стимулирует клеточный рост: регорафениб.
Таргетная терапия при раке желудка
Примерно в 1 из 5 случаев в клетках злокачественных опухолей желудка содержится повышенное количество белка HER2-neu (или только HER2), который стимулирует их размножение. В таких случаях применяют таргетный препарат трастузумаб (Герцептин). Также при раке желудка применяют ингибитор ангиогенеза рамуцирумаб (Цирамза).
Таргетная терапия при раке почки
При раке почек применяют:
- Таргетные препараты, которые блокируют ангиогенез: бевацизумаб.
- Таргетные препараты, которые блокируют белки-тирозинкиназы: сорафениб, сунитиниб, пазопаниб, акситиниб, кабозантиниб, ленватиниб.
- Таргетные препараты, которые блокируют белок mTOR: темсиролимус, эверолимус.
Отзыв пациента Европейской клиники о таргетной терапии
Я нашла клинику по принципу применения таргетной терапии. Искала тщательно и выяснила, что у Европейской клиники самый большой опыт её применения для лечения меланомы. Меня приняли очень быстро, подтвердили диагноз и по гистологическому исследованию назначили дабрафениб, так как есть браф-мутация. Сейчас прохожу второй курс. Побочные эффекты есть, но не такие, как при обычной химии. Судя по динамике, всё хорошо, и вполне можно ожидать хорошего исхода. Доктору Пылёву доверяю полностью. Считаю, что с клиникой и врачами мне очень повезло.
- Консультация химиотерапевта —
- Проведение внутрипузырной химиотерапии (без стоимости лекарственных препаратов) —
- Проведение внутрибрюшинной химиотерапии (без стоимости лекарственных препаратов) —
- Проведение иммунотерапии (без стоимости лекарственных препаратов) —
- Проведение интратекальной химиотерапии —
- Проведение гипертермической интраперитонеальной химиотерапии —
- Проведение химиотерапии с использованием инфузионной помпы 1 сутки (без стоимости лекарственных препаратов) —
- Проведение анти PD-1 терапии —
В Европейской клинике не ограничиваются химиотерапией, а при всех известных злокачественных заболеваниях используют весь спектр противоопухолевых средств, в том числе и инновационную таргетную терапию. Специальные программы помогают лучшей переносимости лечения и улучшению результатов противоопухолевой терапии.
Читайте также:





