Стереотаксическая лучевая терапия рака легкого
Вид лучевой терапии, при котором облучение опухолей производиться высокими дозами за 1-5 сеансов.
Содержание:
Что такое стереотаксическое облучение?
Стереотаксическое облучение – вид лучевой терапии, при котором облучение опухолей производиться высокими дозами за 1-5 сеансов. При облучении высокой дозой радиации за 1 сеанс процедура называется радиохирургией, а в случае подведения лечебной дозы за 3-5 сеансов – стереотаксической лучевой терапией. Тактика лечения определяется размером и расположением опухоли.
Стереотаксическая радиохирургия – это не хирургическая процедура в традиционном понимании, поскольку не является инвазивной. В ее основе лежит высокоточная доставка высокой дозы излучения непосредственно в опухоль в обход здоровых окружающих тканей. В этом и заключается принципиальное отличие данной технологии.
Для проведения стереотаксических радиохирургических операций применяют три основных метода, различия которых в первую очередь заключаются в используемом оборудовании:
- Гамма-нож. В данном случае новообразование облучается пучком четко сфокусированных гамма-лучей. Метод оптимален при интракраниальных поражениях небольших и средних размеров.
- Линейные ускорители. Такое оборудование для фракционированной стереотаксической радиохирургии осуществляет доставку высокоэнергетических рентгеновских лучей (фотонных пучков) прямо к опухолевым очагам. Метод применим и при лечении обширных новообразований.
- Протонная терапия. Это метод радиохирургии тяжелыми частицами, который пока не нашел широкого применения в нашей стране.
Чтобы определить локализацию, форму и размер опухоли, используются технологии трехмерной визуализации: компьютерная, магнитно-резонансная или позитронно-эмиссионная томография.
Благодаря стереотаксической радиохирургии современная медицина получила возможность добраться до самых маленьких опухолей с глубоким залеганием в тканях мозга. Ранее новообразования с такой локализацией считались неоперабельными.
В отличие от традиционной лучевой терапии стереотаксическое облучение можно повторять, поэтому данная технология также востребована при возникновении рецидивов после стандартной радиотерапии.
Другие преимущества технологии:
- неинвазивность;
- отсутствие необходимости в длительной дооперационной подготовке и послеоперационной реабилитации;
- возможность амбулаторного лечения серьезных опухолевых процессов мозга;
- отсутствие анестезиологических и хирургических осложнений.
Показания и противопоказания
Изначально метод стереотаксической лучевой терапии был разработан для лечения новообразований головного мозга, включая артериовенозные мальформации (АВМ), во избежание трепанации черепа. Однако сейчас ее применяют также при раке печени, раке легкого и множественных метастазах.
При опухолях мозга радиохирургическое облучение показано при:
- новообразованиях доброкачественного и злокачественного характера;
- первичных и метастатических поражениях;
- одиночных и множественных новообразованиях;
- остаточных опухолевых очагах после операции;
- интракраниальных поражениях оснований черепа и глазницы;
- артериовенозных мальформациях (АВМ).
Процедура не показана, если размер опухоли превышает допустимый (3-5 см). Это связано с тем, что при большой дозе облучения непосредственно патологического очага также увеличивается дозовая нагрузка на окружающие ткани и органы.
Лечение начинается после предварительного дозиметрического планирования. Процедура может занимать от 10 минут до 1 часа – в зависимости от сложности клинического случая и используемого оборудования. Обычно стереотаксическая радиохирургия проводится одноразово, однако иногда требуется несколько сеансов, например, при крупных опухолях.
Фиксация при стереотаксическом облучении крайне важна, так как в данном случае высок риск облучения жизненно важных органов, расположенных вблизи от облучаемого объекта.
Благодаря стереотаксической лучевой терапии современные онкологи-радиологи могут добиться максимального губительного воздействия на опухоль, минимизировав влияние облучения на здоровые ткани. За счет этого снижается риск возникновения побочных эффектов.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.

Читайте в новом номере
Цель: оценить результаты проведенного лечения пациентов с новообразованиями легких различной природы и размеров в клинике МИБС на двух типах линейных ускорителей.
Материал и методы: с декабря 2011 г. по февраль 2017 г. проведено лечение 71 пациента с совокупным числом первичных и метастатических образований легких 103. Из всех новообразований 37 были центральные, 66 – периферические; пациентам, получающим лечение по поводу первичных опухолей легкого, в хирургическом лечении было отказано. Лечение проводилось на двух типах линейных ускорителей: CyberKnife (СК) (из 64 новообразований для 38 (59,4%) с использованием системы слежения за дыханием Synchrony) и TrueBeam STx (TB) (на область 39 новообразований с использованием системы слежения за дыханием Gating).
Результаты: группу наблюдения составили 50 пациентов с 71 образованием легких. Средний объем опухолей составил 44,7см3 (0,2–496,5 см3). Медиана наблюдения составила 7 мес. (1–57 мес.). Локальный контроль был достигнут в 100% случаев, медиана длительности контроля составила 6 мес. (1–57 мес.). Локальный контроль сохранялся и в большинстве случаев системного прогрессирования основного заболевания. Для 19 (26,8%) образований по результатам лечения был достигнут полный ответ, медиана которого составила 5 мес. (1–47 мес.). Продолженный рост наблюдался в 16 (22,5%) случаях, 15 из которых – первичные опухоли. Частота ранней токсичности (кашель, одышка) при лечении на CK оказалась ниже (8% против 19% на TB), у большинства пациентов не превышала II степени тяжести, осложнения III степени токсичности наблюдались у 5 пациентов. Частота поздних лучевых осложнений не различалась у пациентов, получающих лечение на обоих линейных ускорителях, и не превышала II степени у всех пациентов. Ранних и поздних лучевых осложнений IV степени не наблюдалось ни у одного пациента. 1-, 2- и 3-летняя общая выживаемость составила 83,6, 77,3 и 65,8% соответственно.
Заключение: стереотаксическая лучевая терапия позволяет добиваться и сохранять локальный контроль у большинства пациентов при достаточно низкой частоте лучевых осложнений. При облучении первичных опухолей легкого более высокие дозы могут оказаться более эффективными для достижения и сохранения локального контроля.
Ключевые слова: стереотаксическая лучевая терапия, немелкоклеточный рак легкого, метастазы в легкие.
Для цитирования: Мартынова Н.И., Воробьев Н.А., Михайлов А.В. и др. Применение стереотаксической лучевой терапии у пациентов с первичными и метастатическими опухолями легких. РМЖ. 2017;16:1169-1172.
The use of stereotactic radiation therapy in patients with primary and metastatic lung tumors
MartynovaN.I. 1 , Vorob'ev N.A. 1 - 3 , Mikhailov A.V. 1 , Smirnova E.V. 1 , 3 , Gutsalo Yu.V. 1
1 Medical and Diagnostic Center of International Institute of Biological Systems named after Berezin Sergei, St. Petersburg
2 Saint Petersburg State University
3 North Western State Medical University named after I.I. Mechnikov, St. Petersburg
This study illustrates the evaluation of the treatment of patients with lung neoplasms of various nature and sizes in the IIBS clinic performed on two types of linear accelerators.
Patients and methods: from December 2011 to February 2017, 71 patients with total 103 primary and metastatic formations of the lungs were treated. Of all the tumors, 37 were central and 66 were peripheral; patients receiving treatment for primary lung tumors were refused a surgical treatment. Treatment was carried out on two types of linear accelerators: CyberKnife (CK) (with the use of the Synchrony Breathing System for 38 (59.4%) out of 64 tumors) and TrueBeam STx (TB) (with the use of the Gating Breathing System on the area of 39 tumors).
Results: the observation group consisted of 50 patients with 71 lung formations. The average volume of tumors was 44.7 cm3 (0.2-496.5 cm3). Median observation was 7 months (1-57 months). Local control was achieved in 100% of cases, median duration of control was 6 months (1-57 months). Local control was maintained even in most cases of systemic progression of the underlying disease. For 19 (26,8%) formations, according to the results of treatment, a complete response was achieved, the median of which was 5 months (1-47 months). Continued growth was observed in 16 (22.5%) cases, 15 of which were primary tumors. The frequency of early toxicity (cough, dyspnea) in CK treatment was lower (8% vs. 19% for TB), most patients did not exceed grade II severity, complications of grade III toxicity were observed in 5 patients. The frequency of late radiation complications did not differ in patients receiving treatment on both linear accelerators and did not exceed the grade II in all patients. Early and late radiation complications of grade IV were not observed in any patient. 1-, 2- and 3-year overall survival was 83.6, 77.3 and 65.8%, respectively.
Conclusion: stereotactic radiotherapy allows to achieve and maintain local control in the majority of patients at a sufficiently low incidence of radiation complications. When irradiating primary lung tumors, higher doses may be more effective in achieving and maintaining local control.
Key words: stereotactic radiation therapy, non-small cell lung cancer, metastases to the lungs.
For citation: Martynova N.I., Vorob'ev N.A., A.V. Mikhailov et al. The use of stereotactic radiation therapy in patients with primary and metastatic lung tumors // RMJ. 2017. № 16. P. 1169–1172.
Статья посвящена возможностям применения стереотаксической лучевой терапии у пациентов с первичными и метастатическими опухолями легких
Только для зарегистрированных пользователей
![]()
НМИЦ онкологии им. Петрова: Из-за рака пациенты теряют лицо![]()
Петербургский врач: Польза МРТ с контрастом превышает вред от возможных осложнений![]()
Пороки клапанов сердца: классические подходы и новые альтернативы
В комплексной терапии онкологических заболеваний используются 4 метода лечения: хирургия, химиотерапия, лучевая терапия, иммунотерапия. Сейчас самое большое финансирование и все внимание брошены на лекарственную терапию. Но со следующего года грядут изменения и в лучевой. А это для Петербурга – самое больное место.
Как говорит профессор Сергей Новиков, заведующий отделением лучевой терапии НМИЦ онкологии им Петрова, за последнее десятилетие лучевая терапия сделала большой рывок и ее стремительное развитие не останавливается. Появились новые аппараты, новые технологии, а с ними — новая идеология лучевой терапии.
- Сергей Николаевич, правда ли, что новые технологии в лучевой терапии когда-то заменят хирургию?
- Во многих случаях это уже происходит. Например, только что мы составляли план лечения пациента с ранним немелкоклеточным раком легкого. У него нет изменений в лимфоузлах, нет метастазирования. Но его невозможно прооперировать из-за сопутствующих заболеваний (перенес инфаркт, инсульт), так что операция угрожает жизни. В этой фактически патовой ситуации лучевая терапия позволяет провести радикальное лечение - мы можем подвести чрезвычайно высокую дозу излучения на очень маленький объем тканей. И это приведет не к продлению жизни, а именно к излечению. Опухоли объемом 1-5 см мы можем облучить, избежав при этом серьезного повреждения окружающих тканей. Это называется стереотаксическая лучевая терапия или радиохирургия.
- Вы имеете в виду лечение с помощью гамма-ножа и кибер-ножа?
- Эти технологии тоже относятся к стереотаксической лучевой терапии — гамма-нож применяют для лечения новообразований на головном мозге, а кибер-нож - для направленного радиотерапевтического воздействия на экстракраниальные опухоли (расположенные вне головного мозга). Но сейчас активно развиваются технологии радиохирургии и стереотаксической лучевой терапии на линейных ускорителях. Их преимущество в том, что это универсальные приборы: на одном аппарате может выполняться - стерео-, радио- или классическая лучевая терапия с избирательным воздействием на опухоль (обычная или 3D-конформная). У нас уже три таких аппарата, каждый из них имеет свои преимущества, а в целом умеют все.
- Для лечения какого вида рака они предназначаются, что умеют?
- Легче перечислить, что не умеют — не умеют облучать очень много очагов в головном мозге одномоментно, в отличие от гамма ножа. Но такая ситуация — редкость, а главное, пока нет доказательств целесообразности такой агрессивной терапии, она не продлевает жизнь.
С другой стороны, эти аппараты могут делать все в области высокотехнологичного облучения, когда требуется радиохирургия: используются в комплексном лечении новообразований в головном мозге, локализованных процессах в легких (немелкоклеточный рак), метастатических поражений легких, печени, надпочечников, костей, мягких тканей и т. д. Благодаря высокой точности направления воздействия, они незаменимы в лечении злокачественных новообразований головы и шеи. Например, опухоль языка — очень тяжелая патология, лечить ее хирургически или невозможно, или очень сложно. После операции пациента берем мы. Активно используем методы брахитерапии и стереотаксической лучевой терапии при раке предстательной железы.
Онкологи сегодня говорят, что иммунотерапия перевернула наше сознание в лечении некоторых видов рака. Но забывают упомянуть, что сочетание иммунотерапии с некоторыми видами лучевой терапии увеличивает эффективность практически в два раза. Поэтому трудно встретить протоколы лечения, в которых рекомендована иммунотерапия без лучевой терапии.
— Да, но для ослабленных и пожилых пациентов мы используем стереотаксис, потому что это неинвазивное - щадящее лечение. С моей точки зрения, пациенты с этим диагнозом должны получать прежде всего лучевую терапию, хотя на протяжении многих лет считалось, что главный способ лечения рака предстательной железы – хирургия. Но простатэктомия сопряжена с риском для жизни, с осложнениями — каждый пятый после хирургического вмешательства страдает недержанием мочи, у 70% перенесших операцию возникает нарушение эректильной функции. Эффективность хирургии, брахитерапии и стереотаксической лучевой терапии с точки зрения борьбы с опухолью одинаковая, в некоторых случаях лучевое лечение даже более результативно. Но недержание мочи после него – редкость, всего 1-2% случаев в сравнении с 20% после хирургического удаления предстательной железы и тут даже использование роботизированных хирургических методов не помогает улучшить результаты. Эректильная дисфункция, к сожалению, может возникнуть и после проведения лучевого лечения - у 30-40% пациентов мы отмечаем снижение эректильной функции. Но, к счастью, это существенно меньше 70-80% после хирургического лечения.
- Однако по-прежнему распространен миф о том, что лучевая терапия опасна, потому что может спровоцировать развитие лучевой болезни.
- Если под лучевой болезнью мы подразумеваем то, что происходит с организмом человека, оказавшегося в эпицентре взрыва ядерной бомбы, то даже в 1970 годы лучевая терапия ее не провоцировала. Другое дело, что когда использовали большие поля для облучения, это вызывало разного рода токсичность — развивались осложнения со стороны органов дыхательной или кроветворной системы, например. Я начал работать в 1980-е, и уже тогда были разработаны методы, которые позволяли избегать фатальной или очень серьезной токсичности. Хотя какие-то неприятности от лучевой терапии были, есть и будут. Например, если мы подводим очень высокие дозы в область опухоли предстательной железы, мы можем вызвать повреждения прямой кишки, если облучаем опухоль в легких, — повреждения легких, в мозге — здоровые ткани мозга. И иногда вынуждены рисковать, потому что понимаем: другой возможности спасти человека нет. Да, бывает, лучевая терапия балансирует между добром и злом, но зачастую альтернативы нет. Например, при метастазах в головном мозге — это пациенты, которым часто нейрохирурги уже помочь не могут, возможности химиотерапии, нередко, исчерпаны. А лучевая терапия у таких пациентов ассоциируется с 20-30% риском возникновения лучевого некроза. Но в оставшихся 70-80% случаев есть шанс, что мы поможем пациенту преодолеть на определенное время его проблемы.
- Стереотаксическая лучевая терапия – не самая распространенная технология в Петербурге, возможности для ее применения есть только у двух федеральных специализированных клиник и у одной негосударственной. Часто ли она востребована?
- Когда у нас только появился первый аппарат для стереотаксиса, мы пролечили всего 12 пациентов. Это была, можно сказать, эксклюзивная методика - все отделение собиралось смотреть. А в этом году стереотаксическую лучевую терапию получили уже 350 пациентов, то есть около 20% получивших лучевое лечение в НМИЦ онкологии им. Н.Н. Петрова.
- Парадокс: при том, что в Петербурге можно получить самые современные виды лучевой терапии, петербуржцев направляют на лучевое лечение в клиники, в которых их нет. Более того, на 2020 год из средств петербургского фонда ОМС выделяется 1 млрд рублей на 3D-конформную терапию, выполнять которую в городских специализированных клиниках, можно сказать, не на чем.
- Только кто и на каком оборудовании будет ее проводить? В городских медицинских учреждениях нет современных ускорителей. Да и старые регулярно выходят из строя.
- Мы сражаемся за то, чтобы петербуржцы могли получать современное эффективное лучевое лечение. Но НМИЦ им. Петрова не может принять всех, хотя пока мы никому не отказывали.
Что касается стереотаксической лучевой терапии, которая есть в единичных клиниках Петербурга, мы примерно на 30% увеличиваем объемы ежегодно. И готовы взять на себя столько пациентов, сколько нужно. Поскольку у нас стереотаксическая лучевая терапия проводится на тех же аппаратах, на которых проводится и классическая, чтобы освободить их от загрузки стандартной 3D-конформной лучевой терапией, мы приобрели еще один линейный ускоритель, на котором и будем ее выполнять.
- В Городском онкологическом центре в Песочном и в Городском онкологическом диспансере недостаточно современных линейных ускорителей, на которых можно проводить 3D-конформную лучевую терапию. И мне кажется, что на аппаратах, которые там есть, невозможно использовать сложные технологии, например, радиохирургическое лечение и стереотаксическую лучевую терапию. Поэтому важно, чтобы руководители городской онкологической службы наладили сотрудничество с федеральными учреждениями, частными клиниками, которые готовы и могут помочь петербуржцам.
Конечно, нужно обновлять парк оборудования. Потому что на аппаратах 2001-2005 года, которые морально устарели, а многие уже сняты с производства, можно выполнять паллиативную лучевую терапию, использовать простые методики облучения, но современные достижения радиационной онкологии на них недоступны.
У городских клиник есть рентген-терапия, которой, кстати, у нас нет, в онкодиспансере есть интраоперационный ускоритель, которого больше нет ни у кого в нашем городе.
Задача - дать пациентам возможность получать все существующие на сегодня виды лучевой терапии по показаниям: простую, когда ее достаточно, сложную, когда она необходима. Понимаете, если у мужчины выявили рак предстательной железы, и он попадает в учреждение, где нет аппаратов для проведения стереотаксической лучевой терапии, нет брахитерапии, то, на мой взгляд, он адекватной помощи в этих учреждениях получить не сможет. Потому что если будут подведены достаточно большие дозы на устаревших линейных ускорителях, серьезно вырастут осложнения, если дозы будут меньше, чем необходимы для борьбы с опухолью, то лечение не будет эффективным. Да, часть пациентов выздоровеет, но меньше, чем тот процент, который мог бы и должен был выздороветь. А пациенты, которым можно провести более простую лучевую терапию, должны лечиться там, где она есть, - нет смысла направлять их в НМИЦ онкологии.
То есть Петербургу нужна грамотная маршрутизация. Но это очень болезненный вопрос для городских властей. Тут все должны понимать, что его нужно решать, и мы к этому готовы.
- До сих пор федеральные клиники лечили, конечно, петербуржцев, но – по федеральным квотам. И объясняли это тем, что тарифы ОМС на лучевую терапию слишком малы. А количество квот всегда ограничено.
- Те тарифы, что действуют в системе ОМС сейчас, рассчитаны на ту простую лучевую терапию, что есть в городских клиниках. Мы работаем в рамках программы ВМП, потому что используем технологии, которых нет в городских медучреждениях. Программа ВМП рассчитана на то, что люди могут получить помощь там, где ее могут оказать. И ее финансирование было достаточным, чтобы применять в лечении сложные технологии: закупать дорогие расходники, заниматься техническим обслуживанием оборудования. Теперь, насколько я знаю, запланированные на 2020 год тарифы петербургского фонда ОМС эквивалентны тарифам, действующим в программе ВМП.
- На 1 миллиард рублей запланировано 4 тысячи курсов 3Д-конформной терапии. 4 тысячи пациентов ее получат – это много или мало?
- Немало, но 4 тысячи курсов это не 4 тысячи пациентов. Потому что некоторым приходится проводить их повторно. Например, прошла женщина курс терапии по поводу опухоли в молочной железе, но обнаружился метастаз в лимфоузле или в другом месте, его тоже нужно облучать. Я думаю, что это 3-3,5 тысячи пациентов.
Для сравнения: в НМИЦ онкологии в год лучевую терапию получают 2 тысячи пациентов. Приблизительно столько же - РНЦРХТ им. Гранова. Эту помощь могут оказывать в частных клиниках МИБС и есть один современный ускоритель и аппараты для брахитерапии в ПСПбГМУ им. Павлова. То есть в городе можно выполнять лучевую терапию любой сложности. Важно, чтобы средства были потрачены на ее эффективные методы.
- Люди по-прежнему едут за рубеж, чтобы получить лечение радиоактивным йодом. Почему в России оно до сих пор дефицитное, а в Петербурге его и вовсе нет?
- Это не сложная технология, но для ее применения у нас действуют очень строгие требования, вплоть до строительства специальных очистных сооружений. Чтобы выполнить все, что нужно по нормативам, надо выиграть большое сражение, но сначала вложить в его подготовку огромные деньги. Сейчас предпринимаются усилия, чтобы сделать наше законодательство более демократичным — смягчить требования для применения этой технологии. А мы уже фактически готовы к тому, чтобы использовать ее, даже обсуждаем возможность открытия коек для пациентов, нуждающихся в терапии радиоактивными источниками. Эта терапия — это огромная перспектива на будущее.
Сегодня это, в первую очередь, радиойодотерапия или паллиативная терапия при метастазах в кости - она позволяет сделать комфортной жизнь человека, страдающего от болевого синдрома. Это то, к чему мы уже сегодня готовы. Но есть еще много методик использования радиоактивных источников. Например, лечение препаратами, мечеными лютецием, — это широкий круг препаратов, которые избирательно накапливаются в опухоли и уничтожают ее. То есть это один из вариантов целенаправленной терапии.
- Магической пули, которая бьет только в цель пока нет. И при таргетной терапии избирательность условная, и при стереотаксическом — какая-то доза облучения все же приходится на здоровые ткани и они могут пострадать. Но все же воздействие современных лучей и химиотерапии, действительно, выигрывает в эффективности и точности направленного действия.
- Что нужно сделать, чтобы в лучевой терапии новые технологии появлялись не только в федеральных клиниках? Закупать новые аппараты?
- Я счастлив, что лучевая терапия в нашей стране начала осознано развиваться. Но это огромная машина, она не сдвинется с места мгновенно. Чтобы ее раскрутить, нужно потратить много сил и времени, грамотно использовать финансовые вложения.
То есть миллиарды сначала должны вкладываться не в оборудование, а в людей. Их нужно учить, в том числе за границей, нужно обеспечить их достойным заработком. А когда будут люди, способные работать на современном оборудовании, тогда и нужно его покупать.
- Сколько всего аппаратов для лучевой терапии работают у вас?
- Четыре ускорителя - от самого простого до самого сложного, и еще два аппарата – для брахитерапии. Плюс много компьютерных планирующих систем, задача которых сделать лучевую терапию максимально точной.
Научные публикации
Аникеева О.Ю., Половников Е.С., Бедный И.В., Филатов П.В.
ФГБУ Новосибирский научно-исследовательский институт патологии кровообращения им. акад. Е.Н. Мешалкина Минздрава России, Новосибирск, Россия
Контакты: Аникеева О.Ю. E-mail: sibradiolog@list.ru, o_anikeeva@nrisp.ru
Представлены результаты применения технологии стереотаксической лучевой терапии с использованием системы активного контроля дыхания у больных немелкоклеточным раком лёгкого с конкурирующей сердечнососудистой патологией.
Материалы и методы. 26 больным немелкоклеточным раком лёгкого с сопутствующей сердечнососудистой патологией, получавшим лечение в отделении радиотерапии ННИИПК им. акад. Е.Н. Мешалкина в период с сентября 2010 по март 2012 гг., проведена стереотаксическая конформная лучевая терапия. Медиана возраста составила 67 лет, диапазон – от 48 до 80 лет, соотношение мужчин и женщин было 3:1. 83% пациентов имели верифицированный гистологический диагноз. Средний диаметр опухоли – 6±2,8 см, преимущественно центральные формы (61%), IIB-IIIА стадия, ДН не превышала II ст. Все больные имели серьезную конкурирующую сердечно-сосудистую патологию различной степени выраженности.
Проведение лучевой терапии осуществлялось на стереотаксическом линейном ускорителе. Протокол предлучевой подготовки включал МCКТ топометрическое исследование, оконтуривание и совмещение изображений проводили на станции оконтуривания Focal Pro, расчёт лечебного плана – на планирующей системе Ergo++. Использовали различные устройства для фиксации пациентов, систему контроля по изображению (IGRT). Лечение проводили с использованием активного контроля за дыханием (ABC), при умеренном вдохе с задержкой дыхания в среднем 15-18’, ротационным объёмно-модулированным облучением.
Выводы. Использование системы активного контроля дыхания позволяет достичь увеличения общегообъёмалёгкихи, сокращая PTV, даетзначительное снижение средней токсичной дозы на легкое, а также на критические органы (пищевод, средостение, спинной мозг), увеличивая при этом суммарную поглощенную дозу, что ведет к значительному увеличению выживаемости пациентов с сердечно-сосудистой патологией.
Ключевые слова: стереотаксическая конформная лучевая терапия, радиотоксичность здоровых тканей, ранние и поздние лучевые осложнения, активный контроль за дыханием, коморбидная патология.
ВВЕДЕНИЕ
Сегодня рекомендуемым методом лечения немелкоклеточного рака лёгкого (НМРЛ) является хирургический, однако применить его удается не всегда [6, 19]. Конкурирующая тяжелая сердечнососудистая патология, функциональный статус, дыхательная функция и возраст часто становятся факторами, определяющими выбор метода лечения пациентов этой группы. К сожалению, стандартные критерии отбора таких больных для хирургического лечения отсутствуют [1, 14, 19]. Тем не менее, известно, что наиболее высокий риск развития инфаркта миокарда при резекции легких имеют больные с нестабильной или тяжелой формами стенокардии (III и IV функциональные классы), инфарктом миокарда давностью менее 30 суток, декомпенсированной сердечной недостаточностью, тяжелым поражением клапанного аппарата сердца [7, 10, 16]. Пациентов со сниженными легочными резервами или функциональным статусом, имеющих по причинам коморбидности высокие риски осложнений при оперативном вмешательстве, часто лечат радикальным облучением. Несмотря на то, что они имеют такие же клинические стадии, как и операбельные больные, у них отмечается худший прогноз, ограничивающий возможность сравнения методов лечения [15, 16, 19]. Смертность, не связанная с раком, дает различное процентное соотношение всех смертностей хирургического и лучевого лечения [19]. Кроме того, при использовании лучевого лечения опухолей грудной клетки существенны величина суммарной лучевой нагрузки на уже скомпрометированную конкурирующими заболеваниями сердечно-сосудистую систему и общий объем ткани средостения (при наличии дополнительных зон облучения) [3, 5, 6, 19]. Рак лёгкого по-прежнему остается наиболее распространенной формой онкологического заболевания, при которой оперативное вмешательство не превышает 20%, а резектабельность – 15% [1, 6, 7,15]. Ограниченная способность лучевой терапии осуществлять локальный контроль во многом обусловлена невысокой радиочувствительностью самой опухоли [15]. Прогноз при НМРЛ остаётся крайне неблагоприятным даже у пациентов, подлежащих радикальной лучевой терапии. Это связано тем, что распространенные стадии заболевания, экскурсия лёгких, точность укладки и регулярная воспроизводимость лечения заставляют выбирать широкие поля облучения, захватывающие большие объёмы тканей, в т. ч. здоровых. Риск развития острого лучевого повреждения лёгкого и средостения на фоне лучевой терапии напрямую зависит от дозы облучения и объёма нормальной ткани, подвергшейся облучению [4, 7, 9, 11, 12]. Одной из причин неуспеха лучевой терапии рака лёгкого является необходимость использования высоких дозх облучения для обеспечения локального контроля над опухолью [8] вследствие ее низкой радиобиологической чувствительности на фоне быстро развивающейся радиотоксичности окружающей нормальной ткани лёгкого [3, 9].
На сегодняшний день локальный контроль обеспечивают за счёт использования различных схем нестандартного фракционирования и увеличения суммарной поглощенной дозы, а также систем, позволяющих точно определять объём мишени во время лечения и, как следствие, сокращать объём облучения [9, 17, 20].
В данной работе представлены результаты стереотаксического конформного лучевого лечения при использовании системы активного контроля дыхания ABC (Аctive Breathing Coordinator) у больных c местно-распространенным раком легкого, дающие возможность оценить эффективность увеличения суммарной дозы на опухоль и влияние облучения на сердечно-сосудистую систему [11, 13, 17, 18].
МАТЕРИАЛЫ И МЕТОДЫ
Представлены данные о 26 пациентах, которым проводили лучевое лечение по поводу НМРЛ IIb стадии с использованием умеренного глубокого вдоха с последующей задержкой дыхания при помощи системы ABC. Всем пациентам после комплексного обследования проведена радикальная лучевая терапия. У 83% диагноз был гистологически верифицирован. У всех пациентов имелась серьезная конкурирующая сердечно-сосудистая патология. Большинство (16, или 64%) страдали ишемической болезнью сердца (ИБС), из них у 28% было вмешательство на сердце в объёме аортокоронарного шунтирования, у 72% – стентирования венечных артерий. У четырех пациентов этой группы стентирование было проведено более трех раз. 30% (8) пациентов имели тяжелые приобретенные пороки сердца, состояние после протезирования клапанов сердца, 46% (11) – нарушения ритма сердца различной степени выраженности (у трех пациентов – III степень выраженности сердечной недостаточности). Все пациенты были оперированы в клинике им. акад. Е.Н. Мешалкина в различные периоды конкурирующего заболевания. Медиана возраста составила 67 лет, диапазон от 48-80 лет, соотношение мужчин и женщин – 3:1. Средний диаметр опухоли – 6,0+2,4 см, преобладали центральные формы (61%), стадия рака легкого IIB-IIIА (90%), ДН не превышала II ст. Данным пациентам планировалась радикальная схема лучевого лечения. Был разработан протокол обследования и лечения. Стандартное обследование включало обязательную гистологическую верификацию и МСКТ лёгких с контрастированием на 32/64-срезовом томографе GE. Режим облучения и его объём определяли с учётом стадии заболевания, вовлеченности лимфатических узлов, расположения критических (здоровых) органов, тяжести соматической (сердечно-сосудистой) патологии.
Лучевую терапию осуществляли на стереотаксическом комплексе, на базе линейного ускорителя Elekta Axesse. Протокол предлучевой подготовки включал МCКТ топометрическое исследование, которое проводили на 16-ти срезовом МСКТ сканере Toshiba LB, в аксиальной плоскости, с толщиной среза не более 2 мм, Т1 взвешенное изображение с контрастным усилением (омнискан), угол наклона гентри 0 градусов. Оконтуривание и совмещение изображений проводили на станции оконтуривания Focal Pro, расчёт лечебного плана– на планирующей системе Ergo++.
В работе использовали различные устройства для фиксации пациентов, наличие системы контроля по изображению (IGRT) позволяло контролировать точность установки и воспроизведения укладок. Средняя суммарная доза составила 70-74 Гр, количество фракций зависело от режима фракционирования, доза за фракцию составляла от 2 до 4 Гр, с покрытием 95% изодозой объёма GTV. В охвате PTV стремились к максимально идентичным и сопоставимым планам, насколько это было возможно. Это наиболее трудная задача с учётом подвижности органа и его структурной неоднородности. Нагрузка на критические органы была сделана с учётом толерантности здоровых тканей. На этапе предлучевой подготовки были выполнены МСКТ в двух сериях на свободном дыхании и серия исследований при помощи системы ABC. GTV были очерчены согласно данных визуализации и предложенных атласов RTOG. В данной группе использовали стандартные рекомендованные отступы для CTV = 1,0 см вверх и вниз и 1,0 см в аксиальной плоскости. PTV соответственно составили в верхней и средней доле 0,5 см superior/ inferior, в нижней доле – 0,7 см superior/inferior, anterior/posterior = 0,5см, left/right = 0,5 см для всехдолей. Эти отступы были просчитаны в результате совмещения двух серий изображений МСКТ на свободном дыхании и при МСКТ при использовании ABC устройства. Было определено среднее значение подвижности лёгкого на фоне ABC. Облучение проводили методикой VMAT (Volumetric Modulated Arc Therapy) – ротационное объемномодулированное.
ABC устройство. Active Breathing Coordinator состоит из турбинного спирометра и дисплеев визуально воспроизводящих кривые дыхания. Чтобы повысить точность спирометрических измерений, у пациента, дышащего через трубку с бактериальным фильтром, зажимается нос. После прохождения через спирометр определенного объема воздуха (пороговое значение) управляемый дыхательный клапан перекрывает дыхательную трубку, помогая пациенту задерживать дыхание на одном и том же уровне. Система настраивается индивидуально под каждого пациента или процедуру с возможностью изменения порогового значения и длительности задержки дыхания. Во время манипуляций пациент контролирует работу системы посредством специального пульта с кнопкой. Эта кнопка должна быть нажата для нормального функционирования системы, и если она будет отпущена, клапан автоматический разблокируется, и пациент сможет свободно дышать. Обычно перед использованием требуется ознакомить пациента с возможностями системы. Для этого ещё перед съемкой на КТ пациент проходит обучение и тренировку. В этот же момент выбирается комфортное для данного пациента пороговое значение вдоха (или выдоха) и длительность удержания дыхания. Использование ABC лишь незначительно увеличивает время проведения процедуры и составляет в среднем примерно 15 мин.
Опубликованные данные показывают высокую клиническую эффективность системы и хорошую переносимость пациентами [11, 21]. Даже пациенты с нарушением дыхательных функций в состоянии обеспечить задержку дыхания на 15-20 сек. Главная цель, которой руководствовались создатели ABC, – ограничить респираторные колебания и, как результат, обеспечить более точную доставку дозы. При проведении КТ исследований стационарное положение опухоли увеличивает точность определения мишени [11, 15, 21]. Например, в случае опухолей, расположенных в нижних долях легких, это позволяет не только получать снимки лучшего качества, но и существенно сократить PTV, тем самым сохранив при лечении окружающие здоровые ткани [11, 21]. По существующим данным, при лечении печени с использованием ABC, амплитуда движения мишени сокращается с первоначальных 10-40 мм до 0-5 мм, что позволяет подводить к мишени существенно большие дозы при том же уровне риска осложнений. Высокая воспроизводимость положения мишеней и критических органов при использовании ABC во время одной сессии и между фракциями подтверждена многочисленными клиническими испытаниями. В некоторых случаях АВС снижает необходимость в частом использовании систем визуализации непосредственно в ходе лечения [8, 11, 21, 26].
РЕЗУЛЬТАТЫ
При анализе результатов лечения 26 пациентов, получавших лечение рака легкого с активным контролем дыхания, отмечено увеличение средней суммарной дозы облучения при проведении самостоятельной радикальной программы лучевой терапии (70+4,0 Гр). В исследовании не использовали увеличение эквивалентной СОД более 80 Гр. Это было связано с более часто встречающимися центральными формами НМРЛ и увеличением среднего уровня толерантности критических органов (пищевод, средостение, сердце, спинной мозг). Кроме того, использование АВС позволяет в 70% проводить лучевую терапию без расщепления курса, достоверно увеличивая тем самым эффективность локального контроля над опухолью. Необходимо отметить, что возможность максимального увеличения СОД выше 74 Гр ограничивалась объёмом пораженного органа. При расположении опухоли в непосредственной близости от корня легкого в первую очередь следует обращать внимание на лучевую нагрузку медиастинального отдела. Надо отметить, что у 22 (84,6%) пациентов не было выявлено значительных нарушений гемодинамики или декомпенсации сердечно-сосудистой системы, потребовавших прервать лечение. У 4 пациентов нарушения ритма и изменение гемодинамики носили обратимый характер и купировались приемом стандартных кардиотропных и гипотензивных препаратов. В 30% клинических наблюдений быстро нарастающая лучевая реакция со стороны пищевода (трудности при проглатывании пищи), прогрессирующий кашель, плохо поддающиеся симптоматической терапии, снижение числа лейкоцитов заставляло прекратить лечение и расщеплять курс. Надо отметить, что при большом объеме новообразования, вовлечении лимфатических узлов средостения контроль респираторного цикла в терминах лучевой нагрузки на критические органы не имеет значительных преимуществ перед конвенциальными конформными методиками. Поэтому в некоторых случаях вполне оправдано применение фиксированных полей облучения или методики IMRT на свободном дыхании пациента.
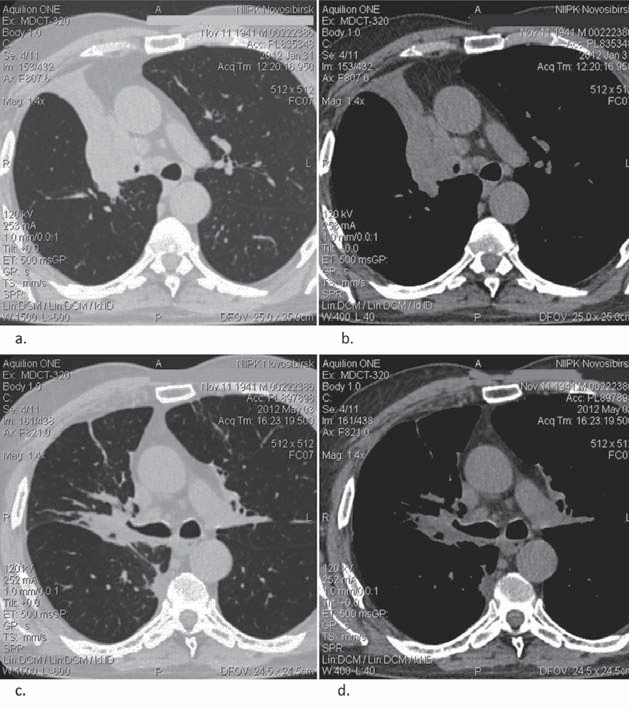
Рис. 1. Б-ой, 71 год. Центральный рак верхней доли правого лёгкого T2N2M0, плоскоклеточный неороговевающий: до начала лучевой терапии (a – легочное окно, b – мягкотканое окно); через 3 мес. после окончания лучевой терапии (c – легочное окно, d – мягкотканое окно).
Ситуация кардинально меняется при небольшой распространенности процесса или наличии отдельных очагов, когда требуется прецизионное облучение сразу нескольких мишеней. В таком случае альтернативы методу контролируемой задержки дыхания нет [21, 22].
На рисунке 1 представлен результат лечения больного раком легкого до и после проведенного курса стереотаксической конформной дистанционной лучевой терапии по радикальной программе в режиме динамического фракционирования СОД=70 Гр.
В таблице 1 приведены данные пациентов, получавших курс лучевой терапии по поводу первичного рака легкого в режиме РОД 2,75 Гр суммарно до 70 Гр с применением ABC.
Как видно из приведенных данных, преимущество VMAT с контролем по дыханию тем очевиднее, чем меньше объем облучаемой мишени. Это может стать определяющим фактором в выборе метода лечения для пациентов с сердечной патологией.
| Лучевая нагрузка на органы средостения при облучении VMAT с использованием системы активного контроля дыхания | |||||
|---|---|---|---|---|---|
| Объем мишени | % доза на вовлеченное легкое | % доза на здоровое легкое | % доза на сердце | % доза на пищевод | % доза на спинной мозг |
| 3 VMAT | 21-36 | 4-25 | 1-24 | 10-57 | 3-15 |
| >500 см 3 VMAT | 33-44 | 4-27 | 4-43 | 44-76 | 14-23 |
Использование устройства активного контроля за дыханием позволяет при глубоком вдохе и задержке дыхания увеличить объём лёгкого, тем самым существенно сократив объём облученной здоровой ткани лёгкого, уменьшить клинические отступы (CTV), снизить лучевые реакции, увеличив суммарную очаговую дозу за курс лечения, и значительно увеличить эффективность локального контроля над опухолью [13, 15, 17, 20-22]. Использование одинаковых подходов при выполнении совмещения изображения МСКТ и системы визуализации на ускорителе при активном контроле над дыханием позволяет значительно снизить процент системной ошибки при укладке, увеличивая её воспроизводимость. Из недостатков данной системы надо отметить более длительную предлучевую подготовку пациента. Само облучение также занимает большее количество времени, снижая пропускную способность. Обязательна высокая квалификация персонала.
ЗАКЛЮЧЕНИЕ
Наличие сопутствующей конкурирующей патологии сердечно-сосудистой системы является важным прогностическим фактором при местнораспространенном раке лёгкого. Использование системы активного контроля дыхания и облучения с использованием методики VMAT дает очевидное преимущество у пациентов с объёмом образования менее 500 см 3 . При активной управляемой задержке дыхания увеличивается общий объём лёгких, сокращается объём PTV, снижается средняя токсичная доза на здоровую ткань легкого, а также на средостение, пищевод, спинной мозг, увеличивается суммарная поглощенная доза, что ведет к значительному увеличению локального контроля над опухолью, снижению лучевой нагрузки на сердце, увеличению безрецидивной выживаемости пациентов.
Читайте также: