Современные методы лечения рака эндометрия
Лечение метастатического рака матки. Может ли произойти рецидив? Что такое паллиативное лечение? Шансы на успешное лечение на разных стадиях рака тела матки.

Современные методы лечения рака тела матки:
- удаление опухоли хирургическим путем
- химиотерапия
- лучевая терапия
- гормональная терапия
Составляя план лечения, врач ориентируется на некоторые факторы:
- Тип и стадия злокачественной опухоли.
- Возможные побочные эффекты.
- Возраст женщины.
- Общее состояние здоровья пациентки.
- Желание женщины иметь в будущем детей.
Хирургическое лечение рака тела матки
Основной вид хирургического лечения при раке тела матки – гистерэктомия, или удаление матки. Существуют два вида операции:
- Если рак не распространился на шейку матки и окружающие ткани, выполняют простуюгистерэктомию. Удаляют матку и шейку.
- Если опухолевые клетки распространились на шейку матки и окружающие ткани, выполняют радикальную гистерэктомию. Помимо матки и ее шейки, удаляют верхнюю часть влагалища и окружающие ткани.
Гистерэктомия может быть выполнена через разрез на животе (абдоминальная) или лапароскопически, специальными инструментами через проколы в брюшной стенке. Иногда матку удаляют через влагалище (вагинальная гистерэктомия). Еще существует роботизированный вариант операции, но соответствующее оборудование и обученные работе с ним хирурги есть далеко не в каждой клинике.
Зачастую одновременно с гистерэктомией проводят сальпингоофоректомию – удаление обеих маточных труб и яичников. После этого наступает искусственная менопауза. Яичники можно попробовать сохранить, если женщине меньше 45 лет, и у нее обнаружен рак матки на I стадии.
Лимфодиссекция – операция, во время которой удаляют ближайшие к матке лимфатические узлы. Ее тоже проводят одновременно с гистерэктомией. Удаленные лимфоузлы отправляют в лабораторию и исследуют на предмет наличия раковых клеток.
Внутри брюшной полости есть жировой слой, который свисает вниз наподобие фартука. Он называется большим сальником. Если есть подозрение, что на него распространились раковые клетки, его также удаляют. Такая операция называется оментэктомией. Хирург может провести биопсию брюшины: получить фрагмент тонкой пленки из соединительной ткани, которая выстилает изнутри брюшную полость, и отправить на цитологическое, гистологическое исследование.
Химиотерапия при раке тела матки
При раке тела матки назначают такие химиопрепараты, как паклитаксел (таксол), карбоплатин, доксорубицин (адриамицин), цисплатин.
Химиотерапию назначают по некоторым правилам:
- Так как механизмы действия препаратов различаются, эффективнее всего работают комбинации из двух и более химиопрепаратов.
- Химиотерапию назначают циклами. После введения лекарства делают перерыв, чтобы организм женщины мог восстановиться.
- Иногда циклы химиотерапии чередуют с сеансами лучевой терапии.
- Иногда химиотерапию проводят одновременно с лучевой терапией. Такое лечение называется химиолучевой терапией. Оно более эффективное, но обладает более сильными побочными эффектами.
Лучевая терапия при раке тела матки
Лучевая терапия при раке эндометрия бывает двух видов: наружная (внешняя) и брахитерапия.
При наружной лучевой терапии область таза облучают из аппарата, который находится на некотором расстоянии от женщины. Процедура напоминает рентгенографию, но длится дольше – примерно полчаса. Обычно сеансы проводят 5 раз в неделю в течение 4–6 недель.
При брахитерапии источник излучения помещают во влагалище. Это помогает уничтожить раковые клетки, которые остались после гистерэктомии, при этом минимизировать лучевую нагрузку на мочевой пузырь, прямую кишку.
Брахитерапия при раке матки бывает двух видов:
- Низкодозовая (LDR). Используют низкие дозы излучения, но процедуру проводят долго – в течение 1–4 дней, и всё это время женщина должна неподвижно лежать. В настоящее время такой вариант лечения применяют редко из-за риска осложнения – тромбоза глубоких вен ног.
- Высокодозовая (HDR). Используются высокие дозы излучений, процедура продолжается не более часа.
Гормональная терапия при раке эндометрия
Клетки некоторых злокачественных опухолей матки имеют рецепторы к эстрогенам и прогестерону. Их называют гормонально-позитивными, так как их рост зависит от гормонов. В таких случаях возможна гормональная терапия.
Чаще всего применяют препараты прогестерона и его аналоги – прогестины. Также используют тамоксифен, ингибиторы ароматазы.
Гормональную терапию назначают на разных стадиях рака матки, в том числе при распространенных опухолях. Если у женщины рак I стадии, и она планирует в будущем иметь детей, она может предпочесть гормональную терапию хирургическому вмешательству.

Паллиативное лечение при раке тела матки
Если злокачественная опухоль признана неизлечимой, это еще не означает, что пациентке ничем нельзя помочь. Паллиативное лечение помогает уменьшить размеры опухоли и затормозить ее рост, продлить жизнь, справиться с симптомами.
Если по прогнозам врачей женщине осталось жить не более 6 месяцев, можно получить помощь в хосписе. Специалисты помогут облегчить симптомы, обеспечат уход и заботу.
Каковы шансы на успешный исход лечения? Бывают ли рецидивы?
В онкологии существует такое понятие, как ремиссия. Это состояние, когда в организме не обнаруживают признаков присутствия рака, и пациент не испытывает симптомов. Всегда сложно сказать, насколько полной является ремиссия у конкретной пациентки. В организме могли остаться раковые клетки, которые невозможно выявить современными методами диагностики. Со временем они могут дать начало новой опухоли.
Эффективность лечения в онкологии оценивают по пятилетней выживаемости. На разных стадиях рака эндометрия она составляет:
- Стадия 0 – 90%.
- Стадия I – 75–88%.
- Стадия II – 69%.
- Стадия III – 47–58%.
- Стадия IV – 15–17%.
Методы лечения рецидива те же, что и при первичном раке. Однако, врач может назначить препараты и процедуры в других комбинациях, учитывая особенности новой опухоли.
Для того чтобы вовремя диагностировать рецидив, врач назначит периодические осмотры. Во время них проводят гинекологический осмотр, берут мазок на цитологию.
Если у женщины есть подозрительные симптомы, доктор может назначить анализ крови на онкомаркер CA-125, компьютерную томографию, ультразвуковое исследование, биопсию.
Чаще всего рецидивы рака тела матки проявляются в виде разных симптомов и изменений, которые можно обнаружить во время гинекологического осмотра.
Медицинский эксперт статьи


Способы лечения рака эндометрия, а также результаты терапии зависят от того, на какой стадии обнаружилось заболевание. Ещё во время диагностики медики изучают всю информацию о проблеме: определяют расположение патологического очага, его тип, распространенность и степень агрессии. После этого сразу несколько врачей (консилиум) составляют индивидуальную схему терапии.
Если на момент диагностики раковый процесс уже распространился на рядом расположенные ткани и органы, то приходится прибегать к резекции матки и придатков, с дальнейшим назначением химиопрепаратов и лучевого лечения.
При интенсивном распространении раковой опухоли (к примеру, в жизненно-важные органы, кости), когда проведение операции крайне затруднено или невозможно, назначают поддерживающее лечение, цель которого – остановка развития болезненного процесса и продление жизни женщины. Чаще всего в подобных ситуациях назначают химиопрепараты, гормоны, иммунотерапию. Консервативное лечение может быть дополнено лучевым воздействием.
Клинические рекомендации
Существует ряд следующих клинических рекомендаций, которые относятся к лечению рака эндометрия.
Из-за относительно слабого общего эффекта от применения химиопрепаратов при раке эндометрия нельзя определить оптимальную схему такого вида лечения. Чаще всего такие препараты применяются в виде моно или политерапии.
Монотерапия предусматривает такие назначения:
- капельное внутривенное введение гемцитабина в количестве 1250 мг/м² на протяжении получаса (первые, восьмые и пятнадцатые сутки, повтор введения через неделю);
- капельное внутривенное введение доксорубицина в количестве 60 мг/м² один раз в 21 день (от четырех до шести курсов);
- капельное внутривенное введение цисплатина в количестве 100 мг/м² один раз в 21 день (от четырех до шести курсов);
- капельное внутривенное введение эпирубицина в количестве 75-100 мг/м² один раз в 21 день (от четырех до шести курсов).
- Количество курсов политерапии назначается в индивидуальном порядке:
- внутривенное капельное введение доксорубицина по 50 мг/м² один раз в 28дней;
- внутривенное капельное вливание циклофосфамида по 500 мг/м² один раз в 28 дней, вливание фторурацила по 500 мг/м² один раз в 28 дней, или цисплатина по 50 мг/м², доксорубицина по 30 мг/м² (первые и восьмые сутки), фторурацила по 400 мг/м² (первые и восьмые сутки), циклофосфамида по 400 мг/м² (первые и восьмые сутки – курс проводят повторно через каждые 28 дней), либо доксорубицин по 50 мг/м² один раз в 21 день;
- капельное введение цисплатина по 100 мг/м² один раз в 21 день.
Гормонотерапия при раке эндометрия
Назначение гормональных препаратов во избежание рецидива и метастазирования практикуют не во всех случаях рака эндометрия. Генерализованный процесс может требовать следующих назначений:
- внутримышечные инъекции гестонорона капроата по 200 мг еженедельно, в течение длительного времени, либо мегестрол перорально от 160 до 320 мг в сутки в течение минимум двух месяцев, либо медроксипрогестерон перорально по 200-800 мг в сутки в течение десяти недель (после чего переходят на пероральный прием 200-800 мг дважды в неделю в течение продолжительного времени).
Динамику воздействия химиопрепаратов определяют по таким критериям:
- степень уменьшения диаметров первичного или рецидивного очага;
- исчезновение или уменьшение диаметров метастатических очагов.
Базовым критерием считается также облегчение общего самочувствия пациенток, исчезновение симптоматики, повышение качества жизни и увеличение его продолжительности.
Современные лекарства с противораковым действием способны воздействовать сразу в нескольких направлениях, поэтому применяют их обычно комплексно. Обычная схема лечения может сочетать в себе препараты, разрушающие раковые клетки, а также средства, тормозящие рост опухоли и предупреждающие формирование новых злокачественных структур.
На поздних этапах болезни практически всегда приходится применять анальгетики, а также разнообразные симптоматические препараты.
Базовыми химиотерапевтическими препаратами считаются такие группы медикаментов:
- Алкилирующие агенты, разрушающие белки, участвующие в формировании ДНК злокачественных структур (типичный представитель – циклофосфамид).
- Платиновые препараты – токсичные цитостатические средства, которые также разрушают ДНК злокачественных клеток.
- Препараты-антиметаболиты – изменяют клеточный генетический механизм, делая невозможным клеточное деление (типичный представитель – гемцитабин).
- Препараты-антрациклины – формируют вещества, способные повреждать ДНК пораженных структур (типичный представитель – даунорубицин).
- Препараты-таксаны – изменяют механизмы деления злокачественных клеток (например, паклитаксел).
- Препараты-винкалкалоиды – вызывают разрушение ракового цитоскелета (например, известные винкристин и винбластин).
Гормональное лечение уместно при многих видах гормонозависимых опухолевых процессов. Эстрогенсодержащие медикаменты применяют для угнетения андрогенной активности, а андрогенсодержащие – для угнетения выработки эстрогенов.
Почему применение таких средств вызывает много споров среди медицинских специалистов? В первую очередь, гормональные препараты могут подавлять действие химиопрепаратов. Во-вторых, при продолжительном гормональном лечении может вырабатываться резистентность организма.
Может ли быть назначен норколут при раке эндометрия? Этот медикамент применяют в таких случаях:
- если речь идет о миоме небольшого размера;
- если имеется эндометриоз, гиперплазия эндометрия.
Раковые процессы репродуктивных органов считаются противопоказанием к применению норколута, поэтому в данной ситуации его не назначают.
Не назначают для лечения рака эндометрия и такой известный препарат, как тамоксифен, который активно применяется при раковых процессах в молочных железах. Более того, долгое время тамоксифен и рак эндометрия связывали друг с другом: считалось, что длительный прием препарата может вызвать злокачественное перерождение слизистых тканей в матке. Несмотря на то, что ученые впоследствии не смогли представить все необходимые доказательства такой информации, применение тамоксифена при раке эндометрия считается нецелесообразным.

[1], [2], [3], [4], [5], [6]
Народное лечение
Стоит ли пытаться вылечить рак эндометрия при помощи народных рецептов? Однозначно ответить на этот вопрос нельзя. Некоторые женщины утверждают, что народная медицина помогла им избавиться от страшного заболевания, а для других такое лечение стало лишь пустой тратой драгоценного времени, что привело лишь к усугублению проблемы.
С точностью можно сказать одно: приступать к подобному лечению допускается только после откровенного разговора с лечащим доктором. Возможно, будут даны соответствующие рекомендации, а народные методы смогут успешно усиливать действие традиционной терапии.
- Измельчают 150 г листьев алоэ, примешивают 250 г меда и 200 мл качественного красного вина. Полученную смесь помещают в холодильник для выдержки в течение пяти дней. Принимают средство по 1 ч. л. трижды в сутки перед едой.
- Заваривают 1 ст. л. растения чертополох в 1 л кипящей воды, настаивают в течение пяти часов, фильтруют. Пьют по 100 мл трижды в сутки, перед едой. Хранят средство в холодильнике не больше трех дней.
- Заливают водой свежие или высушенные почки березы, исходя из пропорции 5:1. Ставят на огонь, доводят до кипения, выключают, накрывают крышкой и выдерживают на протяжении двух часов. Далее средство фильтруют и используют для спринцеваний (ежедневно, утром и вечером).
- Пропитывают ватные или марлевые тампоны маслом облепихи или чистотела. Такие тампоны ставят на ночь ежедневно.

[7], [8], [9], [10], [11], [12], [13], [14]
Лечение травами
- Ежедневно делают спринцевания настоями таких растений, как чистотел, коланхоэ, горец птичий.
- Регулярно пьют чай с добавлением женьшеня, розовой радиолы, барбариса обыкновенного.
- Пьют чай из мелиссы, по 4-5 раз в сутки между приемами пищи.
- Настаивают в термосе корневище белой лилии (1 ст. л. на 1 л кипятка), пьют по 200 мл дважды в сутки.
- Принимают теплые чаи с добавлением отвара ромашки, чертополоха, календулы, по нескольку раз в сутки.
- Принимают настой полыни ежедневно по 30 капель с небольшим количеством воды.
Гомеопатия
Конечно же, онкология – это не повод для экспериментов. Но если учесть, что рак эндометрия является комплексным заболеванием, при котором протекает сразу несколько болезненных процессов, то и воздействовать на проблему необходимо в комплексе. Иначе признаки патологии смогут вернуться снова в виде рецидива.
Многие специалисты уверены, что применение гомеопатического лечения на фоне традиционной терапии приводит к более устойчивому и выраженному результату. Препараты гомеопатии назначают поэтапно:
- прием средств для торможения роста новообразования;
- блокировка опухолевого роста;
- направленное воздействие на опухоль с целью уничтожения;
- восстановление организма, предупреждение повторного заболевания.
Подбор препаратов осуществляется гомеопатом во время индивидуальной консультации с пациенткой, больной раком эндометрия. Преимущество отдается таким средствам:
- Аргентум металликум;
- Асафетида;
- Аргентум йодатум.
Дозировки устанавливаются индивидуально: учитываются не только стадия и симптоматика болезни, но и возраст, а также психические и конституциональные особенности пациентки.
Хирургическое лечение
Для большинства пациенток базовым способом избавления от рака эндометрия становится хирургическое вмешательство. Чаще матку удаляют полностью: такая операция называется тотальной гистерэктомией. Удаление матки и придатков показано в менопаузальном периоде.
При выборе лечебной тактики обязательно учитывается распространенность опухолевого процесса. Известно две разновидности хирургического удаления матки:
- ампутация, когда матку отделяют от шейки;
- экстирпация, когда орган удаляют вместе с шейкой.
По клиническим наблюдениям, первый вариант удаления воспринимается пациентками менее болезненно, да и вероятность развития осложнений при ампутации ниже, чем при экстирпации. Поэтому ко второму варианту прибегают лишь тогда, когда имеются подозрения распространения патологии на область шейки.
Чаще всего в ходе вмешательства придатки удаляют. Безусловно, в результате этого гормональный баланс в организме женщины в какой-то мере снижается, но не критично: за выработку гормонов берутся другие железы – к примеру, надпочечники.
Операция гистерэктомии может проводиться такими методами:
- абдоминальный, с доступом через разрез в животе;
- вагинальный, с доступом через разрез на задней влагалищной стенке.
Лишь в отдельных случаях удаления органа можно избежать: если новообразование не превышает размеры в 3 мм. В подобной ситуации проводят абляцию эндометриального слоя. В результате матка сохраняется, однако женщина все равно становится бесплодной.
Лучевая терапия рака эндометрия
Лучевое лечение подразумевает применение высокоэнергетических лучей для разрушения злокачественных клеток. Облучение может быть внешним или внутренним (так называемая брахитерапия).
Лучевое лечение проводят после оперативного вмешательства, для снижения вероятности рецидивов. Кроме этого, проведение такой терапии уместно в случае, если операция по каким-либо причинам противопоказана.
При повторном развитии опухоли облучение можно применять в качестве основной лечебной процедуры.
У подавляющего числа больных второй или третьей стадией рака эндометрия лучевая терапия применяется в качестве профилактического противорецидивного метода.
Данный вид лечения может сопровождаться рядом побочных проявлений, которые обычно купируются самостоятельно спустя несколько месяцев после окончания воздействия. Так, может отмечаться повышенная сухость кожи, выпадение волос, вагинальные выделения, понос, тошнота, неприятные ощущения при выделении мочи, постоянное чувство усталости. Кроме этого, возможны и долгосрочные последствия в виде лимфатического отека нижних конечностей.

[15], [16], [17], [18], [19], [20], [21], [22]
Лечение рака эндометрия в Израиле
Израильские специалисты в области онкологии и хирургии проводят лечение рака эндометрия, используя щадящие и одновременно эффективные методики. Резекция опухолевого очага и поврежденных тканей выполняется сквозь небольшие проколы в брюшной стенке, либо через внутривагинальный разрез. Такой подход позволяет исключить повреждение здоровых тканей, ускорить период регенерации и предотвратить формирования грубых рубцовых изменений.
В ходе оперативного вмешательства проводится биопсия согласно новой методике Frozen Section. Это взятие материала из всех лимфатических узлов, расположенных поблизости матки, с дальнейшим проведением анализа. Такой метод позволяет определить, какие именно узлы следует удалять, чтобы в дальнейшем избежать рецидива заболевания.
Для сравнения: в большинстве отечественных клиник базовое лечение рака проводят путем открытого хирургического вмешательства, причем гистерэктомия никогда не сопровождается исследованием лимфатических узлов. В итоге, по статистике, у 60% пациенток на протяжении двух лет развивается повторная патология.
Для того чтобы подобрать оптимальную для лечения израильскую клинику, нужно принимать во внимание следующие моменты:
- квалификацию профильных специалистов;
- наличие в клинике современного оборудования, позволяющего удалять опухоли с предельной точностью, во избежание рецидива заболевания;
- уровень сервиса и ценовую политику лечебного центра.
Как правило, выбор хорошей клиники в Израиле для лечения эндометриального рака не представляет особенных проблем. Главное – это заранее связаться с учреждением и обговорить все возможные нюансы.
Питание при раке эндометрия
Раковая опухоль в стадии активного роста поглощает большую часть энергии, что приводит к ослаблению организма. Поэтому пищевой рацион при раке эндометрия следует составить так, чтобы пациентка ежедневно восполняла запасы витаминов и смогла сохранять и поддерживать необходимый энергетический потенциал. Усиление возможностей организма приведет к укреплению иммунитета и усилению ответа на агрессию злокачественного процесса.
На поздних этапах заболевания женщина, как правило, стремительно теряет в весе, истощается. Этот момент тоже необходимо учесть, составляя меню для больной: пища должна сохранять в себе предельно возможный процент полезных компонентов.
Считается, что некоторые продукты способны оказывать своеобразное противоопухолевое действие. К таким продуктам относятся:
- все виды капусты;
- репчатый лук, чеснок;
- спаржа, горох, соевые бобы, фасоль;
- морковь, свекла;
- злаки;
- овощи и фрукты, не прошедшие термическую обработку;
- зелень, ягоды.
От мяса диетологи советуют отказаться вообще, заменив его морской рыбой.
От чего следует наотрез отказаться:
- от спиртных напитков, крепкого черного чая, какао, шоколада;
- от сладостей, сахара;
- от белого хлеба, сдобной выпечки;
- от острых и соленых блюд, копченых продуктов;
- от полуфабрикатов, фастфуда.
Приветствуется употребление чая или отвара на основе лекарственных растений, а также обычной негазированной воды.
За последние 30 лет произошла значительная эволюция методов лечения рака эндометрия (РЭ), особенно при его I стадии. История методов лечения данной нозологии уходит своими корнями в прошлый век. Параллельно со всеобщим признанием метода хирургического определения стадии предоперационная ЛТ как стандарт лечения теряет свою роль.
Хирургическое стадирование позволяет идентифицировать истинную степень распространенности онкологического процесса, а следовательно, истинную стадию рака эндометрия (РЭ). На основании результатов исследований, в которых стадии определяли хирургическим методом, установлено, что приблизительно у 25 % больных с I клинической стадией заболевание распространяется за пределы матки, а у многих пациенток со II клинической стадией перехода процесса на шейку матки не наблюдается.
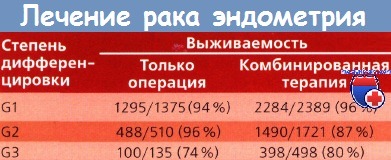
Позднее было накоплено значительное количество данных о возникновении рецидивов во влагалище и выживаемости больных раком эндометрия (РЭ) после хирургического лечения и комбинированной терапии, включающей предоперационную брахитерапию и операцию. Кроме того, проанализированы данные о степени дифференцировки опухоли и глубине инвазии в миометрий. Установлено, что у больных, получивших пред- или послеоперационную ЛТ, частота рецидивов в области культи влагалища была ниже, хотя особых отличий при высоко- (G1) и умеренно дифференцированных (G2) опухолях не выявлено.
Рецидивы в культе влагалища не влияли на выживаемость. Показатели выживаемости после хирургического лечения и комбинированной терапии (ЛТ + операция), особенно при умеренно и высокодифференцированных опухолях, были одинаковыми. Выживаемость больных с низкодифференцированными аденокарциномами после комбинированного лечения была несколько лучше, чем после хирургического. Однако в большинстве исследований статистически значимые различия между этими группами пациенток не обнаружены.
Роль предоперационной ЛТ у больных раком эндометрия (РЭ) освещена в работах нескольких авторов. В исследовании из Германии de Waal и Lochmuller сравнили результаты лечения при I и II стадиях РЭ после комбинированной терапии (предоперационная внутриполостная ЛТ + операция) и только хирургического лечения. Никаких различий между показателями 5-летней выживаемости, частотой возникновения влагалищных, пристеночных тазовых и отдаленных метастазов обнаружено не было. По мнению авторов, предоперационная ЛТ не дает дополнительных преимуществ при лечении РЭ.
Большинство специалистов, даже сторонники предоперационной ЛТ, соглашаются с тем, что в случае высокодифференцированной (G1) опухоли I стадии методом выбора должна быть абдоминальная гистерэктомия с двусторонней аднексэктомией. При наличии массивного процесса в пределах матки или обнаружении метастазов назначают ЛТ, XT и прогестины. В настоящее время не разработаны эффективные схемы лечения умеренно и низкодифференцированного РЭ, о чем свидетельствуют многочисленные предложения применять различные варианты терапии. Некоторые авторы предпочитают проводить предоперационную внутриполостную ЛТ с тампонированием по Heyman и влагалищными овоидами либо с применением тандема и овоидов, если матка небольшого размера.
Абдоминальную гистерэктомию с двусторонней аднексэктомией проводят через 6 нед. Underwood и соавт. рекомендуют выполнять экстирпацию матки сразу после завершения брахитерапии. При наличии глубокой инвазии в миометрий или метастазов применяют ДЛТ в суммарной дозе 40—50 Гр на соответствующие области. Underwood и соавт. показали, что глубину инвазии лучше определять путем измерения толщины миометрия, не затронутого опухолевым процессом, т. е. по направлению от серозной оболочки внутрь до границы опухоли. Если величина этого параметра менее 5 мм, риск рецидивирования высокий, поэтому рекомендуют проводить послеоперационную ДЛТ в суммарной дозе 40—50 Гр на область таза.
При толщине непораженного миометрия от серозной оболочки более 10 мм лечение может быть ограничено только хирургическим вмешательством. Тактика лечения больных со свободной от инвазии толщиной миометрия, измеряемой от серозы, равной 5—10 мм, в настоящее время окончательно не определена, хотя в этих случаях рецидивы возникают чаще, чем при толщине этой зоны более 10 мм.
Bond опубликовал результаты лечения 1703 больных с аденокарциномами эндометрия Iа и Ib стадий, которым провели только хирургическое или комбинированное (операция + послеоперационное облучение влагалища) лечение; объем операции — гистерэктомия с двусторонней аднексэктомией. В группе комбинированной терапии выявлено меньше рецидивов во влагалище по сравнению с хирургической группой (0 vs 3,4 % при неинвазивных опухолях эндометрия и 4,3 vs 8,3 % — при инвазивных).
Влагалище было первым очагом рецидивирования заболевания только у 3,4 % больных; пациенток с рецидивами в области таза или отдаленными метастазами было в 4 раза больше. По мнению Bond, послеоперационное облучение влагалища эффективно в небольшом проценте случаев и не влияет на выживаемость и частоту возникновения как рецидивов в области таза, так и отдаленных метастазов независимо от гистологического типа опухоли. Поэтому он не рекомендует этот вид лечения в качестве стандартной методики. Chen, выполнив небольшое исследование, включившее 32 больных РЭ I стадии с глубокой инвазией в миометрий или низкодифференцированными аденокарциномами (G3), обнаружил, что в 18 случаях процесс не выходил за пределы матки. Никому из этих 18 женщин послеоперационную ЛТ не проводили, и все они прожили более 5 лет.
Из 14 больных с распространением заболевания за пределы матки, которым провели послеоперационное облучение, выжило только 4. По мнению автора, для больных с I стадией РЭ, установленной хирургическим методом, даже при наличии прогностически неблагоприятных факторов хирургическое лечение без адъювантной терапии можно признать радикальным.
Elliott и соавт. (Австралия) суммировали результаты лечения 811 и 116 больных с клинически установленными I и II стадиями РЭ соответственно. Все эти случаи представляли архивный материал за 25-летний период существования лечебного учреждения. По мнению авторов, послеоперационное облучение всего влагалища, но не одной культи уменьшает вероятность возникновения рецидивов. Было выявлено 40 (4,3 %) случаев влагалищных рецидивов. К сожалению, на протяжении многих лет врачи применяли различные методы лечения указанной патологии: простые и радикальные гистерэктомии, ЛТ на область всего влагалища или только его культю, ДЛТ использовали в различных комбинациях. У больных с низким риском (клиническая I стадия, умеренно и высокодифференцированные опухоли с инвазией на 1/3 миометрия) рецидивы в области культи возникли в 2,5, 2,5 и 0% случаев после оперативного вмешательства, операции с облучением культи влагалища и операции с облучением всего влагалища соответственно. В группе низкого риска было 53 % всех пациенток.
По результатам многофакторного анализа эффективным признано только облучение всего влагалища; однако почти у 9 % пациенток возникали осложнения. Благодаря широкому внедрению метода хирургического стадирования при РЭ стали чаще использовать послеоперационную ДЛТ при метастатическом поражении тазовых и парааортальных лимфоузлов. Polish и соавт. облучали парааортальные лимфоузлы у 48 больных с клиническими или морфологическими признаками метастатического поражения. У пациенток, у которых стадии заболевания установлены хирургическим методом, 5-летняя выживаемость составила 67, 47 и 43 % при вовлечении тазовых, парааортальных и обеих групп лимфоузлов соответственно. Общая выживаемость для всех больных равнялась 52 %, при этом в 88 % случаев рецидивы рака локализовались за пределами зон облучения. Показатель смертности находился на допустимом уровне. Другие авторы, участвовавшие в исследованиях GOG по хирургическому стадированию РЭ и осуществлявшие дальнейшее наблюдение за больными, получили аналогичные результаты.
У пациенток с метастазами в лимфоузлах после хирургического лечения наблюдался длительный безрецидивный период. Однако большинство исследователей сегодня выступают за применение послеоперационной ЛТ в случаях метастатического поражения лимфоузлов. Данные об улучшении выживаемости после тщательной лимфаденэктомии еще не представлены.

Kadar и соавт. ретроспективно провели анализ лечения 262 больных раком эндометрия (РЭ) с хирургически установленными стадиями. Степень дифференцировки опухоли, глубина инвазии в миометрий, наличие опухолевых клеток в просветах сосудов, переход процесса на шейку матки, стадия РЭ по классификации FIGO и возраст пациентки были независимыми прогностическими факторами. У больных с наличием одного неблагоприятного фактора или их отсутствием ЛТ не влияла на процент возникновения рецидивов и общую выживаемость. Уровень 5-летней выживаемости у этих женщин достигал 97 %. К сожалению, прогноз для большинства больных с 3 или 4 неблагоприятными факторами риска был плохим, несмотря на проведенную ЛТ. Напрашивается вопрос, способна ли адъювантная терапия улучшить выживаемость, если 5-летний показатель в этой группе больных составил всего 17 % при условии, что 5 из 6 пациенток получили ЛТ.
В следующей группе пациенток, имевших два фактора риска, 24 из 28 получили ЛТ на область таза с надеждой на улучшение выживаемости, однако статистически значимый результат достигнут не был.
К настоящему времени проведено 3 проспективных рандомизированных исследования, в которых изучали эффективность послеоперационной ДЛТ у больных РЭ. Onsrud, Kolstad и Normann провели исследование двух групп пациенток с РЭ I стадии: в первой группе больные после операции получали брахитерапию, во второй — брахитерапию + ДЛТ. Авторы не обнаружили различий в показателях выживаемости между двумя группами пациенток. 5-летняя выживаемость больных, получивших комбинированное лечение (вторая группа), и тех, у кого лечение ограничилось только брахитерапией, составила 88 и 90 % соответственно.
При сравнении показателей выживаемости и частоты возникновения рецидивов с учетом степени дифферен-цировки опухоли, а также инвазии в миометрий различия не обнаружены. У больных, получивших ДЛТ, выявлено меньше рецидивов в области таза, но больше отдаленных рецидивов. У тех, кто не получал ДЛТ, а только брахитерапию, количество местных рецидивов было значительно больше.
Creutzberg (клиническое исследование PORTEC, Нидерланды) идентифицировал 714 больных с I стадией РЭ, у которых были высокодифференцированные (G1) опухоли с инвазией в миометрий более 50% его толщины, умеренно дифференцированные (G2) с любой глубиной инвазии и низкодифференцированные (G3) с инвазией миометрия менее 50%. Хирургическое стадирование не было обязательным критерием включения в исследование. Пациенток рандомизировали в группу получающих послеоперационную ДЛТ либо контрольную группу наблюдения. Среди 654 больных, находившихся под постоянным наблюдением, местные и регионарные рецидивы встречались реже в группе ЛТ (4 vs 14%), чем в группе контроля, а 5-летняя выживаемость была сопоставимой — 81 и 85 % соответственно.
Эксперты GOG провели клиническое исследование III фазы, в котором сравнивалась эффективность хирургического лечения с комбинированным (операция + ДЛТ на область таза) у пациенток с аденокарциномами эндометрия промежуточного риска. В исследование были включены больные с различной глубиной инвазии в миометрий, любой степенью дифференцировки и без признаков метастазирования в лимфоузлы (стадии Ib, Ic, IIа и IIb). Всем проведено хирургическое стадирование заболевания с гистологическим исследованием лимфоузлов. К подгруппе высокого риска относили:
1) опухоли G2—G3 с поражением лимфатических сосудов и наружной трети миометрия;
2) возраст 50 лет или старше при наличии любых двух перечисленных факторов;
3) возраст более 70 плюс любой из перечисленных выше факторов.
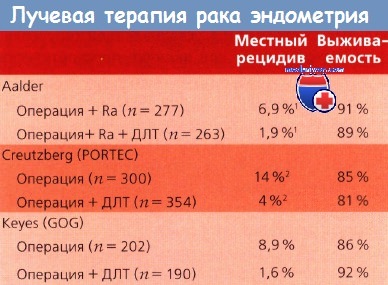
Все остальные больные были отнесены к подгруппе низкого риска. ЛТ не назначили 202 женщинам; 190 получили ДЛТ на область таза. Средняя продолжительность наблюдения составила 69 мес. В итоге в группе не получавших ДЛТ рецидивы наблюдались в 15,3 % случаев по сравнению с 6—8 % в группе пациенток, подвергшихся облучению (р = 0,007). Местные рецидивы выявлены в 8,9 и 1,6% случаев соответственно. Общая выживаемость через 48 мес. составляла 86 и 92 % соответственно; при чиной смерти в 50 % случаев и более в обеих группах были сопутствующие заболевания. Летальные исходы, обусловленные основным заболеванием, составляли 8,4 и 7,9% в группе не получавших и получавших ДЛТ.
Побочные осложнения III и IV степени составили 4,9 и 14% соответственно. Из 13 женщин из группы не получавших ДЛТ, у которых появились рецидивы в области влагалища, 12 назначили ЛТ, из них 5 умерли вследствие прогрессирования заболевания.
В таблице представлены результаты исследований эффективности послеоперационной ЛТ при ранних стадиях РЭ.
В крупном исследовании GOG у 6 % больных РЭ с I клинической стадией было выявлено распространение заболевания в пределах брюшной полости. По мнению Chen, в качестве стандартной процедуры во время хирургических вмешательств по поводу РЭ необходимо выполнять биопсию сальника. Из 84 пациенток с клинически установленным РЭ I стадии у 7 (8,3 %) обнаружены метастазы в сальнике, причем в 5 случаях они были выявлены только при микроскопическом исследовании. Следует помнить, что серозно-папиллярный РЭ часто метастазирует в сальник. Поэтому биопсия сальника оправдана у больных из группы высокого риска. В нескольких исследованиях авторы рекомендуют выполнять влагалищную гистерэктомию при РЭ у тщательно отобранных пациенток с высоким риском хирургических осложнений и избыточной массой тела. Показатели выживаемости аналогичны таковым при абдоминальном доступе. Lelle и соавт. собрали информацию о 60 больных из 2 лечебных учреждений за последние 30 лет. Этим пациенткам были проведены влагалищные гистерэктомии. 5-летняя выживаемость превышала 90%.
У 2/3 пациенток были высокодифференцированные аденокарциномы, у 41 % — отсутствовала инвазия в миометрий. У многих из этих больных перед операцией не был установлен диагноз гиперплазии эндометрия или РЭ. Эти факты представляют частую проблему всех исследований, в которых в качестве хирургического метода лечения при РЭ использовали влагалищную гистерэктомию.
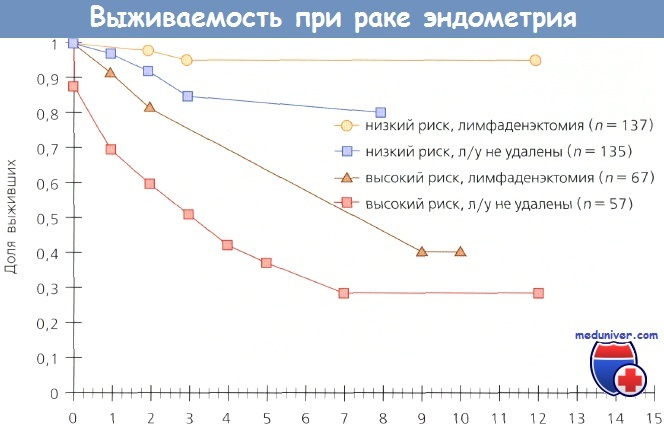
Выживаемость в зависимости от того, выполнена тазовая лимфаденэктомия или нет, и группы риска: низкого (р = 0,026) и высокого (р = 0,0006)
- Вернуться в оглавление раздела "Онкология"
Читайте также:

