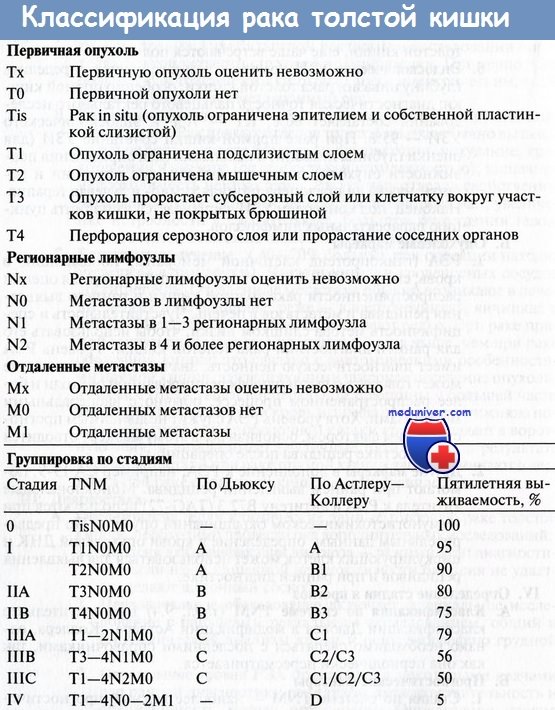
Схема лечения метастазов колоректального рака
А.А. Трякин
Отделение клинической фармакологии и химиотерапии РОНЦ им. Н.Н.Блохина РАМН, Москва
Вступление
Рак толстой кишки (РТК), включая рак прямой кишки, занимает 3-е место в структуре заболеваемости в России. Так, в 2005 г. в России было диагностировано 53 000 новых случаев РТК, в половине из которых потребовалась химиотерапия по поводу диссеминации заболевания. На протяжении последних двух десятков лет наблюдается значительный прорыв в терапии распространенного РТК. Он, прежде всего, связан с появлением новых лекарственных препаратов (иринотекана, оксалиплатина, бевацизумаба, цетуксимаба), а также с повышением частоты выполнения резекций печени и легких при их метастатическом поражении. Результатом этого явилось драматическое увеличение медианы продолжительности жизни больных с 6 мес до 24 мес.
Несмотря на большое число проведенных исследований, исчерпывающий ответ на ряд вопросов до сих пор не получен. Какой режим химиотерапии первой линии выбрать? Какова оптимальная продолжительность терапии? Есть ли необходимость поддерживающей терапии бевацизумабом и/или химиотерапией после достижения эффекта? Какова оптимальная тактика при операбельных метастазах в печень?
Клинический случай
Мужчина, 39 лет, на фоне полного здоровья 3 июля 2006 г. был экстренно госпитализирован в общехирургический стационар с клинической картиной острой кишечной непроходимости. При лапаротомии выявлена стенозирующая опухоль сигмовидной кишки без признаков диссеминации заболевания. Произведена резекция сигмовидной кишки с формированием колостомы. В послеоперационном периоде были выполнены рентгенография органов грудной клетки и ультразвуковое исследование (УЗИ) органов брюшной полости, не выявившие отдаленных метастазов. Патоморфологическое заключение: умеренно дифференцированная аденокарцинома, pT4N0M0 (исследовано 4 регионарных лимфатических узла). Пациенту было рекомендовано наблюдение.
Через 6 нед после операции пациент самостоятельно обратился в клинику РОНЦ им. Н.Н.Блохина РАМН. На момент обращения в клинику он полностью восстановился после операции, жалоб не предъявлял. Была выполнена компьютерная томография (КТ) органов грудной клетки, брюшной полости и малого таза, при которой были выявлены два метастаза в S6 печени диаметром 2,6 см и 1,3 см соответственно (рис. 1). Анализы крови - без патологии, значения опухолевых маркеров РЭА и СА-19.9 соответствуют норме. Произведена аспирационная биопсия большего очага в печени, подтвердившая метастаз аденокарциномы кишечного типа. Таким образом, у пациента имелись два резектабельных метастаза в правой доле печени. Было решено провести 6 курсов предоперационной химиотерапии по программе FOLFOX в сочетании с бевацизумабом, с последующим выполнением резекции правой доли печени и аналогичной адъювантной химиотерапией.
Рис. 1. КТ до начала лечения (август 2006 г.): два метастаза в S6 правой доли печени.

В августе-сентябре 2006 г. проведены 3 курса химиотерапии режимом FOLFOX-6 в сочетании с бевацизумабом 5 мг/кг каждые 2 нед без токсичности. Выполненная контрольная КТ показала полное исчезновение определявшихся ранее метастазов (рис. 2). Учитывая эффект терапии было решено провести еще 1 курс химиотерапии FOLFOX без бевацизумаба и далее выполнить резекцию области ранее определявшихся метастазов. Однако пациент неожиданно отказался от хирургического лечения. В данной ситуации была продолжена лекарственная терапия.
Рис. 2. КТ после 3 курсов FOLFOX в сочетании с бевацизумабом (октябрь 2006 г.): полная регрессия метастазов в печени.

Суммарно проведено 9 курсов химиотерапии FOLFOX в сочетании с бевацизумабом. Лечение хорошо переносилось, явления токсичности не превышали I степень: холодовые реакции, тошнота, общая слабость. Не наблюдались и такие специфические для бевацизумаба токсические явления, как протеинурия и артериальная гипертензия.
Комплексное обследование после 9 курсов терапии подтвердило полный эффект. Было принято решение о продолжении монотерапии бевацизумабом, однако по финансовым причинам лечение не было продолжено: компания, оплачивавшая лечение пациента в рамках добровольного медицинского страхования, не могла продолжать дорогостоящую терапию. Учитывая желание пациента избавиться от колостомы, через 2 мес после завершения химиотерапии (март 2007 г.) была выполнена операция по восстановлению непрерывности кишечной трубки. Обследование, включавшее интраоперационное УЗИ печени, не выявило признаков заболевания. Пациент оставался под наблюдением в клинике РОНЦ им. Н.Н.Блохина РАМН.
По состоянию на последнее наблюдение (март 2009 г.) - 26 мес после завершения лекарственной терапии - у больного сохраняется полный эффект. По данным КТ, на месте ранее существовавшего большего метастаза в S6 печени стал определяться кальцинат (рис. 3). Другой неожиданной находкой стало обнаружение в просветах ветвей правой легочной артерии тромботических масс - рентгенологический признак тромбоэмболии легочной артерии (ТЭЛА). При этом на протяжении нескольких предшествовавших месяцев у пациента отсутствовала всякая специфическая для ТЭЛА симптоматика. При изучении свертывающей системы крови, включая уровень D-димера, все значения были в пределах нормы. Пациенту назначен эноксипарин (Клексан) 40 мг ежедневно на протяжении 6 мес.
Рис. 3. КТ через 26 мес после завершения терапии FOLFOX в сочетании с бевацизумабом (март 2009 г.): сохраняющаяся полная регрессия метастазов в печени. Появление кальцината на месте одного из них.

Обсуждение
Данное клиническое наблюдение не является, к сожалению, типичным как по исходной распространенности опухолевого процесса, так и по достигнутому эффекту. Изолированное метастатическое поражение печени при РТК имеет место у 50% пациентов с IV стадией заболевания, при этом лишь 20-30% из них исходно радикально резектабельны. Выполнение радикальной (R0) резекции позволяет увеличить 5-летнюю выживаемость до 30-40% по сравнению с
Появление новых препаратов, внедрение в практику агентов, повышающих биологическую доступность лекарственного средства, и усовершенствование комбинаций препаратов и последовательности их назначения улучшили перспективы больных с метастазами колоректального рака (КРР): в настоящее время общая выживаемость увеличилась с 6 до > 22 месяцев.
Цели лечения при метастазах:
• Приостановка прогрессии опухоли, уменьшение опухоли (=> возможность дальнейшей резекции по поводу метастатических очагов).
• Поддержание/улучшение общего качества жизни.
• Приемлемый профиль побочных эффектов.
• Длительная выживаемость.
Хотя радикальная резекция с лечебной целью по-прежнему выполняется при ограниченном метастатическом поражении, комбинация с химиотерапией считается наиболее обоснованным выбором. Пути введения: системное назначение (вну-тривенное/пероральное) = стандарт. Регионарная терапия (инфузия в печеночную артерию, внутрибрюшная химиотерапия) в большинстве случаев не имеет преимуществ.
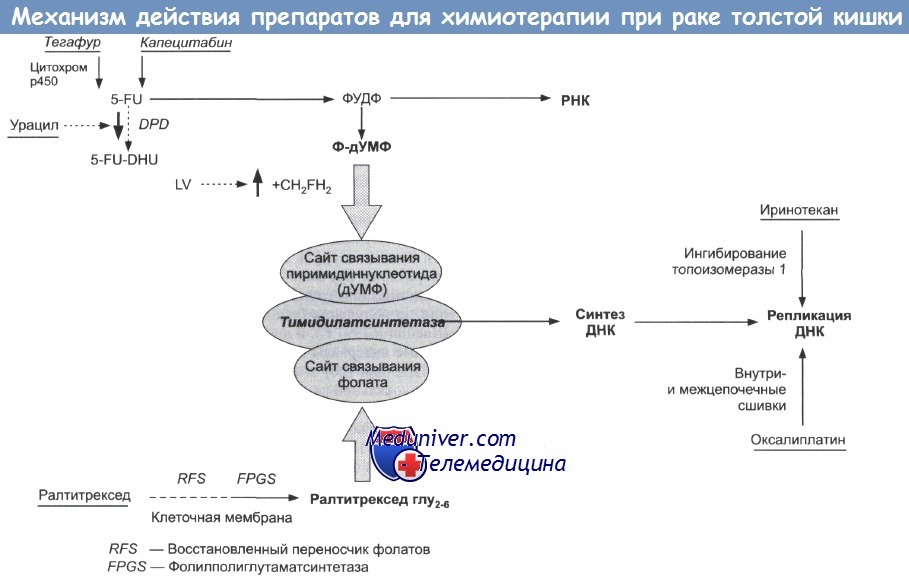
Все обычные режимы химиотерапии основаны на 5-FU/LV (непрерывная инфузия) или его пероральном предшественнике (Кселода) в комбинации с оксалиплатином или иринотеканом.
Добавление таргетных препаратов: бевацизумаб или цетуксимаб (против фактора роста эндотелия сосудов [VEGF], эпидермального фактора роста [EGFR]) увеличивают эффективность химиотерапии с иринотеканом и оксалиплатином => FOLFIRI, FOLFOX или XELOX плюс бевацизумаб показали одинаковую эффективность в отношении ответа и выживаемости без прогрессии в терапии первой линии при метастазах. Возможен даже более выраженный ответ при комбинации иринотекана и оксалиплатина (FOLFOXIRI).
Химиотерапию необходимо продолжать как компонент поддерживающего лечения настолько длительно, насколько она переносима и эффективна. Нет никакого преимущества в полном прерывании химиотерапии, за исключением перерывов в назначении оксалиплатина после 3-х месяцев для предотвращения кумулятивной токсичности (нейропатии); повторное назначение, если имеется прогрессия на фоне 5-FU/LV. Определение наилучшей последовательности схем является предметом текущих исследований.
Показания для химиотерапии метастазов рака толстой кишки:
• колоректальный рак (КРР) IV стадии.
• Нерезектабельный местный рецидив колоректального рака (КРР).
Сумма доказательств эффективности химиотерапии метастазов колоректального рака:
- Стадия IV (с возможной радикальной резекцией).
• Комбинация 5-FU/LV с иринотеканом или оксалиплатином лучше, чем только 5-FU/LV.
• Эффективность капецитабина сопоставима или немного выше, чем 5-FU/LV в/в.
• Бевацизумаб или цетуксимаб, добавленные в базовую комбинацию, улучшают ответ на лечение и увеличивают выживаемость без прогрессии и общую выживаемость.
• Отмена лечения за 4-6 недель до операции.
- Стадия IV (инкурабельная): вышеперечисленное, а также отсутствие преимуществ от прекращения химиотерапии.
- Стадия IV (канцероматоз брюшины): внутрибрюшинная химиотерапия может иметь преимущества после полной макроскопической циторедукции, в противном случае наиболее предпочтительна системная химиотерапия.
Альтернативы:
• Наилучшая поддерживающая терапия
Схемы химиотерапии при метастазах колоректального рака
1. ФОЛиниевая кислота + Фторурацил + ОКСалиплатин (FOLFOX 4) ± бевацизумаб
Оксалиплатин в/в в первый день; лейковорин в/в в первый и второй дни; 5-FU в/в болюсно с последующей непрерывной инфузией в течение первого и второго дня => циклы повторяются каждые 14 дней.
Возможное дополнение: бевацизумаб в/в каждые 2 недели. Показания. Стандартный режим интенсивной химиотерапии при метастазах или рецидиве колоректального рака (КРР).
Противопоказания. Аллергические реакции. Предшествующая нейропатия. Текущий сепсис, нейтропения, печеночная недостаточность, почечная недостаточность.
Токсичность и побочные эффекты. Нейтропения (> 40%), фебрильная нейтропения, периферическая нейропатия (острая III степени - 12%, отдаленная персистирующая - 1%).
2. ФОЛиниевая кислота + Фторурацил + ОКСалиплатин (FOLFOX 6) ± бевацизумаб
Оксалиплатин в/в в первый день; лейковорин в/в только в первый день; 5-FU в/в болюсно с последующей непрерывной инфузией (более высокая доза, чем при FOLFOX4) в течение первого и второго дней => циклы повторяются каждые 14 дней. Возможное дополнение: бевацизумаб в/в каждые 2 недели.
Показания. Такие же, как при FOLFOX4, но доза оксалиплатина выше, назначения более удобны для больного: необходимость госпитализации только в первый день каждого цикла.
Противопоказания. Такие же, как и при FOLFOX4.
Токсичность и побочные эффекты. По существу такие же, как при FOLFOX4.
3. ФОЛиниевая кислота + Фторурацил + ОКСалиплатин (FOLFOX 7) ± бевацизумаб
Оксалиплатин в/в в первый день; лейковорин в/в только в первый день; 5-FU в/в болюсно с непрерывной инфузией (более высокая доза, чем при FOLFOX4) в течение первого и второго дней => общее число циклов шесть каждые 14 дней.
После этого: обычный курс 5-FU/LV (без оксалиплатина): LV в первый день, 5-FU в/в болюсно с непрерывной инфузией в течение первого и второго дней => 12 циклов каждые 2 недели, повторное назначение оксалиплатина при прогрессировании заболевания. Возможное дополнение: бевацизумаб в/в каждые 2 недели.
Показания. Такие же, как при FOLFOX6, но с ограниченной продолжительностью назначения оксалиплатина => поддерживающее лечение 5-FU/LV или капецитабином.
Противопоказания. Такие же, как и при FOLFOX4.
Токсичность и побочные эффекты. По существу такие же, как при FOLFOX6, снижение частоты возникновения отдаленной нейропатии.
4. КАПЕцитабин (КСЕЛода) + ОКСалиплатин (CАРЕОХ, XELOX) ± бевацизумаб
Оксалиплатин в/в в первый день; капецитабин перорально два раза в день ежедневно с 1 по 14 дни + 7 дней перерыв => циклы повторяются каждый 21 день. Возможное дополнение: бевацизумаб в/в каждые 2 недели.
Показания. Альтернативная схема FOLFOX с удобным режимом приема.
Противопоказания. Аллергические реакции. Предшествующая нейропатия. Текущий сепсис, нейтропения, печеночная недостаточность, почечная недостаточность.
Токсичность и побочные эффекты. Сравнимый с FOLFOX или несколько лучший профиль токсичности.
5. ФОЛиниевая кислота + Фторурацил + ИРИнотекан (FOLFIRI) ± цетуксимаб
Иринотекан в/в в первый день; лейковорин в/в в первый день; 5-FU в/в болюсно с последующей непрерывной инфузией в течение первого и второго дней —> всего 12 циклов каждые 14 дней.
Возможна комбинация с цетуксимабом.
Показания. Схема лечения первой линии при метастазах КРР. Альтернатива FOLFOX.
Противопоказания. Текущий сепсис, нейтропения, печеночная недостаточность, почечная недостаточность.
Токсичность и побочные эффекты:
• Диарея, тошнота/рвота, обезвоживание.
• Подавление активности костного мозга.
• Сердечно-легочные осложнения.
6. Иринотекан + 5-FU + лейковорин (IFL, схема Salz) ± цетуксимаб
Иринотекан в/в + еженедельно болюсно 5-FU/LV в течение 4 недель с последующим 2-х недельным перерывом => циклы повторяются каждые 6 недель.
Возможна комбинация с цетуксимабом.
Показания. Схема лечения первой линии при метастазах КРР, возможна комбинация с беваци-зумабом или цетуксимабом.
Противопоказания. Текущий сепсис, нейтропения, печеночная /почечная недостаточность.
Токсичность и побочные эффекты:
• Гастроинтестинальная: диарея, тошнота/рвота, анорексия, боли в животе => тяжелое обезвоживание, электролитный дисбаланс, нейтропения/лихорадка.
• Васкулярный синдром: острый/фатальный инфаркт миокарда, тромбоэмболия легочной артерии, нарушения мозгового кровоснабжения.
Коррекция дозы. Мониторинг признаков угрожающей тяжелой токсичности.
Осложнения. Увеличение летальности, связанной с лечением, вследствие комбинации конкурирующей токсичности (диарея, фебрильная нейтропения, дегидратация).
7. ИРинотекан + ОКСалиплатин (IROX) ± бевацизумаб или цетуксимаб
Оксалиплатин в/в в первый день с последующим в/в введением иринотекана => каждые 3 недели. Возможна комбинация с бевацизумабом или цетуксимабом.
Показания. Схема в разработке.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Лучший профиль токсичности.
8. КАПЕцитабин (КСЕЛода)+ ИРИнотекан (CAPEIRI) ± бевацизумаб или цетуксимаб
Иринотекан в/в в первый день; капецитабин перорально два раза в день ежедневно с 1 по 14 дни + 7 дней перерыв => циклы повторяются через 21 день. Возможна комбинация с бевацизумабом или цетуксимабом.
Показания. Схема лечения второй линии.
Противопоказания. Текущий сепсис, нейтропения, печеночная/почечная недостаточность.
Токсичность и побочные эффекты. Высокая частота тяжелой рвоты, диареи, дегидратации.

- Вернуться в оглавление раздела "Хирургия"
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Российский онкологический научный центр им. Н.Н. Блохина РАМН
В мире колоректальным раком ежегодно заболевает 1–1,2 млн. человек. У 50–60% пациентов с течением времени развиваются метастазы. Еще около 15% больных имеют метастазы при первичном диагнозе. Большая часть пациентов (до 80–85%) имеют метастазы в печень, и у половины из этого числа печень является единственным органом метастазирования, однако только 10–15% таких больных могут быть оперированы [1].
В химиотерапии колоректального рака в последние годы сделаны большие успехи, связанные с широким применением в клинической практике новых высокоэффективных химиопрепаратов (оксалиплатин, иринотекан, томудекс, капецитабин).
Оксалиплатин – новый препарат платины, показавший высокую эффективность в сочетании с 5–фторурацилом и лейковорином. При использовании различных режимов введения 5–фторурацила (струйно, длительные инфузии, хрономодулированный режим) эффективность химиотерапии достигала 50–60% [2–4]. Комбинация оксалиплатина 130 мг/м 2 и томудекса 3 мг/м 2 каждые 3 недели в I-й линии химиотерапии была эффективна в 41,5–67,5% случаев, во II – 9,7% [5–8]. Сочетание оксалиплатина 130 мг/м 2 , день 1-й и капецитабина 2500 мг/м 2 /день, дни 1–14, каждые 3 недели было эффективно в I линии у 44–50% больных, во II линии – у 22% (после терапии 5–фторурацилом) [9].
Другим высокоэффективным препаратом в лечении распространенного колоректального рака является иринотекан. В монотерапии иринотекан в I линии вызывает общий эффект у 29% больных. В комбинации с различными режимами 5–фторурацила общий эффект составляет 40–50% [10–11]. Сочетание иринотекана 350 мг/м 2 и томудекса 3 мг/м 2 каждые 3 недели в I линии химиотерапии позволило достичь эффективности 40% [12]. Исследована активность комбинации иринотекан 350 мг/м 2 день 1 и томудекс 2,6 мг/м 2 в день 2, каждые 3 недели. Общий эффект составил 53% [13].
Исследована также комбинация иринотекана и капецитабина. В одном исследовании общий эффект составил 45% [14]. В другой работе общий эффект составил до 71%. Исследовались два режима: все пациенты получали капецитабин 2500 мг/м 2 /день, дни 1–14 и иринотекан 300 мг/м 2 день 1 или 150 мг/м 2 день 1 и 8 [15].
В исследовании III фазы [16] у 226 пациентов сравнивалась эффективность комбинаций иринотекан + 5–фторурацил + лейковорин и оксалиплатин + 5–фторурацил + лейковорин в I линии химиотерапии, затем во II линии пациенты, получавшие комбинацию с иринотеканом, получали комбинацию с оксалиплатином, и наоборот. Все пациенты получали леволейковорин 200 мг/м 2 инфузия 2 часа в 1 день, 5–фторурацил 400 мг/м 2 болюс 1 день и 2400 мг/м 2 46–часовая инфузия 46 часов день 2–3, каждые 2 недели. В первой ветви исследования больные получали иринотекан 180 мг/м 2 каждые 2 недели, во второй ветви – оксалиплатин 100 мг/м 2 каждые 2 недели. При оценке эффективности общий эффект I линии комбинации с иринотеканом составил 57,5%, время до прогрессирования – 8,4 мес, комбинации с оксалиплатином – 56%, время до прогрессирования – 8,9 мес. Во II линии эффективность комбинации с иринотеканом (после оксалиплатина) составила 7%, комбинации с оксалиплатином (после иринотекана) – 21,5%.
Оценена и эффективность комбинации иринотекана и оксалиплатина [17]. Общий эффект комбинации оксалиплатина 85 мг/м 2 и иринотекана 175 мг/м 2 в I линии терапии составил 42%. Во II линии химиотерапии (после 5–фторурацила) эффективность составила 37,5% [18]. Однако такое сочетание в I линии не оставляет эффективных препаратов на II линию и поэтому не кажется оправданным.
В настоящее время большие надежды возлагаются на блокаторы рецепторов эпидермального фактора роста (РЭФР). При применении моноклональных антител к рецепторам эпидермального фактора роста С225 (Цетуксимаб) в сочетании с иринотеканом после прогрессирования с использованием 5–фторурацила и затем иринотекана у больных с высоким уровнем РЭФР общий эффект составил 22,5%. Аналогичные исследования проводятся и в сочетании с оксалиплатином.
Перспективу имеют также ингибиторы ангиогенеза, фарнезилтрансферазы и т.д.
Очевидно, что введение в клиническую практику новых препаратов позволило резко увеличить эффективность химиотерапии распространенного колоректального рака. Появилась возможность проведения эффективной II линии химиотерапии и тем самым увеличить время контроля над болезнью. Не утратил до настоящего времени своей роли и 5–фторурацил. Однако продолжительность жизни больных увеличилась незначительно, 5–летняя выживаемость остается низкой (не более 5%).
Бурное развитие получила в настоящее время хирургия метастазов в печень, высокочастотная аблация метастазов после неоадъювантной химиотерапии у больных с метастазами колоректального рака в печень.
Хирургическое лечение
Целью хирургического вмешательства должно быть полное удаление всех очагов.
Целесообразность хирургического удаления метастазов была продемонстрирована при сравнении 5–летней выживаемости у пациентов с проведенным хирургическим лечением метастазов и без операции у больных с резектабельными метастазами (табл. 1).
У пациентов после удаления метастазов продолжительность жизни колеблется от 30 до 40 мес, а 5–летняя выживаемость от 27 до 37% (табл. 2).
С учетом достаточной безопасности выполнения резекции метастазов в печень серьезной проблемой остаются показания к резекции метастазов, поиск факторов прогноза.
Абсолютными противопоказаниями к проведению резекции метастазов в настоящее время являются: наличие нерезектабельных внепеченочных метастазов; невозможность сохранить достаточный объем функционирующей ткани печени (20–30% или 2–3 сегмента); наличие метастазов в лимфоузлах ворот печени или чревного ствола.
Вместе с тем обсуждается дополнительное количество факторов негативного прогноза для операции. К ним относятся: стадия первичной опухоли; количество и размер очагов; безрецидивный период; удаление метастазов в пределах здоровых тканей (1 см); наличие внепеченочных метастазов; уровень РЭА; наличие метастазов в одной или обеих долях; объем вмешательства.
Значимость этих факторов прогноза различна, они не являются противопоказаниями для проведения операции, но показано, что 5–летняя выживаемость у пациентов с некоторыми из этих факторов гораздо ниже. Одними из наиболее важных факторов являются наличие позитивных лимфоузлов при первичной операции, количество и размер очагов в печени. Меньшее значение придается уровню РЭА, безрецидивному периоду, наличию метастазов в одной или двух долях печени, количеству метастазов. При послеоперационном планировании тактики лечения предельно важным выступает такой фактор прогноза, как свободный край резекции. 5–летняя выживаемость у пациентов с положительным краем резекции не отличалась от неоперированных [26]. Оптимальной следует считать резекцию около 1 см в пределах здоровой паренхимы.
Фактором негативного прогноза различные авторы считают 3 и более метастазов в печень. Однако Weber et al. [19] при оценке результатов 5–летней выживаемости у 155 пациентов с 4 и более метастазами получили несколько отличные данные. Даже у пациентов с числом метастазов от 9 до 20 этот показатель составил 14%. Считается, что уровень РЭА более 200 нг/мл ухудшает прогноз у таких пациентов. Отмечено, что безрецидивный период менее 2 лет также негативно сказывается на прогнозе. Практически не влияют на прогноз резектабельные внепеченочные метастазы (например, в легком). Также не влияют на прогноз возраст, пол, локализация первичной опухоли (прямая/толстая кишка), объем оперативного вмешательства. Однако Fong et al. [26] отмечали, что при сочетании безрецидивного периода менее 1 года, наличия внепеченочных проявлений болезни, размера наибольшего очага более 5 см, более 1 метастаза в печень, уровня РЭА > 200 нг/мл ни один из оперированных пациентов не прожил 5 лет.
Для наиболее адекватной оценки возможности проведения операции важное значение придается предоперационной оценке распространенности болезни. Абсолютно необходимы компьютерная томография печени, определение РЭА, рентгенография легких. В настоящее время все большее значение для определения распространенности болезни приобретает позитронно–эмиссионная томография (ПЭТ). Для определения тактики операционного лечения полезно выполнение компьютерной томографии печени с одновременным контрастированием печеночной артерии, т.к. доказано, что в отличие от нормальной ткани печени, кровоснабжаемой через v. porta, метастазы кровоснабжаются в основном через a. hepatica. Также показано интраоперационное УЗИ печени. Нераспознанные ранее метастазы в таком случае могут быть обнаружены в 15–25% случаев.
В таблице 3 представлены данные различных авторов о выживаемости после многократных резекций метастазов в печень.
Высокочастотная аблация
Помимо хирургического удаления метастазов, в настоящее время все активнее используется такой метод аблативной хирургии, как высокочастотная аблация (ВЧА). ВЧА метастазов заключается в местном повышении температуры под воздействием высокочастотного радиоизлучения. Существуют различные модификации аппаратов для ВЧА. Ранее использовались аппараты с одним электродом, но площадь некроза не превышала 1,5–2 см. В последнее время используют аппараты с 5–7 электродами, вводимыми в опухолевый очаг, что позволило увеличить площадь некроза до 5 см и более. Манипуляцию производят чрескожно (под контролем УЗИ), при лапароскопии (под контролем лапароскопического УЗИ) и при лапаротомии. Несмотря на преимущества чрезкожной ВЧА, такой доступ обеспечивает наихудший контроль над возможным повреждением окружающих структур (диафрагмы, почек, желчного пузыря, толстой кишки). В настоящее время при изолированной ВЧА широко используется лапароскопический доступ. Наилучший контроль осложнений достигается при лапаротомии, например, при сочетании резекции метастазов и ВЧА.
Помимо хирургического удаления метастазов, в настоящее время все активнее используется такой метод аблативной хирургии, как высокочастотная аблация (ВЧА). ВЧА метастазов заключается в местном повышении температуры под воздействием высокочастотного радиоизлучения. Существуют различные модификации аппаратов для ВЧА. Ранее использовались аппараты с одним электродом, но площадь некроза не превышала 1,5–2 см. В последнее время используют аппараты с 5–7 электродами, вводимыми в опухолевый очаг, что позволило увеличить площадь некроза до 5 см и более. Манипуляцию производят чрескожно (под контролем УЗИ), при лапароскопии (под контролем лапароскопического УЗИ) и при лапаротомии. Несмотря на преимущества чрезкожной ВЧА, такой доступ обеспечивает наихудший контроль над возможным повреждением окружающих структур (диафрагмы, почек, желчного пузыря, толстой кишки). В настоящее время при изолированной ВЧА широко используется лапароскопический доступ. Наилучший контроль осложнений достигается при лапаротомии, например, при сочетании резекции метастазов и ВЧА.
Показания к выполнению ВЧА такие же, как и к резекции метастазов. До сих пор нет однозначного мнения, каков максимальный размер метастазов, которые можно эффективно удалить, особенно в связи с постоянно совершенствующейся техникой. Считается, что количество очагов должно быть до 5–6, а их максимальный размер – до 5–6 см. Однако есть сообщения об успешном одномоментном удалении до 15 очагов и об удалении метастазов до 15 см. Противопоказанием является вовлечение крупных сосудов (правая и левая печеночные вены или артерии) и желчных протоков.
Процент полного некроза очагов после ВЧА колеблется от 52% до 93%. Серьезное влияние на частоту рецидивов в удаленных очагах оказывает используемая техника (одноигольная или с использованием нескольких вводимых в опухоль игл), размер метастазов (наилучшие результаты достигнуты при удалении метастазов до 2 см).
В таблице 4 приводятся данные различных авторов о ВЧА метастазов в печень.
Как видим, полный некроз очагов (по данным компьютерной томографии) был достигнут при использовании многополярных аппаратов и при лапароскопическом доступе. Осложнения ВЧА связаны с возможной перфорацией близлежащих органов (при подкапсульном расположении метастазов), с печеночной недостаточностью, возникающей при множественном удалении метастазов и неизбежном повреждении здоровой ткани печени. Однако эти осложнения могут быть сведены к минимуму при правильном планировании вмешательства. Важным преимуществом ВЧА является короткий послеоперационный период (до 2–3 дней).
Факторами неблагоприятного прогноза, по данным различных авторов, являются: размер аблации меньше, чем размер опухоли; размер очага больше 3 см; признаки инвазии сосудов.
В заключение можно отметить, что высокочастотная аблация метастазов является безопасным методом, который можно многократно повторять без увеличения риска осложнений.
Существенный прогресс в лечении метастазов колоректального рака ожидается при введении в онкологическую практику новых эффективных противоопухолевых препаратов.
1. Greenlee RT et al.: Cancer statistics, 2001. CA Cancer J Clin 50:7–33, 2001.
2. Grothey A et al. Bolus 5–fluoroureacil/folonoc acid Vs. Weekly high–dose 24H 5–Fu Infusion/FA + Oxaliplatin in advanced colorectal cancer. Results of a phase III study Proc Am Soc Clin Oncol 2001, abstr 496
3. Goldschtein D et al. Improving patient convenience: a modified schedule of FOLFOX (Oxaliplatin combined with 5FU) with high activity and tolerability in intreated metastatic colorectal cancer. Proc Am Soc Clin Oncol 2001, abstr 578
4. Adam R. et al. Five–year survival following hepatic resection after neoadjuvant therapy for nonresectable colorectal (liver) metastases. Annals of surgical oncology 8(4): 347–53 2001.
5. J. Bennouna et al. ‘Tomudex’ (Raltitrexed) plus Oxaliplatin (Eloxatin) in previously untreated metastatic colorectal cancer (MCRC) patients: An active combination. European Journal of Cancer Vol 35, Suppl. 4 September 1999, p. 75
6. V. Catalano et al. Raltitrexed (TOM) may replace the De Gramont regiment in combination with Oxaliplatin (L–OHP) for the treatment of advanced colorectal cancer. Proc. ASCO 2001 abstr. 576.
7. Scheithauer W. et.al. Oxaliplatin plus Raltitrexed with advanced colorectal carcinoma. Results of a phase I–II trial. Proc. of ASCO 2000.
8. C. Pinto et al. Oxaliplatin (OHP) and Raltitrexed (RTX) in advanced colorectal cancer (ACRC) patients: a phase II study. Proc. ASCO 2001 abstr. 2204
9. Borner M et al. Phase II study of Capecitabine + Oxaliplatin in first line and second line treatment of advanced or metastatic colorectal cancer. Proc ASCO v 20 abstr 546, 2001
10. Decreux M et al. Irinotecan combined with bolus 5–fluorouracil plus levo–folinic acid, continuous infusion 5–fluorouracil and high–dose leucovorin given every 2 weeks (LV5FU2 regimen). J Clin Oncol 17:2901–08, 1999
11. Vanhoefer U et al. Phase I study of a weekly schedule of Irinotecan, high–dose leucovorin, and infusional 5–fluorouracil as I line chemotherapy in patients with advanced colorectal cancer. J Clin Oncol 17:907–13, 1999
12. Milla A. et al. An ongoing phase II study of Tomudex plus Irinotecan in advanced colorectal cancer. ECCO 11, 2001 abstr 1112.
13. C. Carnaghi et al. Promising activity of Irinotecan (CPT–11) and Raltitrexed (ZD1694) as first line treatment in metastatic colorectal cancer. Proc. ASCO 2000 abstr. 1211
14. Vanhoefer U et al. Phase I study of Capecitabine in combination with a weekly schedule of Irinotecan as I line chemotherapy in metastatic colorectal cancer. Ann Oncol 2000; 11 (Suppl 4):49(abstr 212).
15. Cassata A et al. Ongoing phase II trial with two schedules of Irinotecan (CPT–11) in combination with Capecitabine as I line chemotherapy in patients with advanced colorectal cancer. Proc Am Soc Clin Oncol 2001
16. Tournigand C et al. FOLFIRI followed by FOLFOX versus FOLFOX followed by FOLFIRI in metastatic colorectal cancer: final results of a phase III study. Am Soc Clin Oncol abstr 494, 2001
17. Sheithauer W et al. Irinotecan (CPT–11) plus Oxaliplatin (L–OHP) in advanced colorectal cancer: a randomized phase II study Proc. ASCO 2001 abstr. 538
18. Kretzcshmar A. et al. Weekly combination of Oxaliplatin and Irinotecan in 5–FU resistant metastatic colorectal cancer. Proc. ASCO 2001 abstr. 540
19. Weber SM et al.: Survival after resection of multiple hepatic colorectal metastases. Ann Surg Oncol 7:643–650, 2000.
Читайте также:

