Результаты лечения острого лимфобластного лечения лейкоза
Что такое острый лимфобластный лейкоз?
Острый лимфобластный лейкоз (или острый лимфолейкоз, сокр. ОЛЛ) — это опасное для жизни заболевание, при котором клетки, в нормальных условиях развивающиеся в лимфоциты, становятся злокачественными и быстро замещают нормальные клетки в костном мозге.
- В связи с недостатком нормальных клеток крови у больных могут появляться такие симптомы, как повышение температуры, слабость и бледность.
- Как правило, в таких случаях выполняются анализы крови и исследование костного мозга.
- Проводится химиотерапия, которая часто оказывается эффективной.
Острый лимфолейкоз (ОЛЛ) встречается у больных любого возраста, но является самым распространенным типом онкологических заболеваний у детей и составляет 75% всех случаев лейкоза у детей до 15 лет. ОЛЛ наиболее часто поражает детей младшего возраста (от 2 до 5 лет). Среди людей среднего возраста это заболевание встречается немного чаще, чем у больных старше 45 лет.
При ОЛЛ очень незрелые лейкозные клетки скапливаются в костном мозге, разрушая и замещая клетки, которые производят нормальные клетки крови. Лейкозные клетки переносятся с кровотоком в печень, селезенку, лимфатические узлы, головной мозг и яички, где могут продолжать расти и делиться. При этом клетки ОЛЛ могут скапливаться в любой части организма. Они могут проникать в оболочки, покрывающие головной и спинной мозг (лейкозный менингит), и приводить к анемии, печеночной и почечной недостаточности и повреждению других органов.
Симптомы острого лимфобластного лейкоза

Ранние симптомы ОЛЛ возникают в результате неспособности костного мозга вырабатывать достаточное количество нормальных клеток крови.
- Повышение температуры и чрезмерное потоотделение могут указывать на наличие инфекции. Высокий риск инфекции связан со слишком малым количеством нормальных лейкоцитов.
- Слабость, утомляемость и бледность, свидетельствующие об анемии, могут появляться из-за недостаточного количества эритроцитов. У некоторых больных может наблюдаться затрудненное дыхание, учащенное сердцебиение и боль в груди.
- Быстро появляющиеся кровоподтеки и кровотечения, иногда в форме носовых кровотечений или кровотечений из десен, возникают из-за слишком малого количества тромбоцитов. В некоторых случаях может возникать кровоизлияние в головной мозг или внутрибрюшное кровотечение.
При проникновении лейкозных клеток в другие органы возникают соответствующие симптомы.
- Лейкозные клетки в головном мозге могут вызывать головные боли, рвоту, инсульт и нарушения зрения, равновесия, слуха и лицевых мышц.
- Лейкозные клетки в костном мозге могут приводить к болям в костях и суставах.
- Если лейкозные клетки вызывают увеличение печени и селезенки, может появляться ощущение переполнения желудка и в некоторых случаях боль.
Причины острого лимфобластного лейкоза
Основная причина ОЛЛ остается неизвестной, но существуют факторы риска, которые могут быть экологическими или вторичными по отношению к наследственным и/или приобретенным предрасполагающим условиям. Факторами риска окружающей среды являются прошлое облучение ионизирующим излучением, химическими веществами (бензол, гербициды и пестициды) и химиотерапевтическими агентами.
К наследственным предрасполагающим состояниям относятся синдром Дауна, наследственные расстройства, характеризующиеся дефектом процессов репарации ДНК и регуляции клеточного цикла (анемия Фанкони, синдром Блума и атаксия-телеангиэктазия), наследственные расстройства, характеризующиеся изменением передачи сигнала в процессах пролиферация клеток и апоптоз (синдром Костмана, синдром Швахмана–Даймонда, анемия Даймонда–Блекфена и нейрофиброматоз типа I) и синдром Ли-Фраумени.
Существуют также приобретенные предрасполагающие состояния, такие как апластическая анемия, пароксизмальная ночная гемоглобинурия и миелодиспластический синдром.
Диагностика
Первые признаки острого лимфобластного лейкоза можно обнаружить при помощи анализов крови, таких, как общий анализ крови. Общее количество лейкоцитов может быть сниженным, нормальным или повышенным, но количество эритроцитов и тромбоцитов почти всегда оказывается сниженным. Кроме того, в крови обнаруживаются очень незрелые лейкоциты (бласты).
Чтобы подтвердить диагноз и отличить ОЛЛ от других типов лейкозов, практически во всех случаях проводится исследование костного мозга. Бласты анализируют на наличие хромосомных аномалий, что помогает врачам определить точный тип лейкоза и подобрать подходящие препараты для лечения.
Анализы крови и мочи назначаются для выявления других отклонений, включая электролитные нарушения.
Также могут потребоваться визуализирующие исследования. При выявлении симптомов, позволяющих заподозрить наличие лейкозных клеток в головном мозге, проводится компьютерная томография (КТ) или магнитно-резонансная томография (МРТ). Для выявления лейкозных клеток в области вокруг легких может выполняться КТ органов грудной клетки. При увеличении внутренних органов могут проводиться КТ, МРТ или ультразвуковое исследование брюшной полости. Перед началом химиотерапии может быть выполнена эхокардиография (ультразвуковое исследование сердца), поскольку иногда химиотерапия оказывает отрицательное воздействие на сердце.
Лечение острого лимфобластного лейкоза
Лечение ОЛЛ включает:
- химиотерапию;
- другие препараты, такие как иммунотерапия и/или таргетная терапия;
- в редких случаях трансплантация стволовых клеток или лучевая терапия.
Химиотерапия является высокоэффективной и состоит из следующих фаз:
- индукция;
- лечение головного мозга;
- консолидация и интенсификация;
- поддерживающая терапия.
Индукционная химиотерапия — это первая фаза лечения. Задача индукционной терапии состоит в достижении состояния ремиссии посредством уничтожения лейкозных клеток, что восстанавливает способность нормальных клеток развиваться в костном мозге. В некоторых случаях требуется пребывание в больнице в течение нескольких дней или недель (это зависит от того, насколько быстро восстанавливается костный мозг).
Применяется одна из нескольких комбинаций лекарственных препаратов, дозы которых вводятся повторно в течение нескольких дней или недель. Выбор конкретной комбинации зависит от результатов диагностических анализов. Одна из комбинаций состоит из преднизона (кортикостероида), принимающегося внутрь, и еженедельных доз винкристина (химиотерапевтического препарата), назначаемого вместе с препаратом антрациклина (обычно даунорубицином), аспарагиназой и иногда циклофосфамидом, для внутривенного введения. У некоторых пациентов с острым лимфолейкозом могут использоваться новые препараты, такие как иммунотерапия (лечение, которое использует собственную иммунную систему человека для уничтожения опухолевых клеток) и таргетная терапия (препараты, которые атакуют внутренние биологические механизмы опухолевых клеток).
Лечение головного мозга обычно начинается во время индукции и может продолжаться на всех этапах лечения. Поскольку ОЛЛ часто распространяется и на головной мозг, эта фаза также направлена на лечение лейкоза, уже распространившегося в головной мозг, либо на профилактику распространения лейкозных клеток в головной мозг. Для воздействия на лейкозные клетки в слоях ткани, покрывающих головной и спинной мозг (мозговых оболочках), применяются лекарственные препараты, такие, как метотрексат, цитарабин, кортикостероиды или их комбинации, которые обычно вводятся прямо в спинномозговую жидкость, либо высокие дозы этих препаратов могут вводиться внутривенно. Такая химиотерапия может проводиться в сочетании с лучевой терапией головного мозга.
В фазе консолидации и интенсификации продолжается лечение заболевания костного мозга. Дополнительные химиотерапевтические препараты или те же препараты, что и во время фазы индукции, могут применяться несколько раз за период, который продолжается в течение нескольких недель. Некоторым больным с высоким риском рецидива в связи с определенными хромосомными изменениями в лейкозных клетках назначают пересадку стволовых клеток после достижения ремиссии.
Дальнейшая поддерживающая химиотерапия, которая обычно заключается в приеме меньшего количества препаратов (в некоторых случаях в меньших дозах), продолжается, как правило, в течение 2–3 лет.
Пожилые люди с ОЛЛ могут быть не способны перенести интенсивную схему лечения, используемую у молодых людей. У таких больных может быть использован более щадящий вариант лечения с применением только режимов индукционной терапии (без последующей консолидации, интенсификации или поддерживающей терапии). Иногда у некоторых пожилых людей может назначаться иммунотерапия или более щадящая форма трансплантации стволовых клеток.
Во время всех вышеуказанных фаз для лечения анемии и предотвращения кровотечений может потребоваться переливание крови и тромбоцитов, а для лечения инфекций — прием противомикробных препаратов. Чтобы помочь избавить организм от вредных веществ (таких как мочевая кислота), которые образуются при разрушении лейкозных клеток, могут проводиться внутривенные вливания жидкостей и лечение препаратами аллопуринол либо расбуриказа.
Лейкозные клетки могут начать появляться снова (такое состояние называют рецидивом). Часто они образуются в крови, костном мозге, головном мозге или яичках. Раннее повторное появление таких клеток в костном мозге является особенно серьезным. Химиотерапия проводится еще раз, и, хотя многим больным помогает такое повторное лечение, существует большая вероятность повторного рецидива заболевания, особенно у детей первого года жизни и взрослых. Если лейкозные клетки повторно появляются в головном мозге, химиотерапевтические препараты 1 или 2 раза в неделю вводятся в спинномозговую жидкость. Если лейкозные клетки повторно появляются в яичках, то наряду с химиотерапией проводится лучевая терапия на область яичек.
У некоторых пациентов с рецидивирующим ОЛЛ используются новые перспективные методы лечения с использованием моноклональных антител (белков, которые специфически связываются с лейкозными клетками, маркируя их для уничтожения). Еще более новая терапия, которую можно применять у некоторых пациентов с рецидивом острого лимфобластного лейкоза, называется Т-клеточная терапия с химерным антигенным рецептором (CAR-T). Эта терапия предусматривает модификацию определенного вида лимфоцитов (Т-лимфоцитов, также называемых Т-клетками) от больного лейкозом таким образом, чтобы эти новые Т-лимфоциты лучше распознавали и атаковали лейкозные клетки.
После рецидива у больных, неспособных перенести пересадку стволовых клеток, дополнительная терапия часто оказывается плохо переносимой и неэффективной и обычно приводит к серьезному ухудшению самочувствия. Тем не менее, могут случаться ремиссии. В отношении пациентов, которым не помогает лечение, должен рассматриваться вариант ухода за неизлечимо больными людьми.
Прогноз жизни
До появления лечения большинство больных с острым лимфолейкозом умирали в течение нескольких месяцев с момента постановки диагноза. Теперь ОЛЛ удается излечить примерно у 80% детей и у 30–40% взрослых. У большинства больных первый курс химиотерапии позволяет взять заболевание под контроль (полная ремиссия). Лучшие прогнозы на излечение имеются у детей в возрасте 3-9 лет. Прогнозы для детей первого года жизни и пожилых больных менее благоприятны. Количество лейкоцитов на момент установления диагноза, наличие или отсутствие распространения лейкоза в головной мозг и хромосомные аномалии в лейкозных клетках также влияют на результат лечения.

Для лечения острого лимфобластного лейкоза (ОЛЛ) у взрослых существует несколько общепринятых вариантов лечения. В основном это стандартные варианты, утвержденные в соответствующих инстанциях. Однако параллельно продолжаются клинические испытания развивающихся технологий. По мере понимания эффективности исследуемых методов лечения, часть из них переходит в разряд стандартных процедур.
Лечение взрослых с ОЛЛ обычно состоит из двух фаз
- Индукционная ремиссионная терапия: С этого обычно начинается лечение. Цель состоит в том, чтобы убить лейкозные клетки в крови и костном мозге. Это переводит лейкемию в стадию ремиссии.
- Постремиссионная терапия: Это следующий шаг в лечении лейкоза. Он может быть начат, как только лейкоз перейдет в стадию ремиссии. Целью этого шага является ликвидация всех оставшихся лейкозных клеток. Даже тех, которые могут быть еще неактивными, но могут начать расти и вызвать рецидив. Эта фаза также называется продолжение ремиссионной терапии.
Лечение, называемое ЦНС профилактика или профилактическая терапия ЦНС, обычно назначается на каждом этапе общей терапии.
Стандартные дозы химиотерапевтических препаратов не могут справиться с лейкозными клетками в ЦНС (головном мозге и спинном мозге), поскольку эти клетки способны «найти прибежище” (скрыться) в ЦНС. Высокие дозы некоторых противоопухолевых препаратов, интратекальной химиотерапии и лучевой терапии в мозг в состоянии достигнуть лейкозных клеток в ЦНС. Они назначаются, чтобы убить лейкозные клетки и удерживать рак от повторения (возвращения).
Используются четыре типа стандартного лечения:
Химиотерапия является лечением рака с помощью специальных лекарственных препаратов (химиотерапевтических агентов), целью которого является остановка роста раковых клеток, либо устранение таких клеток или исключение возможности их деления.
Химиотерапевтические препараты принимаются орально или вводятся в вену или мышцу. Действующее вещество поступает в кровоток и может достигать раковых клеток по всему организму (системная химиотерапия). В другом варианте химиотерапии препарат помещается непосредственно в спинномозговую жидкость (интратекальная химиотерапия), в орган или полость, такую как живот. В этом случае, препарат, главным образом, влияет на раковые клетки в этих областях (региональная химиотерапия).
Комбинированная химиотерапия является лечением с использованием более одного противоракового препарата. Назначаемый вариант химиотерапии зависит от типа и стадии рака.
Для лечения острого лимфобластного лейкоза у взрослых, который распространился, или может распространиться, в головном и спинном мозге, может быть использована интратекальная химиотерапия. Интратекальная химиотерапия часто идет в сочетании с традиционной химиотерапией при подаче препаратов орально или введением в вену.

Интратекальная химиотерапия. Противораковые препараты вводятся в интратекальное пространство. Это пространство, которое содержит спинномозговую жидкость. Есть два разных способа сделать это. Один из способов, показанный в верхней части фигуры, это ввод лекарства с помощью резервуара Оммайя (куполообразный контейнер, который устанавливается под кожу головы во время операции и удерживает препараты, пока они протекают через небольшую трубку в мозг). Другой способ, показанный на нижней части фигуры, это ввод лекарства непосредственно в CSF в нижней части позвоночного столба, после местной анестезии.
Трансплантация стволовых клеток представляет собой метод совместного использования химиотерапии и замены кроветворных клеток, разрушенных при лечении рака.

Трансплантация стволовых клеток. (Шаг 1): Кровь берется из вены в руке донора. Донором может быть сам пациент или другое лицо. Кровь проходит через машину, которая изымает стволовые клетки. Затем кровь возвращается к донору через вену в другой руке. (Шаг 2): Пациент получает химиотерапию, чтобы убить кроветворные клетки. Пациент может получать лучевую терапию. (Шаг 3): Пациент получает размороженные стволовые клетки через катетер, введенный в кровеносный сосуд в груди.
Целевая терапия является одним из видов лечения, который использует препараты или другие вещества для идентификации и атаки специфических раковых клеток без вреда для нормальных клеток.
Для лечения некоторых видов острого лимфобластного лейкоза у взрослых используются препараты целевой терапии, называемые ингибиторы тирозинкиназы. Эти препараты блокируют фермент, тирозинкиназу, который вызывает болшее преобразование стволовых клеток в белые кровяные клетки (бласты), чем требуется организму. Вот три из наиболее применяемых препаратов: иматиниба мезилат (гливек), дазатиниб, и нилотиниб.
Проходят клинические испытания и новые виды лечения
В разделе лейкемии широко пробуется биологическая терапия. Напомню, что это специальная терапия, направленная на стимулирование собственной иммунной системы человека на борьбу со злокачественными клетками. Биологическую терапию также иногда называют иммунотерапия.
Возможно, вам удастся принять участие в качестве пациента в очередных клинических испытаниях. Ищите варианты. Контроль за участниками таких испытаний значительно выше, чем за обычными пациентами. В качестве примера.
Может ли иметь лечение отдаленные последствия?
Побочные эффекты от лечения рака, которые начинаются во время или после лечения и продолжаются в течение нескольких месяцев или лет, называются отдаленные последствия. Поздние эффекты лечения для всех видов рака могут включать риск развития вторичного рака (нового типа рака). Регулярные последующие осмотры очень важны для долгосрочного выживания.
Некоторые из тестов, которые были сделаны ранее, чтобы диагностировать рак или выяснить стадию лейкемии, возможно, придется повторить. Некоторые тесты будут повторяться, чтобы увидеть, насколько хорошо работает лечение. Решение о том, продолжать, изменять или прекращать лечение может быть основано на результатах этих тестов. В любом случае вопрос о необходимости и виде обследования решает онколог. Прислушивайтесь к его мнению.
Лейкозы, или гемобластозы, в быту известные под названием белокровие – это злокачественные новообразования, формирующиеся из клеток крови и их предшественников. Все лейкозные клетки – клоны одной исходно изменившейся. Острый лимфобластный лейкоз – это патология лимфоидного ростка кроветворения.
Заболевание преимущественно детское – 60% всех пациентов моложе 20 лет. Чаще всего страдают дети в период с 3 до 4 лет, преимущественно мальчики. Второй пик заболеваемости приходится на период 50-60 лет. Тем не менее, болезнь может развиться в любом возрасте, включая младенческий.
Причины и механизмы развития
В основе патофизиологии опухолевого роста при лейкозах – мутации одной кроветворной клетки, которая перестает реагировать на регуляторные сигналы организма, теряет способность к созреванию (дифференцировке), ограничение числа делений (в норме клетки прекращают существование после примерно 50 митозов) и начинает бесконтрольно размножаться.
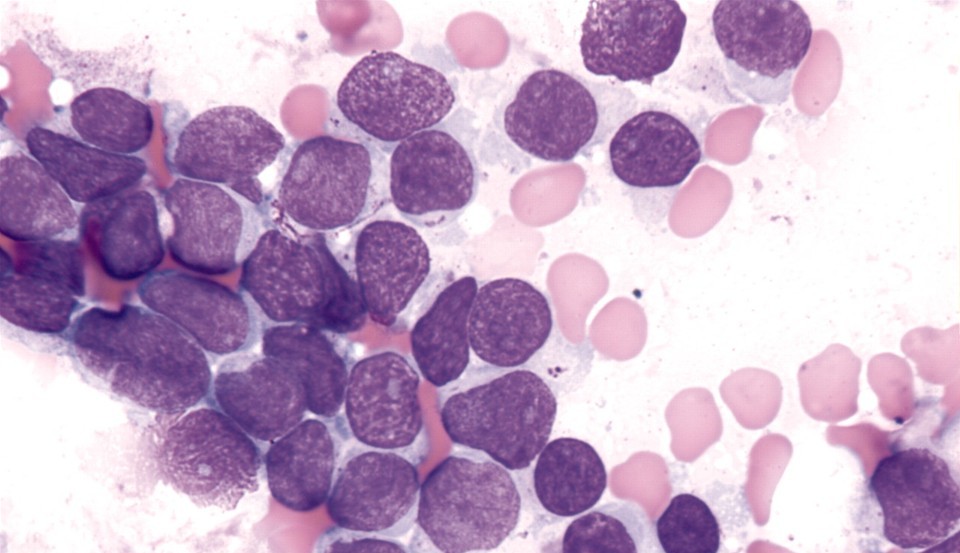
Как правило, назвать одну — единственную причину мутации бывает невозможно, особенно с учетом того, что большинство пациентов – дети. Но существуют предрасполагающие факторы развития лейкоза:
- воздействие химических агентов (бензол, некоторые лекарства);
- биологические факторы (типичный пример – вирус Эпштейна-Барр, вирус HLTV);
- врожденные хромосомные аберрации;
- некоторые наследственные заболевания (синдромы Дауна, Блума, Кляйнфельтера, Вискотта-Олдрича, анемия Фалькони);
- физические факторы: ионизирующее , рентгеновское излучение (работники рентгенологических кабинетов болеют лейкозом чаще среднего в популяции).
Всё потомство – клоны исходной атипичной лимфоцитарной клетки, неконтролируемо размножаясь, подавляют деление и созревание нормальных ростков кроветворных клеток. Сначала они делятся в пределах костного мозга, потом выходят в кровь, селезенку, печень, внутренние органы – и это становится началом клинических проявлений.
Симптомы
Жалобы и симптомы при остром лимфобластном лейкозе вызваны такими факторами, как:
- интоксикация организма продуктами распада злокачественных клеток;
- угнетение кроветворения и его последствия;
- инфильтрация органов лейкозными клетками.
Собственно, три этих фактора и лежат в основе патогенеза лейкоза.
Клиника интоксикационного синдрома обычно ярко не проявляется, и хоть и бывает зачастую первым симптомом лейкоза, не привлекает к себе внимания. Слабость, потливость, субфебрилитет (температура чуть выше 37) обычно связываются с какими-то другими причинами.
- Анемией. Недостаток красных кровяных клеток, а, следовательно гемоглобина, приводит к нехватке кислорода в организме. Основные симптомы: общая слабость, бледность кожи и слизистых, одышка при физической нагрузке.
- Тромбоцитопенией. Недостаток тромбоцитов проявляется кровотечениями. Они могут быть различной интенсивности, от петехий – кожной сыпи – до обильных желудочных, маточных кровотечений и внутричерепных кровоизлияний.
- Развитием иммунодефицита. За защиту от инфекций отвечают лимфоциты, нейтрофильные лейкоциты. Нормальные лимфоциты не вызревают, заменяясь бластами, которые в силу незрелости неспособны защищать от инфекций, а количество лейкоцитов снижено из-за угнетения нормального кроветворения. Тяжесть инфекций может быть различна, вплоть до обширных флегмон и сепсиса. Такие осложнения возникают в 10-20% случаев острого лимфатического лейкоза.
Злокачественные клетки, проникая во внутренние органы, образуют отдалённые очаги — лейкозные инфильтраты. В отличие от метастазов других злокачественных опухолей, лейкозные инфильтраты не разрушают ткани, а раздвигают их. У 75% больных увеличиваются лимфоузлы, печень, селезенка . Появляются лейкозные бляшки на коже. Инфильтрация мозговых оболочек (нейролейкоз) вызывает проявления, сходные с симптомами менингита: тошноту, нарушения координации, головную боль, сонливость. Такие признаки отмечаются у 50% пациентов.
Диагностика
Обычно первым привлекает внимание измененный анализ крови, с количеством лейкоцитов более 15х10 9 /л. Для острых лейкозов характерен так называемый лейкозный провал – в крови огромное количество бластных клеток, немного зрелых лимфоцитов и полностью отсутствуют промежуточные, созревающие клетки.

Для окончательного подтверждения диагноза выполняют анализ костного мозга, полученного при пункции, и исследуют количество бластных клеток. Для большей части острых лейкозов главный онкомаркер – более 20% бластных клеток в костном мозге, но для острого лимфобластного лейкоза диагностический критерий – 25% бластов. Если этот показатель ниже, или бластных клеток нет в костном мозге, но есть лейкозные инфильтраты в других органах и тканях, говорят о лимфобластной лимфоме, лечение которой, впрочем, не отличается от лечения острого лейкоза.
Морфоцитохимическое исследование костного мозга, иммунофенотипирование, цитогенетическое исследование (которое лежит в основе современной классификации лейкозов, рекомендованной ВОЗ), позволяющие определить все особенности клеток лейкозного клона, оговорены в клинических рекомендациях, но на практике возможны только в некоторых крупных медицинских центрах.
Обязательно выполняется люмбальная пункция, чтобы подтвердить или опровергнуть нейролейкоз. Это состояние требует специальной терапии, потому что обычные химиопрепараты не проникают через гематоэнцефалический барьер.
Клинический анализ крови и изучения состояния свертывающей системы позволяют выявить и скорректировать анемию, тромбоцитопению.
КТ грудной клетки и брюшной полости позволяет определить поражение печени, селезенки, лимфоузлов. Особенно опасно увеличение лимфоузлов средостения, расположенных рядом с сердцем, трахеей и крупными бронхами.
Лечение и прогноз острого лимфобластного лейкоза у детей
Современные протоколы терапии превратили острый лимфобластный лейкоз у детей из абсолютно летального в потенциально излечимое заболевание.
Исходя из индивидуальных особенностей, возможно три варианта прогноза.
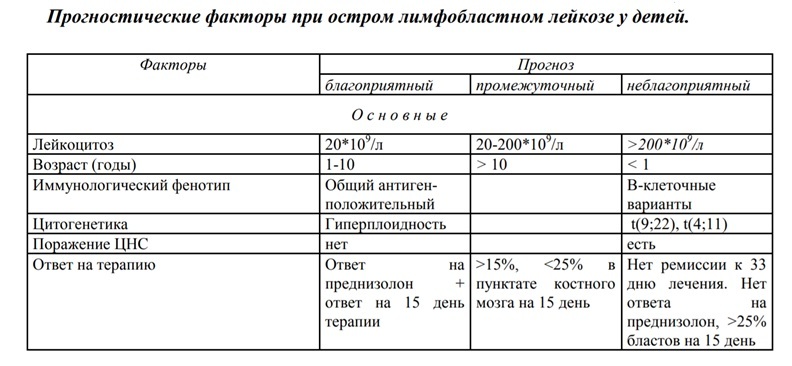
Дело в том, что химиотерапия лейкоза, как, впрочем, и любой другой злокачественной опухоли, очень тяжело переносится. Любой протокол химиотерапии – это нечто вроде золотой середины между эффективностью лечения и его безопасностью. Поэтому для групп благоприятного, промежуточного и неблагоприятного прогноза применяются разные схемы лечения, цель которого – полностью уничтожить лейкозный клеточный клон. В любой из схем используется комбинация цитостатиков и гормонов (преднизолона), разница в количестве препаратов и дозировках.
Во время химиотерапии очень важен тщательный уход за полостью рта и кожей, дезинфекция палаты, личная гигиена родителей, ухаживающих за ребенком.
Химиотерапия состоит из нескольких этапов:
- Индукция ремиссии – первая атака на атипичные клетки. Продолжительность 64 дня.
- Консолидация – самый токсичный этап. 56 дней.
- Поздняя интенсификация – 49 дней.
- Если предыдущие этапы позволили достигнуть ремиссии, далее проводится поддерживающая химиотерапия на протяжении минимум 2 лет.

Это программа для пациентов стандартного и среднего риска с благоприятным или промежуточным прогнозом. В случае высокого риска или неблагоприятного прогноза:
- Индукция ремиссии – 72 дня.
- Консолидация – три блока химиотерапии по 6 дней каждый повторяются дважды (всего 6 блоков).
- Поддерживающая химиотерапия в ремиссии минимум 104 недели.
Именно пациентам этой группы показана трансплантация костного мозга. Если она проходит успешно, рецидивов не случается, но в нашей стране реестр доноров костного мозга находится в стадии разработки, поэтому если среди родственников не находится подходящего донора, вероятность проведения пересадки резко уменьшается.
- К 33 дню терапии не наступила ремиссия;
- Лейкоцитоз более 100 в сочетании с некоторыми генетическими и молекулярно-биохимическими характеристиками опухоли и клинически невыраженный ответ на преднизолон;
- Более 25% бластов в костном мозге к 15 дню индукции ремиссии.
- Ранние и очень ранние рецидивы;
- Все рецидивы Т-клеточного ОЛЛ.
Если ремиссия сохраняется 5 лет и более, пациент считается излеченным. Но иногда лейкозные клетки мутируют, теряя восприимчивость к терапии и тогда возможен рецидив. В этом случае пациента продолжают лечить, но протоколы меняют. Если вывести в стойкую ремиссию пациента не получается, периоды ремиссия-рецидив повторяются вплоть до полного истощения организма, либо до гибели от осложнений лейкоза (кровотечение, инфекция).
Цитостатическая терапия обязательно сопровождается поддерживающей, которая направлена на нормализацию гемоглобина, свертывающей системы, устранение интоксикации, уменьшения побочных эффектов основного лечения.
При остром лимфобластном лейкозе прогноз у детей благоприятный – пятилетняя безрецидивная выживаемость составляет 60 – 80%.
Лечение и прогноз: взрослые
Принципы лечения лейкемии у взрослых не слишком отличаются от таковых у детей – многие схемы были заимствованы или адаптированы из педиатрической практики. Основные этапы лечения – индукция ремиссии, консолидация и поддерживающая химиотерапия.
- Индукция ремиссии: 2 фазы по 4 недели каждая;
- Консолидация ремиссии: 5 этапов по 3 – 4 недели;
- Поддерживающая терапия.
Точно так же как и у детей, схемы различаются в зависимости от генетических особенностей лейкозного клона. Прогностические факторы риска изучаются, но их использование относится к рекомендательным,, так как практика показывает – у 40 – 50% пациентов не имеющих факторов риска рецидива острый лимфолейкоз все равно рецидивирует.
Показания к трансплантации костного мозга у взрослых группы высокого риска зависят от конкретного протокола лечения. Но во всех случаях учитывают состояние пациента и сопутствующие патологии, ухудшающие восстановление после пересадки.
Точно так же, как и при лечении детей, обязательна поддерживающая терапия.
Прогноз у взрослых в целом хуже, чем у детей: пятилетняя общая выживаемость – от 40 до 60%, в зависимости от возраста пациента и генетических особенностей лейкозного клона.
Алло-ТГСК – трансплантация аллогенных гемопоэтических стволовых клеток
Ауто-ТГСК – трансплантация аутологичных гемопоэтических стволовых клеток
АЧТВ – активированное частичное тромбопластиновое время
БРВ – безрецидивная выживаемость
ВКЛ – волосатоклеточный лейкоз
ВОЗ классификация – классификация Всемирной организации здравоохранения
Г-КСФ – гранулоцитарный колониестимулирующий фактор
ИТ – индукционная терапия
ИТК – тирозинкиназный ингибитор
КИ – клинические исследования
КМ – костный мозг
КТ – компьютерная томография
ЛБ – лимфома Беркитта
ЛБЛ – лимфобластная лимфома
МОБ – минимальная остаточная болезнь
НХЛ – неходжкинские лимфомы
ОАК – общий (клинический) анализ крови
ОВ – общая выживаемость
ОЛ – острый лейкоз
ОЛЛ – острый лимфобластный лейкоз
ОМЛ – острый миелоидный лейкоз
ОРДС – острый респираторный дистресс-синдром
ОТ-ПЦР – полимеразная цепная реакция с обратной транскрипцией
ПР – полная ремиссия
ПЦР – полимеразная цепная реакция
ПЭТ/КТ – позитронно-эмиссионная компьютерная томография
ТГСК – трансплантация гемопоэтических стволовых клеток
УДД – уровень достоверности доказательств
УЗИ – ультразвуковое исследование
УУР – уровень убедительности рекомендаций
ХМЛ – хронический миелолейкоз
ЦНС – центральная нервная система
CD – кластер дифференцировки
ECOG (Eastern Cooperative Oncology Group status) – шкала оценки состояния пациента по критериям Восточной кооперативной онкологической группы
EWALL – Европейская исследовательская группа по изучению острого лимфобластного лейкоза
FISH-исследование – исследование методом флуоресцентной гибридизации in situ
GMALL – Немецкая исследовательская группа по изучению острого лимфобластного лейкоза
GRAALL – Французская исследовательская группа по изучению острого лимфобластного лейкоза
MD Anderson CRC – Американская исследовательская группа онкологического научного центра имени М.Д. Андерсона
Ph+ ОЛЛ или Ph-позитивный ОЛЛ – острый лимфобластный лейкоз, при котором определеяется транслокация t(9;22)
Ph– ОЛЛ или Ph-негативный ОЛЛ – острый лимфобластный лейкоз, при котором не обнаруживается транслокация t(9;22)
RALL – Российская исследовательская группа по лечению острого лимфолейкоза у взрослых
TdT – терминальная дезоксинуклеотидилтрансфераза
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
1. 2020 Клинические рекомендации "Острые лимфобластные лейкозы" (Общероссийский национальный союз "Ассоциация онкологов России"; Некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга "Национальное гематологическое общество").
Определение
Острые лимфобластные лейкозы (далее – ОЛЛ)/острые лимфобластные лимфомы (ЛБЛ) – это гетерогенная группа злокачественных клональных заболеваний системы крови, происходящих из клеток-предшественниц гемопоэза преимущественно лимфоидной направленности дифференцировки и характеризующиеся чаще всего исходным поражением костного мозга (далее – КМ), вытеснением нормального кроветворения и вовлечением в процесс различных органов и систем организма (центральная нервная система (далее – ЦНС), яички, лимфатическая ткань любой локализации), а также возможностью исходного поражения органов лимфатической ткани без вовлечения КМ.
Терминология
Острые лимфобластные лейкозы – это гетерогенная группа клональных заболеваний системы крови, возникающих вследствие мутации в Т- или В-клетках-предшественницах.
Ph-негативные острые лимфобластные лейкозы – это группа, объединяющая несколько подтипов острых лимфобластных лейкозов, при которых не обнаруживается филадельфийская хромосома (Ph-t(9;22)). В нее включены все В-клеточные и Т-клеточные острые лимфобластные лейкозы и лимфобластные лимфомы.
Ph-позитивный острый лимфобластный лейкоз – это вариант острого лимфобластного лейкоза, при котором методом стандартного цитогенетического исследования (G-banding) или методом FISH определяется транслокация t (9;22). Диагноз Ph-позитивного острого лимфобластного лейкоза не может быть основан только на методе молекулярной детекции химерного транскрипта. Цитогенетическое или FISH (метод флуоресцентной гибридизации in situ) исследования являются обязательными. Методом полимеразной цепной реакции определяется вариант химерного транскрипта, который в дальнейшем используется для мониторинга минимальной остаточной болезни.
Полная ремиссия – это состояние кроветворной ткани, при котором в пунктате костного мозга обнаруживается 5% и менее бластных клеток при нормальном соотношении всех ростков кроветворения, при количестве нейтрофилов в периферической крови более 1,0×10 9 /л, при количестве тромбоцитов более или равном 100×10 9 /л, при отсутствии экстрамедуллярных очагов лейкемического роста. Констатация морфологически полной ремиссии (соответственно, оценка резистентности) осуществляется либо после первой фазы индукционной терапии, либо после второй. При отсутствии полной ремиссии после завершения двух этапов индукционной терапии регистрируется рефрактерная форма острого лимфобластного лейкоза. В этой связи необходимо подчеркнуть, что у ряда пациентов после завершения второй фазы индукционной терапии на фоне восстановления кроветворения после цитостатического воздействия в ранние сроки после его завершения может определяться увеличенный процент бластных клеток (до 10–12 %). В этом случае (особенно если полная ремиссия была зафиксирована после первой фазы индукционной терапии) через неделю на фоне восстановленного кроветворения целесообразно выполнить повторную стернальную пункцию.
Полная ремиссия подразделяется на три основных типа: 1) цитогенетическая, 2) молекулярная, 3) с неполным восстановлением показателей периферической крови, когда число нейтрофилов менее 1×10 9 /л, а тромбоцитов менее 10×10 9 /л. Последняя категория оговаривается специально, поскольку, по ряду данных, прогноз у таких пациентов несколько хуже. При этом эксперты не рекомендуют констатировать у таких пациентов полную ремиссию. Тем не менее вне клинических исследований эту формулировку ответа применяют редко.
Частичная ремиссия (частичный ответ) – этот термин рекомендуют использовать только в клинических исследованиях I–II фазы, оценивающих противоопухолевую эффективность, токсичность, переносимость новых препаратов и определяющих оптимальные дозы этих препаратов.
Резистентная форма – эта форма заболевания, которая констатируется при отсутствии полной ремиссии после завершения двух фаз индукционной терапии.
Рецидив – это состояние констатируется при обнаружении в пунктате костного мозга более 5 % бластных клеток. Рецидив заболевания не констатируется при обнаружении в очередном контрольном пунктате костного мозга более 5 % бластных клеток, но менее 10 %, в тех случаях, когда пункция костного мозга производится в ранние сроки после курса химиотерапии или использовались ростовые гемопоэтические факторы с целью сокращения периода нейтропении, при этом анализ периферической крови нормальный и отсутствуют экстрамедуллярные поражения. Вторая диагностическая пункция осуществляется через 7–10 дней после первой. Если сохраняется процент бластных клеток выше 5 или отмечается их увеличение (например, с 7 до 13 %), то констатируется рецидив.
Ранний рецидив – эта форма рецидива называется в том случае, если он регистрируется раньше, чем через полгода от момента окончания поддерживающей терапии или на терапии после достижения ремиссии. Поздним считается тот рецидив, который возникает через полгода и более от окончания поддерживающей терапии. Рецидивом также является и внекостномозговое поражение (нейролейкемия, поражение яичек, увеличение селезенки и т. д.) даже при отсутствии изменений в крови и костном мозге. Внекостномозговые рецидивы (особенно поражение центральной нервной системы) при использовании современных протоколов лечения встречаются приблизительно в 4–8 % случаев. Если констатирован изолированный внекостномозговой рецидив, то, кроме локальной терапии (лечение нейролейкемии, облучение/удаление яичка, удаление лейкемического очага в яичнике и т. д.), обязательно проведение и системной индукционной терапии по протоколам, предусмотренным для таких рецидивов.
Минимальная остаточная болезнь, или минимальная резидуальная болезнь – это небольшая популяция опухолевых клеток, которая не может быть зафиксирована с помощью светового микроскопа, но обнаруживается более тонкими методами исследования, выявляющими 1 лейкемическую клетку на 10 4–6 исследуемых. Основными методами детекции минимальной остаточной болезни являются проточная цитометрия и полимеразная цепная реакция. Методы стандартного цитогенетического исследования и метод FISH не используются в целях оценки минимальной остаточной болезни.
Цитогенетическая ремиссия – это полная клинико-гематологическая ремиссия, при этом методами стандартной цитогенетики не выявляются исходные аномалии кариотипа; кариотип должен быть нормальным, а число проанализированных метафаз должно составлять не менее 20. Цитогенетическая ремиссия – новое понятие, появившееся при регулярном использовании методов цитогенетики для исследований пунктатов костного мозга в период полной ремиссии.
Цитогенетический рецидив – это рецидив, который констатируется при наличии в пунктате костного мозга митозов с хромосомными аберрациями, которые обнаружены в дебюте заболевания на фоне сохраняющейся клинико-гематологической ремиссии.
Молекулярная ремиссия – это полная клинико-гематологическая ремиссия при отсутствии в костном мозге исходно определявшихся методом полимеразной цепной реакции молекулярных маркеров острого лейкоза с чувствительностью метода 10 –4 . Это также новое понятие, ставшее в настоящее время ключевым. Следует отметить, что может быть достигнута цитогенетическая ремиссия, но при этом молекулярные маркеры могут еще определяться.
Молекулярный рецидив – это появление исходно определявшихся молекулярных маркеров острых лейкозов в двух повторных анализах (проведенных с коротким интервалом времени) на фоне сохраняющейся клинико-гематологической ремиссии.
Важным и одним из самых точных способов оценки эффективности терапии острых лейкозов являются применение статистических методов и построение кривых выживаемости пациентов, которым проводили то или иное лечение. Чаще всего оценивают общую, безрецидивную, бессобытийную выживаемость и вероятность сохранения полной ремиссии (или обратное понятие – вероятность развития рецидива).
Общая выживаемость. Для оценки общей выживаемости анализируют временные параметры всех пациентов, включенных в исследование. Точкой отсчета является день начала терапии. Событием считается только смерть пациента от любой причины (ранняя летальность, смерть в период ремиссии от любой причины, смерть в период рецидива). Событие на кривой выживаемости графически отображается ступенькой, идущей вниз. Пациентов, живых во время проведения анализа, расценивают как случай и отмечают на кривой черточкой, т. е. цензурируют. Пациентов, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы. Больных, отказавшихся от лечения, цензурируют в день отказа от терапии.
Безрецидивная выживаемость. При оценке безрецидивной выживаемости учитывают данные только тех пациентов, у которых была достигнута полная ремиссия. Точкой отсчета считается дата достижения полной ремиссии. Событиями считаются рецидив или смерть от любой причины (в период консолидации или поддерживающего лечения, от рецидива, в период ремиссии от другой причины, например, суицида). Цензурируют только тех пациентов, которые были живы и находились в полной ремиссии в момент проведения анализа. Больных, судьба которых неизвестна, цензурируют в тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия, но они отказались от лечения в ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии (обратное от вероятности развития рецидива). При оценке вероятности сохранения полной ремиссии учитываются данные только тех пациентов, у которых достигнута полная ремиссия. При этом точкой отсчета служит дата достижения полной ремиссии. Событием считается только рецидив заболевания. Цензурируют всех больных, кто жив в полной ремиссии в момент проведения анализа. Пациенты, умершие в период полной ремиссии от осложнений, связанных с лечением, или от других причин, цензурируют в день смерти, как больных, находившихся в полной ремиссии. Пациентов, судьба которых неизвестна, цензурируют на тот момент, когда было известно, что они живы в полной ремиссии. Пациентов, у которых была достигнута полная ремиссия и которые отказались от лечения в период ремиссии, цензурируют в день отказа от терапии.
Вероятность сохранения полной ремиссии является тем показателем, который позволяет оценивать истинную противоопухолевую эффективность какой-либо терапии без учета таких субъективных моментов, как выхаживание пациентов от осложнений, связанных с самим лечением.
Бессобытийная выживаемость. Этот показатель оценивает выживаемость всех больных, включенных в анализ, с момента начала терапии. Событием считается ранняя летальность, факт недостижения полной ремиссии через два месяца от начала лечения, смерть в период ремиссии от осложнений химиотерапии или других причин, а также рецидив заболевания. Цензурируют только пациентов, у которых была достигнута полная ремиссия в течение первых двух курсов химиотерапии, и они остаются живыми, сохраняя полную ремиссию, на момент проведения анализа.
Индукция – это период начального лечения, целью которого является максимально быстрое и существенное сокращение опухолевой массы и достижение полной ремиссии, называется периодом индукции (обычно 1–2 курса). Именно в этот период на фоне применения цитостатических средств количество лейкемических клеток в костном мозге уменьшается примерно в 100 раз, т. е. в момент констатации полной ремиссии в костном мозге морфологически определяется менее 5 % опухолевых клеток.
Консолидация. Второй этап терапии острых лейкозов – закрепление достигнутого противоопухолевого эффекта (разное количество, в зависимости от протокола). Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток.
Поддерживающее лечение – это продолжение цитостатического воздействия в меньших дозах, чем в период индукции ремиссии, на возможно остающийся опухолевый клон.
Лейкоз/лимфома Беркитта – это высокоагрессивное лимфопролиферативное заболевание из иммунологически зрелых В-клеток с преимущественно экстранодальной локализацией. Клинически выделяют 3 варианта лимфомы Беркитта: эндемический, спорадический и ВИЧ-ассоциированный.
Эндемический вариант лимфомы Беркитта – это вариант лимфомы Беркитта характерен для темнокожих детей-аборигенов экваториальной Африки и мигрантов из Африки в Новую Гвинею. В клинической картине часто наблюдается поражение лицевого скелета: верхней и нижней челюстей, орбиты, а также почек, яичек, яичников, слюнных, молочных желез и центральной нервной системы.
Спорадический вариант лимфомы Беркитта – это типичная лимфома Беркитта по морфологическим, иммунофенотипическим и цитогенетическим признакам, возникающая вне эндемичной зоны.
Иммунодефицит-ассоциированный вариант лимфомы Беркитта – это лимфома Беркитта, возникающая на фоне иммунодефицитных состояний (у пациентов с ВИЧ-инфекцией, после трансплантации органов, у пациентов с первичными иммунодефицитами). Чаще всего встречается у ВИЧ- инфицированных пациентов, причем на ранних этапах развития (до снижения CD 4+ -клеток).
Читайте также:

