Результаты лечения больных раком легкого
Отдаленные результаты хирургического лечения рака легкого во многом зависят от стадии, в которой была произведена операция, и гистологической формы опухоли. Результаты значительно лучше при операциях в I—II стадии, чем III стадии рака. При эпидсрмондном раке результаты лучше, чем при недифференцированных формах. Отмечаются также лучшие результаты после лобэктомии по сравнению с пульмон-эктомией. Это связано с двумя основными факторами: во-первых, лоб-эктомия, как правило, производится при меньшей распространенности ракового процесса: во-вторых, лобэктомия легче переносится больными и значительно реже приводит к легочной недостаточности, которая является причиной смерти ряда больных в отдаленные сроки после пульмоиэк-томнн. Через 5 лет после лобэктомнн продолжают жить 35—40%, после лульмонэктомии — 25—30% больных. Большинство случаев смерти от рецидивов и метастазов рака приходится на первые 2—3 года после операции. Если больные благополучно переживают этот срок и при контрольном исследовании рецидив или метастазы у них не обнаруживаются, прогноз в значительной степени является благоприятным. После радикальных операций по поводу рака легкого больные подлежат диспансерному наблюдению в онкологических учреждениях.
Лучевое лечение рака легкого применяется широко. В отличие от старых методов рентгенотерапии современное мегавольтипс облучение позволяет, не повреждая кожу, интенсивно воздействовать на глубоко расположенную опухоль. Под влиянием облучения раковые клетки подвергаются дегенерации и некрозу, а опухоль часто уменьшается и в отдельных случаях даже исчезает. Облучение обычно оказывает положительное влияние и на воспалительную реакцию вокруг опухоли. Уменьшение опухоли и воспалительной реакции может способствовать улучшению бронхиальной проходимости, ликвидации ателектазов. Для лучевого лечения рака легкого применяются гамма-терапевтические установки "Рокус", "Луч", линейные ускорители, бетатрон. Облучают как зону опухоли, так н зону предполагаемого метастазирования. Разовая доза 200 -250 рад. суммарная — до 6000—8000 рад.
В настояшее время получают распространение и интенсивно изучаются различные комбинированные методы лечения рака легкого. Наиболее пажнымн из них являются облучение с последующей операцией и облучение в сочетании с химиотерапией. Предоперационное облучение проводят в течение 2—3 нед в суммарной дозе 3000—4000 рад. Операцию производят через 12—15 дней после окончания облучения.
Химиотерапия рака легкого пока малоэффективна. Лишь у небольшого числа больных она позволяет получить временный терапевтический эффект: улучшение самочувствия, уменьшение кашля и болей. Размеры опухоли уменьшаются редко. Химиотерапия проводится главным образом в тех случаях, когда нельзя оперировать или облучать. Наиболее употребительными препаратами, применяемыми для лечения рака легкого, являются циклофосфан, тиофосфамид (ТиоТЭФ), 5-фторурацил. Вводят их внутривенно согласно прилагаемым инструкциям. При раковых плевритах во время пункций с отсасыванием жидкости рационально вводить в плевральную полость 60—70 мг тиофосфамида (суммарная доза до 300 мг). Этот препарат способствует прекращению накопления жидкости в полости плевры. Введение химиопрепаратов через катетер в легочную артерию и бронхиальные артерии не имеет выраженных клинических преимуществ по сравнению с внутривенным путем введения, поэтому теперь оставлено.
Облучение в сочетании с химиотерапией (химиолучевое лечение) наиболее целесообразно для лечения неоперабельных больных с недифференцированными формами рака легкого, а также для больных с рецидивами и метастазами рака после операций. Во время такого лечения важно переливать кровь, насыщать больных витаминами. Необходимо следить, чтобы число лейкоцитов в крови не падало ниже 3*109/л (3000 в 1 мкл), а тромбоцитов — ниже 100*109/л (100000 в 1 мкл). Если такое падение наблюдается, в химиолучевом лечении нужно сделать перерыв или прекратить его.
Профилактика рака легкого основывается на знании факторов, которые предрасполагают к его возникновению. Пока все профилактические меры сводятся к рациональной гигиене дыхания. В крупных городах важно добиваться уменьшения выброса дыма в атмосферу системами домового отопления и промышленными предприятиями. Для этого совершенствуются способы сжигания топлива и создаются специальные улавливатели дыма. При составлении планов гралостронтельства следует учитывать необходимость создания санитарно-защитных зон у промышленных предприятий. Автомобильные двигатели для уменьшения загрязнения воздуха канцерогенными веществами нужно хорошо регулировать, а двигатели с большим износом снимать с эксплуатации. Кроме этих широких санитарно-гигиенических мероприятий, важное значение следует придавать пропаганде отказа от курения, а также предупреждению и лечению заболеваний дыхательной системы, которые нарушают механизмы ее самоочищения.
До настоящего времени рак легкого в большей части случаев диагностируется еще поздно — в III и даже IV стадиях болезни. Главными причинами поздней диагностики являются недостаточная онкологическая настороженность врачей, особенно работающих в поликлинической сети, а также скрытое течение н недостаточное внимание ряда больных к появившимся симптомам заболевании и врачебным рекомендациям.
Раннее распознавание рака легкого — одна из важных задач здравоохранения. Основное значение имеет профилактическое обследование легких с помощью флюорографии. Такое обследование следует проводить не реже раза в год и в первую очередь среди групп населения с повышенным риском заболеваемости раком легкого: мужчин старше 40 лет, работников газовой, горной, кожевенной, табачной промышленности, лиц, занятых производством и обработкой камня, асфальта, смол, хроматов, асбеста, никеля. Чрезвычайно важно повышение квалификации врачей, к которым в первую очередь обращаются больные раком легкого,— терапевтов, фтизиатров, рентгенологов.
Рак легких на сегодняшний день является одним из наиболее часто встречающихся видов злокачественных новообразований. В среднем в мире на 100 000 человек приходится 40 страдающих раком легких, причем у мужчин болезнь диагностируется в десять раз чаще, чем у женщин, а доля городских жителей в составе всех заболевших в несколько раз больше сельских. Тем не менее современная медицина располагает мощным арсеналом для лечения этого вида онкологии: при своевременном обращении за помощью высока вероятность не только приостановить развитие заболевания, но и забыть о нем навсегда.
Рак легких: характеристика заболевания и прогноз излечения
Ежегодно в мире от рака легких умирает около пяти миллионов человек. Этот вид злокачественного новообразования также называют бронхогенной карциномой или бронхогенным раком. Опухоль развивается из покровного эпителия слизистой оболочки бронхов, альвеол и эпителия бронхиальных желез. Несмотря на то что этиология заболевания до сих пор остается неясной, к основным причинам его возникновения относят:
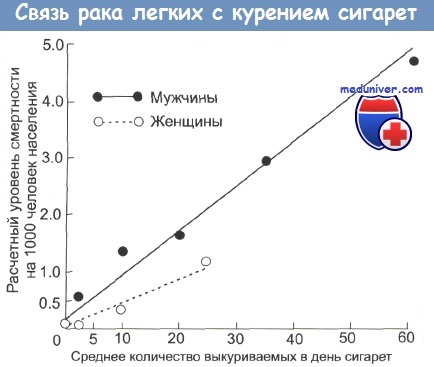
- курение, в том числе пассивное, — основной фактор риска (вызывает примерно 90% случаев рака легких);
- облучение (проводимая ранее лучевая терапия по причине других опухолей внутригрудной локализации);
- фиброз легких;
- ВИЧ и некоторые другие виды вирусной инфекции (вирус папилломы человека, JC вирус, обезьяний вирус 40, BK вирус и цитомегаловирус);
- генетические факторы;
- алкоголь;
- плохое питание;
- факторы внешней среды, например: повышенная концентрация пылевых частиц в воздухе, воздействие радона и некоторых канцерогенов (наиболее опасным для легких является минерал асбест, а также мышьяк).
Патогенез рака легких на сегодняшний день недостаточно изучен. Что касается роста опухоли, то здесь выделяют три стадии: трансформация нормальной клетки в злокачественную, активизация опухоли и стадия ее прогрессирования. Второй этап наиболее важен, так как злокачественные клетки могут долгое время находиться в неактивном состоянии. Активизации способствует регулярное воздействие вредных факторов, которые стимулируют размножение патогенных клеток. Кроме того, на образование опухоли влияет нарушение защитных функций организма (снижение противоопухолевого иммунитета).
Российская статистика
По заболеваемости рак легкого занимает первое место среди других злокачественных опухолей у мужчин в России, а по смертности — первое место среди мужчин и женщин как в России, так и в мире. От рака легкого ежегодно умирает больше людей, чем от рака простаты, молочной железы и толстой кишки вместе взятых [1] .
При отсутствии должного лечения рака легких прогноз неутешительный: 87% больных умирает в течение двух лет. При использовании хирургических методов выживаемость больных составляет 30% в течение пяти лет. Одновременное использование нескольких методов лечения поднимает данный показатель еще на 40%. Кроме того, шансы на излечение существенно возрастают при раннем обнаружении опухоли, достигая 80%.
Различают четыре стадии рака легких. Нулевой стадии предшествует скрытая, когда раковые клетки можно обнаружить только в результате проведения бронхоскопии, цитологического, гистологического исследования.
Международная классификация стадий злокачественных новообразований TNM (tumor, nodus, metastasis) была разработана французским хирургом Пьером Денуа в 1943–1952 годах. Данная классификация применяется прежде всего для описания анатомического распространения опухоли. В основе классификации лежат три компонента:
- Показатель T характеризует распространенность первичной опухоли.
- Показатель N говорит о наличии и распространенности метастазов в регионарных лимфатических узлах.
- Показатель M иллюстрирует наличие или отсутствие отдаленных метастазов.
Существует множество классификаций рака легких, построенных на разнообразных признаках.
Согласно гистологической классификации рак легких подразделяется на следующие типы:
- аденокарцинома;
- аденосквамозная карцинома;
- плоскоклеточный рак;
- крупноклеточный рак;
- веретеноклеточный рак;
- нейроэндокринная карцинома;
- диффузная идиопатическая легочная гиперплазия.
Самым частым является плоскоклеточный вид, который диагностируется в 80% случаев. Он распространяется медленнее и поддается хирургическому лечению. Мелкоклеточный рак составляет порядка 17% случаев и является особенно опасным, так как для него характерно быстрое распространение на другие органы, за пределы легочной ткани. Выживаемость при мелкоклеточном раке составляет 40% в течение трех лет.
Особенности локализации
По расположению рак легких подразделяется на центральный и периферический. В первом случае первичный опухолевый узел возникает в бронхах (главном, промежуточном, долевом, сегментарном и субсегментарном). По направлению роста выделяют [2] :
- экзофитный (эндобронхиальный) рак, когда опухоль растет в просвет бронха;
- эндофитный (экзобронхиальный) рак с преимущественным ростом опухоли в толщу легочной паренхимы;
- разветвленный рак с муфтообразно перибронхиальным ростом опухоли вокруг бронхов;
- со смешанным характером роста опухоли с преобладанием того или иного компонента.
Периферический рак легкого затрагивает эпителий более мелких бронхов или локализуется в паренхиме легкого. Различают узловую округлую опухоль, пневмониеподобный рак и рак верхушки легкого с синдромом Панкоста.
В большинстве случаев клинические проявления рака легких наблюдаются уже при поздней стадии заболевания — это кашель с выделением крови в мокроте, одышка, боль за грудиной, шумы при дыхании [3] . Симптомы могут возникать вследствие распространения первичной опухоли, метастазирования. Вследствие отдаленных эффектов, не связанных с метастазами, могут возникать паранеопластические синдромы [4] .
На разных стадиях рак легкого может сопровождаться тромбофлебитом, различными вариантами нейро- и миопатии, своеобразными дерматозами, нарушениями жирового и липидного обмена, артралгическими и ревматоидноподобными состояниями. Нередко проявляется остеоартропатией (утолщением и склерозом костей голеней и предплечий, мелких костей кистей и стоп, припухлостью суставов, утолщением фаланг пальцев кистей).
При периферическом раке верхушки легкого возможно появление синдрома Бернара — Горнера, при котором поражается одна сторона лица — опущение века, сужение зрачка и уменьшение потоотделения. Сочетается с болями в плечевом суставе и плече, прогрессирующей атрофией мышц предплечья. Поскольку вышеперечисленные симптомы проявляются вне легких, они довольно часто не распознаются пациентом и не всегда определяются в качестве онкосимптомов.
Помимо специфических, рак легких имеет ряд общих симптомов, таких как потеря аппетита и общая слабость, повышение температуры тела, потливость, потеря веса. Однако следует помнить, что некоторые разновидности данного заболевания долгое время не проявляют себя и не имеют заметных симптомов. Именно в таких случаях решающее значение имеет качественная и своевременная диагностика.
Основными методами диагностики рака легких являются:
- Компьютерная томография (КТ) (предпочтительно) — это наиболее информативный метод в выявлении очаговых изменений легочной ткани.
- Рентгенологическое обследование, которое может включать в себя флюорографию и рентгенографию.
- Бронхоскопия — это обязательное исследование при подозрении на рак легкого. Бронхоскопия дает возможность визуально исследовать трахею, главные, долевые, сегментарные, субсегментарные бронхи и в некоторых случаях бронхи 6-го, 7-го и более порядка. Во время бронхоскопии осуществляется забор материала на биопсию.
- Позитронно-эмиссионная томография (ПЭТ КТ) применяется для определения степени распространения метастазов (в соответствии с результатами производится подбор схемы лечения) и для последующего динамического контроля.
- Эндобронхиальное (EBUS) и эндоскопическое УЗИ (EUS) — современный метод, позволяющий хирургам получить образцы тканей лимфатических узлов в области грудной клетки с помощью одной лишь иглы с оптическим прибором и ультразвука (не прибегая к технике надрезов на шее). Метод позволяет диагностировать увеличенные лимфатические узлы в грудной клетке и точно установить стадию рака легких для планирования лечения.
- Обследование с помощью системы бронхолегочной электромагнитной навигацииSuperDimension Bronchus System™ — новейший метод, который дает возможность при помощи гибкого зонда исследовать пораженный участок, расположенный глубоко внутри лимфоузла или легкого. Данный способ позволяет пульмонологам диагностировать злокачественные новообразования на более ранних стадиях заболевания, что дает возможность выбрать соответствующее лечение рака легких и избежать тяжелых последствий.
- Торакоскопия, или трансторакальная биопсия (VATS), — это визуальное исследование поверхности легких и плевральной полости через грудную стенку при помощи прокола, в который вводится торакоскоп. Дает возможность рассмотреть поверхность легких и плевру, взять образцы опухолевого материала для иммуногистохимии с целью получения гистологического заключения, удалить подозрительные легочные узелки.
- Молекулярно-генетическое тестирование опухолевой ткани: PD-L1, EGFR, ALK; другие мутации — ROS1, BRAF, RET, TRK, MET and KRAS. Цель молекулярно-генетического тестирования заключается в выделении пациентов, которым показана таргетная терапия.
Это важно!
Современный высокоточный метод стадирования рака легкого — ПЭТ/КТ (позитронная эмиссионная томография, совмещенная с компьютерной томографией) всего тела. Исследование проводится при всех стадиях заболевания и показано перед операцией. ПЭТ/КТ может обнаружить очаги опухоли в лимфатических узлах, не детектируемые с помощью КТ, а также отдаленные метастазы в других органах. Зачастую по результатам ПЭТ/КТ пересматриваются первоначальная стадия и тактика лечения [5] .
Качественная диагностика легочной онкологии является крайне важной, поскольку от нее зависит выбор подходящих методов лечения. Основными методами являются хирургическое вмешательство, химио- и лучевая терапия. Благодаря бурному развитию медицинских технологий, данные подходы становятся все более безопасными и эффективными.
После завершения диагностического этапа проводится междисциплинарный консилиум, в рамках которого обсуждают этапы комплексного лечения.
Хирургическое лечение рака легких
Хирургическое лечение проводится на ранних стадиях заболевания и при условии технической возможности удаления опухоли в полном объеме. Обязательным этапом операции, независимо от объема удаляемой легочной ткани, является превентивное удаление лимфатических узлов в зоне регионарного метастазирования, включая средостенные.
Современной тенденцией лечения рака легких является использование малоинвазивных методов, которые производятся с применением миниатюрной видеокамеры. Методика носит название Video-Assisted Thoracoscopic Surgery (VATS). Такие операции сопровождаются менее выраженными болевыми ощущениями, а процесс реабилитации после них протекает быстрее. Данный метод применяются в тех случаях, когда удается диагностировать болезнь на клинической 1-й стадии.
Химиотерапия
Основной метод лечения для большинства пациентов, страдающих раком легких. Ее суть заключается в приеме лекарственных препаратов, разрушающих раковые клетки. Химиотерапия может проводиться в одном из двух режимов:
- Неоадъювантная — назначается перед проведением хирургической операции, чтобы остановить рост злокачественных клеток, уничтожить их и оценить эффективность стандартного лечения.
- Адъювантная — используется для уничтожения оставшихся раковых клеток после операции или курса радиотерапии и позволяет снизить риск рецидива болезни.
Таргетная (целевая) терапия рака легкого
Такие препараты распознают злокачественные клетки по их специфическим признакам и уничтожают их, воздействуя на жизненно важные функции (рост, деление). Кроме этого, такие препараты нарушают кровоснабжение опухоли. Таргетная (целевая) терапия может назначаться как самостоятельный метод лечения или в комбинации с химиотерапией в целях повышения эффективности лечения.
Иммунотерапия
Радиотерапия
Лучевую терапию применяют как самостоятельное лечение, а также в сочетании с химиотерапевтическим методом.
Облучение опухоли мощным пучком гамма-лучей, в результате чего раковые клетки погибают (приостанавливают рост и размножение). При радикальном лучевом лечении облучению подвергают как саму опухоль, так и зоны регионального метастазирования. Лучевая терапия применяется также при мелкоклеточном раке. Новейшие медицинские разработки в области радиотерапии включают в себя:
- дистанционную радиотерапию (External Beam Radiation Therapy — EBRT) — воздействие на раковые клетки производится с помощью наружного источника, расположенного вне человеческого тела;
- стереотаксическую лучевую терапию — методика SBRT — возможность лечения рака легкого первой стадии с помощью облучения опухоли высокой дозой;
- высокодозную брахитерапию (High Dose Rate Brachytherapy — HDR Brachytherapy) — воздействие посредством источника, имплантированного в тело пациента и располагающегося в непосредственной близости от опухоли (или внедренного в опухоль).
Одним из новейших методов лечения рака легких является радиотерапия IMRT RapidArc®, которая позволяет подавать всю дозу облучению исключительно на больную ткань без повреждения здоровых тканей. Применяется в том случае, если раковый процесс затрагивает более одной доли легких, но не распространился за их пределы.
Лучевая терапия зачастую проводится совместно с химиотерапией с целью достижения максимального эффекта лечения.
Паллиативное лечение рака легких
Применяется для неизлечимых больных, когда противоопухолевое лечение противопоказано по определенным причинам или возможности лечения исчерпаны. Паллиативное лечение направлено на борьбу с симптомами, а также повышение качества жизни. Паллиативная помощь может быть оказана в рамках стационара, а также на дому. Объем лечения определяется индивидуально.
Этот вопрос мы адресовали представителю многопрофильного медицинского центра. Рассказывает онколог Европейского медицинского центра Оксана Овсий:
«Рак легких — очень коварное заболевание, зачастую на первых стадиях протекающее бессимптомно. По этой причине при ухудшении общего самочувствия рекомендуется не затягивать с обращением к врачу и прохождением диагностического обследования. Помимо сотрудников государственных онкоцентров, помощь могут оказать и специалисты частных клиник.
Чтобы получить доступ к мировым методикам лечения, не уезжая за рубеж, рекомендую обратиться в Институт онкологии ЕМС в Москве, осуществляющий диагностику и лечение рака по современным американским и европейским протоколам.
Мы оказываем весь комплекс диагностических и лечебных процедур пациентам с раком легких:
- прием (осмотр, консультация) врача-онколога, радиотерапевта и других (первичный, повторный, ежедневный);
- компьютерная томография органов грудной полости, средостения и верхних отделов брюшной полости;
- позитронная эмиссионная томография, совмещенная с компьютерной томографией;
- бронхография, в том числе избирательная;
- аспирационная биопсия из нижних дыхательных путей;
- торакоцентез;
- клиническая лабораторная диагностика, включая сложные диагностические услуги (лабораторный, функциональный, инструментальный, рентгенорадиологический и другие методы исследования), формирующие диагностические комплексы;
- назначение лекарственных препаратов при онкологическом заболевании у взрослых;
- хирургическое лечение;
- радиотерапия;
- химио-, таргетная и иммунотерапия злокачественных опухолей;
- услуги по медицинской реабилитации пациента, перенесшего операцию по поводу онкологического заболевания, химиотерапию, лучевую терапию;
- прием (осмотр, консультация) врача по паллиативной медицинской помощи (первичный и повторный).
Институт онкологии EMC обладает новейшими системами для проведения лучевой и стереотаксической лучевой терапии. Стоит отметить, что высокотехнологичное оборудование позволяет выполнять облучение опухоли с миллиметровой точностью, не допуская облучения здоровой ткани и позволяя успешно бороться с раком легкого 1-й стадии. Во время сеанса аппарат контролирует положение пациента и отклонение мишени облучения в режиме online.
- медицинскую деятельность на основании лицензии ЛО-77-01-019876, выданной Департаментом здравоохранения города Москвы 10 апреля 2020 года;
- высокотехнологичную медицинскую деятельность на основании лицензии ФС-99-01-009514, выданной Федеральной службой по надзору в сфере здравоохранения 25 апреля 2018 года.
** Аккредитация Объединенной международной комиссии (Joint Commission International), полученная Европейским медицинским центром (госпиталь на ул. Щепкина, 35), распространяется на период с 7 апреля 2018 года по 6 апреля 2021 года.
Вид и количество выполненных операций и послеоперационные осложнения представлены в табл. 2.16, из которой видно отчетливое преобладание осложнений у больных, оперированных традиционным способом. Касаясь несостоятельности культи главного бронха с формированием бронхоплеврального свища и пострезекционной эмпиемы гемиторакса, следует отметить, что во всех случаях это осложнение наблюдали после расширенной пневмонэктомии, причем обработку главного бронха как при обычных вмешательствах, так и при операциях с видеосопровождением осуществляли аппаратом УДО-40. Признаки несостоятельности культи бронха во всех случаях появлялись через 3 нед после вмешательства и позже.
В обеих группах больных наиболее частыми осложнениями были пневмония и легочно-сердечная недостаточность в раннем послеоперационном периоде, очевидно, обусловленные масштабом резекции и операционной травмой.
Непосредственными причинами смерти после традиционных вмешательств у 13 (6,3 %) больных послужили легочно-сердечная недостаточность (у 9), пневмония (у 1) и инфаркт миокарда (у 3). Однако низкий уровень осложнений в группе больных, оперированных из мини-доступа, обусловлен, по-видимому, не особенностями техники, а более тщательным подбором пациентов и меньшей долей расширенных операций, поскольку обычные вмешательства все же производят у больных, наименее подходящих для малоинвазивной хирургии. Во всяком случае, имея столь ограниченный материал, сложно делать на этот счет окончательные выводы.

Примечание. БПС — бронхоплевральный свищ; ПРЭГ —пострезекционная эмпиема гемиторакса; ЛСН—легочно-сердечная недостаточность; ПП — послеоперационная пневмония; ИМ — инфаркт миокарда; ПЛ — послеоперационная летальность.
Продолжительность традиционных операций в нашем исследовании варьировала от 70,0 до 120,0 мин (в среднем 90,0 ± 10,0 мин), операций с видеосопровождением — от 90,0 до 180,0 мин (в среднем 115,0 ± 15,0 мин). Таким образом, продолжительность вмешательств с видеосопровождением не очень отличалась от таковой при традиционных операциях.
Интраоперационные осложнения при выполении операций с видеосопровождением наблюдали в 3 случаях, в 2 из которых возникло кровотечение из нижней легочной вены в момент диссекции, что потребовало расширения мини-доступа до боковой торакотомии, и в одном — кровотечение из межреберной артерии, остановленное электрокоагуляцией. Необходимость в переходе к традиционной торакотомии по техническим причинам (сомнения в распространенности опухолевого процесса, трудности диссекции, показания к расширению масштаба вмешательства) возникла в 5 случаях.
В предыдущих разделах уже говорилось о выраженности послеоперационного болевого синдрома как одного из показателей степени операционной травмы. Среди наших больных, оперированных по поводу рака легкого как традиционно, так и из мини-доступа с видеосопровождением, практически у всех в качестве анальгетика использовали 2 % раствор промедола. Однако после малоинвазивных операций необходимость в подобной аналгезии возникала лишь в 1-е сутки, в то время как после традиционных вмешательств больные нуждались в наркотиках до 3 сут и более. Естественно, чем меньше выражен болевой синдром в послеоперационном периоде, тем более активен пациент и тем меньше вероятность развития легочно-сердечных расстройств. Возможно, этим обстоятельством обусловлено значительно меньшее количество осложнений после операций с видеосопровождением.
Эстетический результат применения малоинвазивной техники несомненен, однако стремление уменьшить доступ в угоду модному течению или из косметических соображений не должно отражаться на адекватности вмешательства, по какому бы поводу оно ни выполнялось. Использование торакоскопии в чистом виде при раке легкого, на наш взгляд, возможно лишь при очень небольших периферических образованиях у больных, которым не показана радикальная операция, и в тех случаях, когда атипичная резекция оправдана тяжестью сопутствующей патологии.
Во всех других ситуациях выполнение адекватного радикального вмешательства, предусматривающего анатомическую резекцию и лимфаденэктомию, с использованием только торакоскопии без торакотомии невозможно по следующим причинам:
- отсутствует возможность пальпации, что препятствует адекватной оценке распространенности процесса;
- при использовании существующих эндостеплеров невозможна полноценная и надежная обработка крупных сосудов корня легкого, долевого и тем более главного бронха;
- многочасовая, порой крайне сложная и рискованная диссекция элементов корня доли или легкого, заканчивающаяся в конечном счете утилитарной торакотомией, ставит под сомнение целесообразность эндоскопических манипуляций и основную идею этой техники — малоинвазивность.
В настоящем разделе мы не проводили сравнения отдаленных результатов, учитывая не очень обширный материал и небольшие сроки наблюдения, а кроме того, не имели цели противопоставить малоинвазивную хирургию традиционной, но лишь стремились показать ее возможности применительно к описываемой патологии.
Традиционная техника в хирургии рака легкого пока остается основным методом, однако, учитывая сказанное выше, применение видеотехнологий выглядит вполне надежной и полноценной альтернативой для многих больных. Существует уверенность, что постепенное накопление опыта, а также прогресс в создании эндоскопических инструментов расширят показания к использованию этого метода.
Таким образом, операции из мини-доступа с видеосопровождением осуществимы при периферическом раке в стадии T1N0—T2N0 и при центральном раке в стадии T1N0—T2N0 в случае отсутствия инвазии опухоли в соседние анатомические структуры. Однако окончательное решение о возможности выполнения операции из мини-доступа с видеосопровождением возможно лишь в процессе полноценной торакоскопической ревизии оперируемой зоны.
А.М. Шулутко, А.А.Овчинников, О.О.Ясногородский, И.Я.Могус
Рак легких: диагноз, а не приговор
Злокачественные новообразования в легких — достаточно обширная группа опухолей, каждая из которых имеет свою излюбленную локализацию, скорость развития и прогноз. Некоторые виды рака способны незаметно расти на протяжении многих лет, другим свойственно молниеносное течение. Тем не менее врачи отмечают и общие свойства у новообразований легочной ткани: так, они действительно чаще обнаруживаются у людей, которые курили на протяжении долгих лет, а также у жителей городов с плохой экологией, у шахтеров и сотрудников вредных производств. Вероятность развития рака легких повышается с возрастом: в группе высокого риска — пожилые люди 50–70 лет.
Примерно каждый седьмой человек в России болеет раком легкого. Мировая статистика тоже неутешительна: по данным Всемирной организации здравоохранения, ежегодно выявляется миллион больных с этим недугом.
Между тем медики уверены, что если бы пациенты обращались к ним своевременно, на 1 и 2 стадиях заболевания, то спасти от смерти можно было бы подавляющее большинство больных. И даже при запоздалой диагностике шансы на выздоровление есть, главное — пройти полноценное обследование и эффективный курс лечения рака легких.
Классификация рака легких упрощает подбор оптимальной лечебной тактики, однако врачи анализируют ситуацию далеко за пределами условных стадий — ведь каждая опухоль и каждый пациент индивидуальны.
В это же самое время в европейских странах, известных прогрессивной организацией здравоохранения, — в Германии, Израиле, Швеции и других — врачи знают, по каким, на первый взгляд неочевидным, признакам можно заподозрить рак легкого на ранних стадиях, как достоверно установить место расположения опухоли и при помощи каких анализов и проб выяснить конкретную разновидность новообразования, чтобы подобрать наилучшую комбинацию лечебных методов.
Когда необходимые данные о заболевании собраны, врач принимает решение о тактике борьбы с раком. Ошибочно думать, что единственным эффективным методом лечения опухоли является хирургическая операция. Однако в некоторых ситуациях онкологи отдают предпочтение химиотерапии, лучевой терапии или новейшим технологиям, которые предоставляют возможность уменьшить объемы новообразования, сохранив при этом легкое.
Хирургическое лечение применяется в ситуациях, когда опухоль имеет четкие границы и может быть удалена одномоментно вместе с ближайшими лимфатическими узлами. Если стадия рака начальная, врачи принимают решение об удалении одной доли легкого (лобэктомия). Однако если у онкологов есть основания подозревать, что злокачественные клетки распространились шире, они предложат удалить сегмент (несколько долей) или все легкое целиком (пульмонэктомия). Бояться такого подхода не нужно — клиническая практика показывает, что пациенты способны жить полноценной активной жизнью и с одним легким. В некоторых случаях, когда надежды на полное исцеление нет, хирурги проводят операцию, направленную на уменьшение объема опухоли и удаление метастазов из жизненно-важных органов.
Некоторые виды рака легкого — например мелкоклеточный рак — растут так быстро, что попытка удалить его при помощи скальпеля почти всегда обречена на неудачу. На помощь приходит химиотерапия: лечение опухолей при помощи лекарств, которые губительны для злокачественных клеток (к сожалению, часто и для здоровых). В некоторых случаях этот метод является единственным, способным помочь больному. В других — химиотерапия сочетается с операцией, позволяя уменьшить объем хирургического вмешательства и исключить рецидив.
Оптимальное решение — индивидуальный подбор препаратов с учетом особенностей протекания заболевания, что возможно лишь после генетического анализа клеток опухоли, извлеченных при биопсии.
Лекарства назначаются курсами, с интервалами в несколько недель (это необходимо, чтобы дать организму оправиться от побочных эффектов). По окончании терапии пациент проходит томографию, чтобы отслеживать, как меняется опухоль под воздействием химиотерапии.
Сочетание этого метода с классической радиотерапией значительно повышает эффективность воздействия последней непосредственно на раковые клетки, вместе с тем максимально снижая губительное влияние радиации на здоровую ткань. Подход позволяет ускорить проведение сеанса радиотерапии в 5 раз.
Этот метод появился в арсенале врачей-онкологов сравнительно недавно. Фотодинамическая терапия представляет собой сеансы воздействия световыми лучами определенной длинны на опухоль, которая предварительно обрабатывается особым лекарством (фотосенсибилизирующим агентом), повышающим чувствительность злокачественных клеток к такому воздействию. Под влиянием лучей новообразование уменьшается в размерах, причем эффект от курса длится в течение нескольких месяцев. Фотодинамическая терапия может использоваться как дополнительный метод лечения рака легких, улучшающий прогноз выздоровления, так и в качестве основной лечебной тактики, для облегчения симптомов заболевания в необратимой стадии.
Несмотря на обнадеживающие результаты научных исследований, врачи по-прежнему не могут гарантировать результат в каждой конкретной клинической ситуации: рак легкого — коварный и терпеливый враг, который иногда реагирует на лечение непредсказуемым образом. Однако и больной, и его родные должны сделать все возможное, чтобы не дать опухоли шанса. Немаловажную роль в прогнозе играет психологический настрой пациента: наградой за целеустремленность, терпение и оптимизм станут счастливые годы жизни без рака.
Читайте также:

