Результат химиолучевой терапии рака прямой кишки

Рак прямой кишки продолжает оставаться одной из наиболее актуальных проблем в современной онкологии. Он занимает положение в десятке наиболее часто встречаемых злокачественных опухолей – 5 место у мужчин и 6–7 место у женщин. Увеличение за последние 10 лет удельного веса колоректального рака в общей структуре злокачественных заболеваний в мире с 9 % до 13 % является очевидным этому подтверждением [2].
Имеются данные об эндо- и экзогенных факторах, оказывающих влияние на весь организм и его подсистемы в концепции канцерогенеза колоректального рака. Отмечено действие на орган-мишень, клеточный аппарат и микроокружение. В дальнейшем развиваются генетические мутации и неконтролируемая пролиферация клеток [8]. Особое значение имеет микроокружение в формировании колоректального рака и роль иммунологического ответа опухоли и макроорганизма [3].
Отправной точкой приложения начальной реализации опухолевых изменений являются эпителиальные клетки слизистой оболочки, разнородные по составу и функции [10]. На подавление опухолевого роста и направлена лучевая терапия. Она способствует также и подавлению циркулирующих опухолевых клеток, значению которых при колоректальном раке в последние годы уделяется большое внимание [4].
Современные технологии лучевой терапии позволяют получить высокий ответ на проводимое лечение (полная регрессия опухоли), уменьшение частоты и интенсивности острых лучевых повреждений: тяжелого раннего токсического мукозита (3–4 степени), использование объемно-модулированной лучевой терапии арками (VMA – Rapid.Arc) позволяет уменьшить время проведения одного сеанса лучевой терапии по сравнению с IMRT с 20 до 3–5 минут [6]. Химиолучевое лечение в предоперационном периоде приводит к увеличению сфинктеросохраняющих операций без увеличения числа послеоперационных осложнений, возможность получить в ряде наблюдений (до 16,6 % пациентов) полный гистологический ответ [9].
Работы последних лет убеждают, что при облучении в режиме динамического фракционирования дозы наблюдали менее выраженные лучевые реакции, как во время лечения, так и при его завершении. Повышение суммарной дозы с добавлением радиомодификаторов увеличивает частоту полных ответов при приемлемом уровне токсичности. При этом отмечено уменьшение болевого синдрома, купирование кровотечений [1,5].
Подход к лечению рака прямой кишки является мультидисциплинарным. Хирургия рака прямой кишки включает в последние годы следующие моменты: сохранение функции без ухудшения онкологических результатов и применение все более расширенных хирургических вмешательств. Лучевая или химиолучевая терапия при различных методиках фракционирования убедительно доказывает свою целесообразность [7].
Все вышеизложенное дало основание провести исследование по сопоставлению результатов лечения пролонгированной лучевой терапии и короткого курса.
Целью исследования явился анализ результатов предоперационной лучевой терапии рака прямой кишки при пролонгированном и коротком курсе.
Для решения вопроса о преимуществах короткого и пролонгированного курса лучевой терапии нами были проанализированы ретроспективные данные о 119 пациентах с резектабельным локализованным и местно-распространенным раком прямой кишки, прошедшим лечение в РНИОИ с применением современных технологий с 2013 по 2015 год.
Были поставлены следующие задачи:
- изучить переносимость пациентами лечения;
- сравнить объемы хирургических вмешательств и число послеоперационных осложнений;
- изучить непосредственные и отдаленные результаты лечения.
Больные были разделены на две группы: 67 пациентам проведена предоперационная пролонгированная химиолучевая терапия и 52 пациентам проведен предоперационный короткий курс лучевой терапии (РОД 5 Гр, 5 фракций, СОД 25 Гр). Распределение больных по полу и возрасту было сопоставимо. В группе с пролонгированным курсом ЛТ превалировали пациенты с пораженными л/узлами – почти 63 %. По гистологическому типу опухоли были представлены в большинстве случаев умеренно дифференцированной аденокарциномой. Проводилась оценка переносимости данных вариантов лечения.
Результаты и их обсуждение. В период проведения неоадъювантного лечения все пациенты удовлетворительно переносили назначенный курс, во всех случаях ЛТ была завершена в запланированном объеме. После окончания пролонгированного курса лучевые реакции наблюдались чаще и были более выраженными: в 64 % после пролонгированного курса и в 36,5 % после короткого. Однако через 6–8 недель наблюдалось купирование реакций и непосредственно к операции больные подходили с минимальным количеством их проявлений и отмечались реже в два раза, чем после короткого курса. При оценке лейкопении и анемии, в группе с пролонгированным курсом больные исходно были с худшими показателями крови: 15 % и 5,8 % соответственно. Но на фоне сопроводительной терапии и уменьшении кровотечений из прямой кишки на конец лечения состояние больных не ухудшилось. А после перерыва лейкопения и анемия III степени не отмечены. Клинический эффект от проводимой ХЛТ выражался, как правило, в значительном уменьшении, а в ряде случаев полном исчезновении, клинических симптомов опухолевого поражения прямой кишки. Наибольшая положительная динамика отмечена в группе с пролонгированным курсом в виде уменьшения болей и уменьшения кровянистых выделений. Одной из основных целей пролонгированного курса ХЛТ являлось уменьшение размеров опухоли прямой кишки.
При выполнении эндоскопического исследования после проведения пролонгированной лучевой терапии через 6–8 недель отмечалось уменьшение экзофитного компонента опухоли, вплоть до образования язвы, уменьшения протяженности опухоли и увеличение диаметра просвета прямой кишки. В группе с коротким курсом отмечался отек слизистой оболочки и незначительное уменьшение опухоли.
В группе больных с раком прямой кишки, которым проводилась пролонгированная лучевая терапия, протяженность опухоли уменьшилась в 1,7 раза. Расстояние от ануса до нижнего края опухоли увеличилось с 6,3 см до 7,6 см. А при проведении короткого курса лучевого лечения протяженность опухоли и расстояние до нижнего края опухоли остались прежними или изменения расстояния не происходило. В группе с локализацией опухоли в нижнеампулярном отделе после пролонгированного курса лучевой терапии в процессе лечения медиана расстояния от Z-линии увеличивалась в 2,5 раза, что давало возможность обеспечить условия для выполнения большего числа сфинктерсохраняющих вмешательств. По данным МРТ-исследования лечебный патоморфоз выражался в виде уменьшения опухоли и нарастания фиброзной ткани, увеличение расстояние от края опухоли до мезоректальной фасции, в сокращении метастатических л/у. При оценке клинических результатов по данным МРТ-исследования через 6–8 недель после завершения ХЛТ полный клинический регресс был достигнут у 14,9 % пациентов. Частичный регресс выявлен в 56,7 % случаев, стабилизация в 28,4 %. После завершения курсов лучевой терапии, как пролонгированной, так и короткофокусной выполняли оперативные вмешательства. При сравнении объемов оперативного вмешательства у больных с локализацией опухоли в нижнеампулярном отделе сфинктеросохраняющие операции в группе с пролонгированной химиолучевой терапией были выполнены в 26 % случаев, в группе с коротким курсом в 6 %. В процессе выполнения хирургического этапа лечения каких-либо особенностей в сравниваемых группах не отмечено. При анализе особенностей послеоперационного периода общее количество осложнений в сравниваемых группах практически не отличалось – 15,6 % и 13,5 % соответственно.
Таким образом, проведение различных вариантов предоперационного лечения не выявило различий влияния на течение репаративных процессов. Доказательством проводимой терапии явилось морфологическое исследование операционного материала. Морфологические изменения в группе больных с коротким курсом сводились к некробиотическим и дистрофическим процессам в опухоли, незначительной десмопластической реакции стромального компонента. Сохранялся высокий пролиферативный (Ki-67) и апоптический (p 53) потенциал опухоли. Патоморфоз опухоли на проводимое лечение I–II степени достигал 95 %.
Длительный курс ХЛТ вызывал в опухоли значительные изменения, которые заключались в некробиотических и дистрофических и апоптатических процессах, выраженной воспалительной реакции, обширных очагах развития фиброзной ткани на месте опухоли, замещающей паренхиматозный компонент. Маркер пролиферативной активности Ki 67 и апоптотический индекс Р53 были снижены (рис.1).
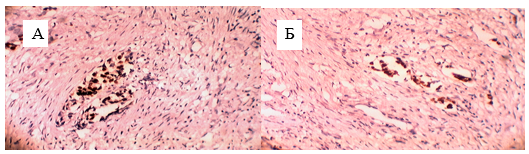
Рис. 1. Патоморфоз после пролонгированного курса: А – экспрессия Ki-67,
Б – экспрессия Р 53
В фиброзной ткани наблюдали образование петрификатов. (рис. 2). Патоморфоз достигал IV степени в 17 % наблюдений и в 72 % случаев – III степени.
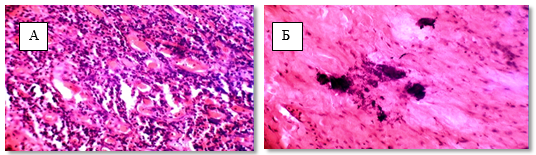
Рис. 2. Патоморфоз после пролонгированного курса: А – 4 степень стромальный компонент, Б – 4 степень петрификаты
Учитывая сроки проведения операции после крупных фракций, незначительное повреждающее действие лучевой терапии, была проведена ДНК-цитометрия.
Исследование ДНК-цитометрии удаленных во время операции опухолей прямой кишки, показало значительное снижение злокачественного потенциала опухоли после крупнофракционной лучевой терапии, определяемое по достоверному снижению темпа пролиферации клеток опухоли вследствие снижения доли клеток в S-фазе и снижению в 1,6 раза индекса пролиферации опухоли.
После пролонгированной лучевой терапии не обнаружено столь выраженных изменений при ДНК-топометрическом анализе, что, вероятно, обусловлено исследованием через 6–8 недель после окончания лечения. К этому времени, по всей видимости, уже происходит восстановление пролиферативной активности оставшихся после лучевой терапии опухолевых клеток. Эти данные свидетельствуют о недопустимости превышения интервалов между этапами лечения.
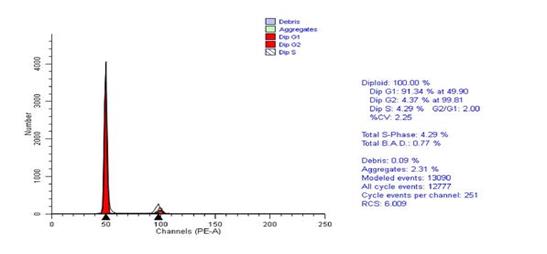
Рис.3. Гистограмма распределения по фазам клеточного цикла. Короткий курс
о недопустимости превышения интервалов между этапами лечения.
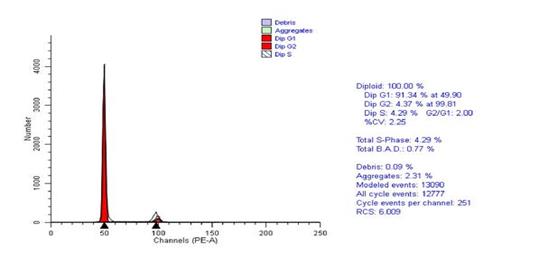
Рис. 4. Гистограмма распределения по фазам клеточного цикла. Пролонгированный курс
Общее число рецидивов в группе с пролонгированной ЛТ составило 6,25 %, в группе с коротким курсом 6,5 %.
Больше половины рецидивов в обеих группах составили опухоли, локализующиеся в нижнеампулярном отделе. Из пациентов с опухолями нижнеампулярного отдела в группе с пролонгированной лучевой терапией (27 пациентов) отмечено 7,4 % рецидивов. В группе с коротким курсом лучевой терапии в 11,8 % случаев отмечены рецидивы с опухолями нижнеампулярного отдела в сроки от 12 до 15 месяцев. В этих наблюдениях у больных были опухоли с исходными метастазами в регионарных л/у. Отдаленные метастазы были диагностированы у 4,7 % пациентов в группе с ПЛТ, у 6,5 % в группе с КЛТ в сроки от 13 до 35 месяцев. Все пациенты имели подтвержденные исходно метастазы в регионарных лимфатических узлах.
Несмотря на тенденцию к увеличению применения неоадъювантной пролонгированной ХЛТ, короткий курс лучевой терапии не дает худшие результаты лечения. Последнее обстоятельство находит свои доказательства в отсутствии существенных различий в показателях безрецидивной выживаемости и отдаленного метастазирования, послеоперационных осложнений. Дифференцированное применение того или иного подхода зависит от целей предоперационного лечения.
Заключение. Таким образом, проведенное исследование позволяет сделать следующее заключение о целесообразности применения того или иного курса предоперационного лечения.
Пролонгированная лучевая терапия показана:
- Пациентам с опухолями, требующим регресса.
- Пациентам с опухолями, локализующимися в нижнеампуллярном отделе, так как дает возможность проведения сфинктеросохраняющих операций и отмечается меньшее количество рецидивов при данной локализации.
- Пациентам с Т4, а также при пораженных лимфатических узлах с любым Т.
Короткий курс крупнофракционной лучевой терапии показан:
- Пациентам с опухолями Т3N0, не требующим регресса, когда предоперационной лечение не может повлиять на объем хирургического вмешательства.
- Пациентам, которым невозможно проведение пролонгированного курса.
Определение понятия
Одновременная химиолучевая терапия - это одновременное применение лучевой терапии и химиотерапии. В отличие от комбинированной терапии, в которой эти методы используются последовательно (= один за другим), одновременное применение данных двух методов лечения позволяет использовать дополнительные эффекты, которые являются результатом их тесного временного взаимодействия .
Теоретические основы
Из клинических и экспериментальных исследований можно определить следующие преимущества одновременной химиолучевой терапии по сравнению с однократной лучевой терапией или химиотерапией или последовательной комбинацией обоих методов (таблица 1):
- Лучевая и химиотерапия имеют разные цели на клеточном уровне . Менее радиочувствительные клетки, которые пропускают лучевую терапию, теоретически могут быть уничтожены посредством химиотерапии и наоборот .
- Некоторые цитостатики при их одновременном применении с облучением оказывают радиосенсибилизирующее действие: в дополнение к их независимой цитотоксичности они усиливают эффект лучевой терапии в опухолевой ткани . Экспериментально этот эффект хорошо доказан, особенно на относительно нечувствительных к радиации гипоксических клетках . Радиосенсибилизация может иметь большое значение при комбинации облучения с определенными цитотоксическими агентами, такими как Цисплатин, 5-фторурацилили Таксол . Однако специфическая радиосенсибилизация в конечном итоге может быть четко продемонстрирована только в условиях in vitro. Играет ли она также значительную роль в клинической картине, пока не доказано.
- В случае быстро пролиферирующих опухолей важно вводить цитотоксическое лечение в максимально короткие сроки, чтобы противодействовать ускоренному клеточному делению (репопуляции), происходящему в опухоли во время терапии . При одновременном сочетании лучевой терапии и химиотерапии оба метода лечения применяются в очень короткий общий период лечения. Эта интенсификация, вероятно, играет особенно важную роль . Превосходство одновременной и последовательной химиолучевой терапии (последовательное проведение лучевой и химиотерапии) было недавно продемонстрировано на примере плоскоклеточного раке области головы и шеи в мета-анализах всех рандомизированных исследований, а в этих опухолях скорость роста особенно высока .
Исходя из этих соображений, можно выделит конкретные условия, при которых одновременная химиолучеваятерапия (ХЛТ) кроме лечебной цели имеет еще и теоретическую целесообразность:
- вероятность определенного локального контроля опухоли при проведении только лучевой терапии ограничена ,
- гистологически опухоль является чувствительной к воздействию радио- и химиотерапии ,
- (потенциальная) скорость роста опухоли достаточно высока ,
- применяемые химиотерапевтические агенты хорошо сочетаются с лучевой терапией в плане токсичности .
Как гистологический объект, плоскоклеточный рак и уротелиальный рак, в частности, соответствуют этим требованиям . Плоскоклеточный рак относительно чувствителен к воздействию лучевой терапии и реагирует на различные цитотоксические агенты. Кроме того, они часто имеют высокие темпы роста; потенциальное время удвоения таких опухолей в области головы и шеи составляет, например, в среднем всего 4,5 дня. Многочисленные клинические данные показывают, что скорость излечения этих опухолей зависит от продолжительности лечения, и что улучшение эффективности лечения за счет сокращения общего времени лечения может улучшить локальный контроль опухоли.
Радиобиологические эффекты одновременной химиолучевой терапии
Эффект
Радиационно-биологическое обоснование
Клиническое значение
Аддитивный противоопухолевый эффект
Больший цитотоксический эффект за счет добавления отдельных эффектов лучевой терапии и химиотерапии
Различные точки атаки
Химиотерапия убивает радиорезистентные клетки и наоборот
Химиотерапия может повышать интенсивность внутриклеточного облучения, в частности, например, в гипоксических клетках
Побочные эффекты распространяются на разные системы органов, следует избегать токсических доз соответствующих методов лечения
Интенсификация благодаря более короткому общему времени лечения по сравнению с последовательным проведением химиолучевой терапии
Влияет на пролиферацию опухоли (репопуляцию) во время нескольких недель лучевой- или химиолучевой терапии
Протоколы лечения для одновременной химиолучевой терапии
Основой протоколов клинического лечения обычно является режим лучевой терапии с дозой облучения в диапазоне от 50 до 60 Грей. Следует избегать соответствующего снижения дозы облучения, поскольку химиотерапия не может заменить лучевую терапию. Одновременно с лучевой терапией выполняются инъекции одного или двух цитостатических средств, которые являются наиболее эффективными в соответствующей опухолевой структуре, их вводят в эффективной дозировке, которая также является обычной в случае проведения только химиотерапии. В течение нескольких недель лучевой терапии обычно могут быть проведены два или три курса химиотерапии. При этом выбор наименования и дозировки цитостатиков проходит таким образом, что нет необходимости достигать соответствующих компромиссов в лучевой терапии, являющейся основным терапевтическим элементом.
Клинические результаты и текущий спектр показаний
Первым опухолевым заболеванием, при котором было предпочтительной одновременная химиолучевая терапия, была плоскоклеточная карцинома анального канала. Одновременная ХЛТ дает те же результаты в отношении выживаемости при анальных карциномах, что и радикальная операция с удалением прямой кишки и наложением стомы . Тем не менее, в отличие от операции она способна поддерживать функцию мышцы сфинктера примерно у 80 процентов пациентов и позволяет избежать искусственного выведения кишечника. Только около 20 процентов пациентов, несмотря на первоначальное успешное консервативное лечение, вынуждены в дальнейшем перенести радикальную операцию в результате рецидивов. Превосходство одновременной химиолучевой терапии основано на возможности сохранения функций органа или самого органа . Сходная ситуация наблюдается при локально прогрессирующих карциномах мочевого пузыря.
При таких опухолях (обычно категории T3-4) при одновременной химиолучевой терапии полная ремиссия может достигаться в более 70% случаев. В ходе клинических исследований, проведенных до настоящего времени, п оказатели пятилетней выживаемости были такими же, как и после радикальной цистэктомии, при этом примерно три четверти всех пациентов смогли сохранить функционирующий мочевой пузырь .
Одновременная химиолучевая терапия не только улучшает локальный контроль над опухолью и функциональный результат при некоторых типах опухолей, но также, по-видимому, улучшает показатели выживаемости. Это особенно касается неоперабельного плоскоклеточного рака полости рта и горла. Одновременная химиолучевая терапия приводит к значительно более высоким показателям локального контроля опухоли по сравнению с только лучевой терапией, которая до настоящего времени была стандартным методом лечения .
Поскольку при этих заболеваниях отдаленные метастазы встречаются редко, а местное рецидивирование часто является единственной причиной неэффективности терапии, повышение выживаемости также является результатом улучшения местного контроля опухоли . Большое исследование в Германии недавно снова подтвердило этот факт (Таблица 2).
Даже при неоперабельных карциномах пищевода эффективность одновременной химиолучевой терапии превосходит эффективность только лучевой терапии, хотя она также связана со значительно более высоким риском, чем паллиативное облучение, из-за часто значительно ухудшенного общего состояния у таких пациентов . Многочисленные исследования в настоящее время изучают, возможно ли достичь более благоприятных результатов лечения при карциноме пищевода с помощью окончательной или предоперационной химиолучевой терапии, чем с помощью хирургического вмешательства или только лучевой терапии.
Показание к одновременной химиолучевой терапии имеется также при карциномах прямой кишки на II и III стадии (рТ3-4 или поражение лимфатических узлов) после операции или в качестве предоперационной терапии при неоперабельных карциномах прямой кишки . Обзор текущего спектра показаний представлен в таблице 3.
Комбинации лучевой и химиотерапии являются предпочтительным лечением для многих других опухолей, тем не менее, отдельные методы лечения обычно применяются последовательно . Имеется опыт одновременного проведения ХЛТ при бронхиальной карциноме, прогрессирующем раке молочной железы и рецидиве рака молочной железы и шейки матки, недифференцированной саркоме мягких тканей и различных саркомах у детей . О днако при этих злокачественных опухолях все еще неясно, дает ли одновременная ХЛТ преимущества по сравнению с прежней методикой лечения с последовательным проведением указанных видов терапии или следует продолжать применять две терапевтические методики одну за другой с учетом их токсичности .
Превосходство одновременной химиолучевой терапии с применением Цисплатина / 5-фторурацила по сравнению с применением только лучевой терапии при локально прогрессирующих плоскоклеточных карциномах в области головы и шеи
Только лучевая терапия
Одновременная химиолучевая терапия
Клиническая значимость
Локальный контроль опухоли через три года
p Трехлетняя выживаемость
p Результаты рандомизированного исследования отдела радиационной онкологии Немецкого общества борьбы с раковыми заболеваниями (Вендт и др., 1997)
Побочные эффекты и поддерживающая терапия
Одновременное сочетание лучевой терапии и химиотерапии приводит к более острым побочным эффектам, но они часто распределяются между различными системами органов . Лучевая терапия может привести к острым побочным эффектам в пролиферативно-активных органах в области облучения (тканях, которые регулярно обновляются) и особенно острым реакциям со стороны кожи и слизистых оболочек. Напротив, острые побочные эффекты системной химиотерапии проявляются при вышеназванных онкологических заболеваниях и препаратах преимущественно в органах вне поля облучения . Только это распределение токсичности позволяет одновременно комбинировать две высокоэффективные терапии .
Тем не менее, одновременная ХЛТ может вызвать серьезные побочные эффекты из-за взаимного усиления токсичности каждого их методов лечения в данной комбинации . Например, локальное воспаление слизистой оболочки в области облучения может иметь более серьезное течение и более легко приводить к вторичным осложнениям (например, суперинфекции) при наличии у пациента лейкопении, связанной с химиотерапией . Поэтому предпосылкой для проведения одновременной ХЛТ является не только корректно установленное показание опытного радиоонколога совместно с онкологами-терапевтами и онкологами-хирургами с учетом индивидуальной пользы (лучший контроль опухоли) и риска (повышенная частота побочных эффектов), но и всестороннее медицинское наблюдение со стороны команды онкологов. Потенциальные побочные эффекты, которые могут препятствуют проведению лечения по установленной временной схеме, необходимо предотвращать или своевременно выявлять и устранять их .
Следовательно, по всем правилам лечение должно проводиться в условиях стационара. Часто требуется проведение профилактической поддерживающей диетотерапии посредством эндоскопической гастростомии (ПЭГ), мероприятий по защите слизистой оболочки и применение гематопоэтических факторов роста. В таких условиях риск летального исхода вследствие одновременной химиолучевой терапии составляет от одного до трех процентов, в зависимости от характеристики опухоли . Это благоприятное количество по сравнению с риском смертности от других видов куративной терапии в соответствующей группе пациентов.
Среди прочего, значительный риск одновременной ХЛТ является следствием ее высокой эффективности, поскольку терапевтический эффект и достигаемое в результате этого уплощение опухоли иногда происходят так быстро, что возникают перфорации или кровотечение . Следовательно, в отдельных случаях, например, при раке пищевода с трахеальной инфильтрацией, одновременная ХЛТ может быть противопоказана, так как в противном случае успешная терапия может привести к опасному для жизни осложнению, такому как пищеводно-трахеальная фистула . Согласно современному уровню знаний, при одновременной ХЛТ не следует ожидать значительного увеличения периода выраженности хронических последствий терапии по сравнению с только лучевой терапией. П оскольку цитостатическое лечение клеток, ответственных за возникновение поздних последствий лучевой терапии (фибробласты, капиллярный эндотелий), почти не влечет за собой значимых долгосрочных эффектов, значительного повышения риска поздних последствий даже теоретически ожидать не стоит.
Согласно имеющимся в настоящее время клиническим данным, по крайней мере, при установленных показаниях (таблица 3) повышенный риск поздних эффектов отсутствует, тем не менее, в данной связи необходимы дальнейшие долгосрочные наблюдения.
Показания к одновременной химиолучевой терапии (ХЛТ), согласно действующим рекомендациям Немецкого общества борьбы с раковыми заболеваниями
Вид опухоли/стадия
Эффект одновременной ХЛТ
Дополнительные методы лечения
Доза облучения
(Гр) /цитостатики
Анальные карциномы, все стадии (плоскоклеточная карцинома, базалоидная карцинома)
Выживаемость, как при радикальном хирургическом лечении, сохранение сфинктера примерно у 80%
Удаление прямой кишки при наличии остаточной опухоли или при рецидиве
около 50Гр / Митомицин С + 5-фторурацил
Прогрессирующие плоскоклеточные карциномы в полости рта и в горле (T3-4 или N3)
Лучшая выживаемость, чем при проведении только лучевой терапии, сохранение органов более чем в 90% случаев
В отдельных случаях операция по поводу остаточной опухоли или рецидива
60-70 Гр / Цисплатин + 5-фторурацил
Локально прогрессирующие карциномы прямой кишки (T4)
Предоперационно для уменьшения размеров опухоли для последующего куративного хирургического лечения
В основном резекция / экстирпация прямой кишки после химиолучевой терапии
Локально прогрессирующие карциномы прямой кишки pT3-4 или pN1-3 после куративного хирургического лечения
Улучшение выживаемости и более оптимальный локальный контроль опухоли с помощью послеоперационной ХЛТ
Дополнительная химиотерапия с 5-фторурацилом до / после ХЛТ
Неоперабельные карциномы мочевого пузыря T3-T4
Выживаемость как при радикальной операции, сохранение мочевого пузыря примерно в 70% случаев
Необходима радикальная цистэктомия при наличии остаточной опухоли или при рецидиве
54-60 Гр / Цисплатин
Неоперабельные карциномы поджелудочной железы
Наиболее эффективная терапия при неоперабельности
Выводы
В целом, результаты клинических исследований, проведенных до настоящего времени, показывают, что при некоторых онкологических заболеваниях оптимальная комбинация лучевой терапии и химиотерапии может обеспечить успешный исход терапии.
Такое оптимизированное лечение может принести пользу пациенту в отношении более высокой выживаемости и/или лучшего качества жизни (сохранение функции органов) . В дополнение к необходимым техническим и профессиональным требованиям, решающую роль в этой терапии играет тесное междисциплинарное сотрудничество специалистов в области онкологии.
- Необходимый объем исследований
- Противопоказания к химиотерапии
- Показания к химиотерапии
- Лечение рака прямой кишки по стадиям
- Виды химиотерапии
- Таргетная терапия при раке прямой кишки
- Осложнения и методы их предотвращения
Хотя ведущим методом лечения при раке прямой кишки является хирургическая операция, химиотерапия применяется в рамках комбинированного лечения при местнораспространенных и метастатических формах заболевания. Она преследует следующие цели:
- Системное воздействие на опухоль с целью уничтожения/уменьшения метастазов, в том числе микрометастазов, которые могут пока никак не обнаруживаться.
- Приостановить рост опухоли на максимальный период.
- Перевести неоперабельные опухоли в резектабельное состояние для последующей попытки радикального удаления.
Долгое время для химиотерапевтического лечения рака прямой кишки применялся 5-фторурацил. Он и сегодня не утратил своей актуальности, но применяют его совместно с препаратами других групп:
- Препараты платины третьего поколения — оксалиплатин.
- Антагонисты пиримидинов — капецитабин.
- Капмтотецины — иринотекан.
Необходимый объем исследований
Перед началом лечения необходимо установить стадию заболевания и тип злокачественного новообразования, поскольку от этого будет зависеть тактика ведения пациента. Необходимо проведение комплексного обследования, включающего в себя следующие процедуры:
- Тотальная колоноскопия, а при ее невозможности ректо- и сигмоскопия. Позволяют визуализировать опухоль, оценить риск развития осложнений (перфорация, кровотечение) и взять материал для гистологии. Без данных этого анализа не рекомендуется начинать планирование лечения.
- МРТ органов малого таза позволяет определить глубину инвазии опухоли и состояние регионарных лимфатических узлов. Данное исследование необходимо для планирования хирургического и химиолучевого лечения.
- КТ органов брюшной и грудной полости — поиск отдаленных метастазов.
- УЗИ брюшной полости, проводится с аналогичной целью.
- Определение уровня онкомаркеров СА 19-9 и РЭА. Необходимо для оценки эффективности лечения, контроля рецидива и прогрессирования заболевания.
Также полученный опухолевый материал подвергается иммуногистохимическому и молекулярно-генетическому исследованию для решения вопроса о необходимости назначения дополнительных таргетных препаратов.
Противопоказания к химиотерапии
- Гиперчувствительность к химиопрепаратам.
- Уровень лейкоцитов ниже 5*10 9 для 5ФУ и ниже 2 для оксалиплатина, количество тромбоцитов меньше 10*10 10 .
- Печеночная и почечная недостаточность.
- Сепсис и другие тяжелые системные инфекции.
- Беременность. И кормление грудью.
- Наличие периферической сенсорной нейропатии до начала химиотерапевтического лечения с помощью оксалиплатина.
Показания к химиотерапии
Химиотерапия проводится, когда необходимо решить следующие задачи:
- Уменьшение объема опухоли на предоперационном этапе.
- Уничтожение оставшихся злокачественных клеток после оперативного лечения, в том числе микрометастазов.
- Приостановление роста злокачественного новообразования.
- Снижение риска рецидива и прогрессирования рака прямой кишки.
Лечение рака прямой кишки по стадиям
При первой стадии рака прямой кишки проводятся органосохраняющие щадящие операции. Химиотерапия не показана.
При 2 стадии проводят хирургическое лечение в объеме резекции или экстирпации прямой кишки совместно с удалением параректальной клетчатки и регионарных лимфатических узлов. Если при последующем гистологическом исследовании обнаруживаются опухолевые клетки в краях отсечения и удаленных лимфатических узлах, лечение дополняют химиолучевой терапией с фторпиримидинами. Адъювантная (предоперационная) химиотерапия не показана.
Лечение рака прямой кишки 3 стадии начинается с адъювантной химиолучевой или лучевой терапии и только через 6-8 недель после окончания первого этапа решается вопрос о хирургической операции. При локализованных опухолях проводят радикальные операции. При изначально неоперабельных опухолях делается попытка радикального лечения, или проводят паллиативные операции, паллиативную химиотерапию или продолжают лучевую терапию.
Лечение 4 стадии рака прямой кишки будет зависеть от количества, размеров и места локализации отдаленных метастазов. При единичных резектабельных метастазах возможно проведение радикальной операции. В остальных случаях назначается химиотерапия и после нескольких курсов оценивается состояние опухоли и делается попытка ее удаления. Если это невозможно, проводят поддерживающее и симптоматическое лечение.
Виды химиотерапии
Адъювантная или профилактическая химиотерапия применяется после радикальной операции при местнораспространенных опухолях, а также при наличии регионарных метастазов. Продолжительность такого лечения должна составлять не менее 6 месяцев.
Минимальным вариантом адъювантной химиотерапии при раке прямой кишки являются схемы, включающие в себя фторпиримидины. В основном применяется схема клиники Мейо, которая предполагает применение лейковарина с фторурацилом. Препараты вводятся в течение 5 дней, после чего делают перерыв. Следующий курс начинают на 29 день. Также используются другие схемы лечения с увеличенным содержанием лейковарина и 5-фторурацина (Roswell Park, AIO, модификации LV5FU или De Gramont).
Оптимальным вариантом адъювантной химиотерапии является назначение оксалиплатина с фторпинимидинами по режимам FOLFOX (оксалиплатин, лейковарин, 5-фторурацил) или XELOX (оксалиплатин и капецитабин). Если на фоне данного лечения развиваются симптомы нейротоксичности, препараты платины отменяют и лечение продолжают монотерапией фторпиримидинами.
На этапе адъювантной химиотерапии таргетное лечение моноклональными антителами не проводится.
Неоадъювантная химиотерапия рака прямой кишки показана при лечении метастатических и диссеминированных форм заболевания. Хирургическое удаление метастазов существенно улучшает прогноз больных и увеличивает пятилетнюю выживаемость до 30-40%, а при радикальном удалении этот показатель увеличивается до 60%.
К сожалению, радикальные операции на 4 стадии можно провести лишь 10-20% больных, в остальных случаях процесс неоперабельный. Чтобы помочь таким пациентам, назначают неоадъювантную химиотерапию. Ее целью является повышение резектабельности опухоли и/или продление жизни больному. В рамках неоадъювантной химиотерапии используются комбинации FOLFOX, XELOX, FOLFIRI.
При изначально резектабельных опухолях используются следующие тактики:
- Хирургическое удаление метастазов с последующей химиотерапией по режиму FOLFOX или XELOX.
- Периоперационная химиотерапия. Сначала идет три месяца химиотерапии, затем удаление метастазов, а потом еще 3 месяца химии.
Если метастазы нерезектабельны, или потенциально резектабельны, проводится химиотерапия по режимам FOLFOX, XELOX, FOLFIRI (иринотекан, лейковарин, 5-ФУ) до перевода метастазов в резектабельное состояние. Если не выявлены мутации в гене RAS, к первым двум схемам возможно добавление таргетных анти-EGFR препаратов.
Также для улучшения качества лечения могут применяться следующие варианты:
- Добавление к двухкомпонентных химиотерапевтическим схемам бевацизумаба (без учета мутации RAS).
- Применение тройной комбинации FOLFOXIRI, в ряде случаев ее усиливают моноклональными антителами. Однако такой режим довольно токсичен и требует тщательного контроля.
Интенсивные курсы химиолучевой терапии (ХЛТ) могут стать альтернативой хирургической операции у пациентов с локализованной и местнораспространенной опухолью прямой кишки. Пока такое лечение не утверждено в протоколах, но ведутся клинические испытания (IWWD) направленные на изучение данного вопроса и расширение показаний для безоперационной терапии.
В настоящее время ХЛТ применяться в рамках комбинированного лечения, на дооперационном или послеоперационном этапе. Проводится дистанционная лучевая терапия в разовой дозе 2 Гр до суммарной очаговой дозы на зону регионарных метастазов 44 Гр, на опухоль 50-60 Гр, в зависимости от локализации и степени распространения опухоли. Облучение проводится курсами по 5 дней с перерывом в 2 дня. Параллельно с этим проводится химиотерапия фторпиримидинами (монотерапия), или совместно с оксалиплатином.
Таргетная терапия при раке прямой кишки
Таргетная терапия — это лечение, основанное на воздействии на молекулярные мишени, которые играют ключевую роль в патогенезе злокачественного новообразования. Таких мишеней известно очень много. В рамках лечения рака прямой кишки наибольший интерес представляют ингибиторы эпидермального фактора роста EGFR и сосудистого фактора роста.
Рецепторы EGFR располагаются на клеточных мембранах и при контакте с эпидермальным фактором роста запускают каскад химических реакций, которые регулируют процессы клеточного роста и размножения. Если блокировать этот рецептор с помощью антител, передача сигнала станет невозможной, и процесс пролиферации остановится.
Такими блокаторами при лечении рака прямой кишки выступают два препарата: цетуксимаб и панитумумаб. Их назначение улучшает ответ опухоли на химиотерапию и увеличивает время до прогрессирования рака.
Однако такое лечение показано не всем. Например, при мутации в гене KRAS, в большом количестве начинают синтезироваться сигнальные молекулы, которые занимают промежуточное положение при передаче сигнала от рецептора EGFR до ядра, поэтом его блокирование не приведет к улучшению ситуации. Поэтому при наличии данной мутации, лечение антителами к EGFR не показано.
Второй мишенью является сосудистый фактор роста. Опухоль стимулирует рост кровеносных сосудов за счет выделения большого количества эндотелиального фактора роста. Бевацизумаб блокирует его и нарушает рост новых кровеносных сосудов, тем самым лишает опухоль полноценного питания и способности к гематогенному метастазированию.
Осложнения и методы их предотвращения
- Тошнота и рвота. Для предотвращения и купирования этих проявления назначаются различные антиэметики, например, дексаметазон, блокаторы серотонина и др.
- Диарея. Для восполнения жидкости назначается регидратационная терапия, для купирования диареи применяются препараты, действующие на моторную функцию кишечника (лоперамид, аттапульгит), для уменьшения болевого синдрома используются спазмолитики и анальгетики.
- Мукозит — специфическое воспаление полости рта. Для его устранения используются дезинфицирующие растворы местного действия, обволакивающие и ранозаживляющие средства, а также анальгетики.
- Миелотоксичность. При существенном угнетении кроветворения необходима коррекция доз цитостатиков.
- Дерматотоксичность, которая проявляется в виде очагов сыпи, гиперпигментации или зуда. Также может быть ладонно-подошвенный синдром, с покраснением, отеком и зудом кожи рук и стопы. При развитии такого осложнения требуется снижение дозы химиотерапевтических препаратов или их отмена.
Критериями эффективности химиотерапии является уменьшение размеров опухоли по данным объективного обследования: КТ, МРТ, УЗИ.
Читайте также:

