Протоколы лечения острого миелобластного лейкоза
Медицинский эксперт статьи

Общая стратегия лечения острого миелобластного лейкоза
В современной гематологии терапию лейкозов, в том числе и острого миелобластного, необходимо проводить в специализированных стационарах по строгим программам. Программа (протокол) включает перечень необходимых для диагностики исследований и жёсткий график их проведения. После завершения диагностического этапа пациент получает лечение, предусмотренное этим протоколом, с жёстким соблюдением сроков и порядка элементов терапии. В настоящее время в мире существуют несколько ведущих исследовательских групп, анализирующих диагностику и лечение острого миелобластного лейкоза у детей в мультицентровых исследованиях. Это американские исследовательские группы CCG (Children's Cancer Group) и POG (Pediatric Oncology Group), английская группа MRC (Medical Research Council), немецкая группа BFM (Berlin-Frankfurt-Miinster), японская CCLG (Children's Cancer and Leukemia Study Group), французская LAME (Leucamie Aique Mycloi'de Enfant), итальянская AIEOP (Associazione Italiana Ematologia ed Oncologia Pediatric) и др. Результаты их исследований - основные источники современных знаний о диагностике, прогнозе и лечении острого миелобластного лейкоза у детей.
Основная цель лечения - эрадикация лейкемического клона с последующим восстановлением нормального гемопоэза.
Первый этап - индукция ремиссии. Для прогноза важна оценка чувствительности к терапии после проведения индукционного курса. Окончательную оценку, согласно большинству протоколов, проводят после двух курсов лечения.
Постремиссионная терапия должна состоять не менее чем из трёх блоков. Это может быть только химиотерапия или химиотерапия с последующей аутологичной или аллогенной трансплантацией гемопоэтических стволовых клеток. Некоторые терапевтические режимы включают поддерживающую терапию. Важный элемент - профилактика и лечение поражений ЦНС путём интратекального введения цитостатических препаратов, системной высокодознои терапии, а иногда и краниального облучения. Основной препарат для интратекальной терапии при остром миелобластном лейкозе - цитозин-арабинозид, в некоторых протоколах дополнительно используют преднизолон и метотрексат.
Современная терапия острою миелобластного лейкоза должна быть дифференцированной, т.е. различной по интенсивности (а значит, и по токсичности) в зависимости от группы риска. Кроме того, лечение должно быть настолько специфичным, насколько это возможно.
Терапия индукции
Цитотоксическая терапия острого миелобластного лейкоза вызывает транзиторную, но тяжёлую миелосупрессию с высоким риском инфекций и геморрагических осложнений. Спектр цитостатических препаратов, эффективных в отношении острого миелобластного лейкоза, достаточно невелик. Базовые препараты - цитозин-арабинозид, антрациклины (даунорубицин, митоксантрон, идарубицин), этопозид, тиогуанин.
В 1989-1993 годах группа CCG провела исследование 589 детей с острым миелобластным лейкозом. Исследование показало преимущество индукции в режиме интенсивного тайминга. Суть этого режима в том, что больные получают индукционную терапию, состоящую из двух одинаковых 4-дневных курсов с интервалом 6 дней. Каждый курс лечения включает цитозин-арабинозид, даунорубицин, этопозид и тиогуанин. Необходимость повторения курса лечения строго через фиксированный интервал, независимо от показателей гемопоэза, обусловлена тем, что леикемические клетки, которые находились во время первого курса вне митотической фазы, войдут в неё ко времени начала второго курса и подвергнутся цитотоксическому воздействию химиопрепаратов. Преимущество интенсивного тайминга в достоверном увеличении EFSc 27% у больных, получавших ту же терапию в стандартном режиме, до 42%. В настоящее время группа CCG опубликовала данные о пилотном исследовании индукции интенсивного тайминга с использованием идарубицина, показаны преимущества этого препарата в терапии индукции у детей.
Группа MRC в исследовании AML-9 (1986 год) показала преимущества продлённой терапии индукции (5-дневную индукцию с применением даунорубицина, цитозин-арабинозида и тиогуанина сравнивали с 10-дневной). Несмотря на более высокий уровень смертности от токсичности (21 против 16%), уровень достижения ремиссии был выше в группе продлённой терапии. Следующее исследование этой группы - AML-10 - включало 341 ребёнка. Индукционная терапия в AML-10 была основана на стандартных дозах цитозин-арабинозида и даунорубицина с добавлением трегьего препарата - этопозида или тиогуанина, в зависимости от группы рандомизации. Индукция в AML-12 (в исследование включены 529 детей) состояла из схемы ADE (цитозин-арабинозид + даунорубицин + этопозид), в другой группе рандомизации - из схемы АМЕ (цитозин-арабинозид + митоксантрон + этопозид). Ремиссия в обоих исследованиях составила 92%, смерть в индукции и резистентные острые миелобластные лейкозы - по 4%. Уровень ремиссии в обеих ветвях протокола AML-12 (ADE и АМЕ) был практически одинаковым - 90 и 92%. В начале 1990-х годов DFS при остром миелобластном лейкозе увеличилась с 30 до 50%; с 1995 года (протокол AML-12) значение данного показателя составляет 66%.
Индукция по протоколу исследовательской группы LAME состоит из стандартных доз цитозин-арабинозида и митоксантрона (суммарная доза 60 мг/м 2 ), ремиссия достигнута у 90% больных.
В России наиболее хорошо известны протоколы группы BFM. До 1993 года индукционная терапия состояла из курса ADE (цитозин-арабинозид + даунорубицин + этопозид). Согласно протоколу AML-BFM-93 (исследование включает 471 ребёнка), индукционная терапия в одной группе рандомизации была прежней - ADE, в другой группе - состояла из цитозин-арабинозида, этопозида и идарубицина. Уровень достижения ремиссии среди всех пациентов составил 82,2%. Показано, что введение идарубицина достоверно увеличило редукцию бластов у пациентов к 15-му дню от начала индукционной терапии, однако это не повлияло на частоту досгижения ремиссии и DFS, которая в этих группах была сходной.
Постиндукционная терапия
Большинство протоколов в качестве постремиссионной терапии предполагает два или более курса цитостатиков. Как правило, не менее одного курса полихимиотерапии основано на высоких дозах цитозин-арабинозида (1-3 г/м 2 в одно введение). Дополнительные препараты - этопозид и/или антрациклины (идарубицин или митоксантрон).
Наиболее успешны протоколы, предусматривающие три постремиссионных блока химиотерапии, часть которых проводят в режиме интенсивного тайминга и/или с использованием высоких доз цитозин-арабинозида.
Трансплантация гемопоэтических стволовых клеток
Современная терапия острого миелобластного лейкоза предусматривает для определённых категорий пациентов трансплантацию гемопоэтических стволовых клеток (ТГСК). Существуют два принципиально различных вида трансплантации - аллогенная и аутологичная.
По сравнению с аллогенной, роль аутологичной трансплантации в профилактике рецидива не столь очевидна.
Терапия острого промиелоцитарного лейкоза
Вариант М, по ЕАВ - особый вид острого миелолейкоза. Его регистрируют во всех регионах мира, но в некоторых он существенно преобладает. Среди всех случаев острого миелобластного лейкоза в США и Европе на острый промиелоцитарный лейкоз приходится 10-15%, в то время как в Китае - около трети, а среди латиноамериканской популяции - до 46%. Основное звено патогенеза и диагностический признак острого промиелоцитарного лейкоза - транслокация t(15;17)(q22;ql2) с образованием химерного гена PML-RARa. В клинической картине лидирует коагулопатия (в равной степени вероятны ДВС и гиперфибринолиз), которая может усугубляться на фоне химиотерапии, формируя высокий уровень смертности от геморрагического синдрома в начале лечения (20%). Неблагоприятные в отношении прогноза факторы - инициальный лейкоцитоз (количество лейкоцитов превышает 10х10 9 /л) и экспрессия CD56 на лейкемических промиелоцитах.
Большинству пациентов для достижения ремиссии достаточно применения ATRA в качестве монотерапии, однако без дополнительной терапии заболевание практически всегда рецидивирует в течение первого полугодия. Наилучшая стратегия - комбинирование ATRA с индукционной химиотерапией. Показано, что индукция с использованием all-трансретиноевой кислоты в комбинации с антрациклинами, несколько курсов основанной на антрациклинах консолидации и поддерживающая низкодозная терапия с или без ATRA обеспечивает 75-85% EFS в течение 5 лет у взрослых. Применение ATRA в индукции одновременно с химиотерапией даёт более высокую безрецидивную выживаемость, чем последовательное использование препаратов. Применение поддерживающей терапии также уменьшает вероятность рецидива, а увеличение дозы антрациклинов в индукционной терапии и ATRA в консолидации может улучшить результаты лечения больных группы риска.
Результаты исследований эффективности лечения острого промиелоцитарного лейкоза у детей до настоящего времени не опубликованы, однако природа заболевания и принципы терапии одинаковы во всех возрастных группах.
Какой прогноз имеет острый миелобластный лейкоз?
алло-ТГСК – трансплантация аллогенных гемопоэтических стволовых клеток
алло-ТКМ – трансплантация аллогенного костного мозга
ауто-ТГСК – трансплантация аутологичных гемопоэтических стволовых клеток
ВОЗ – Всемирная организация здравоохранения
ИФТ – иммунофенотипическое исследование
КТ – компьютерная томография
МДС – миелодиспластический синдром
МОБ – минимальная остаточная болезнь
МПЗ – миелопролиферативное заболевание
ОЛ – острый лейкоз
ОЛСФ – острый лейкоз смешанного фенотипа
ОМЛ – острый миелоидный лейкоз
ПР – полная ремиссия
ПЦР – полимеразная цепная реакция
ТГСК – трансплантация гемопоэтических стволовых клеток
ТКМ – трансплантация костного мозга
УЗИ – ультразвуковое исследование
ECOG – (Eastern Cooperative Oncology Group) Восточная объединенная онкологическая группа
FAB-классификация – французско-американско-британская классификация
FISH – флуоресцентная in situ гибридизация
MPO (myeloperoxidase) – миелопероксидаза
NCCN – (National Comprehensive Cancer Network) Национальная общественная противораковая сеть
** – жизненно необходимые и важнейшие лекарственные препараты
# – препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
1. 2020 Клинические рекомендации "Острые миелоидные лейкозы" (Общероссийский национальный союз "Ассоциация онкологов России"; Некоммерческое партнерство содействия развитию гематологии и трансплантологии костного мозга "Национальное гематологическое общество").
Определение
Острые миелоидные лейкозы (ОМЛ) – клональные опухолевые заболевания кроветворной ткани, связанные с мутацией в клетке-предшественнице гемопоэза, следствием которой становятся блок дифференцировки и бесконтрольная пролиферация незрелых миелоидных клеток.
Терминология
Острые миелоидные лейкозы (ОМЛ) – клональные опухолевые заболевания кроветворной ткани, связанные с мутацией в клетке-предшественнице гемопоэза, следствием которой становятся блок дифференцировки и бесконтрольная пролиферация незрелых миелоидных клеток.
Полной ремиссией (ПР) ОМЛ принято называть состояние кроветворной ткани, при котором в пунктате костного мозга обнаруживается 5 % и менее бластных клеток при нормальном соотношении всех ростков кроветворения, отсутствуют бластные клетки с палочками Ауэра и экстрамедуллярные очаги при количестве нейтрофилов в периферической крови ³1,0 ´ 10 9 /л, при количестве тромбоцитов ³100 ´ 10 9 /л, при отсутствии экстрамедуллярных очагов лейкемического роста. Указанные показатели должны сохраняться в стабильном состоянии в течение > 1 месяца. Устанавливается при отсутствии данных о статусе минимальной остаточной болезни (МОБ).
Полная ремиссия с отсутствием МОБ – ПР с отсутствием в пунктате костного мозга, обнаруженного в дебюте ОМЛ генетического маркера (методом полимеразной цепной реакции (ПЦР)) или клеток с аберрантным иммунофенотипом (методом проточной цитометрии).
Минимальная остаточная болезнь – небольшая популяция опухолевых клеток, которая не может быть зафиксирована с помощью светового микроскопа, но обнаруживается более тонкими методами исследования, выявляющими 1 лейкемическую клетку на 10 4–6 исследуемых.
Полная ремиссия с неполным восстановлением – ПР при сохраняющейся нейтропении ( 9 /л) или тромбоцитопении ( 9 /л).
Частичная ремиссия – все гематологические критерии ПР; снижение процента бластных клеток в пунктате костного мозга до 5–25 %; снижение числа бластных клеток в пунктате костного мозга не менее чем на 50 % от исходного до начала лечения. Данный критерий используется для оценки эффективности лечения ОМЛ преимущественно в ходе клинических исследований I–II фазы.
Общая выживаемость. Для оценки общей выживаемости анализируют временные параметры всех пациентов, которым начали лечение. Точкой отсчета является день начала терапии. Событием считается только смерть пациента от любой причины (ранняя летальность, смерть в период ремиссии от любой причины, смерть в период рецидива). Этот анализ позволяет оценить число реально оставшихся в живых пациентов с ОМЛ на фоне проведенной терапии.
Безрецидивная выживаемость. При оценке безрецидивной выживаемости учитывают данные только тех пациентов, у которых была достигнута ПР. Точкой отсчета считается дата достижения ПР. Событиями считаются рецидив и смерть от любой причины (в период консолидации или поддерживающего лечения, от рецидива, в период ремиссии от другой причины, например, суицида). Цензурируют только тех пациентов, которые были живы и находились в ПР в момент проведения анализа.
Вероятность сохранения ПР (обратное от вероятности развития рецидива). При оценке вероятности сохранения ПР учитываются данные только тех пациентов, у которых достигнута ПР. При этом точкой отсчета служит дата достижения ПР. Событием считается только рецидив заболевания. Цензурируют всех пациентов, кто жив в ПР в момент проведения анализа. Пациенты, умершие в период ПР от осложнений, связанных с лечением, или от других причин, цензурируют в день смерти, как пациентов, находившихся в ПР.
Вероятность сохранения ПР является тем показателем, который позволяет оценивать истинную противоопухолевую эффективность какой-либо терапии без учета таких субъективных моментов, как выхаживание пациентов от осложнений, связанных с самим лечением.
Бессобытийная выживаемость. Этот показатель оценивает выживаемость всех пациентов, включенных в анализ, с момента начала терапии. Событием считается ранняя летальность, факт недостижения ПР через 2 месяца от начала лечения, смерть в период ремиссии от осложнений химиотерапии (ХТ) или других причин, а также рецидив заболевания. Цензурируют только пациентов, у которых была достигнута ПР в течение первых 2 курсов ХТ, и они остаются живыми, сохраняя ПР, на момент проведения анализа.
Резистентная форма ОМЛ, по мнению большинства российских экспертов, констатируется при отсутствии ПР после завершения 2 курсов индукционной терапии. Важно отметить, что, по международным критериям, резистентность при ОМЛ можно оценивать лишь через 7 дней после завершения курса полихимиотерапии. Если пациент умирает в течение курса ХТ или в течение 7 дней после него, определить, резистентная у него форма лейкоза или нет, нельзя, и пациентов в этом случае относят к категории неудач в лечении как неопределенный исход.
Смерть от неопределенной причины – 1) смерть пациента до завершения терапии; 2) смерть пациента в период гематологический – обнаружение в пунктате костного мозга более 5 % бластных клеток и/или экстрамедуллярного очага опухоли, в том числе нейролейкемии.
Рецидив молекулярный/иммунологический – выявление МОБ методом проточной цитометрии и/или ПЦР при условии анализа аберрантного иммунофенотипа или выполнения молекулярного исследования до начала терапии.
Индукция ремиссии – период начального лечения, целью которого являются максимально быстрое и существенное сокращение опухолевой массы и достижение ПР (обычно 1–2 курса). Именно в этот период на фоне применения противоопухолевых препаратов цитостатических средств количество лейкемических клеток в костном мозге уменьшается примерно в 100 раз, т. е. в момент констатации ПР в костном мозге морфологически определяется менее 5 % опухолевых клеток.
Консолидация ремиссии. Вторым этапом терапии острого лейкоза (ОЛ) является закрепление достигнутого противоопухолевого эффекта (обычно 1–2 курса). В настоящее время в большинстве случаев консолидация – наиболее агрессивный и высокодозный этап при лечении ОЛ. Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток.
Поддерживающее лечение – продолжение цитостатического воздействия в меньших дозах, чем в период индукции/консолидации ремиссии, или иного (таргетного) воздействия на возможно остающийся опухолевый клон.
Профилактика или, при необходимости, лечение нейролейкемии. Этот этап распределяется на все периоды программного лечения – индукцию ремиссии, консолидацию и поддерживающее лечение.
Трансплантация костного мозга (ТКМ). Под этим термином объединены трансплантация гемопоэтических стволовых клеток (ТГСК) костного мозга периферической крови и пуповинной (плацентарной) крови.
УДД
Расшифровка
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования
Несравнительные исследования, описание клинического случая
Имеется лишь обоснование механизма действия или мнение экспертов
УДД
Расшифровка
Систематический обзор рандомизированных клинических исследований с применением метаанализа
Отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа
Нерандомизированные сравнительные исследования, в том числе когортные исследования
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов
УУР
Расшифровка
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными)
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными)
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными)
Острый миелобластный лейкоз (ОМЛ) – это злокачественный процесс в костном мозге, нарушающий функцию кроветворения. Заболевание поражает миелоидный росток. Здоровая клетка лейкоцит не созревает и выходит в кровоток в изменённом виде. Начинается неконтролируемое деление. Лейкоциты лишены способности защищать организм от микроорганизмов и инфекций. Угнетается производство эритроцитов и тромбоцитов. Начинает развиваться анемия и тромбоцитопения. Изменяется состав периферической крови.
Причины, провоцирующие развитие болезни, до конца не изучены. Учёные связывают ряд факторов с мутациями кроветворной системы, к примеру, наследственность, облучения или генетические аномалии.
Миелоидная лейкемия наиболее часто диагностируется у взрослых пациентов. Болезнь поражает людей после 50 лет. Пик развития рака приходится на 63 года. Миелоидному лейкозу больше подвержены пожилые мужчины. Среди молодого поколения одинаково страдают представители обоих полов.
У детей заболевание носит первичный характер. Ребёнок подвергается лейкозу при аномалиях в генетическом коде, при контакте матери с тяжёлыми отравляющими веществами (радиация, канцерогены) или если история болезней кровных родственников содержит онкологические патологии. Симптомы болезни как у взрослых.
В начале заболевания клиническая картина смазана. Постепенно больной замечает необычные изменения в состоянии. При остром течении болезни пациент отмечает симптомы самочувствия:

- Утомляемость;
- Одышка;
- Синяки и мелкие кровоподтеки;
- Кровоточивость слизистой ротовой полости;
- Инфекционные поражения организма, не поддающиеся классическому лечению и имеющие ярко выраженную симптоматику.
Для лейкозов терминальной стадии развития костный мозг лишается работоспособности, метастазы поражают органы и системы человеческого тела. Для этого характерны признаки:
- Значительное снижение веса;
- Бледность кожных покровов;
- Желудочно-кишечные и носовые кровотечения;
- Слабость;
- Боль и ломота в костях;
- Обмороки;
- Рвота с кровью;
- Чёрный стул;
- Боли в животе;
- Если поражается мочеполовая система, отмечается частичная или полная задержка мочи.
Лечением занимаются онкогематологи. Код по МКБ-10 миелолейкоза С92.
Классификация онкологической патологии
Нелимфобластный лейкоз представляет группа подвидов болезни. Для каждого вида шансы выживаемости и тактика лечения подбираются индивидуально.
Система ФАБ состоит из 9 разновидностей острого миелоидного лейкоза. Формы отличаются по типам предшественников лейкоцитов и степеням их зрелости. Клетки определяют при проведении микроскопического и цитогенетического исследования.
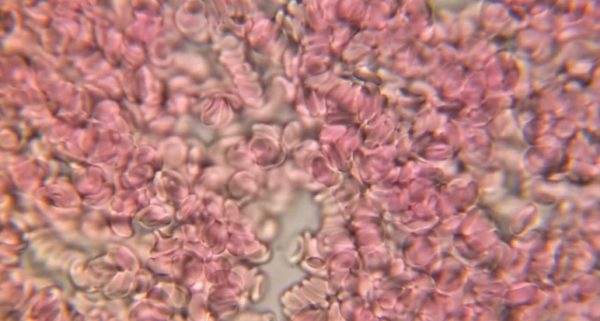
- Показатель М0 означает минимально-дифференцированную острую миелоидную лейкемию.
- М1 характеризует миелоцитарный лейкоз без созревания. В единичных бластах обнаруживаются азурофильные гранулы и палочки Ауэра.
- При М2 для лейкоза характерно созревание. Бласты преимущественно с палочками Ауэра и азурофильными гранулами.
- М3 обозначает острую форму промиелоцитарного рака крови. Клетки гипергранулированы. Палочки Ауэра присутствуют множественно.
- М4 представляет острый миеломонобластный онкологический процесс.
- При М4ео наблюдается миеломоноцитарная патология с повышенным уровнем эозинофилов в костном мозге.
- М5 определяет острый монобластный (-цитарный) лейкоз.
- М6 характеризует острые эритроидные заболевания крови.
- М7 означает мегакариобластную лейкемию.
- Подвид М8 представляет базофильное малокровие.
Исследования при лейкозах
Диагностика лейкозов заключается в изучении состава крови и костного мозга. Точный диагноз определяется только после забора биоптата из бедра или ребра для дальнейшего исследования.
Вначале проводят анализ крови. Наблюдаются отклонения в показателях лейкоцитов. Результат может быть представлен от 0,1*109/л до 10*100*109/л. Небольшие нарушения свидетельствуют о монобластной лейкемии или о эритромиелозе. В сыворотке крови не обнаруживаются базофилы. Скорость оседания эритроцитов (СОЭ) увеличена.
Эритроциты представлены низкими показателями. В крови преобладают бласты и клетки зернистого ряда. Отмечаются созревшие моноциты. Снижен уровень гемоглобина.
С помощью биохимического исследования определяется количество общего белка, билирубина, альбумина, мочевины и креатинина.

Для острого лейкоза первой фазы анализ крови может иметь следующую картину:
- Показатели общего белка – 78 ммоль/л.
- Общего билирубина – 14-17 ммоль/л.
- Прямого билирубина – 3,5-4,5 ммоль/л.
- Уровень креатинина – 108 мкмоль/л.
Благодаря цитохимическим показателям изучается активность ферментов, состав крови, костного мозга и других тканей организма.
Иммунологический тест является комплексным исследованием нарушений в работе иммунитета. Для анализа используют венозную кровь. Определяются иммунные клетки, их функции, активность и способность уничтожать бактерии.
Для выявления метастазов в миокарде используют электрокардиограмму и эхокардиографию.
Ультразвуковая диагностика выявляет отклонения во внутренних органах человека. Метод позволяет изучить печень, органы желудочно-кишечного тракта и мочеполовой системы, лимфатические узлы.
Вариант глобальной диагностики всех органов и систем представлен проведением магнитно-резонансной и компьютерной томографии. Методы послойно сканируют участки тела. Выявляются даже незначительные изменения в тканях.
Лечебная тактика
На первом этапе лечения назначенные препараты без разбора убивают здоровые и раковые клетки. Развиваются побочные явления:
- Тошнота;
- Рвота;
- Вялость;
- Язвенные поражения полости рта;
- Назальные кровотечения;
- Организм больного подвержен присоединению опасных инфекций.
На втором этапе назначают несколько курсов цитостатиков. Для уничтожения рака важен приём высокой дозы цитозин-арабинозида. Препарат препятствует созданию частиц, переносящих наследственную информацию. При печёночной и почечной недостаточностях или угнетении костного мозга приём препарата запрещен.
Для угнетения функций костного мозга и борьбы с опухолевыми клетками назначают Идарубицин.
Митоксантрон подавляет иммунитет и уничтожает опухоли.
Для достижения максимальной эффективности используют протоколы с тремя блоками постремиссионной химии.
Прогноз жизни на фоне химиопрепаратов значительно улучшается.
При поражении органов центральной нервной системы рекомендована лучевая терапия. Ионизирующее излучение вступает в реакцию с аномальными клетками, нарушает их структуру и провоцирует гибель.
Среди людей ходят истории об исцелении рака крови с помощью народной медицины. Однако ни один метод или препарат не показал 100% эффективности. Отказываясь от врачебного вмешательства, больной позволяет лейкозу стремительно развиваться и нарушать работу жизненно важных органов! Лечением может заниматься только квалифицированный врач онколог после проведения тщательной диагностики. Нетрадиционные методы обычно только усугубляют течение болезни.
Полное выздоровление наступает после пересадки костного мозга. Метод имеет нюансы и последствия:
- До начала проведения операции (вливание донорского материала через установленный в артерию катетер) больному уничтожают костный мозг с помощью ударных доз химиотерапии.
- При отсутствии иммунитета любые инфекции и болезни, к примеру, ОРЗ или царапина могут привести к летальному исходу.
- Трансплантируемый материал может не взаимодействовать с организмом пациента:
- В первом случае чужой костный мозг организм человека воспринимает за чужеродный и отторгает его. Нарушается работа всех органов. Иммунные клетки убивают все на своем пути. Однако при этом окончательно уничтожаются раковые клетки без возможности развиться снова. Иммуносупрессивная терапия помогает наладить нормальный кроветворный процесс.
- Организм пациента отвергает введенные стволовые клетки. Иммунитет не формируется. Выработка кровяных телец не начинается.
- При введении биоматериала развивается аллергия или анафилактический шок.
- Половина пациентов умирают в первый месяц после операции.
Подходящий костный мозг трудно достать. Лучшими донорами являются однояйцевые близнецы, родные братья и сестры. Материал родителей подходит очень редко.
Стволовые клетки могут быть взяты у самого пациента в период ремиссии или у постороннего человека.
Прогнозы на жизнь
Шанс на полное выздоровление имеют 90% пациентов до 60 лет. Пожилой организм не справляется с раком и нагрузками при химиотерапии. Пациент до конца жизни использует паллиативное лечение. Пятилетняя выживаемость пожилых людей составляет 12-25%.
Шанс на выживаемость снижается при наличии сопутствующих онкологических проблем или заболеваний генетического типа (болезнь Дауна). Рецидив развивается в любой момент. Вторичное заболевание не поддаётся лечению.
Если больной в течение 5 лет не отмечал симптомы лейкоза и не обращался за помощью, его снимают с онкологического учёта и считают здоровым.
Специфическая профилактика лейкемии отсутствует.

Острый миелобластный лейкоз (ОМЛ) — термин, который объединяет ряд острых миелолейкозов, характеризующихся развитием сбоев в механизме созревания миелобластов.
На ранних этапах развития болезнь проявляется бессимптомно и диагностируется слишком поздно.
Чтобы выявить лейкоз своевременно, необходимо знать, что это такое, какие симптомы говорят о начале развития заболевания и какие факторы влияют на его возникновение.
Код МКБ-10
Код заболевания — C92.0 (Острый миелобластный лейкоз, относится к группе миелоидных лейкозов)
Что это такое?
ОМЛ — злокачественная трансформация, охватывающая миелоидный росток кровяных клеток.
Пораженные кровяные тельца постепенно заменяют здоровые, и кровь перестает полноценно выполнять свою работу.
Это заболевание, как и другие типы лейкозов, именуют раком крови в повседневном общении.
Слова, из которых состоит это определение, дают возможность понять его лучше.
Лейкоз. При лейкозе измененный костный мозг начинает активно вырабатывать лейкоциты — кровяные элементы, которые ответственны за поддержание иммунной системы — с патологической, злокачественной структурой.
Они замещают собой здоровые лейкоциты, проникают в разные части организма и формируют там очаги поражения, схожие со злокачественными новообразованиями.

Отличия здоровой крови от больной лейкозом
Миелобластный. При ОМЛ начинается избыточное продуцирование пораженных миелобластов — элементов, которые должны превратиться в одну из разновидностей лейкоцитов.
Они вытесняют здоровые элементы-предшественники, что приводит к дефициту других кровяных клеток: тромбоцитов, эритроцитов и нормальных лейкоцитов.
Острый. Это определение говорит о том, что продуцируются именно незрелые элементы. Если пораженные клетки находятся в зрелом состоянии, лейкоз называется хроническим.
Острый миелобластоз отличается стремительным прогрессированием: миелобласты в крови разносятся по организму и вызывают тканевую инфильтрацию.

Симптомы
Обычно ОМЛ развивается у взрослых и пожилых людей. Ранние стадии миелобластной лейкемии характеризуются отсутствием ярко выраженной симптоматики, но, когда заболевание охватило организм, возникают серьезные нарушения многих функций.
Развивается из-за тканевой инфильтрации под действием лейкоза. Разрастаются периферические лимфоузлы, увеличивается селезенка, нёбные миндалины, печень.
Поражаются лимфоузлы области средостения: если они разрастаются значительно, то передавливают верхнюю полую вену.
Кровоток в ней нарушается, что сопровождается возникновением отечности в зоне шеи, учащенного дыхания, синюшности кожных покровов, набуханием сосудов на шее.
Также поражаются десна: появляется стоматит Венсана, который характеризуется развитием тяжелых симптомов: десны отекают, кровоточат и сильно болят, есть и ухаживать за полостью рта затруднительно.

Более половины больных имеют те или иные его проявления, развивается из-за острой нехватки тромбоцитов, при которой стенки сосудов истончаются, нарушается свертывание крови: наблюдаются множественные кровотечения — носовые, внутренние, подкожные, которые долгое время не удается остановить.
Увеличивается риск геморрагического инсульта — кровоизлияния в мозг, при котором летальность составляет 70-80%.
На ранних стадиях острого миелобластного лейкоза нарушение свертываемости проявляется в виде частых носовых кровотечений, кровоточивости десен, синяков на разных частях тела, которые появляются от незначительных воздействий.
Характеризуется появлением:
- Выраженной слабости,
- Быстрой утомляемости,
- Ухудшением трудоспособности,
- Раздражительности,
- Апатии,
- Частых болей в голове,
- Головокружений,
- Обмороков,
- Стремления есть мел,
- Сонливости,
- Болей в области сердца,
- Бледности кожи.
Затруднена даже незначительная физическая активность (наблюдается сильная слабость, учащенное дыхание). Волосы при анемии часто выпадают, ногти ломкие.
Температура тела повышена, вес падает, аппетит пропадает, наблюдается слабость и избыточное потоотделение.
Начальные проявления интоксикации наблюдаются на начальных этапах развития заболевания.
Если инфильтрация затронула мозговые ткани, это ухудшает прогноз.
Наблюдается следующая симптоматика:
- Многократная рвота,
- Острая боль в голове,
- Эпиприступы,
- Обмороки,
- Внутричерепная гипертензия,
- Сбои в восприятии реальности,
- Нарушения слуха, речи и зрения.
Развиваются на поздних стадиях заболевания, когда количество пораженных миелобластов в крови становится выше 100000 1/мкл.
Кровь густеет, ток крови становится медленным, нарушается кровообращение во многих органах.
Мозговой лейкостаз характеризуется возникновением внутримозговых кровотечений. Нарушается зрение, возникает сопорозное состояние, кома, возможен летальный исход.
При легочном лейкостазе наблюдается учащенное дыхание (возможно возникновение тахипноэ), озноб, повышение температуры. Количество кислорода в крови сокращается.
При остром миелобластном лейкозе иммунная система крайне уязвима и не способна защищать организм, поэтому высока восприимчивость к инфекциям, которые протекают тяжело и с массой опасных осложнений.
Причины
Точные причины развития ОМЛ неизвестны, но существует ряд факторов, которые увеличивают вероятность развития заболевания:
- Радиационное облучение. В группе риска люди, которые взаимодействуют с радиоактивными материалами и приборами, ликвидаторы последствий ЧАЭС, пациенты, проходящие лучевую терапию при другом онкологическом заболевании.
- Генетические заболевания. При анемии Факони, синдромах Блума и Дауна риск развития лейкоза увеличивается.
- Воздействие химических веществ. Химиотерапия при лечении злокачественных заболеваний негативно воздействует на костный мозг. Также вероятность повышается при хроническом отравлении ядовитыми веществами (ртуть, свинец, бензол и прочие).
- Наследственность. Люди, близкие родственники которых страдали лейкозами, также могут заболеть.
- Миелодиспластический и миелопролиферативный синдромы. Если лечение одного из этих синдромов будет отсутствовать, заболевание может трансформироваться в лейкоз.
У детей крайне редко фиксируется этот тип лейкоза, в группе риска — люди старше 50-60 лет.
Формы ОМЛ
Миелобластная лейкемия имеет ряд разновидностей, от которых зависит прогноз и тактика лечения.
| Название и классификация по FAB | Описание |
| ОМЛ с незначительной дифференциацией (М0). | Низкая восприимчивость к химиотерапевтическому лечению, легко приобретает резистентность к ней. Прогноз неблагоприятный. |
| ОМЛ без созревания (М1). | Отличается стремительным прогрессированием, бластные клетки содержатся в большом количестве и составляют порядка 90%. |
| ОМЛ с созреванием (М2). | Уровень моноцитов при этой разновидности — менее 20%. Не меньше 10% миелобластных элементов развиваются до стадии промиелоцитов. |
| Промиелоцитарный лейкоз (М3). | В костном мозгу интенсивно накапливаются промиелоциты. Относится к наиболее благоприятным по течению и прогнозу лейкозам — в течение 10-12 лет живут не менее 70%. Симптоматика схожа с остальными разновидностями ОМЛ. Лечится с применением оксида мышьяка и третиноина. Средний возраст заболевших — 30-45 лет. |
| Миеломоноцитарный лейкоз (М4). | Диагностируется у детей чаще, чем другие разновидности заболевания (но в целом ОМЛ в процентном соотношении, по сравнению с другими типами лейкозов, выявляется у детей редко). Лечится с применением интенсивной химиотерапии и пересадки стволовых клеток (ТГК). Прогноз неблагоприятный — показатели выживаемости в течение пяти лет — 30-50%. |
| Монобластный лейкоз (М5). | При этой разновидности в костном мозгу содержится не менее 20-25% бластных элементов. Лечится химиотерапией и ТГК. |
| Эритроидный лейкоз (М6). | Редко встречающаяся разновидность. Лечится с применением химиотерапии и пересадки стволовых клеток. Прогноз неблагоприятный. |
| Мегакариобластный лейкоз (М7). | Этой разновидности ОМЛ подвержены люди с синдромом Дауна. Характеризуется быстрым течением и низкой восприимчивостью к химиотерапии. Детские формы болезни чаще текут благоприятно. |
| Базофильный лейкоз (М8). | Чаще встречается в детском и юношеском возрасте, прогноз жизни М8 неблагоприятный. Помимо злокачественных элементов, в крови выявляются аномальные элементы, которые затруднительно выявить без специального оборудования. |
Также, помимо упомянутых разновидностей, существуют и другие редкие виды, не внесенные в общую классификацию.
Диагностика
Острая лейкемия выявляется с применением ряда диагностических мероприятий.
Диагностика включает в себя:
- Развернутый анализ крови. С его помощью выявляется содержание в крови бластных элементов и уровень остальных кровяных телец. При лейкемии обнаруживается избыточное количество бластов и сниженное содержание тромбоцитов, зрелых лейкоцитов, эритроцитов.
- Взятие биоматериала из костного мозга. Применяется для подтверждения диагноза и проводится после проведенных обследований крови. Этот метод применяется не только в процессе диагностики, но и на протяжении лечения.
- Биохимический анализ. Дает информацию о состоянии органов и тканей, содержании различных ферментов. Этот анализ назначается для получения развернутой картины поражения.
- Другие виды диагностики: цитохимическое исследование, генетическое, УЗИ селезенки, брюшной полости и печени, рентген зоны груди, диагностические мероприятия для выявления степени поражения головного мозга.
Могут быть назначены и другие методы диагностики, в зависимости от состояния пациента.
Лечение
Лечение ОМЛ включает применение следующих методов:
- Химиотерапия. Медикаменты воздействуют на клетки, подавляя их активность и размножение. Ключевой метод лечения лейкемии.
- Консолидация. Лечение, назначаемое во время ремиссии, нацелено на снижение вероятности рецидива.
![]()
Трансплантация стволовых клеток. Пересадка костного мозга при лейкозе применяется при лечении больных младше 25-30-летнего возраста и необходима в тех ситуациях, когда заболевание течет неблагоприятно (наблюдается нейролейкоз, концентрация лейкоцитов крайне высока). Пересаживаются либо собственные клетки, либо донора. Обычно донорами становятся близкие родственники.- Дополнительная терапия. Восстанавливает состояние крови, включает введение кровяных элементов.
Также может быть применена иммунотерапия — направление, использующее иммунологические препараты.
Применяются:
- Медикаменты на основе моноклональных антител,
- Адаптивная клеточная терапия,
- Ингибиторы контрольных точек.
При таком диагнозе, как острый миелолейкоз, продолжительность лечения составляет 6-8 месяцев, но может быть увеличена.
Прогноз жизни
Прогноз зависит от следующих факторов:
- Типа ОМЛ,
- Чувствительности к химиотерапии,
- Возраста, пола и состояния здоровья пациента,
- Уровня лейкоцитов,
- Степени вовлеченности головного мозга в патологический процесс,
- Продолжительности ремиссии,
- Показателей генетического анализа.
Если заболевание чувствительно к химиотерапии, концентрация лейкоцитов умеренная, а нейролейкоз не развился, прогноз положительный.
При благоприятном прогнозе и отсутствии осложнений выживание в течение 5 лет составляет более 70%, частота рецидивов менее 35%. Если состояние пациента осложнено, то выживаемость равняется 15%, при этом рецидивировать состояние может в 78% случаев.
Чтобы своевременно выявить ОМЛ, необходимо регулярно проходить плановые медицинские обследования и прислушиваться к организму: частые кровотечения, быстрая утомляемость, возникновение синяков от небольшого воздействия, длительное беспричинное повышение температуры могут говорить о развитии лейкоза.
Видео: Острый миелолейкоз
Читайте также:


