Принципы лечения опухолей костей
22.03.2012 - Меланома и беременность
Различные ее аспекты до сих пор остаются спорными. читать
18.03.2012 - Меланома у детей
Ее наблюдали лишь в 2,5% случаев среди детей с различными злокачественными опухолями читать
17.03.2012 - Методы лечения поверхностного рака мочевого пузыря
опухоли стадии Ta, T1 или Tis читать
| Консультации |
19.04.2015
Здравствуйте Игорь Петрович! У мамы при колоноскопии обнаружили темноклеточную высокодиференцированную. читать
19.04.2015
Здравствуйте уважаемый доктор! Моему отцу 68 лет во время УЗИ поставлено заключение:Объемное образование. читать
27.03.2015
Добрый день! Маме 50 лет. Рак яичников 2 ст. 15.11.10 обнаружили и сделали операцию - экстирпация матки с. читать
| Тематические новости |
19.05.2015 - Бесплатное гормональное лечение РАКА ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ
Научная программа в Национальном медицинском исследовательском радиологическом центре читать
26.11.2014 - ДЕНЬ ОТКРЫТЫХ ДВЕРЕЙ,
посвященный диагностике и профилактике злокачественных образований кожи. читать
25.11.2014 - Какова выживаемость при раке мочевого пузыря ?
Ниже приводится стандартный протокол динамического наблюдения: читать
Принципы лечения опухолей костей
Главная страница - Онкологические болезни - Опухоли костей - Принципы лечения опухолей костей
Лечение большинства больных с первичными злокачественными опухолями костей комбинированное с использованием химио- и(или) лучевой терапии и оперативных вмешательств. Следует учитывать степень чувствительности различных опухолей к химиолучевым методам. Хрящевые опухоли не чувствительны к химиолучевой терапии и для них единственным радикальным методом лечения является радикальное оперативное вмешательство. В противном случае опухоль Юинга и ретикулоклеточная саркома кости высокочувствительны к лучевой терапии и полихимиотерапии, что делает эти методы основными в лечении этих больных, а оперативное вмешательство дополнительным компонентом, используемым по показаниям участи больных. Остальные опухоли занимают промежуточное положение. Основным методом лечения для больных с такими опухолями остается радикальное оперативное вмешательство, а химиолучевые методы лечения используются как дополнительные.
Применяются как калечащие (ампутации, экзартикуляции), так и сохранные (резекции) операции. И тот, и другой тип оперативных вмешательств должен быть выполнен радикально и абластично. Это означает, что злокачественная опухоль удаляется с мышечно-фасциальным влагалищем, производится на вышележащем сегменте конечности с пересечением ее выше места прикрепления мышц, переходящих с пораженного на непораженный сегмент конечности (принцип футлярности по А.И. Ракову). При радикальной резекции опухоль также удаляется с мышечно-фасциальным влагалищем. В зоне, где граница футляра технически недоступна, опухоль удаляется со значительным слоем окружающих ее мышц (принцип зональности по Ракову). Сохранная операция по радикальности и абластичности выполнения должна быть адекватна соответствующей ампутации (экзартикуляции). На плечевом поясе конечностей такой сохранной операцией является межлопаточно-грудная резекция; на тазовом межподвздошно-брюшная резекция; на конечностях резекция целого ее сегмента, при этом удаляется не только пораженный отдел кости, но и все мягкие ткани сегмента. Для этого производятся циркулярные разрезы кожи и мягких тканей на двух уровнях (выше и ниже границ опухоли). Сохраняются только магистральные сосуды и нервы, питающие и иннервирующие периферический отдел конечности. Иммобилизация осуществляется в аппарате внешней фиксации. Возникающее при этом значительное укорочение конечности (до 25 см) компенсируется в последующем специальной обувью, протезами с двойным следом или больным осуществляется удлинение конечности.
При резекции кости линия ее пересечения должна отстоять от проксимального полюса опухоли на расстоянии не менее ее длины и только при некоторых ограниченных формах хондросарком, паростальной саркоме на расстоянии, равном половине длины опухоли. При распространении опухоли на большую часть трубчатой кости производится ее тотальное удаление.
Наиболее распространенным у нас в стране методом замещения дефекта кости является эндопротезирование по К.М. Сивашу. После тотального удаления бедренной кости используется протез-комплекс Сиваша (коленный и тазобедренный суставы). При тотальном удалении плечевой кости используются эндопротезы из пластмасс.
Не потеряли своего значения алло- и аутопластическое замещение дефектов. Существенно улучшаются исходы аутопластики при пересадке васкуляризованных трансплантантов с применением микрохирургической техники.
Выбор метода лучевой терапии в основном определяется морфологическим строением опухолей с учетом различной их радиочувствительности. Лучевые методы используются только в сочетании с химиотерапией или в качестве предоперационной подготовки в дозах до 40-50 Гр. Метод предоперационной лучевой терапии и выбор источника облучения зависит от возраста больного, локализации и размеров опухоли, других данных и характера планируемого оперативного вмешательства.
В настоящее время применяются хирургические, лучевые, лекарственные и комбинированные методы лечения новообразований костей. Выбор метода лечения в основном зависит от характера опухоли (доброкачественная, злокачественная, метастатическая), ее гистологического строения, степени распространенности опухолевого процесса и общего состояния больного.
Хирургическое лечение. Оперативные методы лечения костных опухолей предложены давно, но до настоящего времени являются важнейшими и наиболее часто применяемыми способами местного лечения значительного числа больных с доброкачественными и злокачественными новообразованиями костей.
При хирургическом лечении опухолей костей должны соблюдаться следующие основные принципы: 1) радикальный характер операции при возможно меньшем риске ее; 2) абластичность оперативного вмешательства; 3) сохранение по возможности конечности, пораженной опухолью, без нарушения ее функции. У больных с доброкачественными опухолями костей основными методами лечения являются сберегательные операции — кюретаж и резекция.
Кюретаж (экскохлеация) — операция, заключающаяся в тщательном выскабливании очага поражения с последующим заполнением образовавшейся полости костной стружкой, взятой из большеберцовой кости, или гомокостью. Эта операция наиболее часто применяется при гигантоклеточных опухолях и центрально расположенных хондромах. Существенный недостаток — нередкие местные рецидивы опухоли.
Резекция кости является более радикальным методом лечения доброкачественных опухолей костей и в ряде случаев дает стойкое излечение и при злокачественных новообразованиях скелета. Сущность операции заключается в широком удалении опухоли вместе с частью пораженной ею кости, а иногда и со всей костью (ключица, лопатка и др.). При сегментарных резекциях длинных трубчатых костей применяются различные методы костной ауто- или гомопластики.
Выбор вида резекции кости зависит от характера опухоли, ее размеров и локализации. Непременным условием выполнения такой операции является сохранение функции конечности лучшей, чем после ампутации.
Ампутация и экзартикуляция являются основным методом лечения большинства больных с первичными злокачественными опухолями костей, прежде всего остеогенных сарком и хондросарком. Эти операции применяются также при рецидивах злокачественных опухолей после нерадикальных хирургических вмешательств и при далеко зашедших заболеваниях с паллиативной целью.
Наиболее существенным моментом при выполнении этих операций является правильный выбор уровня ампутации. Уровень ампутации конечности устанавливается в зависимости от локализации и протяженности злокачественной опухоли, степени вовлечения в патологический процесс мягких тканей и задач предстоящего протезирования. С последней точки зрения, ампутация по возможности должна быть произведена на функционально выгодном уровне и выполнена в техническом отношении так, чтобы получить выносливую безболезненную и опорную культю. Ампутация прл злокачественных опухолях, как правило, должна производиться за пределами пораженных костей. Исключением из этого правила являются злокачественные опухоли, расположенные в дистальном отделе бедра. В настоящее время большинство хирургов осуществляют в подобных случаях подвертельную ампутацию бедра.
Лучевая терапия. Роль лучевой терапии как самостоятельного метода лечения при большинстве злокачественных опухолей костей остается ограниченной. Все шире применяются методы комбинированного лечения, при которых лучевая терапия сочетается с оперативным вмешательством или химиотерапевтическим воздействием. Выбор метода лечения в основном определяется гистологическим строением опухоли — фактором, обусловливающим ее радиочувствительность. Лучевая терапия осуществляется в виде одного основного курса лечения (очаговая доза 5000—6000 рад).
Облучение проводится на телегамма-установке или рентгенотерапевтическом аппарате. Применяют многопольное облучение с учетом истинной протяженности опухоли. При облучении учитывают кожные изменения соответственно полям облучения и изменения картины крови вследствие лучевого воздействия на систему кроветворения. Для снятия или смягчейия указанных изменений используют все средства, повышающие), толерантность кожи и стимулирующие функции кроветворного аппарата. Большие возможности открывает использование источников высоких энергий (бетатроны, линейные ускорители).
Наиболее разработанным методом комбинированного лечения первичных злокачественных опухолей костей является сочетание лучевых методов с хирургическим вмешательством. По данным ряда авторов, комбинированное лечение этих опухолей уменьшает угрозу их диссеминации. Лечение начинают с предоперационной лучевой терапии. Методика предоперационной лучевой терапии и выбор источника излучения зависят от локализации опухоли, ее размеров, возраста больного и характера последующей операции.
Обычно используется наружное облучение, проводимое многопольным методом через различные по количеству и размеру поля облучения. Уточнение размеров облучаемой площади является крайне важным моментом лечения, так как рентгеновское изображение опухоли отнюдь не соответствует истинной протяженности патологического процесса.
Каким должно быть питание при онкологических заболеваниях? Какие продукты абсолютно противопоказаны при той или иной форме рака?
Фитотерапия способна оказать существенную помощь не только в лечении онкологических заболеваний, но также и в их профилактике.
Многих людей, имеющих у себя или у родственников онкологическое заболевание, интересует вопрос: передается ли рак по наследству?
Лечение рака во время беременности является довольно сложным, ведь большинство лекарственных средств обладает токсичностью.
Какие перспективы у беременности после перенесенного онкологического заболевания? Следует ли выдерживать срок после лечения рака?
Профилактика является важной частью общей борьбы с онкологическими заболеваниями. Как же уменьшить вероятность возникновения рака?
Что представляет из себя паллиативное лечение рака? Как оно может повлиять на качество жизни онкологического больного и изменить ее к лучшему?
Учеными разработано достаточно много перспективных методов лечения рака, пока еще не признанных официальной медициной. Но все может измениться!
Как найти силы для борьбы с раком? Как не впасть в отчаяние от возможной инвалидности? Что может послужить надеждой и смыслом жизни?
Бытует такое мнение, что постоянные стрессовые ситуации способны привести к развитию онкологических заболеваний. Так ли это?
Многие онкологические больные часто страдают от резкой потери веса. Чем это вызвано и можно ли как-то справиться с этой проблемой?
Правила ухода за больными, вынужденными постоянно находиться в кровати, имеют свои особенности и их нужно обязательно знать.
Тактика лечения первичных новообразований скелета зависит от нескольких факторов. Во-первых, это их гистологическая форма. В лечении доброкачественных опухолей ведущим является хирургический метод. Злокачественные опухоли костей представляют собой разнородную группу нозологических форм, отличающихся по клиническим проявлениями, способностью к метастазированию, рецидивированию, чувствительностью к химиотерапии и лучевым методам воздействия. Так, например, хондросаркомы низкой степени злокачественности не чувствительны к химиолучевой терапии, и для них единственным методом лечения является радикальная операция. В то же время остеосаркомы, ЗФГ, саркомы Юинга/ПНЭО, низкодифференцированные хондросаркомы склонны к ранней гематогенной диссеминации, поэтому их лечение должно предусматривать воздействие на субклинические метастазы с помощью химиотерапии.
Вторым определяющим фактором при выборе тактики лечения является стадия заболевания. При наличии явных отдаленных метастазов, на первый план выходят лекарственные методы. В дальнейшем, в зависимости от характера ответа на проводимую терапию, в лечебную программу вносятся необходимые коррективы. При выраженном ответе возможно хирургическое удаление первичной опухоли, а также отдаленных метастазов.
Важнейшим моментом является определение объема хирургического вмешательства. Главным условием операции при саркомах костей является радикальность удаления опухоли, которая должна гарантировать отсутствие местного рецидива. Радикальным считается удаление в пределах слоя здоровых мышечных тканей, отсутствие опухолевых клеток по линии костного спила, исключение вскрытия псевдокапсулы.
В зависимости от возраста больного, гистологической формы опухоли, степени ее местной распространенности, вовлечения сосудисто-нервных образований, характера ответа на предоперационное лечение определяется вид операции. Хирургические вмешательства при саркомах костей могут быть калечащими (ампутации, экзартикуляции) и сохраняющими конечность. Калечащие операции показаны при местно-распространенных саркомах, вовлекающих магистральные сосуды и нервы, мышцы, кожу, а также при угрозе распада опухоли. В остальных случаях, в первую очередь следует рассматривать возможность выполнения сохранной операции. Применяемая в последние годы предоперационная химиотерапия, может уменьшить размеры опухоли, способствовать ее отграничению псевдокапсулой и перевести в резектабельное состояние. Образовавшиеся после сегментарных резекций дефекты замещают с помощью металлических эндопротезов или костными трансплантатами. Существенно улучшаются исходы костной пластики при пересадке васкуляризированных трансплантантов с применением микрохирургической техники и внеочаговой фиксации аппаратом Илизарова.
Лучевая терапия используется только в сочетании с химиотерапией или в качестве предоперационной подготовки при ряде радиочувствительных сарком. Методика облучения, доза и источник зависят от возраста больного, локализации и размеров опухоли и характера планируемой операции.
Лекарственное лечение сарком костей высокой степени злокачественности стало применяться тогда, когда стало ясным, что эти опухоли склонны к ранней гематогенной диссеминации, что обусловливает их системный характер уже в момент установления диагноза.
ОСТЕОСАРКОМА
До 70-х годов прошлого столетия хирургический метод являлся основным в лечении данной опухоли. Несмотря на выполнение радикальных, чаще всего калечащих операций или проведение лучевой терапии, прогноз оставался крайне неблагоприятным. Более 90% больных с клинически локализованной опухолью погибали в течении ближайших двух лет от прогрессирования легочных метастазов. Стало очевидным, что дальнейший прогресс в лечении может быть достигнуть только путем системного воздействия на опухолевый процесс.
В первой половине 70-х годов прошлого столетия впервые была показана эффективность лекарственной терапии при метастатической остеосаркоме. Наиболее активными оказались доксорубицин, комбинация доксорубицин — цисплатин и метотрексат в высоких дозах. Использование этих цитостатиков после радикального удаления опухоли увеличило безметастатическую выживаемость с 7—20% в группах исторического контроля до 40—65%. В тот период органосохраняющие операции выполнялись не более чем у 40% больных, и главным образом в высокоспециализированных центрах.
Ключевую роль в развитии органосохраняющей хирургии сыграло внедрение в конце 70-х начале 80-х годов прошлого столетия предоперационной или, как ее называют в последние годы, индукционной химиотерапии. С учетом биологических особенностей остеосаркомы ее использование обосновывалось необходимостью раннего воздействия на субклинические метастазы, стремлением уменьшить размеры первичной опухоли, и улучшить тем самым условия для выполнения операции, уменьшением риска появления химиорезистентных клонов. Гистологический ответ в удаленной опухоли учитывается при планировании режима адьювантной химиотерапии. Эта стратегия была названа неоадьювантной и стала стандартом лечения остеосаркомы в большинстве клиник мира.
Арсенал активных в отношении остеосаркомы противоопухолевых препаратов относительно невелик. Это метотрексат в высоких дозах, антрациклиновые антибиотики (доксорубицин), производные платины (цисплатин) и ифосфамид.
Отдельно хотелось бы остановиться на регионарной химиотерапии, у истоков которой в начале 60-х годов прошлого столетия стоял академик Н. Н. Трапезников. Эта методика позволяет получить более высокую концентрацию препарата в зоне опухоли, при этом концентрация на системном уровне аналогична той, что достигается при внутривенном введении, т. е. достаточна для воздействия на микрометастазы.
Цисплатин является наиболее подходящим для артериального введения цитостатиком, так как частота осложнений не превышает 4%. Доксорубицин в артерию практически не вводится из-за выраженной локальной токсичности. При совместном регионарном введении цисплатина и доксорубицина частота экстравазаций и некрозов кожи может достигать 23%.
Доксорубицин в комбинации с артериальным введением цисплатина более эффективны, чем системное введение этих препаратов. По данным РОНЦ им. Н.Н. Блохина при артериальном введении цисплатина патоморфоз III—IV степени встречался более чем в 1,5, а полный некроз в 3 раза чаще. При внутривенном лечении риск рецидивирования был в 3, а после органосохраняющих операций в 5,5 раз выше, чем при регионарной химиотерапии.
Ответ опухоли на индукционную химиотерапию может быть оценен с помощью клинических, инструментальных, лабораторных и морфологических методов.
характеризуется уменьшением или исчезновением болевого синдрома, что обусловлено в первые дни и недели от начала химиотерапии в большей степени анальгезирующим эффектом цитостатиков, нежели регрессией опухоли. За счет регрессии внекостного компонента значительно снижается давление на внескелетные структуры, что приводит к улучшению или полному восстановлению функции конечности (рис. 7).
Методы лечения опухолей костей
В настоящее время принципы лечения некоторых видов злокачественных опухолей костей претерпели существенные изменения.
Радикальные хирургические вмешательства могут являться самостоятельными методами лечения исключительно доброкачественных и высокодифференцированных злокачественных опухолей (хондросаркома, фибросаркома, паростальная саркома).
Хирургическoe лечение опухолей костей
Хирургическое вмешательство является главным составным элементом почти любого комплекса лечебных мероприятий при опухолях костей.
К радикальным операциям при саркомах костей относятся ампутация, экзартикуляция и органосохраняющие операции. Ампутации и экзартикуляции выполняют в рамках радикального лечения или с паллиативной целью при далекозашедшем опухолевом процессе (распад опухоли с выраженной интоксикацией, кровотечение из эрозированных магистральных сосудов, патологические переломы с выраженным болевым синдромом).
Ампутация по возможности должна быть произведена на функционально выгодном уровне и технически выполнена так, чтобы получить полноценную культю с целью последующего оптимального протезирования.
При злокачественных опухолях ампутацию необходимо выполнять за пределами пораженной кости (рис. 42). Исключение составляют злокачественные новообразования, локализующиеся в Стегальном отделе бедра. В данном случае принято производить подвертельную ампутацию.
К расширенным, или сверхрадикальным, операциям относятся межподвздошно-брюшное вычленение и межлопаточно-грудную ампутацию (amputatio interscapulothoracica).
В связи с возросшей эффективностью лекарственного и лучевого лечения, применением радио- и химиомодификаторов в последнее время у больных с саркомами костей все чаще проводятся органосохраняющие операции, в выполнении которых можно выделить три этапа:
- радикальное удаление опухоли,
- реконструкция кости с использованием костного аутоаллотрансплантата или эндопротезирования,
- устранение дефекта мягких тканей и укрытие места резекции путем перемещения мышечных и кожно-мышечных лоскутов.
Органосохраняющие операции выполняются в рамках радикального лечения:
- высокодифференцированных низкозлокачественных новообразований в начальных периодах развития (хондросаркома, паростальная саркома, фибросаркома) в виде самостоятельного лечения;
- низкодифференцированных высокозлокачественных новообразований (остеосаркома, саркома Юинга, злокачественная фиброзная гистиоцитома, дедифференцированная хондросаркома и др.) в рамках комплексного лечения. К числу типичных органосохраняющих операций относятся:
- краевая резекция (применяется исключительно при саркоме Юинга);
- сегментарная резекция кости без замещения дефекта (применяется при локализации опухолей в малоберцовой и локтевой костях, ключице, ребрах, костях кисти, стопы и др.);
- сегментарная резекция кости с одномоментной костной аутоаллопластикой или эндопротезированием (линия резекции кости должна отстоять от рентгенологически установленного края опухолевого поражения на 5—6 см);
- экстирпация всей пораженной опухолью кости с замещением кости аллотрансплантатом (эндопротезом) или без замещения.
Противопоказаниями к органосохраняющим оперативным вмешательствам являются:
- вовлечение в опухолевый процесс основного сосудисто-нервного пучка, патологические переломы, инфицирование тканей в зоне опухоли, обширное опухолевое поражение мышц.
Лучевая терапия опухолей костей
Лучевая терапия в качестве самостоятельного вида лечения злокачественных опухолей костей в настоящее время практически не применяется. Иногда ее используют с целью паллиативного лечения больных с нерезектабельными опухолями, отдаленными или при невозможности выполнения радикального хирургического вмешательства.
Различные морфологические варианты злокачественных опухолей костей имеют значительные различия в чувствительности к лучевой терапии.
Традиционно считается, что остеосаркома, хондросаркома, фибросаркома являются радиорезистентными костными опухолями. Именно поэтому лучевая терапия в системе лечения больных, страдающих этими новообразованиями, применяется крайне редко.
Высокой радиочувствительностью обладает саркома Юинга и лимфома кости.
Тем не менее, несмотря на хороший ответ первичного опухолевого очага (вплоть до полной регрессии) на терапевтическое воздействие ионизирующей радиацией излечение наблюдалось лишь у 5—20% больных. Однако применение лучевой терапии в системе комплексного лечения с (или без) резекцией кости позволяет добиться излечения или длительной стабилизации опухолевого процесса в значительном числе случаев (до 60—70%).
Химиотерапия опухолей костей
В настоящее время уже не вызывает сомнений целесообразность включения химиотерапии в систему лечения больных злокачественными новообразованиями со сниженной дифференцировкой (остеосаркома, саркома Юинга и др.).
Применение различных схем и режимов неоадъювантной химиотерапии нашло широкое признание у всех онкологов, поскольку это позволяет осуществлять раннее воздействие на микрометастазы. Кроме того, в значительном числе случаев неоадъювантная химиотерапия позволяет уменьшить мягкотканный компонент опухоли, что технически упрощает органосохраняющее хирургическое вмешательство и снижает возможность диссеминации опухоли во время операции, облегчает выполнение органосохраняющей операции.
Еще одним преимуществом неоадъювантной химиотерапии является возможность на основании ответа опухоли на предоперационные курсы химиотерапии выделить группу больных высокого риска и применять у них чередующиеся курсы химиотерапии, позволяющие повысить шанс на излечение.
Адъювантная (послеоперационная) химиотерапия также является неотъемлемой составной частью комплексного лечения низкодифференцированных сарком костей. Основная ее цедь — подавление роста и уничтожение субклинических и микроскопических метастазов. Обычно проводится от 4 до 10 курсов послеоперационной химиотерапии, в зависимости от морфологической формы костной опухоли и степени лечебного патоморфоза. Однако несмотря на теоретическое и практическое обоснование применения химиотерапии у больных злокачественными новообразованиями костей, а также проведенные широкомасштабные международные исследования до сих пор отсутствует единая концепция по использованию какой-либо определенной комбинации противоопухолевых препаратов как при остеосаркоме, так и при саркоме Юинга.
При лечении остеосаркомы наиболее высокая эффективность установлена для комбинаций, включающих метотрексат, доксорубицин, цисплатин и ифосфамид.
В системе комплексного лечения саркомы Юинга хорошо себя зарекомендовали и используются комбинации доксорубицина, винкристина, ифосфамида, дактиномицина, этопозида и циклофосфана.
Критериями для выработки лечебной тактики являются общее состояние больного, гистологический тип, биологические особенности (степень злокачественности), размеры, объем, локализация, распространенность опухоли.
При высокозлокачественных саркомах (остеосаркома, саркома Юинга и др.) радикальное лечение предусматривает ликвидацию первичного очага поражения, профилактику и лечение отдаленных метастазов. С этой целью используются различные схемы комплексного лечения, включающие в себя пред- и послеоперационные курсы полихимиотерапии, оперативное вмешательство, лучевую терапию.
Для преодоления химио- и радиорезистентности костных сарком в схемы лечения вводятся модифицирующие воздействия; общая и локальная гипертермия, искусственная гипергликемия, гемосорбция.
Выбор тактики лечения и прогноз определяются типом рака кости, который диагностирован у пациента, и некоторыми другими факторами.
Разновидности рака костей
Остеосаркома — наиболее распространенная разновидность первичного рака костей. Чаще всего встречается в возрасте 10–30 лет, как правило, возникает в костях рук и ног, таза. Мужчины болеют чаще по сравнению с женщинами. Менее 10% случаев остеосаркомы приходится на людей старше 60 лет.
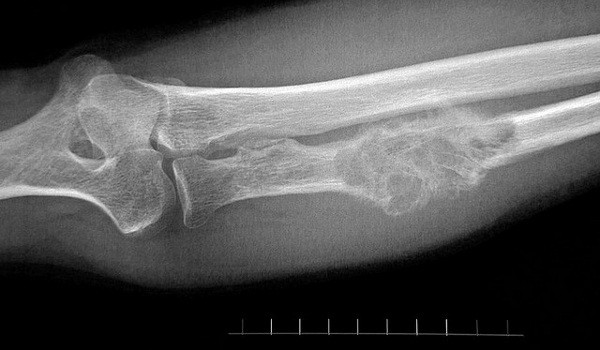
Хондросаркомы происходят из хрящевой ткани, это второй по распространенности тип первичного рака костей. Молодые люди до 20 лет болеют очень редко. С 20 до 75 лет риск возникновения хондросаркомы постепенно нарастает, мужчины и женщины болеют примерно одинаково часто. Хондросаркомы могут возникать в костях рук и ног, таза, черепа, в лопатке. Они могут начать расти и во внутренних органах, в которых присутствует хрящевая ткань, например, в гортани, трахее.
Саркома Юинга — третий по распространенности тип рака костей. Поражает детей, подростков, молодых людей. После 30 лет заболевание встречается крайне редко. Чаще всего опухоль локализуется в костях таза, нижних и верхних конечностях, лопатках, ребрах.
Злокачественная фиброзная гистиоцитома обычно локализуется в мягких тканях, в редких случаях — в костях. Заболевание преимущественно встречается в среднем и пожилом возрасте. При костной локализации чаще всего поражаются кости ног в области колена. Злокачественная фиброзная гистиоцитома склонна к локальному росту, но иногда может давать метастазы, например, в легких.
Фибросаркома также чаще встречается в мягких тканях. У людей среднего и пожилого возраста может поражать кости рук, ног.
Хордома — опухоль, которая чаще всего находится в основании черепа или позвоночном столбе. Обычно диагностируется после 30 лет, у мужчин примерно вдвое чаще, чем у женщин. Хондромы склонны к медленному локальному росту, в редких случаях дают метастазы в лимфатические узлы, печень.
Лечение рака костей
Лечением пациента со злокачественной опухолью костной ткани занимается команда врачей, в которую могут входить: онколог, хирург, специализирующийся в сфере ортопедии, химиотерапевт, врач лучевой терапии, ортопед, реабилитолог, психоонколог.
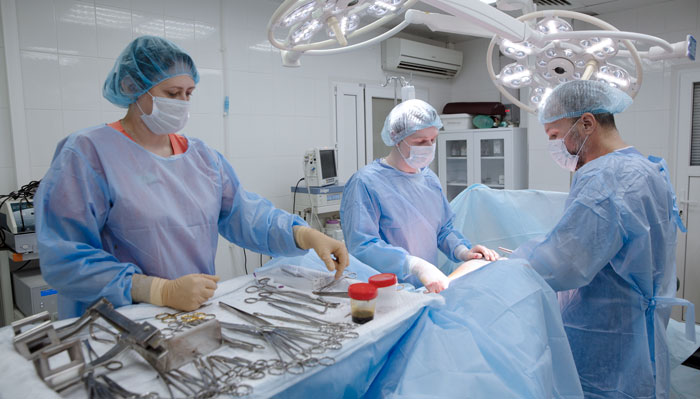
Хирургическое лечение рака костной ткани
Хирургия — основной радикальный метод лечения рака костей. В прошлом у большинства пациентов прибегали к ампутации — удалению всей конечности или ее части, пораженной опухолью. В настоящее время хирурги стараются отдавать предпочтение органосохраняющим вмешательствам. Удаленную часть кости заменяют костным трансплантатом или эндопротезом из металла, других материалов. Если приходится удалять фрагмент бедренной или плечевой кости, нижележащую часть конечности можно сохранить. При этом рука или нога станет короче, но сможет ограниченно выполнять свои функции.
Иногда в качестве альтернативы хирургическому вмешательству применяют криодеструкцию (разрушение опухолевой ткани низкой температурой), кюретаж (выскабливание специальным инструментом), введение в отверстие в кости цемента из полиметилметакрилата (при затвердевании он нагревается и разрушает опухолевые клетки).
Лучевая терапия при раке костей
Для того чтобы уничтожить опухолевые клетки в кости, требуются высокие дозы излучения, которые приводят к серьезным побочным эффектам. Поэтому лучевая терапия при раке костей находит ограниченное применение:
- Если опухоль невозможно полностью удалить хирургически.
- При положительном крае резекции по данным биопсии после операции.
- В качестве паллиативного метода лечения при рецидиве, чтобы уменьшить боль и отек.
Наиболее широкое применение лучевая терапия находит при саркомах Юинга.

Химиотерапия при раке костей
Химиотерапию чаще всего применяют для лечения остеосарком и сарком Юинга. Другие виды рака костей реагируют на нее плохо. Применяют различные химиопрепараты: цисплатин, доксорубицин, ифосфамид, этопозид, метотрексат, циклофосфамид, винкристин.
Иногда применяют таргетные препараты — лекарственные вещества, которые блокируют молекулы, необходимые для роста и выживания злокачественных опухолей.
Лечение при метастазах рака в костях
При лечении метастазов в костной ткани используют химиопрепараты, которые эффективны против первичной опухоли. Применяют лучевую терапию. Если метастатические очаги приводят к значительному разрушению костной ткани, назначают бисфосфонаты. Эти препараты вводят внутривенно каждые 3–4 недели, они помогают предотвратить патологические переломы, уменьшить боль, снизить уровень кальция в крови.

Хирургическое лечение носит паллиативный характер. При патологических переломах кости укрепляют с помощью винтов, стержней и других металлических конструкций. Иногда прибегают к радиочастотной аблации: в опухоль вводят иглу и подают на нее ток высокой частоты, который разрушает опухолевые клетки.
Реабилитация после лечения рака костей
После ампутации конечности показано протезирование. При правильно спланированных реабилитационных мероприятиях пациенты, перенесшие ампутацию нижней конечности, обычно могут снова ходить спустя 3–6 месяцев.
После органосохраняющих операций реабилитационный период продолжается дольше. Способность ходить восстанавливается примерно через год. Если не проводить реабилитационное лечение, возникает стойкая утрата функции конечности. При инфицировании, смещении или разрушении эндопротеза требуется повторное хирургическое вмешательство. Некоторым пациентам в последующем приходится выполнять ампутацию.
После наступления ремиссии и завершения лечения пациент должен находиться под наблюдением врача. При возникновении любых симптомов нужно посетить клинику и пройти обследование. Это помогает вовремя диагностировать рецидив рака в кости, метастазов в других органах.
Прогноз выживаемости
На прогноз влияют такие факторы, как тип и стадия рака кости, локализация и размер опухоли, возраст пациента. В среднем пятилетняя выживаемость (процент пациентов, которые остаются живы в течение 5 лет с момента диагностики заболевания) при всех типах злокачественных опухолей костей составляет 70%.
Стадии рака костей
Выделяют 4 стадии развития опухолей кости:
- 1 стадия: опухоль ограничена костью, не прорастает в соседние ткани, не распространяется в лимфатические узлы, отдаленные метастазы отсутствуют. Опухоль является высокодифференцированной и отличается низкой степенью агрессивности.
- 2 стадия: опухоль также ограничена костью, не прорастает в соседние ткани, но является низкодифференцированной (опухолевая ткань практически утратила черты нормальной ткани) и более агрессивной.
- 3 стадия: в кости имеется 2–3 очага, они могут быть высоко- или низкодифференцированными.
- 4 стадия: опухоль, которая распространилась за пределы кости в другие органы и ткани.

Причины и факторы риска рака костей
Точные причины возникновения злокачественных опухолей костей неизвестны. Некоторые факторы риска повышают вероятность развития заболевания:
- Остеосаркомы чаще диагностируют у людей, которые перенесли курс лучевой терапии и/или химиотерапии по поводу других типов рака.
- Риски остеосаркомы повышает применение металлических фиксирующих устройств (скоб, спиц, пластин, винтов) при переломах костей.
- Играют роль некоторые наследственные заболевания: наследственная ретинобластома (редкая злокачественная опухоль глаза), синдром Ли-Фраумени.
- У пожилых людей возникновению рака костей может предшествовать Болезнь Педжета — заболевание, при котором нарушается процесс естественного обновления костной ткани, и кости становятся хрупкими.
Симптомы злокачественных опухолей костей
Зачастую первым проявлением рака костей становится боль. Поначалу она возникает лишь во время сна и физических нагрузок, затем становится постоянной, мучительной. Если пораженный участок кости не прикрыт массивными мышцами и находится близко к коже, опухоль можно увидеть при визуальном осмотре, прощупать. Возникает отек.
Рак разрушает нормальную костную ткань, ослабляет кости, в итоге происходят патологические переломы от небольшого усилия. Во время перелома в кости возникает сильная острая боль. Если опухоль сдавливает нерв, в пораженной части тела появляется онемение, покалывание, слабость мышц (парезы, вплоть до паралича).
Похожие симптомы могут возникать и при других заболеваниях, например, при артритах, остеомиелите, после перенесенных травм. Рак костей встречается редко, но при возникновении болей в костях без видимой причины лучше сразу посетить врача и провериться.
Методы диагностики
Компьютерная томография помогает уточнить размеры, расположение, количество опухолевых очагов, степень прорастания в окружающие ткани, обнаружить метастазы в лимфатических узлах и внутренних органах. По показаниям назначают МРТ: она помогает лучше визуализировать опухоль, оценить состояние мягких тканей, головного и спинного мозга.
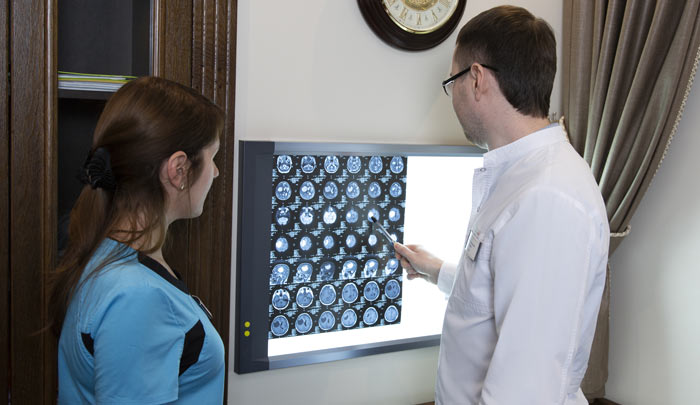
В поиске мелких метастазов помогает позитронно-эмиссионная томография. Во время исследования в организм вводят молекулы сахара с радиоактивной меткой. Опухолевые клетки поглощают радиофармпрепарат и становятся видимыми на снимках, выполненных специальным аппаратом.
Наиболее точный метод диагностики онкологических заболеваний — биопсия. Во время исследования получают фрагмент предположительно опухолевой ткани и отправляют в лабораторию для изучения внешнего вида клеток, строения ткани, молекулярно-генетических характеристик. Биопсию можно провести разными способами:
- При тонкоигольной биопсии используют шприц с иглой. Если кость находится глубоко, скрыта мышцами, процедуру проводят под контролем компьютерной томографии.
- При трепан-биопсии используют толстую иглу диаметром примерно полтора миллиметра. Считается, что этот метод лучше, чем тонкоигольная биопсия, он позволяет установить более точный диагноз.
- Иногда для исследования нужен большой фрагмент кости. В таких случаях проводят эксцизионную или инцизионную биопсию: выполняют хирургическое вмешательство, удаляют всю опухоль или ее часть.
Читайте также:

