Первая линия терапии рака
Последние мои публикации были посвящены результатам применения ингибиторов контрольных точек иммунного ответа в первой линии системной терапии немелкоклеточного рака легкого (НМРЛ). Результаты исследований, доложенные на прошедших конгрессах AACR и ASCO в этом году, полностью изменили наше представление о характере ее проведения.
Уместно вспомнить, что еще в декабре 2016 года схема лечения метастатического НМРЛ была предельна проста. Больные аденокарциномой с активирующими мутациями были кандидатами для получения таргетных препаратов. В случае прогрессирования после ингибиторов тирозинкиназы больным было показано назначение химиотерапии. Остальные больные НМРЛ были кандидатами для получения химиотерапии. У больных аденокарциномой в качестве химиотерапии первой линии преимущественно назначали комбинации цисплатина и пеметрекседа или карбоплатина и паклитаксела. У больных плоскоклеточным раком в качестве химиотерапии первой линии назначали комбинацию цисплатина и гемцитабина или цисплатина и паклитаксела. В случае прогрессирования больным назначали вторую линию препаратами пеметрексед или доцетаксел.
Все изменилось в декабре 2016 года, когда стали доступны результаты исследования KEYNOTE 024, в котором проводили сравнение между ингибитором PD-1 пембролизумабом и химиотерапией в качестве первой линии у больных НМРЛ с экспрессией PD-L1 более 50%. Столь высокая экспрессия PD-L1 диагностируется у 25-30% больных НМРЛ независимо от гистологии опухоли. Назначение пембролизумаба в первой линии достоверно снизило относительный риск прогрессирования на 50% и риск смерти на 37% по сравнению с химиотерапией [1]. Медиана продолжительности жизни в группе пембролизумаба достигла 30,0 мес. по сравнению с 14,2 мес. в группе химиотерапии при одновременной лучшей переносимости лечения [2]. В связи с этим пембролизумаб был рекомендован в качестве предпочтительной первой линии системной терапии у больных как аденокарциномой, так и плоскоклеточным раком с высокой экспрессией PD-L1. Ни ниволумаб, ни атезолизумаб в монотерапии не смогли продемонстрировать преимущество перед химиотерапией у больных НМРЛ.
В исследовании KEYNOTE 189 у больных аденокарциномой независимо от экспрессии PD-L1 проведено сравнение химиотерапии и комбинации химиотерапии и пембролизумаба. Комбинация пембролизумаба и химиотерапии продемонстрировала лучшие отдаленные результаты по сравнению с химиотерапией только, достоверно уменьшив относительный риск прогрессирования и смерти на 48% и 51% соответственно [3]. Преимущество комбинации отмечено во всех изученных подгруппах, в том числе и у больных с различной экспрессией PD-L1. Относительный риск смерти при добавлении пембролизумаба был снижен на 41% в группе с отсутствием экспрессии PD-L1, на 45% – в группе с экспрессией PD-L1 1-49% и на 58% – в группе с экспрессией более 50%. Остается неясным, есть ли выигрыш от использования комбинации химиотерапии и пембролизумаба в сравнении с пембролизумабом только, который в монотерапии показал прекрасные результаты у больных с высокой экспрессией PD-L1. При этом большинство специалистов рекомендуют монотерапию пембролизумабом у больных с высокой экспрессией, резервируя использование комбинации с химиотерапией для больных аденокарциномой с низкой экспрессией (менее 50%) или ее отсутствием.
В исследовании iMPower 150 у больных с аденокарциномой независимо от экспрессии PD-L1 оценена целесообразность добавления атезолизумаба к комбинации химиотерапии и бевацизумаба. При медиане наблюдения 9,5 мес. добавление атезолизумаба достоверно уменьшило относительный риск прогрессирования на 38% и риск смерти на 22% по сравнению с комбинацией химиотерапии и только бевацизумаба [4]. Улучшение результатов лечения при добавлении атезолизумаба было отмечено у всех больных, независимо от уровня экспрессии PD-L1. Интерес представляет наблюдение о высокой активности комбинации атезолизумаба, бевацизумаба и химиотерапии у больных с активирующими мутациями при прогрессировании на фоне ингибиторов тирозинкиназы.
Оставалась еще одна группа больных, для которой требовалось определить эффективность иммунотерапии в первой линии. Это больные с плоскоклеточным раком и экспрессией PD-L1 менее 50%. В исследовании KEYNOTE-407 проведено сравнение химиотерапии и комбинации химиотерапии и пембролизумаба у больных IIIb-IV стадией плоскоклеточного рака независимо от уровня экспрессии PD-L1. При медиане наблюдения 8 месяцев назначение комбинации привело к снижению относительного риска смерти на 36% и прогрессирования на 44% по сравнению с химиотерапией [5]. Увеличение продолжительности жизни при добавлении пембролизумаба наблюдалось во всех анализируемых подгруппах, в том числе и при различной экспрессии PD-L1. Сделан предварительный вывод, что добавление пембролизумаба к химиотерапии достоверно и существенно улучшает отдаленные результаты лечения больных плоскоклеточным раком легкого независимо от уровня экспрессии PD-L1. Полученные результаты являются серьезным аргументом для регистрации комбинации пембролизумаба и химиотерапии в качестве предпочтительной первой линии системной терапии у больных плоскоклеточным раком с низкой экспрессией PD-L1.
Для больных плоскоклеточным раком независимо от уровня экспрессии PD-L1 в исследовании iMpower 131 проведено сравнение химиотерапии и комбинации химиотерапии и атезолизумаба. При медиане наблюдения 17 мес. добавление атезолизумаба к химиотерапии уменьшило относительный риск прогрессирования на 29% по сравнению с только химиотерапией, не оказав влияния на показатели общей выживаемости [6].
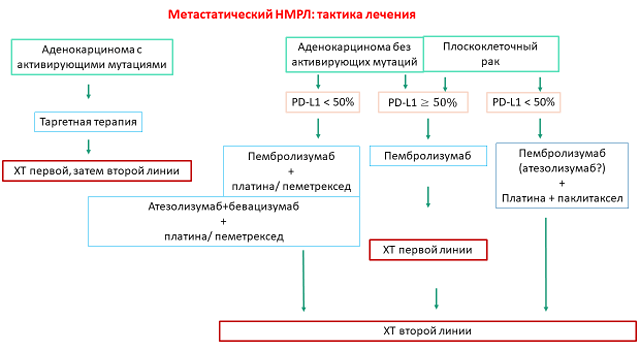
Рисунок 1. Тактика лечения больных метастатическим НМРЛ (по результатам проведенных исследований).
Таким образом, проведенные исследования изменили рекомендации по выбору первой линии системной терапии у больных НМРЛ (рис. 1). Химиотерапия, которая была до недавнего времени основным методом лечения этих больных, потеряла свое самостоятельное значение. У больных с высокой экспрессией PD-L1, вероятно, достаточно назначения одного пембролизумаба. У больных с аденокарциномой и низкой экспрессией PD-L1 показано назначение пембролизумаба и химиотерапии или комбинации атезолизумаба, бевацизумаба и химиотерапии. У больных с плоскоклеточным раком и низкой экспрессией PD-L1 рекомендовано назначения комбинации пембролизумаба и химиотерапии. Возможно, для этой группы больных будет рекомендована комбинация атезолизумаба и химиотерапии.
Теперь для определения тактики лечения нам необходимо кроме гистологии и наличия активирующих мутаций в опухоли знать уровень экспрессии PD-L1. Российское общество клинической онкологии в рамках программы молекулярно-генетической диагностики (www.cancergenome.ru) начало определение экспрессии PD-L1 в опухоли. Хочется надеяться, что использование моноклональных антител ингибиторов контрольных точек иммунного ответа отдельно или совместно с химиотерапией станут доступны и российским онкологам, что непременно приведет к существенному улучшению отдаленных результатов лечения больных метастатическим НМРЛ.
Ключевые слова: немелкоклеточный рак легкого, пембролизумаб, атезолизумаб, химиотерапия.
- Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N. Engl. J. Med. 2016; 375 (19): 1823-1833.
- Brahmer JR, Rodríguez-Abreu D, Robinson AG, et al. Health-related quality-of-life results for pembrolizumab versus chemotherapy in advanced, PD-L1-positive NSCLC (KEYNOTE-024): a multicentre, international, randomized, open-label phase 3 trial. Lancet Oncol. 2017 Dec; 18(12): 1600-1609.
- Gandhi L, Rodriguez-Abreu D, Gadgeel S, et al. KEYNOTE-189: randomized double-blind, phase 3 study of pembrolizumab or placebo plus pemetrexed and platinum as first-line therapy for metastatic NSCLC. AACR 2018.
- Socinsky M.A., Jotte R.M., Cappuzzo F, et al. Atezolizumab for first-line treatment of metastatic nonsquamous NSCLC. N. Engl. J.Med 2018, published online June 4.
- Paz-Ares L, Luft A, Tafreshi A, et al. KEYNOTE-407: phase 3 study of carboplatin-paclitaxel/nab-paclitaxel with or without pembrolizumab for metastatic squamous NSCLC. ASCO 2018.
- Jotte RM, Cappuzzo F, Vynnychenko I, et al. IMpower131: Primary PFS and safety analysis of a randomized phase III study of atezolizumab + carboplatin + paclitaxel or nab-paclitaxel vs carboplatin + nab-paclitaxel as 1L therapy in advanced squamous NSCLC. ASCO 2018; abstract LBA9000.
С помощью лекарств сегодня лечат большинство опухолей. Это самый универсальный и самый распространенный метод лечения рака в силу его особенностей:
С развитием нанотехнологий, молекулярной медицины и генной инженерии в портфеле онкологов появились множество новых противоопухолевых препаратов, лекарства стали более избирательными к злокачественным клеткам и менее токсичными для здоровых тканей и организма в целом. Появились прицельные лекарства, так называемые таргетированные, молекулы которых воздействуют более избирательно на клетки рака.
Все лекарства против рака по механизму действия делят на цитостатические и цитотоксические. Первые, цитостатические, тормозят размножение злокачественных клеток и вызывают их апоптоз, или программу самоуничтожения, клеточный распад. Вторые, цитотоксические, препараты вызывают гибель клеток вследствие их интоксикации, разрушения оболочки и ядра клетки, других структур, и в конечном итоге некроз опухоли.
Учитывая разные механизмы действия, в большинстве случаев онкологи подбирают комбинацию из двух-трех препаратов разных фармакологических групп.
К лекарственному лечению онкологических заболеваний относят:
- Химиотерапию.
- Гормональную терапию.
- Иммунотерапию.
- Таргетную терапию.
- Фотодинамическую терапию.
Лекарственное лечение обычно проводится курсами. Курс включает время введения препарата (от 1 до 5 дней для внутривенных препаратов, может быть дольше для таблетированных препаратов) и время перерыва для восстановления организма и снижения риска побочных эффектов лечения. Перед началом каждого нового курса обычно производится контроль анализов крови и консультация врача онколога для решения вопроса о необходимости корректировки доз препаратов и/или увеличения интервала до следующего введения препарата.
Химиотерапия – наиболее распространённый вид лекарственной терапии. Химиотерапия бывает:
1. Лечебной – когда химиотерапия является основным методом лечения заболевания. Например, для многих пациентов с лейкозами, лимфомами, герминогенными опухолями яичка химиотерапия может быть основным методом лечения, который часто приводит к выздоровлению. Для большинства пациентов с распространёнными формами рака, с метастазами в различные органы, химиотерапия является основным методом лечения, дающим максимальную возможность длительно сдерживать болезнь.
2. Неоадъювантной – когда химиотерапия предшествует основному методу лечения. Чаще всего такая химиотерапия назначается перед некоторыми видами операций, с целью уменьшения опухоли и снижения активности её клеток.
К наиболее распространённым противоопухолевым препаратам относят следующие группы:
1. Алкилирующие антинеопластические препараты.
Механизм их действия основан на внедрение алкильной группы препарата к ДНК раковой клетки: происходит нарушение структуры ДНК и она не может дальше делиться, запускается апоптоз. В эту группу входят: производные бис-B-хлорэтиламина - исторически первые цитостатические противоопухолевые средства; производные нитрозомочевины и препараты платин, содержащие двухвалентную платину.
Неклассические алкилирующие агенты, пролекарства, которые для проявления своей противоопухолевой активности должны пройти ряд метаболических превращений в организме, в результате которых образуются метилирующие агенты. Последние, внедряясь в ДНК и РНК раковой клетки, не позволяют ей дальше делиться.
Конкурентно вмешиваются в процесс деления клетки, вызывая ее апоптоз.
Механизм их действия основан на цитотоксическом действии. Они ингибируют синтез ДНК, нарушают проницаемость клеточных мембран и другие механизмы жизнедеятельности клеток.
Цитостатические препараты, избирательно нарушающие структуру ДНК и деление раковых клеток на разных этапах.
Химиопрепараты в большинстве случаев вводятся внутривенно или перорально, тогда они оказывают системное воздействие на весь организм. Но могут быть использованы и местно, например, во время хирургической операции для обработки операционного поля, или регионарно, например, в желудочки головного мозга.
Показана только для гормоночувствительных видов рака. Будет ли опухоль реагировать на лечение гормонами или нет, определят с помощью специальных анализов и лабораторных исследований клеточного материала, взятого из опухоли.
Опухоли, реагирующие на гормоны, часто обнаруживают в репродуктивной системе и железах внутренней секреции, например, это:
- рак молочной железы
- рак предстательной железы
- рак яичников
- рак эндометрия (рак тела матки).
Гормонотерапия может быть назначена до удаления опухоли с целью стабилизации ее роста или уменьшения размера, тогда она называется неоадъювантной. Или после - с целью предотвратить повторный рост или метастазирование, такую терапию называют адъювантной.
На поздних неоперабельных стадиях опухолей, чувствительных к данному лечению, гормональная терапия может использоваться в качестве основного лечения. Как паллиативное лечение некоторых видов рака она достаточно эффективна и может продлить жизнь пациента на 3-5 лет.
Иммунитет играет важную роль в профилактике и борьбе с раком. В норме иммунные тельца распознают атипичную клетку и убивают ее, защищая организм от развития опухоли. Но когда иммунитет нарушается в силу разных причин, и раковых клеток становится много, тогда опухоль начинает расти.
Иммунотерапия при раке помогает организму справится с заболеванием за счет активизации защитных ресурсов и не допустить развития повторных опухолей и метастазов. В онкологии используют интерфероны, вакцины от рака, интерлейкины, колониестимулирующие факторы и другие иммунные препараты.
Лечение подбирает иммунолог на основе лабораторных данных о состоянии иммунной системы онкопациента совместно с лечащим врачом-онкологом и другими специалистами, участвующими в лечении конкретного пациента.
Основные механизмы иммунотерапии:
- подавление роста опухолевых клеток и их последующее уничтожение;
- профилактика рецидива опухоли и образования метастазов;
- уменьшения побочного влияния противоопухолевых средств, лучевой терапии;
- профилактика инфекционных осложнений при лечении опухолей.
От английского target - цель, мишень. Относят к перспективным методам молекулярной медицины, будущему в лечении онкопатологий, как и разработку вакцин против рака.
Таргетные лекарства очень специфичны и разрабатываются под конкретный мутировавший ген раковой клетки данного вида опухоли. Поэтому до таргетного лечения обязательно проводят генетическое исследование материала, взятого на биопсию.
Например, разработаны эффективные таргетные препараты для лечения различных генетических форм рака молочной железы, множественной миеломы, лимфомы, рака предстательной железы, меланомы.
В силу своей специфики и целевого попадания на раковую клетку-мишень таргетные препараты более эффективны для лечения опухолей, чем например, классические противоопухолевые. И менее вредны для нормальных клеток, не обладающими характеристиками опухолевых. Многие таргетные методы относят к иммунотерапии, так как по сути они формируют нужный иммунный ответ.
Осуществляется препаратами, воздействуя световым потоком определённой длины волны на раковые клетки и разрушая их.
Самое известное и пугающее онкопациентов осложнение после химиотерапии - выпадение волос. Происходит потому, что противоопухолевые препараты токсичны для молодых активно делящихся клеток, какими являются в том числе волосяные фолликулы и ногтевые пластины. На практике далеко не все виды химиотерапии вызывают выпадение волос. Это осложнение характерно для узкого спектра препаратов, многие пациенты с ним не сталкиваются. На время действия препарата может снижаться активность обновляющихся клеток организма, из-за чего перестают расти ногти и волосы, происходит выпадение волос, угнетается система кроветворения. После курса химиотерапии необходим восстановительный период, в течение которого организм приходит в норму.
Выраженные осложнения наблюдаются далеко не у всех пациентов, но риск их возрастает с увеличением продолжительности лечения.
Часто встречаются следующие побочные эффекты после проведения лекарственной терапии:
- выпадение волос, ломкость ногтей;
- тошнота, рвота;
- нарушение аппетита, изменение вкуса;
- анемия, кровотечение;
- нарушение иммунитета;
- диарея;
- бесплодие, нарушение сексуальной и репродуктивной сферы.
Большинство осложнений поддаётся корректировке, при правильном проведении лечения многие из них можно предотвратить или остановить при первом проявлении. Тяжёлые осложнения могут быть причиной увеличения интервалов между курсами химиотерапии.
Чем раньше обнаружен рак и точнее диагностирован тип опухолевых клеток, тем успешнее лечение рака и благоприятнее прогноз выздоровления. Поэтому следует постоянно следить за состоянием своего здоровья, проходить диагностические исследования согласно возрасту, не закрывать глаза на недомогание или периодический дискомфорт в теле. Также лучше не тратить время на попытки вылечиться самостоятельно или при помощи нетрадиционной медицины, не имеющей никаких убедительных данных об эффективности, игнорируя современные методы медицинского лечения. Так можно только запустить онкологический процесс, усугубить стадию заболевания и затруднить последующее лечение. Не теряйте драгоценное время, обследуйтесь в специализированных центрах на современном оборудовании у высококвалифицированных врачей.
Первая линия химиотерапии рака яичника (Июль 2020).
Лечение или терапия первой линии просто относится к начальному или первому лечению, рекомендованному для заболевания или заболевания. Их также можно отнести к первичному лечению, первичному лечению или индукционной терапии. При многих состояниях, включая рак, существует множество возможных способов лечения, которые могут быть эффективными. Ожидается, что лечение первой линии для большинства людей даст наилучшие результаты с наименьшим количеством побочных эффектов. Напротив, лечение второй линии используется, когда лечение первой линии не помогло улучшить рак, или если оно работало некоторое время, а затем рак прогрессировал.
Понимание лечения первой линии
Лечение первой линии против второй линии
В отличие от лечения первой линии, лечение второй линии обычно представляет собой лечение, которое выбирается после того, как лечение первой линии не достигло цели (либо оно не работает, либо все, либо оно работает в течение определенного периода времени, а затем перестает работать), или имеет побочные эффекты, требующие прекращения использования этого лечения. Лечение второй линии часто уступает лечению первой линии, но не всегда. Например, при метастатическом раке молочной железы терапия второй линии, как правило, не контролирует рак так долго, как терапия первой линии. В некоторых случаях существует два (или более) метода лечения, которые могут давать очень похожие результаты (и иметь похожие побочные эффекты), и лечение второго ряда может быть одинаково эффективным по сравнению с лечением первого ряда.
Третья линия терапии и многое другое
В дополнение к лечению первой и второй линии, часто есть и другие варианты. Например, при метастатическом раке молочной железы вы можете услышать, как ваш онколог говорит о терапии четвертой или пятой линии. Эту терапию можно попробовать, когда лечение первой, второй и третьей линии больше не работает для борьбы с раком.
Это может измениться для того же рака
Каждый рак отличается, и важно помнить об этом, если вы слышите о другом лечении рака вашего типа. Первая линия лечения одного рака определенного типа и стадии может отличаться от первой линии лечения рака другого человека того же типа и стадии, но другого молекулярного профиля. В дополнение к этому, другие факторы, такие как возраст, общее состояние здоровья и сосуществующие состояния, могут сделать то, что является лечением первой линии для одного человека, в качестве терапии второй линии для другого.
Лечение первой линии - выбор
Мы вступаем в эру, известную как ' совместная медицина«в котором люди, больные раком, гораздо больше участвуют в оказании медицинской помощи. Решения принимаются командой, а не патерналистскими отношениями между врачами и пациентами прошлого. После обсуждения и изучения как можно больше информации о вашем раке, у вас, скорее всего, будет выбор между разными подходами.
Вопросы
Когда вы и ваш врач рассматриваете лечение первой линии или лечение первой линии, продумайте эти вопросы.
- Уточнить тип, стадию и молекулярный профиль вашей опухоли. Есть ли дальнейшее тестирование, которое должно быть сделано? (Если у вас был диагностирован прогрессирующий рак, спросите о молекулярном профиле вашей опухоли, и если это не было сделано, спросите, почему нет).
- Какова ваша цель в получении этого лечения? У разных людей разные цели. Некоторые люди хотят быть настолько агрессивными, насколько это возможно (и терпеть любые побочные эффекты), чтобы иметь шанс продлить жизнь, тогда как другие могут выбрать меньшее количество побочных эффектов и лучшее качество жизни, даже если выживание может быть короче.
- Какие побочные эффекты вы готовы терпеть? Побочные эффекты, которые люди готовы терпеть, могут сильно различаться. Некоторые люди хотят избежать кожных высыпаний, в то время как другие считают усталость худшим симптомом. Некоторые люди могут хотеть избежать тошноты любой ценой, в то время как другие не будут испытывать тошноту, если их усталость будет слабее.
- Что такое лечение второй линии, если это лечение не работает? Как насчет третьей, четвертой и других строк? Некоторым людям очень полезно знать, каковы могут быть следующие шаги, если их текущее лечение не работает.
- Существуют ли какие-либо клинические испытания, которые могут лучше соответствовать вашим потребностям? Спросите об этом или изучите их сразу же, так как некоторые препараты первой линии могут лишить вас возможности участвовать в некоторых клинических исследованиях. Если вы рассматриваете возможность клинического испытания, но хотели бы сначала попробовать другое лечение, спросите, может ли рассматриваемое вами лечение отвести вас от участия в этом клиническом исследовании в будущем.
- Какова стоимость для вас лечения (ы)?
- Каков средний показатель успешности лечения (й)?
- Каковы некоторые возможные риски?
- Как скоро вам нужно будет начать лечение?
- Где бы вы порекомендовали мне второе мнение?
Был некоторый интерес (и много интернет-мошенничества) с альтернативными подходами, которые замена другое лечение для обычных методов лечения. Это опасно, и в настоящее время нет альтернативных методов лечения, которые можно было бы считать лечением рака первой линии.
Слово от DipHealth
Лечение первой линии - это те, которые вы и онколог выберете как лучший выбор для вашего конкретного рака. Часто доступно несколько различных вариантов, но лечение первой линии - это те, которые, как ожидается, будут контролировать вашу болезнь с наименьшим количеством побочных эффектов в процессе. Является ли терапия второй линии с вашим раком неполноценной или взаимозаменяемой, с терапией первой линии будет зависеть от множества различных факторов. Потратьте время, чтобы узнать о своем раке, чтобы вы могли сделать осознанный выбор, какие методы лечения должны стать для вас лечением первой линии.


Как проходит первая химиотерапия — один из самых частых вопросов пациентов и их близких. Химиотерапия (ХТ) пугает не меньше самого злокачественного процесса и добавляет негатива восприятию своего заболевания. Боятся осложнений, но главное — в неизвестности непосредственной реакции и отдалённого результата — вдруг мучения окажутся напрасными.
- Как проходит?
- Подготовка к химиотерапии
- Режим и время приема препаратов
- Длительность курса химиотерапии
- Количество курсов химиотерапии и побочные эффекты
- Можно ли прерывать курс?
- Перерыв между курсами химиотерапии
- 1-й курс химиотерапии
Как проходит?
Химиотерапия предполагает использование цитостатиков, но на практике так называют любое противоопухолевое лекарственное лечение, в том числе использование таргетных и иммуно-онкологических препаратов. Что логично, поскольку они объединяются в схемы с цитостатиками, дополняют курсы химиотерапии и приходят на смену цитостатическим средствам при неэффективности.
Выбор схемы и входящих в неё лекарств обусловлен локализацией злокачественного процесса, так по-разному лечат рак молочной железы и карциному желудка. Лекарства подбираются по морфологической структуре опухоли, то есть плоскоклеточный рак и аденокарцинома легкого неодинаково чувствительны к лекарственным препаратам.
Способы проведения курса химиотерапии многообразны:
Подготовка к химиотерапии
Обязательное условие для начала любой химиотерапии у любого больного — морфологическая верификация злокачественного процесса, то есть полученный при биопсии или во время операции кусочек опухоли изучен под микроскопом, заболевание классифицировано и доказано, что это точно злокачественный процесс. В сомнительных случаях, когда нет 100% уверенности, что это рак, саркома, меланома, лейкоз и так далее, химиотерапию проводить нельзя.
К первому курсу химиотерапии пациент подходит полностью обследованным, если планируется предоперационная или неоадъювантная ХТ, или уже получившим на первом этапе радикальное лечение в виде операции, по необходимости дополняемой профилактической или адъювантной ХТ.
Обследованным пациент будет считаться, когда:
- определены все зоны локализации опухолевого процесса и размеры узлов;
- выяснено состояние сердечно-сосудистой и дыхательной систем, ЦНС и ЖКТ — есть понимание объективного состояния организма, объем функций и ограничений со стороны других органов позволяет провести терапию определенной комбинации и длительности;
- в биохимическом и клиническом анализах крови, анализе мочи все показатели в норме, то есть нет доказательств недостаточности функциональных возможностей и скрыто протекающих патологических состояний;
- при некоторых злокачественных процессах необходима информация о концентрации опухолевых маркёров, что в дальнейшем позволит оценить эффективность терапии.
Режим и время приема препаратов
Каждое лекарственное средство имеет собственный профиль фармакологического действия, требует определенного способа введения в кровь больного и оптимальную дозу на введение.
Разовая дозировка рассчитывается на килограмм веса больного или на кожную поверхность. Для набора достаточной цикловой дозы какое-то лекарство необходимо принимать несколько недель каждый день, что-то требуется вводить раз в неделю, а что-то можно ввести один раз на целых три недели.

Длительность курса химиотерапии
Курс ХТ состоит их нескольких циклов, где цикл предполагает введение определенной комбинации препаратов — схемы в определенной дозе и с определенными интервалами, если необходим набор суммарной дозы. Так циклом считается 14-дневный пероральный прием капецитабина, пять введений раз в неделю винорельбина или введение за один день сразу двух препаратов — паклитаксела и доксорубицина.
Несколько таких циклов составляют курс или одну линию химиотерапии. Оптимальная длительность курса с числом циклов определяется в клинических исследованиях, где учитывается не только процент наилучших результатов, но и накопление токсичности — кумулятивный эффект.
Количество курсов химиотерапии и побочные эффекты
Курсы проводятся пока можно надеяться на уменьшение злокачественной опухоли. Как уменьшение опухоли, стабилизация ракового процесса тоже свидетельствует о пользе лечения и говорит об уничтожении популяции чувствительных к цитостатикам клеток. Прогрессирование процесса на фоне лечения свидетельство неэффективности ХТ и необходимости смены комбинации лекарств.
Стандартная комбинация, предлагаемая для первого применения, самая результативная при данной структуре рака и не самая агрессивная. Второй рекомендуется менее эффективная схема лечения, третьей — ещё менее полезная. Для большинства злокачественных процессов разработано три линии лечения, то есть с той или иной пользой можно провести три курса ХТ из нескольких циклов, дальнейшая терапия малоперспективна и точно обещает побочные эффекты, но не позитивный результат.
Когда на первых циклах при нескольких линиях химиотерапии опухоль уменьшалась, а потом возобновляла рост, клетки можно считать чувствительными и есть основания для использования четвёртой-пятой линий.
Ограничить непрерывную смену линий могут побочные эффекты и истощение ресурсов организма по восстановлению химиотерапевтических повреждений. Так с каждым циклом ХТ всё дольше восстанавливается кроветворение, всё выраженнее повреждение почек и периферических нервов, всё труднее печени бороться с интоксикацией.
Можно ли прерывать курс?
Прерывать курс нежелательно, для лучшего результата необходимо соблюдать разовые и суммарную дозы и интервалы между введениями. Тем не менее, приходится прекращать лечение при опасных для жизни осложнениях, в том числе снижении ниже критического уровня лейкоцитов и тромбоцитов, развитии стоматита и проявляющегося поносами лекарственного колита.
Перерыв между курсами химиотерапии
Перерыв между курсами зависит от достигнутого результата — ремиссии заболевания. Частичная ремиссия — когда клетки опухоли находятся в спящем режиме, полная — полностью уничтожены все проявления болезни. Свободный от проявлений злокачественной опухоли интервал может занять месяцы и годы, период ремиссии очень индивидуален и предсказать его длительность невозможно.
1-й курс химиотерапии
Первый курс обязательно завершится, и совершенно точно, что пройдет он не так, как предполагал пациент. Химиопрепараты убивают не только раковые клетки, но и нормальные, поэтому невозможно предугадать переносимость, гораздо важнее достигнутый в результате лечения результат. Переносимость следующего цикла будет отличаться от предыдущего, потому что на спектре и частоте осложнений сказывается состояние здоровья и настроение, погода и качество препаратов, время года и состояние пищеварения, и ещё много чего.
Клинические исследования выявили оптимальный курс для начала лечения, но это не означает, что у конкретного пациента первая химиотерапия будет самой эффективной, вполне возможно, что второй или даже третий курс дадут лучшие результаты.
Чувствительность злокачественных клеток к лекарствам очень индивидуальна, предсказать её помогает анализ, который выполняют в Европейской клинике. Известна вероятность развития осложнений, но какими они будут и будут ли вообще, сказать невозможно. Тем не менее, в Европейской клинике для каждого пациента рассчитывается индивидуальная программа сопровождения химиотерапии, помогающая перенести лечение с наименьшими потерями для здоровья при максимально возможном результате.
Читайте также:

