Осложнения лекарственной терапии злокачественных опухолей
Иммунотерапия: как всё начиналось
Иммунотерапию можно назвать старейшим видом лечения злокачественных новообразований. И в античных, и в средневековых источниках описывались случаи, когда злокачественные опухоли, как правило, локализующиеся на видимых участках тела, значительно уменьшались после явного воспаления с лихорадкой или каких-то других воспалительных заболеваний, перенесённых человеком.
Одним из примеров такого исцеления можно назвать чудо, произошедшее с итальянским святым Пеллегрино Лациози (1265-1345) у которого после сильной лихорадки регрессировала опухоль правой ноги. То есть произошёл сильный запуск местного иммунитета, который привёл к самоизлечению злокачественного процесса.
Научные изыскания в сфере влияния иммунитета на злокачественные новообразования ведутся с 70-80-х годов XX века. И сегодня, на наших глазах, произошло прорывное событие в онкологии и в лекарственной терапии злокачественных опухолей – разработана и внедрена в клиническую практику иммуноонкологическая терапия.
Создатели современного метода иммунотерапии: Джеймс Эллисон и Тасуку Хондзо в 2018 году были удостоены Нобелевской премии – открытый ими принцип положил начало иммуноонкологическим препаратам.

В настоящее время это направление активно развивается – расширяется список онкологических заболеваний, при которых показано и эффективно лечение иммунными препаратами, применяемыми в клинической практике. Используются различные комбинации иммуноонкологических препаратов, они сочетаются либо с другими иммуноонкологическими, либо с таргетными или химиотерапевтическими препаратами.
Действующие сегодня стандарты лечения предполагают применение иммуноонкологической терапии в лечении пациентов после хирургического вмешательства, в рамках так называемой адъювантной, то есть поддерживающей терапии. Сейчас изучается возможность лечения иммуноонкологическими препаратами пациентов с ранними стадиями онкологических заболеваний перед хирургическим вмешательством – в неоадъювантном режиме. То есть стандарты использования этой группы препаратов, скорее всего, будут пересмотрены, а применение расширено.
Как работает иммунная система, и каким образом на неё действует иммунотерапия
Иммунитет – особая биологическая система в пределах нашего организма, которая работает по своим сложным алгоритмам. Она обладает способностью активироваться при любом инфекционном, воспалительном процессе, в то же время у неё есть и собственные подавляющие механизмы.
Когда опухолевые клетки только зарождаются в организме человека в результате генетических мутаций, влияния канцерогенных факторов и др., иммунная система их уничтожает. Но на каком-то этапе вдруг наступает сбой, и происходит её торможение. На самом деле, это нормальная, непатологическая функция иммунитета, которая включается и у здорового человека.
В чём её назначение? Известен целый ряд аутоиммунных (ревматических) заболеваний, при которых иммунная система начинает вырабатывать антитела и бороться с собственными клетками. Это происходит при системной волчанке, ревматоидных артритах и ряде других заболеваний. У пациентов с такими диагнозами здоровые суставы и мышцы поражаются собственной иммунной системой. В организме здоровых людей этому препятствуют специальные механизмы торможения/блокировки. Развиваясь, злокачественный процесс их запускает, и они блокируют иммунный ответ. Опухоль набирает силу. Наступает процесс равновесия, когда иммунная система ещё контролирует патологические клетки, но справляется с ними уже с трудом. Потом происходит ускользание, иммунная система перестаёт распознавать опухоль, которая начинает бесконтрольно расти и распространяться по всему организму.
Необходимо очень тонко воздействовать на противоопухолевый иммунитет с помощью современных имунноонкологических препаратов, чтобы снять все возникшие факторы торможения.

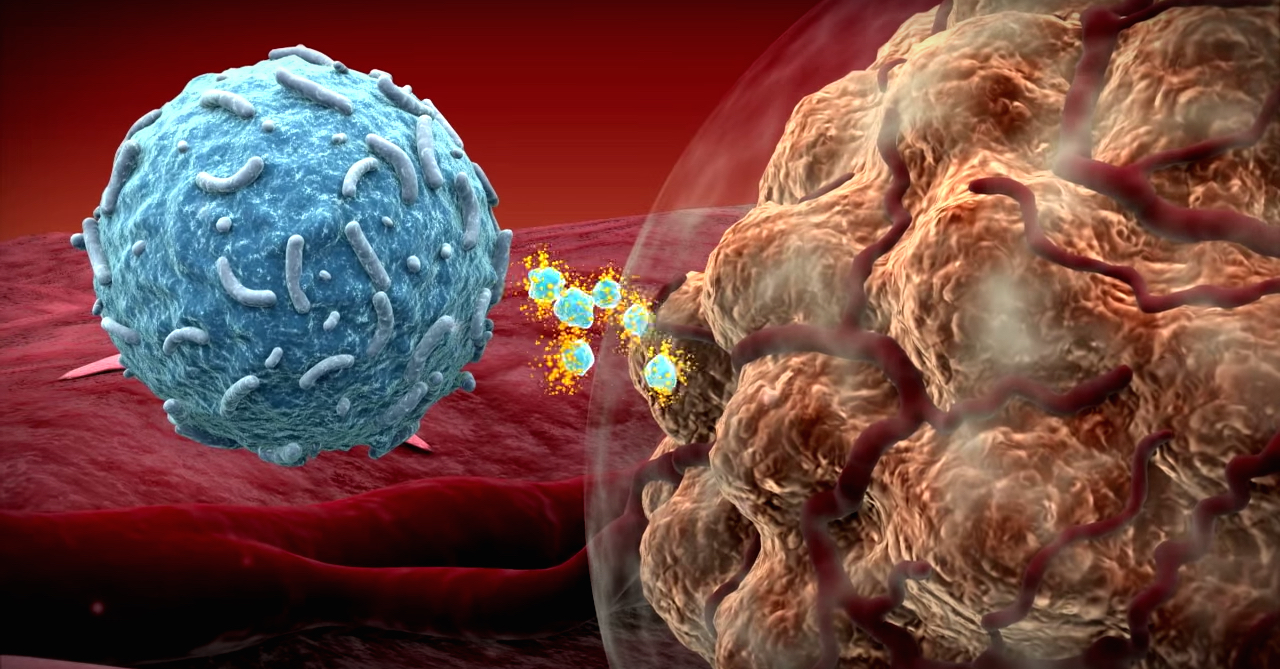
Цель иммунотерапии – помочь собственной иммунной системе бороться с опухолью. Это единственное направление современной лекарственной терапии, которое не предполагает введения ядовитых веществ – молекул, которые влияют на биологию опухоли. Иммунотерапия разблокирует собственную иммунную систему человека, заставляет её снова активно уничтожать патологические клетки. Ведь работают не чужеродные лекарственные препараты, а собственная иммунная система пациента.
Ингибиторы иммунных точек контроля: как работают, когда наступает эффект и как долго он длится
Воздействие на иммунную систему может производиться разными путями. Одно из направлений – это лекарственные препараты, которые активируют иммунную систему организма, противоопухолевый иммунитет, специалисты называют их ингибиторы иммунных точек контроля.
Постоянно расширяется перечень опухолей с доказанной эффективностью лечения блокаторами иммунных точек контроля. Сегодня это не только пигментная опухоль (меланома), это и опухоль лёгкого, лимфопролиферативные заболевания (лимфома Ходжкина), опухоль почки, мочевого пузыря, печени и т.д.
Принцип применения этого вида иммунотерапии – универсальность. Используется один препарат, который работает при многих опухолях, в отличие от химиопрепаратов, которые специализируются на тех или иных видах опухолей: при опухоли молочной железы работают одни агенты, при опухоли кишки – другие. В иммунотерапии используется один препарат – ингибитор PDL-1, который работает и при опухоли желудка, и опухоли кишки, и опухоли лёгкого и т.д. Он влияет не на опухоль, а на иммунную систему, с помощью этого антитела разблокируются её клетки.
Клиническое применение иммуноонкологических препаратов за рубежом началось в 2000-х, то есть за многими клиническими случаями, конкретными пациентами, врачи наблюдают на протяжении 10 лет с того момента окончания лечение. Многие из них живы, они считаются излеченными. То есть речь идёт даже уже не о пятилетней ремиссии, при наличии которой пациенты считаются излеченными, а о десятилетней выживаемости без признаков заболевания.

Несмотря на то что иммунотерапия, как и все другие виды лечения не панацея, отвечают на неё 20-30% пациентов, но она способна полностью излечить от заболевания, позволить контролировать его длительное время.
Специалистам НМИЦ онкологии им. Н.Н. Петрова также встречались клинические случаи, когда выраженный регресс опухоли происходил довольно быстро – на протяжении трёх месяцев.
В иммунотерапии важен опыт врача, поскольку опухолевая масса элиминируется (гибнет) в организме, необходимо провести процесс её выведения без интоксикации продуктами распада, без повышенной реакции со стороны иммунной системы.
Часто злокачественные опухоли дают метастазы в головной мозг, это всегда отягощает течение заболевания, требует проведения лучевой терапии или операции, поскольку это действительно очень серьёзное проявление заболевания. Иммунотерапия работает и при поражении головного мозга.
Пока механизм действия иммунной системы остаётся загадкой, которую в полной мере ещё не разгадали, но полученные сегодня результаты воодушевляют.
Даёт ли иммунотерапия осложнения?
Как и любой другой вид лечения, иммунотерапия даёт осложнения. Они непохожи на осложнения при химиотерапии или гормонотерапии ни по своим проявлениям, ни по схемам их лечения.

Важно, чтобы пациенты понимали механизмы всех осложнений, знали, на что обращать внимание, как быстро нужно обращаться к врачу при их возникновении, чтобы они не достигли степени, когда будет сложно с ними бороться.
Осложнения иммунотерапии связаны с тем, что иммунитет сильно активируется и начинает бороться не только с опухолевыми клетками, но и с любыми собственными тканями. Чем больше мы лечим иммуноонкологическими препаратами, тем более редкие осложнения встречаем. Это, например, изолированное поражение языка – воспаление, уплотнение, сложности с речью или реакция со стороны органов зрения – конъюнктивит или иридоциклит.
Почему важно, чтобы врач и пациент знали, что любой орган системы может быть поражён именно воздействием иммунной системы? Чтобы пациент, например, при конъюнктивите не пошёл сразу на приём к офтальмологу, который, скорее всего, пропишет ему капли от сезонного конъюнктивита, а на самом деле, это будет осложнение иммунотерапии, и лечить его нужно определённым способом. Перечисленные выше осложнения были успешно вылечены по протоколу стандартного лечения осложнений, связанных с гиператакой иммунной системы против собственного организма.
Примерные сроки проявления осложнений
Сроки появления осложнений могут быть разными: как в ближайшее время после введения иммунного препарата, так и через несколько лет. Описаны случаи, когда осложнения возникали через пять лет после завершения терапии, поэтому необходимо всегда быть начеку. Как правило, более ранние осложнения – со стороны кожных покровов, более поздние – со стороны печени, и эндокринной системы.
Если пациент отмечает какие-либо непонятные неприятные изменения в своём состоянии: высыпания, расстройство стула, то не надо заниматься самолечением, а необходимо срочно обратиться к своему лечащему врачу-химиотерапевту. Он уже определит, нужно ли подключать дополнительно узких специалистов или назначит лечение, которое, как правило, будет успешным в плане коррекции возникших осложнений.

Многие осложнения могут представлять угрозу для жизни, например, очень выраженное расстройство стула способно привести к обезвоживанию, нарушению электролитного обмена и работы сердца. К лечащему врачу-онкологу необходимо обращаться на самых ранних этапах возникновения осложнений.
Наиболее частые осложнения иммунотерапии
Чаще всего страдают кожа, желудочно-кишечный тракт, печень, эндокринная система, нервная система, дыхательная система. Список можно продолжить, потому что появляются данные, что могут поражаться и миокард (сердечная мышца), и почки, наверное, нет органа, который не может быть поражён гиперактивной иммунной системой.
Кишечные осложнения проявляются не очень специфично, то есть если у пациента многократный жидкий стул с примесью крови или слизи, боли в животе, повышение температуры, пациент может подумать или неопытный врач решить, что это пищевое отравление. Но, к сожалению, это проявление агрессии иммунной системы в отношении здорового кишечника. В этой ситуации обязательно используются высокие дозы кортикостероидов, при этом пациент должен быть госпитализирован. Всё, что связано с кишечником, это, безусловно, уже серьёзные осложнения, которые требуют наблюдения в условиях стационара.
Как правило, врач, который проводит лечение, снабжает пациента памяткой, где указаны все основные проявления, которые могут возникнуть при проведении данного лечения, моменты, на которые нужно обратить внимание, и особенности диеты, которая назначается при том или ином осложнении.
У многих пациентов возникает вопрос: зачем после получения иммуностимулирующего препарата использовать иммуносупрессрующий, т.е. подавляющий иммунную систему (в эту группу входят кортикостероиды). Не скажется ли это на эффективности лечения?
Доказано, что использование кортикостероидов для лечения осложнений не сказывается на эффекте иммунотерапевтического лечения. При этом очень важно их применение в назначенных врачами дозах. По имеющимся данным, наличие осложнений, то есть проявление гиперактивности иммунной системы, это косвенный признак эффективности лечения.
Со стороны кожи наблюдаются самые различные осложнения. Как правило, это высыпания, локализующиеся в первую очередь в подмышечных впадинах, подколенных ямках, локтевых сгибах. Они могут покрывать практически всю поверхность тела. Это уже серьёзно: если кожные покровы повреждены сильно, то происходит инфицирование. Воспаление кожных покровов – элемент выраженной интоксикации, поэтому при первых появлениях высыпаний нужно обязательно обратиться к врачу.
Изменения со стороны печени часто протекают бессимптомно, чтобы их выявить, перед очередным введением препарата необходимо сделать биохимический анализ крови. Аутоиммунную реакцию со стороны печени можно определить по повышению трансаминазы, печёночных ферментов, билирубина. Бывает, что при иммунотерапевтическом лечении значение трансмаминазы у пациента – 1500 единиц (при максимально допустимом – 35-50 единиц). При этом нет жалоб и других симптомов. Это основание для того, чтобы отменить очередное введение иммуноонкологического препарата, назначить большие дозы кортикостероидов и иное лечение.
Чаще всего страдает щитовидная железа, чуть реже – гипофиз, который находится в головном мозге, а также надпочечники. Симптомы при этом очень неспецифические, это может быть слабость, сухость кожи, потливость, сильное сердцебиение.
Осложнения со стороны дыхательной системы могут быть серьёзными: пульмониты, пневмониты, лёгочная ткань может стать отёчной и не фильтроваться, может произойти отёк висцеральной ткани лёгкого. Этот может стимулировать присоединение инфекции. Поэтому о любых изменениях со стороны дыхательной системы пациент должен рассказать своему доктору.
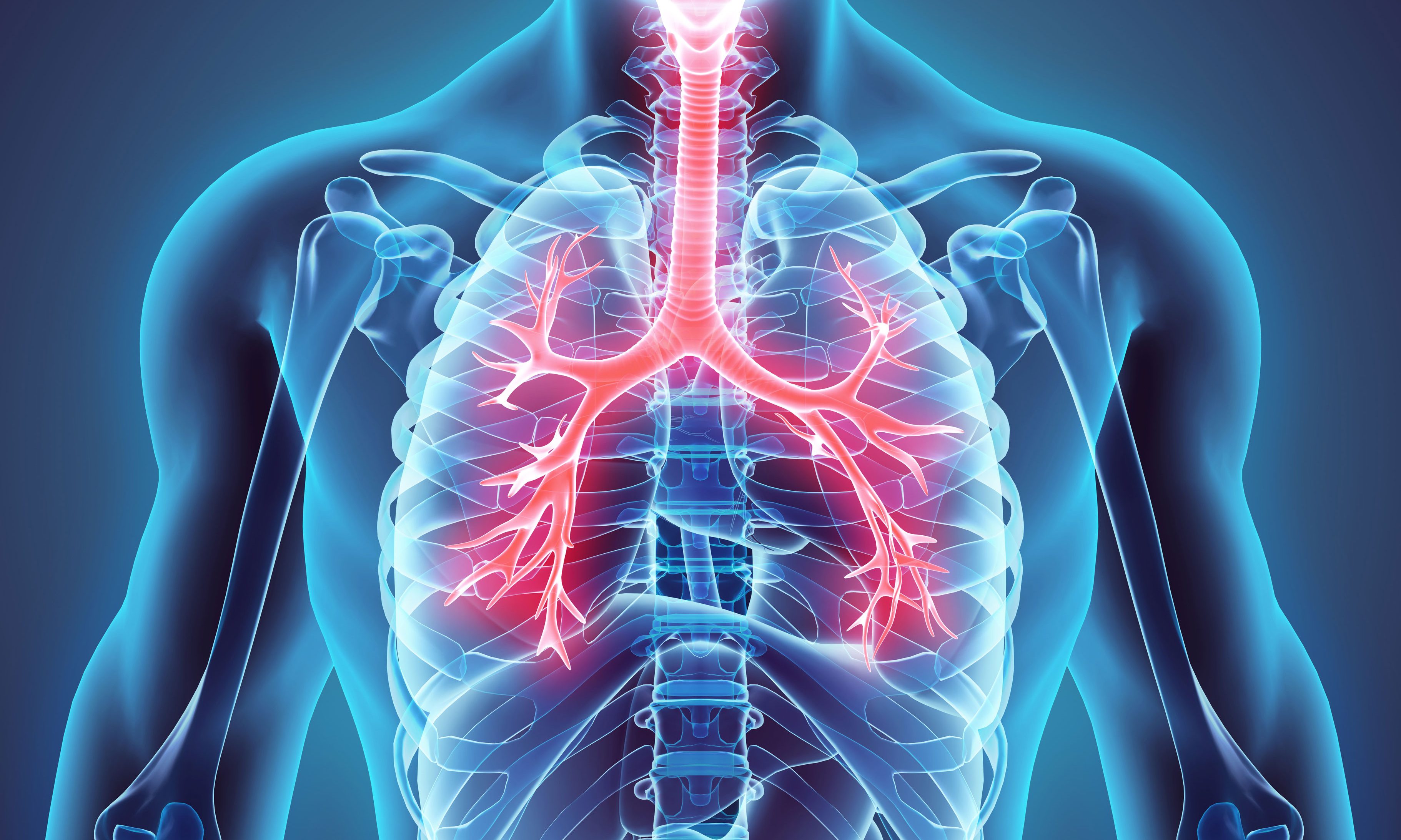
Токсическое действие иммунотерапии на лёгочную ткань может не иметь клинических проявлений и быть выявленным только на КТ.
Осложнения могут иметь рецидивирующее волнообразное течение. Это случается, как правило, если курс лечения кортикостероидами проведён не полностью, например, через одну или две недели после начала он прерван пациентом или доктором по неопытности. В этом случае иммунная система вновь становится активной и с большей степенью тяжести воздействует на тот же поражённый орган. Так что длительное лечение осложнений должно быть обязательным, при этом даже интервалы между введениями иммунных препаратов могут быть большими.
Пациенты должны помнить, что все осложнения иммунотерапии требуют специального лечения: самолечение здесь недопустимо! Необходимо поддерживать контакт со своим лечащим врачом и следовать его рекомендациям, а для лечения ряда осложнений может потребоваться и госпитализация в стационар.


Авторская публикация:
Семенова А. И.
Старший научный сотрудник
НМИЦ онкологии им Н.Н. Петрова,
врач-онколог, химиотерапевт, доцент

Доклад подготовлен:
Новик А. В.
Старший научный сотрудник
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, трансфузиолог, аллерголог, иммунолог
Большинство побочных действий препаратов является следствием их недостаточной избирательности в отношении опухолевой ткани.
Предполагается, что быстро пролиферирующая опухолевая ткань несколько больше повреждается противоопухолевыми препаратами, чем нормальная. Однако и в ряде нормальных тканей темп пролиферативных процессов весьма высок и именно в них больше проявляются побочные эффекты противоопухолевых средств.
В первую очередь это: костный мозг, слизистые оболочки пищеварительного тракта, иммунокомпетентные органы, волосяные фолликулы и т. д. Следовательно, при лекарственном лечении злокачественных опухолей приходится учитывать неизбежную токсичность препаратов, однако проявления ее должны быть обратимыми.
Вид и интенсивность токсических проявлений химиотерапии зависят от ряда факторов, в основном от дозы препарата (или комбинации препаратов), режима его применения, предшествующего лечения, вида опухоли, стадии заболевания, общего состояния больного, функции отдельных органов и т. д.
Тошнота и рвота относятся к серьезным проявлениям токсичности препаратов у больных, получающих противоопухолевую химиотерапию. При применении производных платины эти побочные реакции особенно выражены и в 83% могут быть причиной прекращения лечения. К веществам, часто вызывающим рвоту, относят: также ДТИК, дактиномицин, адриамицин, стрептозотоцин, эмбихин, производные нитрозометилмочевины. В настоящее время могут считаться активными антиэметиками антигистамины, антихолинергетики, антагонисты…
Антигистамины (блокаторы Н1-гистамина): димедрол, пипольфен, супрастин. Действуют на рвотный центр. Н1-блокаторы наиболее эффективны при вестибулярной рвоте. При больших дозах возможны антихолинергический и сильный седативный эффекты. Антихолинергетики: скополамин, атропин, платифиллин, метацин. Так же, как и антигистамины, действуют на рвотный центр. Эффективны при морской и воздушной болезни. Основным противопоказанием является глаукома. Нейролептические препараты Производные фенотиазина: аминазин, этаперазин,…
Триоксазин — препарат с минимальным побочным действием, по-видимому, действует на хеморецепторы. Многие авторы подчеркивают, что антиэметики (особенно при лечении производными платины) нужно применять парентерально, а не внутрь. В настоящее время широко применяют комбинированную химиотерапию (комбинации могут состоять из препаратов с разным механизмом рвотного действия) и некоторые препараты (производные платины) имеют двойной механизм рвотного действия, поэтому…
Различают 5 степеней побочного действия (токсичности) противоопухолевых препаратов Степень 0 — никаких изменений самочувствия и лабораторных данных нет. Степень I — минимальные изменения, не влияющие на общую активность больного. Лабораторные данные изменены незначительно и не требуют коррекции. Степень II — умеренные изменения, нарушающие нормальную активность и жизнедеятельность больного и вызывающие заметные изменения лабораторных данных, требующие…
Все или отдельные противоопухолевые препараты не должны применяться совсем или могут применяться в сниженных дозах при следующих обстоятельствах. I. Массивная предшествующая химио- и лучевая терапия, вызвавшая значительное угнетение костномозгового кроветворения (все миелотоксическйе препараты). II. Глубокая старость и возраст до 6 мес (все противоопухолевые препараты). III. Резко сниженное питание, кахексия (все противоопухолевые препараты). IV. Снижение функции…
При числе лейкоцитов 4*109/л или более и числе тромбоцитов 12*1010/л вводят рекомендуемые дозы противоопухолевых препаратов. При снижении числа лейкоцитов до 3,9 — 2,5*109/л или числа тромбоцитов до 11,9 — 7,5*109/л в 2 раза снижают дозы адриамицина, дактиномицина, циклофосфана, фторурацила, метотрексата, митомицина С, прокарбазина, тиофосфамида, фторафура и розевина. При дальнейшем снижении числа лейкоцитов или тромбоцитов лечение…
Побочные проявления Степень 0 Степень I Степень II Степень III Степень IV Гематологические Гемоглобин ≥11,0 г/100 мл ≥110 г/л ≥6,8 ммоль/л 9,5 — 10,9 г/л 95 — 109 г/л 5,6 — 6,7 ммоль 8,0 — 9,4 г/100 мл 80 — 94 г/л 4,95 — 5,8 ммоль/л 6,5 — 7,9 г/100 мл 65 — 79 г/л…
Подобно тому, как снижают дозы при увеличении билирубина, первое уменьшение доз тех же препаратов производят при увеличении в 2 — 4 раза по сравнению с нормой содержания сывороточного альбумина или увеличении в 2 — 4 раза протромбинового времени или повышении в 2 — 4 раза активности аминотрансфераз сыворотки. При большем отклонении от нормы указанных показателей…
До настоящего времени классической триадой при резком снижении показателей крови (лейкоциты менее 1*109/л и тромбоциты менее 5*109/л) являются: переливание крови или ее компонентов — лейко- или тромбомассы, назначение высоких доз кортикостероидов (до 1 мг/кг) и антибиотиков широкого спектра действия. Однако высокие дозы кортикостероидов следует применять недолго (3 — 4 дня) и с большой осторожностью, с…
Лекарственное лечение злокачественных опухолей подразумевает применение различных препаратов, тормозящих пролиферацию или необратимо повреждающих опухолевые клетки. Противоопухолевые препараты обладают либо цитостатическим или цитолитическим действием на опухолевую популяцию клеток. Противоопухолевый эффект можно получить различными путями: прямым повреждающим действием препарата на опухолевую клетку; увеличением времени генерации опухолевых клеток настолько, что они практически перестают делиться; повреждением клеток и потеря ими основных свойств метастазирования и инвазивности; стимуляцией иммунологических реакций направленных на опухолевые клетки; коррекцией апоптоза опухолевых клеток. Однако до сих пор не предложено и не внедрено в клиническую практику универсального противоопухолевого препарата, вызывающего лечебный эффект при большинстве или многих опухолях. В настоящее время в клиническую онкологию внедрено более 60 различных противоопухолевых препаратов, которые можно разделить на следующие группы: алкилирующие препараты, антиметаболиты, противоопухолевые антибиотики, препараты растительного происхождения, прочие препараты, гормоны и антигормоны. В последние годы широко изучаются различные физиологически активные вещества, так называемые цитокины, регулирующие процессы пролиферации, дифференцировки и функциональную активность клеток. К ним относятся интерфероны, интерлейкины, гимопоэтины и др. Эффективность лечения во многом зависит от клеточной кинетики опухоли и ее пролиферативного пула, которые должны определять выбор противоопухолевых препаратов, их комбинаций и режимы введения. Основными принципами лекарственной терапии злокачественных опухолей являются: подбор препарата соответственно спектру его противоопухолевого действия; выбор оптимальной дозы, режима и способа введения, обеспечивающих лечебный эффект без необратимых токсических реакций со стороны жизненно-важных органов и систем организма. Назначение химиотерапии возможно только при наличии морфологической верификации злокачественной опухоли; наличие условий для выявления и лечения возможных токсических реакций химиотерапии. Общее состояние больного является одним из важнейших прогностических факторов и в значительной мере определяет успех химиотерапии. Больным в терминальном состоянии с огромной массой опухоли значительным нарушением функции жизненно-важных органов и тканей химиотерапия может принести скорее вред, чем облегчение. По способу применения противоопухолевых препаратов различают системную, региональную и локальную химиотерапию. К системной химиотерапии опухолей относится введение цитостатиков внутрь, внутримышечно, внутривенно или ректально. Региональная химиотерапия подразумевает воздействие препарата на опухоль путем введения его в кровеносные сосуды, питающие новообразование. При локальной химиотерапии цитостатики вводят в серозные полости при асцитах и плевритах, внутрипузырно при новообразованиях мочевого пузыря, или используют мази для наружного нанесения на опухоль. Важное значение в химиотерапии опухолей имеет пролиферативная гетерогенность клеток новообразования. Опухолевые клетки находятся в различных фазах жизненного цикла. Оказалось, что противоопухолевая активность различных противоопухолевых препаратов находится в прямой зависимости от фазы цикла деления клеток. В таблице приведены сведения о противоопухолевой активности препаратов в зависимости от пролиферативной гетерогенности популяции опухолевых клеток. В связи с этим в настоящее время в клинической практике используется полихимиотерапия, комбинация противоопухолевых препаратов с лучевой терапией или оперативным вмешательством. Полихимиотерапия подразумевает применение нескольких активных противоопухолевых препаратов, но различающихся по механизму действия. В основе создания новых комбинаций лежит токсикологический принцип. В схему полихимиотерапии включают цитостатики, которые при монохимиотерапии эффективны в отношении данной опухоли, но оказывают разные токсические реакции, т.е. обладают разной токсичностью. Схема МОРР (мустарген, онковин, прокарбазин, преднизолон) вызывает лечебный эффект при лимфогранулематозе у 80-90% больных, в тоже время применение указанных противоопухолевых препаратов в монохимиотерапии эффективно только у 30-40% пациентов. Однако такой же суммации токсического действия не наблюдается, поскольку эти препараты оказывают разные токсические реакции. Адьювантная химиотерапия — это дополняющее хирургические и лучевые методы лечения злокачественных опухолей. Основной целью адьювантной химиотерапии является эрадикация опухолевых клеток в зоне операции и микрометастазов опухоли после удаления или лучевого излечения первичной опухоли. Для того чтобы назначать проведение адьювантной химиотерапии необходимо знать биологические и клинические особенности злокачественных опухолей и терапевтическую активность цитостатиков при данной опухоли.
Неоадьювантная химиотерапия назначается до оперативного вмешательства или проведения курса лучевой терапии с целью уменьшения массы опухоли, определения индивидуальной чувствительности опухоли к цитостатикам и выполнения операций в условиях большей абластики. Химиотерапию в комбинации с лучевой терапией используют при многих злокачественных опухолях. Принципиальная необходимость создания такой комбинации заключается в усилении повреждающего воздействия ионизирующего излучения и цитостатиков на опухолевую ткань. Подобный эффект может быть достигнут в результате синергизма противоопухолевого действия лекарственного и лучевого компонентов, меньшего повреждения или отсутствие повреждения нормальных тканей. Химиотерапию можно комбинировать с лучевой терапией только в том случае, если цитостатик активен при данной опухоли и в тоже время не усиливает повреждающее действие облучения на нормальные ткани, входящие в зону лучевого воздействия. Выделяют токсические реакции обусловленные цитостатическим действием препаратов: местнораздражающее воздействие на ткани и сосуды — флебиты, дерматиты и др.; системные осложнения — миелодепрессия, диспептический синдром, нейротоксичность, гепатотоксичность, кардиотоксичность, нарушение репродуктивной функции, иммунодепрессия с развитием интеркуррентной инфекции, эмбриотоксическое и канцерогенное действие. Условно разделяют непосредственные, ближайшие и отсроченные токсические реакции. К непосредственным токсическим проявлениям, проявляющимися сразу или в течение первых суток относятся тошнота, рвота, диарея, лихорадка. Ближайшие проявления наступают в течение 7-10 дней. К ним относятся угнетение костно-мозгового кроветворения, диспептический синдром, неврологические и токсические поражения органов. Отсроченные токсические реакции возможны через несколько недель после окончания курса лечения.
Осложнения химиотерапии зависят от типа и дозы препаратов, длительности лечения. Наиболее часто больные отмечают тошноту и рвоту, временное выпадение волос, увеличение частоты инфекционных заболеваний, повышенную утомляемость. Однако со многими осложнениями можно справиться с помощью лекарств и других методов, а также изменением режима химиотерапии.
Применение противоопухолевой химиотерапии часто сопровождается побочными реакциями. Химиопрепараты в первую очередь повреждают быстро обновляющиеся клетки пищеварительного тракта, костного мозга, волосяных фолликулов и пр. Кроме этого, противоопухолевые препараты способны повреждать практически все нормальные ткани организма.
Различают 5 степеней выраженности побочных действий химиопрепаратов - от 0 до 4. • 0 степень - не наблюдаются изменения в самочувствии больного и данных исследования. • 1 степень - могут быть незначительные изменения, которые не влияют на общую активность больного и не требуют вмешательства врача. • 2 степень - отмечаются умеренные изменения, нарушающие нормальную активность и жизнедеятельность больного; лабораторные данные существенно изменены и требуют коррекции. • 3 степень - имеются резкие нарушения, требующие активного лечения, отсрочки или прекращения химиотерапии. • 4 степень - опасна для жизни и требует немедленной отмены химиотерапии.
Токсическое действие химиопрепаратов на кроветворение является наиболее частым побочным эффектом химиотерапии и проявляется угнетением всех ростков кроветворения. Особенно часто повреждаются клетки-родоначальники лейкоцитов и тромбоцитов и реже клетки, ответственные за развитие эритроцитов.
К факторам риска развития токсического действия химиопрепаратов на костный мозг относятся: предшествующая химио - и лучевая терапия, возраст больных старше 60 лет и моложе 1 года, общее состояние больного, истощение. Угнетение кроветворения отмечается обычно в ближайшие дни после назначения химиотерапии (на 7-12 день). Некоторые препараты вызывают отсроченный токсический эффект.
Резкое и длительное снижение числа лейкоцитов может привести к повышенной частоте возникновения инфекционных осложнений. В последние 20 лет наблюдается увеличение случаев грибковой и вирусной инфекции. При значительном снижении количества тромбоцитов могут отмечаться носовые,желудочно-кишечные кровотечения,кровоизлияния в мозг и др.
Токсическое действие химиотерапии на желудочно-кишечный тракт может привести к появлению тошноты, рвоты, стоматита, энтерита и диареи (жидкого стула) в результате повреждения слизистых оболочек полости рта и кишечника, токсического поражения печени. Тошнота и рвота являются не самым опасным, но часто встречающимся и наиболее тягостным проявлением токсического действия химиопрепаратов. В ряде случаев эти реакции могут привести даже к отказу от лечения. Токсическое поражение печени чаще выявляется у больных, перенесших ранее гепатит или имеющих нарушение функции печени до начала химитерапии.
Кардиотоксичность (повреждение сердечной мышцы) возникает в основном при применении антрациклинов (адриамицин, рубомицин) и реже - при использовании других препаратов (циклофосфамид, 5-фторурацил, этопозид и др.). К ранним проявлениям кардиотоксичности относятся: снижение артериального давления, учащенное сердцебиение, нарушение ритма, боли в области сердца. Более поздние симптомы кардиотоксич-ности возникают за счет повреждения сердечной мышцы, нарушение ритма. Иногда возможно появление инфаркта миокарда. Признаками мио-кардита(повреждения сердечной мышцы)являются: учащенное сердцебиение, одышка, увеличение размеров сердца, нарушение кровообращения.
Поражение мочевыводящей системы связано с тем, что большинство химиопрепаратов выделяется почками. Степень токсичности препаратов зависит от их дозы и сопутствующих заболеваний почек, а также от возраста больного. Нарушение функции почек в процессе химиотерапии наиболее выражены при использовании платины. Мочекислая нефропатия. При высокой чувствительности опухоли к химиотерапии быстрое сокращение опухоли (лизис-синдром) может сопровождаться увеличением содержания мочевой кислоты в сыворотке крови и развитию серьезного осложнения со стороны почек - мочекислой нефропатии. К начальным признакам этого осложнения относятся: уменьшение количества мочи, появление большого количества кристаллов мочевой кислоты в осадке мочи и пр.
Аллергические реакции могут отмечаться у 5-10% пациентов при применении различных химиопрепаратов. У больных, получающих паклитаксел, доцетаксел и L-аспарагиназу, аллергические реакции встречаются наиболее часто.
Нейротоксичность может проявляться в различных отделах нервной системы. В большинстве случаев она слабо выражена, разнообразна и наблюдается при лечении многими химиопрепаратами (винкристин, этопозид, проспидин, натулан, платина, таксол и др.). Симптомы центральной нейротоксичности чаще всего проявляются в виде нарушения внимания, памяти, эмоциональных расстройств, понижении общего тонуса. Серьезными осложнениями следует считать появление галлюцинаций и возбуждения. Периферическая нейротоксичность проявляется в виде легкого покалывания в пальцах, нарушения функции верхних и нижних конечностей, вздутия живота, ухудшения зрения и слуха. Нейротоксичность может наблюдаться при введении химиопрепаратов в спинномозговой канал или применении высоких доз. При этом у больных могут отмечаться головные боли, головокружение, тошнота, рвота, нарушение ориентации и сознания.
Токсическое действие химиопрепаратов на кожу может проявляться в виде ее покраснения, появления сыпи, зуда, повышения температуры тела и снижения чувствительности. Позднее эти явления могут усугубляться и превращаться в стойкие изменения кожи с развитием инфекции, гиперпигментации кожи, ногтей и слизистых оболочек. Многие токсические реакции кожи и ногтей проходят самостоятельно вскоре после прекращения химиотерапии.
Облысение (алопеция) возникает при применении некоторых химиопрепаратов, повреждающих волосяные мешочки (фолликулы). Алопеция обратима, но является тяжелой психической травмой, особенно для молодых больных и женщин. Это осложнение часто встречается при лечении доксорубицином, эпирубицином, этопозидом, таксанами и др. препаратами. Полное восстановление волос происходит через 3-6 месяцев после окончания химиотерапии.
Токсическое повышение температуры наиболее часто отмечается у 60-80% больных, получающих блеомицин. Повышение температуры тела бывает также при лечении L-аспарагиназой, цитозаром, адриамицином, митомицином С, фторурацилом, этопозидом. Температура быстро нормализуется и, как правило, не служит причиной отмена химиотерапии.
Токсические флебиты (воспаление вен) развиваются чаще после нескольких введений препаратов и проявляются: сильными болями по ходу вен во время введения химиопрепарата, тромбозом и закупоркой вен. Наиболее часто токсические флебиты развиваются при лечении эмбихином, цитозаром, винбластином, дактиномицином, доксорубицином, рубомицином, эпирубицином, дакарбазином, митомицином С, таксанами, невельбином и при многократных введениях препаратов в одну и ту же вену.
Местное токсическое действие химиопрепаратов возникает при попадании некоторых их них (производные нитрозомочевины, доксорубицин, рубомицин, винкристин, винбластин, митомицин С, дактиномицин и др.) под кожу во время внутривенного введения. В результате этого возможен некроз (омертвение) кожи и глубжележащих тканей.
Поздние осложнения химиотерапии встречаются нечасто. Они развиваются в течение года и более длительного периода времени после проведенной химиотерапии. К наиболее опасным осложнениям химиотерапии относятся: остеопороз (разрежение костей), поражение слизистой оболочки мочевого пузыря и возникновение новых (вторых) злокачественных опухолей. В поздние сроки возможно также развитие стойкого угнетения костного мозга, иммунной системы, функции половых желез, поражения сердца и легких. У детей при лечении циклофосамидом, метотрексатом, дактиномицином, адриамицином и гормонами могут возникать нарушения роста и развития.
Читайте также:

