Органосохраняющее лечение при раке мочевого пузыря
В.Ю. Старцев 1 , И.Н. Дыленок 2 , Т.Р. Джемилев 2
По данным мировой литературы, у 30 % больных раком мочевого пузыря (РМП) опухоль впервые выявляют в стадии инвазивного роста и еще в 30 % случаев немышечно-инвазивного рака мочевого пузыря опухоль прогрессирует в стенку мочевого пузыря, несмотря на адекватное лечение. При лечении больных мышечно-инвазивным РМП стандартно выполняют радикальную цистэктомию (РЦ) с удалением мочевого пузыря, регионарных лимфатических узлов и окружающих структур (матка или предстательная железа) с деривацией мочи [1].
Ближайшие и отдаленные результаты этого вмешательства связаны с высокой (30–61 %) частотой осложнений, а деривация мочи оказывает выраженное влияние на функцию мочевых путей, органов желудочно-кишечного тракта, половую функцию и снижает качество жизни пациента [2]. Больные после РЦ нуждаются в особом уходе медицинского персонала с высокой профессиональной подготовкой, что возможно в крупных специализированных центрах [3].
Цель данного исследования заключалась в проведении метаанализа данных о возможности сохранения мочевого пузыря, профиле токсичности и контроле состояния опухоли при использовании органосохраняющих технологий у больных неметастатическим мышечно-инвазивным РМП. В 80–90-х гг. XX столетия многие исследователи признавали, что органосохраняющее лечение больных мышечно-инвазивным РМП, включающее трансуретральную резекцию мочевого пузыря (ТУРМП), химиотерапию (ХТ) и/или лучевую терапию (ЛТ), приводит к однозначно худшим результатам с точки зрения локального контроля опухоли и долгосрочной общей и беспрогрессивной выживаемости [4].
Результаты исследований легли в основу документов, опубликованных в 2014 г. Группой онкологической радиационной терапии (RTOG), что стало важным вкладом в развитие методов сохранения мочевого пузыря как альтернативы РЦ [8]. С современных позиций, консервативный подход оправдан для двух групп пациентов: при расположении опухоли в пределах стенки мочевого пузыря (и при желании больного избежать агрессивной операции) и у пациентов с тяжелыми сопутствующими заболеваниями [9].
Сохранение мочевого пузыря для отдельных групп пациентов по сей день рассматривается в качестве альтернативы руководящим принципам ведущих научных сообществ (National Comprehensive Cancer Network (NCCN) и European Association of Urology (EAU)) [10, 11]. Цель органосохраняющего лечения больных мышечно-инвазивным РМП — сохранение высокого качества жизни, снижение угрозы потенциальной прогрессии опухоли или смертности после РЦ без ущерба для онкологического результата [12].
Мультимодальный подход при органосохраняющем лечении
Однако до сих пор не опубликованы рандомизированные исследования с проспективным сравнением результатов РЦ и ТМТ. Показатели эффективности БМТ значительно уступают результатам после полного цикла ТМТ [9]. Причиной отказа в проведении ХТ служат сопутствующие заболевания, однако потребность в комплексном подходе к пациентам пожилого возраста привлекает все больше внимания во всем мире.
Недостатки ТМТ включают частое выявление мышечно-инвазивного рецидива РМП в сохраненном мочевом пузыре (чаще в зоне первоначального расположения раковой опухоли), отсутствие лечебного вмешательства на регионарных лимфатических узлах, рост числа смертельных исходов у больных мышечно-инвазивным РМП после спасительной РЦ при прогрессировании опухоли или ее рецидиве после высокой дозы облучения органов малого таза [14].
Возможности сохранения мочевого пузыря у больных пожилого возраста
При ретроспективном анализе распространенности РМП у жителей Дании (2016) установлено, что заболеваемость мышечно-инвазивным РМП в 7–10 раз выше у пациентов старше 70 лет в сравнении с более молодыми людьми. Показатели смертности с течением времени снижались у пациентов всех возрастных групп, кроме 90-летних больных [16]. С учетом мировых данных внимание к сопутствующим заболеваниям и ментальному статусу больных мышечно-инвазивным РМП пожилого и старческого возраста имеет большое значение.
S. Poletajew et al. рекомендуют органосохраняющее лечение больным мышечно-инвазивным РМП при наличии следующих факторов: старческий возраст (в среднем — 78 лет), высокий индекс массы тела (свыше 25,7 кг/м2 ), низкий показатель гемоглобина (ниже 11,6 г/л), курение (72,1 %), интервал между первым проявлением болезни и установлением диагноза РМП свыше 60 дней [17]. В результате исследования эффективности органосохраняющего лечения у пациентов пожилого возраста (≥75 лет), проведенного R.H. Clayman et al., было установлено, что пяти- (60 %) и десятилетние (56 %) показатели раковоспецифической выживаемости такие же, как после РЦ [18].
С учетом общемировой тенденции старения населения ожидается возрастание численности пациентов с мышечно-инвазивным РМП, а значит, контингента пациентов с выраженной сопутствующей патологией и онкологическим диагнозом. В 2016 г. A. Erlich и A.R. Zlotta предложили алгоритм выбора лечения возрастных больных мышечно-инвазивным РМП (табл. 1) [19].
Таблица 1 Алгоритм органосохраняющего лечения пациентов пожилого возраста с мышечно-инвазивным раком мочевого пузыря [19]
S.J. Byun et al. ретроспективно изучили результаты органосохраняющего лечения 50 пациентов с мышечно-инвазивным РМП (средний возраст — 71,5 года): пятилетняя общая выживаемость и раковоспецифическая выживаемость составили 37,2 и 30,2 % соответственно [20]. При многофакторном анализе индекс G оказался статистически значимым показателем прогноза, что позволило представить графическую зависимость (рис. 1). Для принятия решения о предстоящем лечении, помимо возраста больного, необходим учет его работоспособности, производительности, качества жизни, социальных показателей и собственных предпочтений [21].
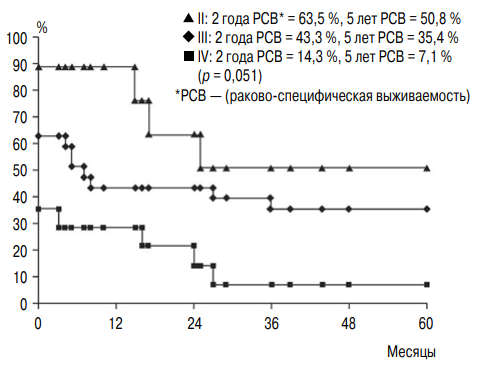
Рис. 1. Общая выживаемость больных мышечно-инвазивным раком мочевого пузыря с учетом степени злокачественности опухоли [20]
Хирургические технологии в программе органосохраняющего лечения
Во время выполнения ТУРМП, составной части ТМТ, стараются добиться максимальной резекции опухоли, поскольку оставление резидуальной ткани обычно сопровождается низким показателем раковоспецифической выживаемости [22]. Монотерапия ТУРМП продемонстрировала невысокую эффективность в нескольких исследованиях из-за высокой частоты развития локальных рецидивов в ближайшие (до полугода) сроки после операции [23, 24].
Следовательно, у пациентов с мышечно-инвазивным РМП следует предпочесть более агрессивное лечение с мультимодальным подходом. Для улучшения качества визуализации и снижения побочных эффектов терапии М.М. Garcia et al. (2014) предложили выполнять трансуретральную разметку границ опухоли с помощью специальных маркеров с микрозубчиками в подслизистом слое органа, в 5–7 мм от края резекции, что улучшает переносимость ЛТ [25].
Хирургическое лечение больных с распространением опухоли на соседние органы (Т 4) характеризуется невысокой (10–12 %) пятилетней общей выживаемостью [27]. Для таких пациентов наиболее предпочтителен мультимодальный подход или внутриартериальная химиотерапия.
Лучевая терапия в программе мультимодального лечения больных мышечно-инвазивным раком мочевого пузыря
S. Hafeez et al. сообщают, что при помощи предлучевого планирования конусной лучевой компьютерной томографии существует возможность подведения к опухоли СОД = 70 Гр с оптимальным уровнем воздействия и минимальным побочным эффектом (2 из 19 лучевых циститов через 5,3 месяца после ЛТ) [30].
В 2008–2014 гг. проведены исследования у больных мышечно-инвазивным РМП, позволившие улучшить ряд показателей после органосохраняющего лечения. Целью исследований было достижение максимальной эффективности лечения путем эскалации общей дозы ЛТ, использования нетрадиционных схем фракционирования, сокращения общего времени терапии, а также сочетания дистанционного излучения с интерстициальной брахитерапией и новыми методами ЛТ, радиосенсибилизаторами и гипертермией [32, 33].
Новое лечебное направление в радиологии — радиотерапия с модулированной интенсивностью, позволяетдостигать высоких результатов у пожилых (старше 75 лет) больных мышечноинвазивным РМП. L.J. Lutkenhaus et al. сообщили о полном опухолевом ответе у 87 % пожилых больных мышечно-инвазивным РМП (трехлетняя общая выживаемость — 44 %, признаков продолженного роста не обнаружено у 73 % больных за 36 месяцев наблюдения) при невысокой токсичности (недержание мочи и стула G ≥ 2 у 14 и 5 % пациентов соответственно) [31].
Современная химиотерапия в комплексном лечении больных мышечно-инвазивным раком мочевого пузыря
Поиск оптимального соотношения варианта введения и дозы химиопрепаратов, дающего возможность снизить проявления побочных эффектов и сохранить высокий опухолевый ответ, составляет одну из актуальных проблем онкоурологии [34, 35]. Местнораспространенный и диссеминированный РМП хорошо поддается воздействию системной ХТ на основе цисплатина [35].
Что касается сроков начала проведения ХТ при органосохраняющем лечении, до сих пор не получено окончательных данных, подтверждающих преимущество использования неоадъювантной или адъювантной химиотерапии. Полный лекарственный патоморфоз после неоадъювантной химиотерапии в 28 % случаев мышечно-инвазивного РМП отметили V.K. Pokuri и et al.: эффект зависел от морфологического типа строения опухоли. Так, у пациентов с переходноклеточной карциномой патоморфоз отмечался после трех курсов неоадъювантной химиотерапии [36].
Опухолевый ответ на ХТ на основе цисплатина наблюдается у 50–60 % пациентов с прогрессирующим мышечно-инвазивным РМП, но в ряде случаев отмечается химиорезистентность. Цитотоксический эффект платины опосредован необратимым повреждением ДНК, но экспрессия репарации ДНК белков (комплементарный фактор перекрестной репарации 1 (ERCC1) и ген восприимчивости 1 (BRCA1)) не связана с ответом на препараты платины [37].
Альтернативные подходы для прогнозирования чувствительности к платине с участием экспрессии нескольких генов в настоящее время изучаются. Так, в 2016 г. Е.А. Guancial et al. измеряли концентрацию платины в опухолевой ткани с использованием беспламенной атомно-абсорбционной спектрофотометрии (FAAS) и сравнивали с показателями в нормальном уротелии мочевого пузыря после применения комбинации неоадъювантной химиотерапии и РЦ [38].
Для установления причин химиорезистентности РМП исследовали цисплатин-резистентные клеточные линии РМП: были определены гены, вызывающие дерегуляцию РНК-последовательностей (секвенирование РНК) и метилирование ДНК [39, 40]. P. Sidaway проанализировал метилирование ДНК in vitro в опухолях 18 пациентов, получавших цисплатин. Было установлено, что промотор метилирования HOXA9 может служить потенциальным прогностическим биомаркером мышечно-инвазивного РМП, а децитабин сенсибилизирует резистентные опухоли у пациентов, получающих ХТ на основе цисплатина [41].
Полученные результаты, вероятно, послужат началом для изучения тканевых факторов, определяющих персонализированный подход у больных мышечно-инвазивным РМП при использовании ХЛТ. При нечувствительности к платине, а также у ослабленных пациентов с мышечно-инвазивным РМП используют и другие химиопрепараты, например из класса таксанов [35].
Еженедельные инъекции паклитаксела (80 мг/м2 ) удовлетворительно переносятся больными, наиболее выраженными проявлениями токсичности (Grade3–4) оказываются анемия, слабость (10 %) и боль (38 %), что чаще связано с костными метастазами РМП и требует проведения локальной ЛТ и пероральных болеутоляющих у взрослых и у пациентов детского возраста [42, 43].
Гемцитабин, антиметаболит пиримидина, демонстрирует выраженный эффект при системном использовании и низкую токсичность по сравнению с другими агентами. Дополнение курса ХТ вторым препаратом позволяет увеличить общую выживаемость больных мышечно-инвазивным РМП (p Рис. 2. Общая выживаемость больных мышечно-инвазивным раком мочевого пузыря после органосохраняющего лечения [33]
J. Nowak-Sadzikowska et al. провели полноценное исследование результатов органосохраняющего лечения у больных мышечно-инвазивным РМП, что дало возможность сформулировать выводы на основе наблюдения 73 пациентов в стадии pT2– 4aN0M0 [33]. За 67 месяцев наблюдения скончались 33 (45 %) пациента (в том числе 28 от прогрессирования РМП). Трех- и пятилетняя общая и раковоспецифическая выживаемость составила 65 и 52 %, 70 и 59 % соответственно.
Пятилетние показатели общей выживаемости в группе ТМТ — 59 %, в группе БМТ — 41 % (р = 0,0520) (рис. 2). Авторы сделали вывод о том, что в группе работоспособных пациентов с мышечно-инвазивным РМП (тяжелые сопутствующие заболевания с высоким риском радикального хирургического вмешательства) только у 6–19 % пациентов можно соблюсти все критерии комбинированного подхода [33].
В Канадском междисциплинарном центре по лечению РМП (MDBCC) 4,5 года наблюдали 112 пациентов с мышечно-инвазивным РМП (56 получали РЦ и 56 — ТМТ), в среднем в возрасте 68 лет. Около трети пациентов (29,5 %) имели стадию РМП cT3/cT4 [57]. Число случаев летальных исходов в группах РЦ и ТМТ составило 20 (35,7 %) и 22 (39,3 %) соответственно (по 13 случаев в результате прогрессии РМП), а пятилетняя раковоспецифическая выживаемость — 73,2 и 76,6 % соответственно (p = 0,49). Сделан вывод, что ТМТ позволяет достичь результатов выживаемости, сравнимых с таковыми для отобранных пациентов после РЦ.
Обсуждение и заключение
В отсутствие рандомизированных исследований трудно сравнивать возможность сохранения мочевого пузыря со стандартной РЦ из-за широкой гетерогенности отбора пациентов. В систематическом обзоре клинических ретроспективных и проспективных исследований, включавших 13 396 пациентов (2015), средняя пятилетняя общая выживаемость в группе ТМТ составила 57 %, тогда как в группах, получавших РЦ или РЦ и адъювантную химиотерапию, — 52 % (р = 0,04) и 53 % (р = 0,38) соответственно [7]. В результате вполне закономерен вопрос: можно ли продолжать игнорировать доказательства возможности органосохраняющего лечения пациентов с мышечно-инвазивным РМП [58]?
Итак, идеальный кандидат для сохранения мочевого пузыря — здоровый пациент с небольшой унифокальной опухолью (менее 5 см), без резидуальных изменений после ТУРМП, с отсутствием обструкции мочеточника или гидронефроза, без карциномы in situ (диагностированной с помощью биопсии подозрительных участков), в отсутствие признаков поражения тазовых лимфатических узлов [59]. До 15 % пациентов с мышечно-инвазивным РМП могут стать кандидатами для сохранения мочевого пузыря, а ТУРМП с сопутствующей ХЛТ можно рассматривать как оптимальный лечебный подход с позиции переносимости и эффективности [59].
Основными вариантами токсичности при ХЛТ остаются проблемы кроветворных, желудочно-кишечных органов и мочевыводящих путей. В ряде случаев при ХТ на основе цисплатина отмечается невропатия. Пятилетняя общая выживаемость больных, перенесших спасительную РЦ, не превышает 25–30 % [60].
Тем не менее признано возможным сохранение мочевого пузыря у отдельной, тщательно отобранной группы больных мышечно-инвазивным РМП, в частности, у престарелых пациентов и больных с выраженными сопутствующими заболеваниями, что позволяет сохранить качество жизни и самостоятельное мочеиспускание. Это является крайне важным моментом для данной гериатрической популяции.
Продолжаются исследования, касающиеся качества выполнения хирургического вмешательства, модификации дозы химиопрепаратов и лучевой энергии, а также экспрессии генома раковой клетки. Представляются перспективными рандомизированные исследования с целью сравнения результатов ТМТ и РЦ, что необходимо для выбора оптимального индивидуального метода лечения.
Стандартным лечением рака мочевого пузыря есть радикальная цистэктомия (полное удаление мочевого пузыря). Несмотря на долгий безрецидивный период, 5-летняя выживаемость, в среднем, 50%. Хорошо разработанная хирургия обеспечивает довлетворительное качество жизни послеопераций. Хотя отведение мочи или половая функция требуют последующей реабилитации и медицинского лечения.
Органосохраняющее лечение может быть предложено пациентам с раком мочевого пузыря, у которых отсутствуют метастазы. Первоначально выполняется ТУР (трансуретральная резекция - операция через трубку, введенную в мочеиспускательный канал, без дополнительных разрезов) мочевого пузыря с удалением всех видимых опухолевых образований.
Следующий шаг это химиолучевая терапия с препаратами платины, обладающими радиосенсибилизирующим действием, то есть усиливают чувствительность опухоли к лучевой терапии. Регрессию опухоли оценивают по данным цистоскопии и биопсии. В случае слабой регрессии больному предлагается радикальная цистэктомия. При отсутствии новообразования после биопсии продолжается химиолучевая терапия.
В результате использования органосохраняющего лечения рака мочевого пузыря, включающего ТУР с последующим химиолучевым лечением, полная регрессия опухоли отмечается у 70% больных.
Основным критерием качество лечения онокбольных является выживаемость. Выживаемость в течение пяти лет при удалении мочевого пузыря составила 49-63%, а с сохраненным пузырем - от 38% до 45%. В среднем 80% больных сохранили функционирующий мочевой пузырь без ущерба для продолжительности жизни.
Многие онкологи считают, что после лучевой терапии, химиотерапии функция мочевого пузыря становится плохой. В нескольких исследованиях изучалось качество мочеиспускания после органосохраняющего лечения рака мочевого пузыря. Анализ качества жизни с помощью опросников, а в ряде исследований и с использованием специальных обследований, не выявил у большинства больных выраженных нарушений.
Важным аспектом качества жизни есть сохранение половой функции. Имеются весомые различия в выраженности сексуальных проблем у мужчин и женщин. Большинство женщин не отвечают в опросных листах на такие пункты; мужчины, наоборот, отвечают и оценивают качество своей половой функции. Сексуальные проблемы отмечаются чаще в процессе лечения. В сравнении с лечением рака предстательной железы эти проблемы менее выражены. Не более 8% больных высказывают неудовлетворение половой функцией.
В настоящее время интенсивно изучается роль неоадъювантной (послеоперационной) химиотерапии в органосохраняющем лечении рака мочевого пузыря. Сведения по этому вопросу противоречивы. Одним из недостатков этого метода - потеря времени при нечувствительности опухоли к лечению. В это время пациенту может быть проведена радикальная операция и больше вероятности избавиться от рака. Продолжаются исследования которые должны определить роль этого метода в органосохраняющем лечении рака мочевого пузыря.
Задать вопрос врачу онкологу
Диагностка и лечение онкологии в медицинских центрах Израиля подробная информация
Подпишитесь на рассылку Новости онкологии и будьте в курсе всех событий и новостей в мира онкологии.
Высокая послеоперационная летальность (15-50%) после цистэктомии, а также большое количество осложнений различных методов деривации мочи и связанные с этим серьезные проблемы дальнейшей социальной реабилитации пациентов служат стимулом для выполнения органосохраняющих операций при раке мочевого пузыря (РМП).
Основным принципом их применения при мышечно-инвазивной опухоли является то, что эти операции должны выполняться как один из этапов комбинированного лечения, т.е. лечение необходимо дополнить неоадъювантной и/или адъювантной системной химиотерапией и/или лучевой терапией (ЛТ).
Трансуретральная резекция мочевого пузыря
Трансуретральная резекция (ТУР) мочевого пузыря (МП) широко применяется при лечении поверхностного РМП, однако в последнее время используется рядом авторов и при инвазивных новообразованиях. Данное оперативное вмешательство, как правило, является первым этапом в диагностике и лечении этого заболевания и носит лечебно-диагностический характер, его основная цель — максимально радикально удалить имеющуюся опухоль и установить стадию заболевания. Анализ достаточного количества гистологического материала, полученного при ТУР, дает возможность определить дальнейшую тактику лечения больного.
Решающими моментами в выборе тактики ведения пациента и прогнозирования дальнейшего развития заболевания являются прежде всего гистологическое заключение о строении опухоли и степени ее дифференцировки (категория G), а также глубина инвазии в стенку МП (категория Т). Однако существует ряд моментов, сдерживающих применение трансуретральная резекция при инвазивном раке. В первую очередь к ним следует отнести невозможность гарантированно удалить всю опухоль.
При инфильтративном росте всегда существует вероятность оставить резидуальную опухолевую ткань в макроскопически неизмененных участках стенки МП. Если применение ТУР при стадии заболевания T2а, т.е. новообразовании, инфильтрирующем внутреннюю половину мышечного слоя, при отрицательной биопсии из ложа опухоли можно считать радикальным, то при распространении заболевания на всю толщу стенки МП (Т2b), а тем более за ее пределы радикальность выполнения данного оперативного вмешательства представляется сомнительной.
Другим отрицательным моментом является то. что при этой операции не удаляются регионарные лимфатические узлы, довольно часто поражаемые метастазами инвазивного РМП (до 10% при стадии Т2, до 37% случаев при стадии Т3). Нередко использование метода ТУР при мышечно-инвазивной опухоли может быть ограничено локализацией в труднодоступных участках мочевого пузыря и размерами образования, степенью инвазии в стенку органа, мультифокальностью и распространенностью онкологического заболевания, а также зависит от наличия сопутствующей CIS.
В настоящий момент не существует однозначного мнения в отношении показаний к трансуретральной резекции при инвазивном раке мочевого пузыря, Некоторые урологи считают ТУР основным методом лечения при стадии заболевания Т2. Другие исследователи считают возможным выполнять ТУР только при высокой и умеренной степенях дифференцировки (Gr G2) в стадии Т2, предполагая необходимость выполнения цистэктомии при низкодифференцированных опухолях и считая, что трансуретральные оперативные вмешательства при стадии Т3 носят лишь паллиативный характер.
Присутствие рака in situ не считается противопоказанием, но подчеркивается необходимость адъювантной БЦЖ-терапии и более тщательного наблюдения. По данным различных авторов в 40% случаев трансуретральной резекции выявляет первоначально заниженную степень инвазии опухоли в стенку МП.
Техника ТУР при мышечно-инвазивном РМП заключается в следующем (рис. 3.58-3.60).

Рис. 3.58. Цистоскопия. Инвазивная опухоль мочевого пузыря (рТ2в)

Рис. 3.59. ТУР-биопсия мышечного слоя (основание опухоли). Удалена опухоль
Предварительно эндоскопическими щипцами выполняется биопсия экзофитной части и основания опухоли. После этого первым этапом осуществляется трансуретральная резекция экзофитного компонента опухоли путем горизонтальной или вертикальной резекции, затем выполняется полная резекция видимых участков поражения, включая послойную глубокую биопсию основания опухоли.
При ТУР боковых стенок вводятся миорелаксанты короткого действия для предотвращения возможной неконтролируемой перфорации стенки МП в результате синдрома запирательного нерва. В случаях сдавления или прорастания опухолью мочеточникового устья выполняется его резекция с катетеризацией (стентированием) соответствующего мочеточника.
Во всех случаях экзофитную часть удаленной опухоли и резецированные фрагменты стенки МП маркируют для гистологического исследования раздельно. При множественном росте материал от каждого опухолевого образования подлежит раздельной маркировке. После удаления видимых опухолей обязательно выполняется полифокальная биопсия остальных участков стенки МП для возможной верификации CIS. Операция заканчивается визуальным контролем и дренированием мочевого пузыря катетером Фолея, в ряде случаев с применением ирригационной системы.
В течение нескольких лет ведутся дискуссии о целесообразности применения в качестве лечебно-диагностического метода ранней повторной цистоскопии и ТУР-биопсии, широко известной в зарубежной литературе под названием second look TUR. Ранняя повторная цистоскопия и биопсия являются методом, позволяющим установить истинную стадию заболевания путем повторной трансуретральной резекции МП, таким образом она приобретает особое значение при определении дальнейшей тактики лечения инвазивного РМП. Среди ряда зарубежных урологических клиник пациентам с поверхностным раком мочевого пузыря введено в практику выполнение ранней повторной цистоскопии и ТУР-биопсии (second look TUR) в сроки от 2 до 8 нед после первой ТУР.
Хорошо известен тот факт, что переходно-клеточный рак в стадиях T1-T2 со степенью дифференцировки G2 и G3 склонен к прогрессивному течению заболевания. Поэтому многие авторы считают достаточно рискованным удлинять интервал между проведением контрольных цистоскопии у пациентов со степенью дифференцировки G2 и G3, предполагая тем самым выполнение ранней повторной цистоскопии и биопсии.
В одном из последних исследований, проведенном в больнице Memorial Sloan-Kettering, 170 пациентам как с поверхностным, так и с инвазивным РМП после первичного трансуретрального оперативного вмешательства была выполнена ранняя повторная цистоскопия и биопсия. При этом у 114 (76%) больных выявлены резидуальные опухоли.
В группе пациентов с поверхностным РМП (Та, Тis, Тx) рецидивы выявлены у 72 (75%) патентов, из которых у 28 (22%) обнаружены инвазивные опухоли. А у больных с первичным мышечно-инвазивным раком мочевого пузыря (стадия Т2) только у 12 (22%) при ранней повторной цистоскопии и биопсии не выявлено рецидивов заболевания.
Основываясь на результатах данного исследования, можно предположить, что трансуретральная резекция, выполненная в качестве монотерапии у пациентов с мышечно-инвазивным РМП, не может быть рассмотрена как стандартный алгоритм лечения этой категории больных. Таким образом, необходим строго дифференцированный подход у больных с мышечно-инвазивным РМП при выборе органосохраняющей оперативной тактики лечения.
Кроме того, возможно применение ТУР МП с паллиативной целью у неоперабельных больных. ТУР может быть выполнена у пациентов со стадией заболевания Т3a, у которых в результате неоадъювантной химиотерапии или химиолучевой терапии достигнута полная регрессия опухоли, подтвержденная данными повторной цистоскопии и биопсии, а также на основании гистологического исследования. Однако для однозначного решения вопроса о целесообразности трансуретральной резекции при инвазивном раке мочевого пузыря необходимо дальнейшее проведение рандомизированных исследований.
Резекция мочевого пузыря
Резекции МП нередко технически сложны и сопровождаются послеоперационными осложнениями у значительной части больных, но выбор уролога чаще продиктован несовершенством принятых методов деривации мочи и стремлением обеспечить пациенту приемлемое качество жизни, а не отсутствием желания выполнять радикальную цистэктомию.
В зарубежной практике урологи выполняют так называемую парциальную цистэктомию при инвазивном раке в случае первичного, солитарного поражения и при наличии возможности выполнения резекции стенки МП, отступив на 2 см от края опухоли. При этом необходимо выполнить биопсию из различных участков стенки мочевого пузыря.
Отечественные исследователи также считают, что эта операция может быть произведена при первичном поражении МП; при этом опухоль должна быть одиночной, локализованной на подвижных стенках МП и отстоять от шейки не менее чем на 3 см; размеры опухоли не должны превышать 5-6 см в диаметре; в окружающей макроскопически неизмененной слизистой оболочке и простатическом отделе уретры не должно быть рака in situ или тяжелых диспластических изменений.
Следует отметить, что при резекции МП необходимо удаление регионарных лимфатических узлов, так как при инвазивном раке увеличивается риск их поражения. Гистологическое исследование удаленных лимфатических узлов способствует правильному установлению стадии заболевания и решению вопроса о проведении дополнительного лечения после операций.
Только при соблюдении этих условий отдаленные результаты резекции мочевого пузыря не уступают таковым после радикальной цистэктомии. Исследования, основанные на вышеизложенных критериях отбора пациентов для выполнения резекции МП, показывают, что только 6-19% больных в последующем была выполнена радикальная цистэктомия. По данным РОНЦ РАМН, 5-летняя выживаемость больных инвазивным РМП после резекции составила 70,5%.
В зарубежной практике общая 5-летняя выживаемость варьирует от 25 до 60%, при этом уровень общего рецидивирования РМП составляет 40-78%. Рецидивы после выполнения резекции МП выявлены при стадии заболевания Т2 у 29% пациентов, при стадии Т3 в 33% и при стадии Т4 в 20% случаев. По данным М.Э. Ситдыковой и Э.Н. Ситдыкова, частота рецидивов также зависит от стадии рака мочевого пузыря. Она составляет 31,5% при стадии Т2 и 70,1% при опухолевой инвазии Есей толщи стенки МП. Авторы считают, что резекция мочевого пузыря является эффективным методом лечения при стадии Т2 и нерадикальна в стадии Т3.
С другой стороны, некоторые авторы полагают, что вышеперечисленные показания к резекции МП могут быть расширены у больных, получавших неоадъювантную химиотерапию с хорошим эффектом. Органосохраняющие техники могут использованы при центральной локализации опухоли, включая основание МП.
Некоторые урологи считают допустимой резекцию с реимплантацией устья мочеточника при расположении в данной зоне опухоли МП. Кроме того, некоторые авторы не считают противопоказанием наличие рака in situ в оставшейся слизистой оболочке или по краю резекции, так как данным больным после операции может быть проведена внутрипузырная БЦЖ-терапия. Насколько оправданы такие расширенные показания для выполнения резекции у больных с инвазивным РМП, должны показать последующие рандомизированные исследования.
Лучевая терапия
ЛТ — метод лечения злокачественных новообразований при помощи ионизирующего излучения, в основе которого лежит его повреждающее воздействие на злокачественные клетки, приводящее к их гибели. Лучевая терапия как радикальный метод лечения больных инвазивным РМП вызывает противоречивые суждения среди врачей и исследователей как в России, так и за рубежом. Неоднозначны результаты ЛТ и их интерпретация.
В литературе накопилось достаточно данных о положительных результатах — стойкой ремиссии заболевания и сохранности адекватной функции мочевого пузыря. Существующие мнения разнятся и зависят от наличия соответствующей оперативной или радиологической базы. Так, урологи США и Канады больше предпочитают оперативные пособия при мышечно-инвазивном раке мочевого пузыря. В Великобритании, напротив, лучевая терапия является стандартным методом лечения при данной стадии заболевания. Большинство специалистов все-таки предпочитают оперативные пособия ЛТ, которая редко используется в качестве первичного лечения инвазивного РМП.
Многие авторы полагают, что при соответствующих критериях отбора пациентов для ЛТ удается в 60-70% случаев достичь полной регрессии опухоли, сохранить функцию МП и обеспечить высокое качество жизни. При этом результаты лечения коррелируют с дозой облучения: чем выше подведенная доза, тем лучше ожидаемые результаты лечения. Однако следует отметить, что с увеличением дозы облучения возрастает вероятность возникновения как непосредственных, так и отсроченных (поздних) лучевых осложнений лечения.
Эффективность ответа на лучевую терапию выше при низкодифференцированных опухолях (G3). Местные рецидивы чаще развиваются у больных с меньшей степенью злокачественности опухоли В различных зарубежных исследованиях приводятся данные о 5-летней выживаемости практически 40% пациентов с инвазивным РМП после ЛТ. При этом уровень рецидивирования составляет 40-50%.
Отдаленные метастазы выявляются всего у 10% пациентов, 5-летняя выживаемость и уровень рецидивирования зависят от стадии заболевания. Так, при стадии Т 5-летняя выживаемость составляет приблизительно 20%, а уровень рецидивирования рака мочевого пузыря варьирует от 50 до 70%. Соответственно, при стадии заболевания Т4 5-летняя выживаемость больных составляет всего 10%.
Большинство авторов предлагают следующие критерии отбора пациентов для применения ЛТ в качестве первичного лечения инвазивного РМП: наличие папиллярной опухоли высокой степени дифференцировки меньше чем 5 см в диаметре. При этом предварительно выполненная ТУР перед началом облучения позволяет улучшить качество лечения.
Тем не менее результаты исследований ряда авторов о применении лучевой терапии в лечении инвазивного РМП остаются неутешительными. Holmang и соавт. сообщают о 74 пациентах с инвазивным раком мочевого пузыря, которым выполнялась ЛТ, В 84% случаев наблюдалось персистирование опухоли, рецидивирование и сморщивание МП. Средняя выживаемость пациентов со стадиями заболевания Т2 и T3 составила 16 мес, при этом наблюдался высокий уровень непосредственных и отсроченных осложнений лечения.
Из-за осложнений ЛТ, как ранних, так и поздних, умерли 7 (9,5%) больных. Отмечено, что наибольшая смертность была среди пациентов пожилого возраста (70-75 лет), а также при высокой дозе облучения — 65 Гр и выше. Наибольшая выживаемость была в группе больных, которым перед началом лучевой терапии была выполнена ТУР мочевого пузыря. Таким образом, результаты первичного применения ЛТ примерно одинаковы с результатами трансуретральной резекции МП, выполненной в качестве монотерапии инвазивного РМП.
В своем исследовании Montie приводит данные об улучшении результатов ЛТ на 10-20% при применении радиосенсибилизаторов (cisplatin) у больных с инвазивным РМП. Канадские исследователи сообщают о 104 пациентах, которым удалось вызвать клиническую ремиссию заболевания в 90% случаев путем комбинированного использования лучевой терапии и интраартериального введения цисплатина.
8 литературе, также приводятся данные о комбинированном использовании 1921г и экстракорпоральной ЛТ, что приводит к улучшению результатов лечения пациентов с инвазивным раком мочевого пузыря, но при этом значительно увеличивается токсичность и смертность. Так, Wijnmaalen и соавт. сообщают о 66 больных РМП в стадии Т1 с солитарным поражением и размером опухоли менее 5 см, которым первично была выполнена ТУР с последующим комбинированным назначением ЛТ и 1921г. При данном лечении выживаемость пациентов составила 60%, а безрецидивное течение заболевания наблюдалось более чем у 61% больных.
Основываясь на вышеизложенных данных литературы, лучевая терапия, используемая в качестве монометода у пациентов с инвазивным РМП, не дает результатов выживаемости, сравнимых с эффективностью радикальной цистэктомии.
Считается, что ЛТ показана при местно-распространенном раком мочевого пузыря (Т3b, Т4, N+), а также в случаях невозможности выполнения оперативных вмешательств пациентам с выраженными интеркурентными заболеваниями и в пожилом возрасте. В данных случаях лучевая терапия играет паллиативную роль в лечении пациентов с мышечно-инвазивным РМП. Таким образом, этот вид терапии занимает свое место з лечении определенного контингента больных.
Читайте также:

