Октреотид в лечении нейроэндокринных опухолей
Аналоги соматостатина (АСС) играют ключевую роль в лечении диссеминированных высокодифференцированных НЭО, как функционирующих, так и нефункционирующих. Воздействуя на рецепторы соматостатина, они ингибируют гормональную активность НЭО и оказывают прямой антипролиферативный эффект, увеличивая медиану времени до прогрессирования.
В настоящее время считается, что антипролиферативный эффект осуществляется путем связывания с рецепторами соматостатина и с системным воздействием, что приводит к угнетению таких клеточных функций, как секреция, подвижность и пролиферация.
АСС являются терапией первой линии при функционально активных НЭО, включая опухоли с проявлениями карциноидного синдрома и других функционально активных НЭО.
Препараты пролонгированного действия (ланреотид 120 мг глубоко подкожно 1 раз в 28 дней, октреотид 20-30 мг внутримышечно 1 раз в 28 дней) используются в течение длительного времени при успешном контроле симптомов, вызванных гиперсекрецией функционально активных НЭО.
АСС рекомендуются в качестве первой линии системной терапии при высокодифференцированных НЭО для контроля роста опухоли. Согласно рекомендациям ENETS 2016 года, АСС можно использовать в качестве первой линии системной терапии при НЭО G1 и G2 (Ki67
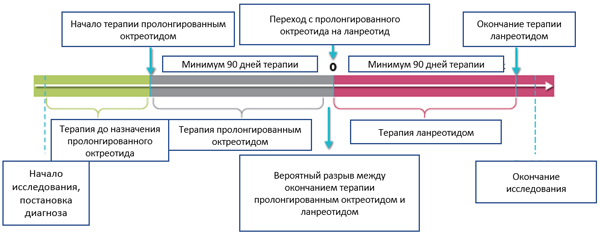
Причинами перехода были: прогрессирование (n=20; 22%), изменение формы введения препарата (n=14; 15,4%), предпочтение пациента (n=9; 9,9%), не указана причина перехода (n=33; 36,3%)
После постановки диагноза ГЭП НЭО пациенты начинали терапию октреотидом в среднем через 17 мес. и получали октреотид в среднем в течение 38,4 мес.
Клинически подтвержденное прогрессирование на момент начала терапии ланреотидом наблюдалось у 24,2% пациентов.
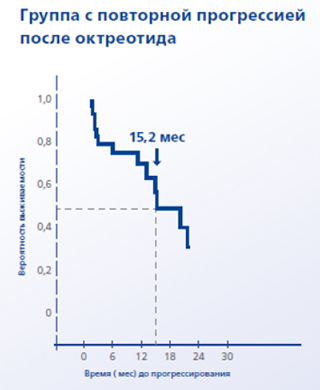
В группе с повторной прогрессией после перехода с пролонгированного октреотида на ланреотид время до повторного прогрессирования составило 15,2 мес.
Частота встречаемости ассоциированных с заболеванием симптомов и нежелательных явлений:
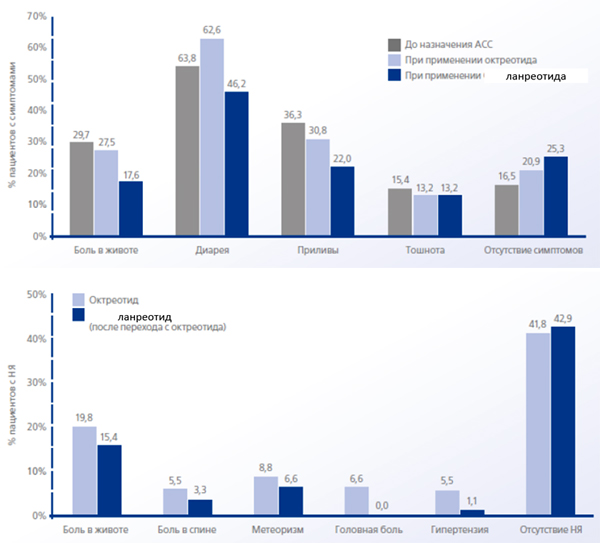
- Проведенный ретроспективный анализ показал возможность перехода с пролонгированного октреотида на ланреотид у пациентов с локально распространенными или метастатическими ГЭП НЭО.
- В группе с повторной прогрессией после перехода с пролонгированного октреотида на ланреотид время до повторного прогрессирования составило 15,2 мес.
- Пациентам с локально распространенными или метастатическими ГЭП НЭО, как непрогрессирующими, так и прогрессирующими, может быть осуществлен безопасный переход с пролонгированного октреотида на ланреотид [2].
Таким образом, выбор терапии для лечения нейроэндокринных опухолей зависит от локализации, морфологических и функциональных особенностей. Основные алгоритмы и подходы к лечению были опубликованы в клинических рекомендациях ENETS 2016 года. Аналоги соматостатина (ланреотид и октреотид) являются первой линией терапии для высокодифференцированных опухолей, тогда как химиотерапия – стандарт лечения низкодифференцированных НЭО.
- Емельянова Г.С., Орел Н.Ф. Лекарственная терапия нейроэндокринных опухолей. Фарматека, №12, 2018, С.76-80.
- Pavel M., O’Toole D., Costa F., et al. ENETS Consensus Guidelines Update for the Management of Distant Metastatic Disease of Intestinal, Pancreatic, Bronchial Neuroendocrine Neoplasms (NEN) and NEN of Unknown Primary Site. Neuroendocrinology 2016; 103: 172-185.
- Wasif M. Saif, Rohan Parikh, et al. The sequencing of lanreotide (LAN) after octreotide LAR (OCT) for the treatment of gastroenteropancreatic neuroendocrine tumors (GEP-NETs). Poster. Presented at the North American Neuroendocrine Tumor Society (NANETS), Seattle, Washington, USA, October 4-6, 2018.


Сайт использует файлы cookies для более комфортной работы пользователя. Продолжая просмотр страниц сайта, вы соглашаетесь с использованием файлов cookies, а также с обработкой ваших персональных данных в соответствии с Политикой конфиденциальности.
ЗАБОЛЕВАЕМОСТЬ
Одна из наиболее часто встречающихся опухолей диффузной нейроэндокринной системы!
Опухоль секретирует:
- серотонин
- брадикинин
- 5-гидрокситриптофан
- простагландины
- ВИП
- гистамин
Это приводит к развитию карциноидного синдрома.
Проявления:
- приливы (63-94%). Внезапное появление глубокой красной или фиолетовой эритемы верхней части туловища, в основном лица и шеи. Сопровождается неприятным ощущением тепла, слезотечением, зудом, отеком лица и конъюнктивитом, саливацией и потоотделением, ощущением пульсации.
- диарея (68-84%)
- бронхоспазм (3-19%)
- одышка (3-19%)
- телеангиэктазии (25%)
- изменения сердца (11-53%)
- пеллагроподобный синдром с гиперкератозом и пигментацией (2-6%)
- поражение сердца – карциноидный кардиальный синдром (синдром Хедингера)выявляется более чем у 50% больных.
Синдром обусловлен развитием фиброзных изменений в эндо- и миокарде правых отделов сердца с поражением клапанов.
Характерны стеноз и недостаточность трехстворчатого клапана и клапана легочной артерии.
- Может возникать спонтанно или провоцироваться стрессами, алкоголем, некоторой пищей (например, сыром), инъекциями катехоламинов.
- Первоначальные приступы длятся 2-5 минут, а в дальнейшем их продолжительность может увеличиваться до нескольких часов.
- Кризы чаще возникают при суточной экскреции 5-ГИУК более 200 мг и провоцируются стрессами, наркозом, биопсией или операцией, химиотерапией, давая высокую летальность.
- Высокодифференцированная нейроэндокринная опухоль (доброкачественная).
- Высокодифференцированная нейроэндокринная карцинома (низкой степени злокачественности).
- Низкодифференцированная нейроэндокринная карцинома (мелкоклеточная).
- Смешанная экзокринная и эндокринная карцинома.
- Опухолевоподобное поражение.
- низкий пролиферативный потенциал
- способность секретировать различные биологические вещества
- низкая чувствительность к химиотерапии.
К ним относятся различные карциноиды передней, средней и задней кишки, феохромоцитома, медуллярный рак щитовидной железы.
- высокозлокачественные опухоли с высоким пролиферативным потенциалом
- чувствительны к химиотерапии и лучевой терапии.
К ним относится мелкоклеточный рак легкого и других органов.
- к ним относятся различные опухоли поджелудочной железы (кроме карциноидов)
- чувствительность к химиотерапии данных опухолей умеренная.
- Верхние (2-9%) (передняя кишка): опухоли дыхательных путей, тимуса, пищевода, желудка, двенадцатиперстной кишки, поджелудочной железы. Характерна низкая секреция серотонина, повышенная – гистамина и различных гормонов, атипичное течение карциноидного синдрома, частое метастазирование в кости.
- Средние (75-87%) (средняя кишка): опухоли тонкой кишки, аппендикса, слепой кишки, восходящего отдела ободочной кишки. Гиперсекреция серотонина и других вазоактивных субстанций, карциноидный синдром.
- Нижние (1-8%) (задняя кишка): опухоли поперечно-ободочной и нисходящей ободочной кишки, сигмовидной и прямой кишки. Карциноидный синдром не характерен, частое метастазирование в печень.
- Гормонально-активные опухоли – характерна гиперсекреция гормонов. Клинические симптомы позволяют осуществить раннюю диагностику.
- Гормонально-неактивные опухоли(нет симптомов гиперсекреции гормонов) – до 50% нейроэндокринных опухолей. Клинически проявляются при большой опухолевой массе – на этом этапе опухоль метастазирует, а также может проявляться симптомами сдавления кишки.
- Определение уровня серотонина и его метаболитов в моче. Наиболее распространенный тест – измерение экскреции 5-ГИУК (5-гидроксииндолуксусной кислоты) в суточной моче. Однако данный анализ может давать ложноположительные результаты в зависимости от характера употребляемой больными пищи (цитрусовые, бананы, ананасы, киви, орехи).
- Определение уровня хромогранина А в крови (повышение уровня хромогранина А наблюдают у 87-99% больных), норма - менее 4,5 ммоль/л. Этот плазменный маркер является самым достоверным при НЭО.
- Определение уровня экскреции нейронспецифической енолазы в крови.
ИНСТРУМЕНТАЛЬНАЯ ДИАГНОСТИКА
- рентгенография органов грудной клетки
- рентгенография пищевода и желудка
- ирригоскопия
- ЭГДС
- ректороманоскопия
- колоноскопия
- бронхоскопия
- УЗИ
- Ультразвуковая допплерография сосудов
- Эндосонография
- Интраоперационное УЗИ
- Лапароскопическое УЗИ
- Сцинтиграфия костей скелета
- Сцинтиграфия с Октреотидом, меченным 111 In
НЭО на поверхности клеток имеют рецепторы, обладающие высоким сродством к гормону соматостатину. В 87% случаев они присутствуют как в первичной опухоли, так и в метастазах. В связи с этим в последние годы для определения локализации опухоли и метастазов используется радиоизотопный метод с меченным 111 In Октреотидом. Введенный внутривенно Октреотид, 111 In через 24-48 ч. определяется на соматостатиновых рецепторах и позволяет визуализировать соматостатинпозитивную опухоль, а также определить возможность применения аналогов соматостатина для лечения.
Метод с применением Октреотида, 111 In обладает чувствительностью 87%, специфичностью 75% и частотой совпадения диагнозов 87%.
Лечение
Хирургическое лечение
Основной метод лечения НЭО – хирургический. Возможные варианты оперативного вмешательства определяют по локализации опухоли, наличию или отсутствию метастазов и осложнений опухолевого процесса. Однако контроль симптомов при хирургическом лечении достигается не всегда!
Немедикаментозное лечение
Контроль за проявлениями карциноидного синдрома: исключение стрессов, алкоголя, соблюдение диеты.
Биотерапия:
- синтетические аналоги соматостатина: раствор для инъекций Октреотид и лиофилизат для приготовления суспензии для внутримышечного введения пролонгированного действия Октреотид-депо.
- интерферон-?, пролонгированная форма ИНФ-? (PEG-интерферон).
- монохимиотерапия: стрептозоцин, доксирубицин, фторурацил, дактиномицин, этопозид, цисплатин, дакарбазин.
- ПХТ: сочетания стрептозоцина, фторурацила и доксирубицина, цисплатина с этопозидом.
- гипотензивные препараты
- антигистаминные препараты
- диуретики
- бронходилататоры
- антидиарейные препараты.
- Препарат оказывает симптоматический эффект, понижая секрецию гормонов и пептидов, экскретируемых при випомах в 89%, при глюкоганомах в 75%, при инсулиномах в 65%.
- После применения Октреотида-депо при разных НЭО диарея прекращается у 40-60% больных.
- При ВИПомах Октреотид-депо полностью прекращает диарею в 38%случаев, еще у 38% больных значительно её уменьшает.
- Улучшает общее состояние в 75-85% случаев.
- Октреотид-депо контролирует гипогликемию при инсулиномах, некролитические кожные повреждения при глюкоганомах, что значительно улучшает качество жизни пациентов.
При карциноидных опухолях применение Октреотида-депо может приводить к уменьшению выраженности симптомов заболевания, в первую очередь, таких как приливы и диарея. Во многих случаях клиническое улучшение сопровождается снижением концентрации серотонина в плазме и экскреции 5-гидроксииндолуксусной кислоты с мочой.
При опухолях, характеризующихся гиперпродукцией вазоактивного интестинального пептида (ВИПомы), применение Октреотида-депо приводит у большинства больных к уменьшению тяжелой секреторной диареи, которая характерна для данного состояния, что, в свою очередь, приводит к улучшению качества жизни больного. Одновременно происходит уменьшение сопутствующих нарушений электролитного баланса, например, гипокалиемии, что позволяет отменить энтеральное и парентеральное введение жидкости и электролитов. По данным компьютерной томографии у некоторых больных происходит замедление или остановка прогрессирования опухоли, и даже уменьшение ее размеров, особенно метастазов в печень. Клиническое улучшение обычно сопровождается уменьшением (вплоть до нормальных значений) концентрации вазоактивного интестинального пептида (ВИП) в плазме.
При глюкагономах применение Октреотида-депо в большинстве случаев приводит к заметному уменьшению некротизирующей мигрирующей сыпи, которая характерна для данного состояния. У больных, страдающих диареей, Октреотид-депо вызывает ее уменьшение, что сопровождается повышением массы тела. При применении Октреотида-депо часто отмечается быстрое снижение концентрации глюкагона в плазме, однако при длительном лечении этот эффект не сохраняется. В то же время симптоматическое улучшение остается стабильным длительное время.
При гастриномах/синдроме Золлингера-Эллисона Октреотид-депо, применяемый в качестве монотерапии или в комбинации с блокаторами H2-рецепторов и ингибиторами протонного насоса, может снизить образование соляной кислоты в желудке и привести к клиническому улучшению, в т.ч. и в отношении диареи. Возможно также уменьшение выраженности и других симптомов, вероятно связанных с синтезом пептидов опухолью, в т.ч. приливов. В некоторых случаях отмечается снижение концентрации гастрина в плазме.
У больных с инсулиномами Октреотид-депо уменьшает уровень иммунореактивного инсулина в крови. У больных с операбельными опухолями Октреотид-депо может обеспечить восстановление и поддержание нормогликемии в предоперационном периоде. У больных с неоперабельными доброкачественными и злокачественными опухолями контроль гликемии может улучшаться и без одновременного продолжительного снижения уровня инсулина в крови.
У больных с редко встречающимися опухолями, гиперпродуцирующими рилизинг-фактор гормона роста (соматолибериномами), Октреотид-депо уменьшает выраженность симптомов акромегалии. Это, по-видимому, связано с подавлением секреции рилизинг-фактора гормона роста и самого гормона роста. В дальнейшем возможно уменьшение размеров гипофиза, которые до начала лечения были увеличены.
Обнаружено, что применение Октреотида-депо в дозах 30 мг и выше оказывает антипролиферативный эффект, связанный с прямым цитотоксическим действием препарата на опухоль при взаимодействии с соматостатиновыми рецепторами, а также с угнетением образования сосудов, питающих опухоль.
При эндокринных опухолях ЖКТ и поджелудочной железы для больных, у которых подкожное введение Октреотида обеспечивает адекватный контроль проявлений заболевания, рекомендуемая начальная доза Октреотида-депо составляет 20 мг каждые 4 недели.
Подкожное введение Октреотида следует продолжать еще в течение 2 недель после первого введения Октреотида-депо.
Для больных, не получавших ранее Октреотид подкожно, рекомендуется начинать лечение именно с подкожного введения Октреотида в дозе 0.1 мг 3 раза/сут. в течение относительно короткого периода времени (примерно 2 недели) с целью оценки его эффективности и общей переносимости. Только после этого назначают Октреотид-депо по вышеприведенной схеме.
В случае, когда терапия Октреотидом-депо в течение 3 мес. обеспечивает адекватный контроль клинических проявлений и биологических маркеров заболевания, возможно снизить дозу Октреотида-депо до 10 мг, назначаемых каждые 4 недели.
В тех случаях, когда после 3 мес. лечения Октреотидом-депо удалось достичь лишь частичного улучшения, дозу препарата можно увеличить до 30 мг каждые 4 недели.
На фоне лечения Октреотидом-депо в отдельные дни возможно усиление клинических проявлений, характерных для эндокринных опухолей ЖКТ и поджелудочной железы. В этих случаях рекомендуется дополнительное подкожное введение Октреотида в дозе, применявшейся до начала лечения Октреотидом-депо. Это может происходить, главным образом, в первые 2 мес. лечения.
Октреотид-депо – препарат первой линии для монотерапии или комбинированной терапии высокодифференцированных нейроэндокринных опухолей ЖКТ и поджелудочной железы, эффективно купирующий гормональные синдромы за счет подавления гиперсекреции гормонов этими опухолями, повышая качество жизни и выживаемость больных.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Диагностика и лечение функционирующих и нефункционирующих нейроэндокринных опухолей представляет собой сложную задачу. В последние десятилетия заболеваемость нейроэндокринными опухолями неуклонно растет. Несмотря на то, что единственным радикальным методом лечения этих новообразований остается хирургический, опухоли нередко диагностируют уже на стадии метастазирования, когда возможна лишь паллиативная тактика. Задачей лечения больных с этой патологией являются ликвидация самой опухоли и подавление симптомокомплекса, обусловленного карциноидным синдромом, который сам по себе может стать причиной смерти больного. Торможение опухолевого роста и подавление гормональной экспрессии аналогами соматостатина (в частности, октреотидом) позволяют значительно продлить жизнь и улучшить ее качество у больных. В лечении пациентов с нейроэндокринными опухолями препаратом с доказанной эффективностью, способным подавлять клиническую симптоматику карциноидного синдрома, остается октреотид, который также обладает антипролиферативной активностью. Октреотид пролонгированного действия (Октреотид-депо) обладает бóльшим удобством в использовании для пациентов. В статье приведены обзор литературы, исследования и клинические случаи, в которых рассмотрены вопросы введения более высоких доз препарата при ряде состояний, а также описаны редкие заболевания, при которых может эффективно использоваться октреотид пролонгированного действия.
Ключевые слова: октреотид пролонгированного действия, аналоги соматостатина, нейроэндокринные опухоли, карциноидный синдром, метастазы.
Для цитирования: Моргунов Л.Ю. Аналоги соматостатина в лечении нейроэндокринных опухолей. РМЖ. 2019;6:10-14.
Somatostatin analogs in neuroendocrine tumors treatment
L.Yu. Morgunov
Russian University of Peoples’ Friendship, Moscow
Functioning and non-functioning neuroendocrine tumors diagnosis and treatment is a difficult task. In recent decades, the neuroendocrine tumors incidence has been steadily increasing. Despite the fact that the only radical treatment method for these neoplasms remains surgical, tumors are commonly diagnosed at the metastasis stage, when only palliative care is possible. The task of treating patients with this pathology is to eliminate the tumor itself and suppress the symptom-complex caused by carcinoid syndrome, which itself can cause patient death. Tumor growth inhibition and hormonal expression suppression by somatostatin analogs (in particular, octreotide) can significantly extend the life and improve its quality in patients. In the patient’s treatment with neuroendocrine tumors, a drug with proven effectiveness that can suppress the carcinoid syndrome clinical symptomatology remains octreotide, which also has antiproliferative activity. Sustained-release octreotide (Octreotide-depo) has great usability for patients. The article provides a literature review, studies and clinical cases in which the higher doses introduction of the drug in a number of conditions is considered, as well as rare diseases in which sustained-release octreotide can be effectively used.
Keywords: sustained-release octreotide, somatostatin analogs, neuroendocrine tumors, carcinoid syndrome, metastases.
For citation: Morgunov L.Yu. Somatostatin analogs in neuroendocrine tumors treatment. RMJ. 2019;6:10–14.
Представлен обзор литературы возможностей использования аналогов соматостатина в лечении нейроэндокринных опухолей. Рассмотрено введение более высоких доз препарата при ряде состояний, а также описаны редкие заболевания, при которых может эффективно использоваться препарат пролонгированного действия
Введение
В последние десятилетия заболеваемость нейроэндокринными опухолями (НЭО) неуклонно растет. НЭО — относительно редкая гетерогенная группа новообразований с ежегодной заболеваемостью 35 случаев на 100 000 человек. Обновленная ВОЗ классификация гастроэнтеропанкреатических (ГЭП) опухолей верифицирует их в зависимости от локализации, клинических проявлений и степени дифференцировки. Из-за медленного роста и отсутствия ранних симптомов большинство НЭО часто диагностируют на поздних стадиях, когда варианты лечебного воздействия ограничены [1].
НЭО возникают в любых органах, где имеются эндокринные клетки. Эти новообразования могут не давать клинической симптоматики, однако в случае их функциональности развиваются эндокринные синдромы, представляющие угрозу здоровью и жизни пациентов.
Задачей лечения больных с НЭО являются ликвидация самой опухоли и подавление симптомокомплекса, обусловленного карциноидным синдромом. Единственным радикальным методом лечения остается хирургический, а при невозможности его использования торможение опухолевого роста и подавление гормональной экспрессии аналогами соматостатина (в частности, октреотидом) позволяют продлить жизнь и улучшить ее качество у больных.
Использование аналогов соматостатина в лечении НЭО
Октреотид, первый синтетический аналог соматостатина, первоначально использовался для коррекции клинических проявлений карциноидного синдрома. Недавние исследования показали, что лечение октреотидом может быть не только симптоматическим, но и таргетным, учитывая противоопухолевые эффекты препарата. Разработан октреотид длительного действия, который обеспечивает большее удобство введения [2].
Клинические эффекты октреотида пролонгированного действия
Октреотид продемонстрировал хорошее действие на гормональную гиперсекрецию и рост НЭО. Препарат играет ключевую роль в коррекции симптоматики, вызванной секрецией нейропептидов у пациентов с высокодифференцированными карциномами, обладает противоопухолевой активностью при карциноидах кишечника, значительно увеличивая время прогрессирования НЭО. Октреотид пролонгированного действия эффективен как в качестве монотерапии, так и в сочетании с химио- или радионуклидной терапией пептидных рецепторов [3]. Препарат вводят 1 раз в месяц, он оказывает эффективное и безопасное противоопухолевое и симптоматическое действие при непрерывном поддержании концентрации в организме [4–6].
Карциноиды представляют собой в основном медленно растущие НЭО с низкой пролиферативной активностью. Октреотид остается стандартом симптоматической терапии карциноидного синдрома, обладая антипролиферативной активностью, одновременно тормозит рост опухолей. Хотя лечение октреотидом само по себе редко приводит к ремиссии опухолевого процесса, он замедляет прогрессирование опухоли. Если радикальные или интервенционные методы лечения метастазов в печень невозможны, или метастазы не ограничиваются одной локализацией, то единственным вариантом остается системное лечение аналогами соматостатина [7]. Стандартное консервативное лечение проводится октреотидом, интерфероном-α и химиотерапией. Из-за сложности исследований эффективности, а также высокого потенциала побочных эффектов широкое применение интерферона-α в лечении метастатических НЭО ограничено, а высокодифференцированные НЭО не обладают высокой чувствительностью к химиотерапии из-за низкой скорости митоза, высоких уровней антиапоптотического белка Bcl-2 и повышенной экспрессии гена резистентности ко многим лекарственным средствам. Поэтому наиболее перспективным пока остается применение аналогов соматостатина [8].
Аналоги соматостатина являются стандартом лечения пациентов с функционирующими НЭО гастроэнтеропанкреатической локализации. Снижение гормональной гиперсекреции получено более чем у 70% пациентов со злокачественными функционирующими НЭО кишечника и поджелудочной железы, стабилизация опухолевого роста наблюдалась более чем у 50% пациентов с прогрессирующим ростом опухоли [9]. Гастроэнтеропанкреатические нейроэндокринные опухоли (ГЭП НЭО) представляют собой относительно редкую группу гетерогенных новообразований с индолентным течением. Использование октреотида в их лечении кардинально изменило терапевтическую тактику. Клинические исследования PROMID и RADIANT-2 подтвердили преимущества лечения ГНО октреотидом пролонгированного действия: примерно в половине случаев размер опухоли стабилизировался и примерно у 10% пациентов уменьшался. Октреотид длительного действия имеет надежный профиль безопасности и хорошо переносится, прекращение лечения из-за побочных эффектов встречается редко [10–13].
Исследование PROMID (плацебо-контролируемое проспективное рандомизированное исследование пациентов с метастатическими НЭО кишечника), проведенное в 18 центрах Германии и включавшее 85 больных, продемонстрировало антипролиферативный эффект октреотида пролонгированного действия при высокодифференцированных НЭО желудочно-кишечного тракта, 40% из которых были функционирующими и 60% нефункционирующими, со статистически значимым увеличением выживаемости без прогрессирования по сравнению с плацебо. Доказала свою эффективность и комбинированная терапия аналогами соматостатина вкупе с радионуклидной терапией [14].
Возможности коррекции дозы октреотида
Пациентам, которые не отвечают или перестают реагировать на стандартные дозы октреотида, назначают высокие дозы этого препарата, которые приводят к снижению или нормализации выработки биологически активных аминов и нейропептидов [15]. Поиск литературы, посвященной эффективности и безопасности октреотида пролонгированного действия в дозах, превышающих одобренные FDA для лечения НЭО (30 мг/мес.), в базах данных PubMed (за 1998–2012 гг.) и Кохрейновской библиотеки (за 2000–2013 гг.) выявил 1086 публикаций. В 11 исследованиях сообщалось об использовании более высоких доз для контроля симптомов и прогрессирования опухоли, хотя количественная оценка тяжести симптомов и анализа качества жизни не проводилась. В 10 исследованиях сообщалось об эффективности препарата у 260 больных в диапазоне доз от 40 мг/мес. или 30 мг в 3 нед. до 120 мг/мес. В 8 исследованиях изложено клиническое мнение экспертов о целесообразности повышения дозы препарата до 60 мг/мес. для контроля симптомов и предотвращения прогрессирования опухоли. Восемь исследований были посвящены безопасности высоких доз, при этом не отмечалось повышенной токсичности, ассоциированной с дозами, превышающими 30 мг/мес. [16].
J.R. Strosberg et al. (2014) изучили возможности увеличения дозы октреотида у пациентов с НЭО. Пациенты с карциноидным синдромом или НЭО поджелудочной железы получали дозу октреотида более 30 мг каждые 4 нед. в период с 2000 по 2012 г. Среди 239 пациентов с НЭО было 53% мужчин, средний возраст при первой эскалации дозы составил 60 лет (стандартное отклонение (SD) 11 лет), время от начала увеличения дозы — 1,7 года (SD 2,0 года). Основными показаниями к увеличению дозы были проявления карциноидного синдрома или иная гормональная активность (62%), а также рентгенологически подтвержденное прогрессирование опухоли (28%). Наиболее часто дозу увеличивали до 40 мг каждые 4 нед. (71%) и 60 мг каждые 4 нед. (18%). Из 90 пациентов, у которых до первого повышения дозы отмечались приливы, 73 (81%) либо перестали испытывать их вовсе, либо отмечали их меньшую выраженность. Из 107 пациентов с диареей 85 (79%) отметили ее урежение или полное купирование после первой эскалации дозы. Это исследование показало, что увеличение дозы вводимого октреотида может привести к улучшению контроля проявлений карциноидного синдрома [17].
Октреотид пролонгированного действия стабилизирует высокодифференцированные опухоли кишечника, но анализ выживаемости не проводился из-за недостаточного количества описанных случаев. Для купирования карциноидного синдрома часто применяются высокие дозы препарата. S.C. Lau et al. (2018) провели исследование с целью определить, коррелирует ли доза октреотида с выживаемостью пациентов с ГНО. Сравнили общую выживаемость у 170 пациентов, которые получали низкие ( 30 мг). Среди 222 пациентов 81 (36%) получал низкие дозы, 82 (37%) — средние и 59 (27%) — высокие. Многофакторный анализ показал, что по сравнению со средней низкая доза была ассоциирована со значительно худшей выживаемостью (ОР 2,00; p=0,001), тогда как высокая исходная доза (ОР 1,09; p=0,719) не показала дополнительных преимуществ по сравнению со средней. Это популяционное исследование определило потенциальные преимущества препарата в дозе 21–30 мг в отношении выживаемости для пожилых пациентов с НЭО поздних стадий [19].
K. Al-Efraij et al. провели ретроспективный обзор лечения неоперабельных пациентов с НЭО и метастазами, получавших октреотид пролонгированного действия в дозе 30 мг/мес. и выше с 2005 по 2011 г. Увеличение дозы октреотида было ассоциировано с эффективным нивелированием симптомов НЭО у пациентов, которые были невосприимчивы к стандартным дозам [20].
Исследования эффективности октреотида пролонгированного действия
S. Saglam et al. (2015) ретроспективно проанализировали медицинские карты 23 пациентов с нефункциональными метастатическими или неоперабельными ГЭП НЭО, которые получали лечение октреотидом пролонгированного действия в качестве первой линии в дозе 30 мг каждые
4 нед. Первичными и вторичными конечными точками были выживаемость без прогрессирования (ВБП) и общая выживаемость (ОВ); пациенты наблюдались в среднем в течение 47 мес. В среднем ВБП и ОВ составили 25,0±3,4 мес. [95% ДИ: 18,4; 31,5] и 71,3±9,5 мес. [95% ДИ: 52,7; 89,9] соответственно, с оценкой 5-летней ОВ 58%. Пациенты с ≤25% опухолевой нагрузки на печень имели лучшую ВБП по сравнению с пациентами, имевшими >25% таковой (32,2±6,2 против 19,4±2,7 мес.; р=0,043). Октреотид является эффективным вариантом лечения с хорошей переносимостью у пациентов с высокодифференцированными нефункциональными ГЭП НЭО [21].
F. Cioppi et al. (2017) провели продольное открытое исследование LARO-MEN1 с целью оценки возможности раннего назначения препарата в качестве профилактического подхода для лечения ГЭП НЭО, связанного с синдромом множественной эндокринной неоплазии 1 типа (MЭН1). Было обследовано 30 пациентов с МЭН1, и 8 из них, у которых выявлялись небольшие ( Литература
Только для зарегистрированных пользователей
Читайте также:

