Новости в лечении острого лейкоза
2020. Tafasitamab - новый препарат от рака крови - на подходе

Американская фармакомпания Incyte выкупает у немецкого биотек-стартапа MorphoSys права на препарат Tafasitamab почти за $2 млрд. Это препарат на основе антител для лечения B-клеточной лимфомы, хронического лимфоцитарного лейкоза (ХЛЛ) и В-клеточной неходжкинской лимфомы. Препарат усиливает работу иммунных B-клеток, которые цепляются к раковым клеткам и привлекают макрофаги для их уничтожения. На данный момент Tafasitamab проходит последнюю стадию клинических испытаний и его эффективность сравнима с более дорогой CAR-T терапией. Incyte надеется выпустить препарат в продажу уже в этом году.
2019. В России создали нейропроцессор для диагностики рака крови

Российский научно-технический центр Модуль разработал нейросетевое устройство, которое умеет анализировать микроснимки анализа крови и выявлять атипичные клетки, которые могут быть связаны со злокачественным заболеванием кроветворной системы. Нейросеть обучалась на массиве данных лаборатории патологической анатомии одной из малазийских клиник. Разработчики говорят, что точность диагноза от нейросети составляет 98%, а анализ проводится всего за несколько секунд. В перспективе нейросеть Модуля сможет определять раковые клетки по результатам биопсии других видов рака. Сейчас устройство готовят к сертификации FDA в США.
2017. В США одобрили вторую генную терапию для лечения рака крови

Американский регулятор FDA одобрил вторую генную терапию для борьбы с раком крови: препарат Yescarta (компании Kite Pharma). Он предназначен для лечения агрессивной лимфомы у взрослых. Первым одобренным антираковым генотерапевтическим препаратом стал Kymriah (компании Novartis). В Yescarta применяется та же технология (CAR-T), что и в первой генной терапии. Она редактирует иммунные Т-клетки так что они начинают атаковать раковые клетки. Стоит Yescarta немного дешевле - 373 тыс. долларов для одного пациента. Причем есть потенциал к снижению этой стоимости, т.к. в США - более 7 тысяч пациентов в год, которым подходит эта технология. А чем больше пациентом покупают препарат, тем дешевле он становится.
2017. Антираковая генотерапия CAR-T сертифицирована в США
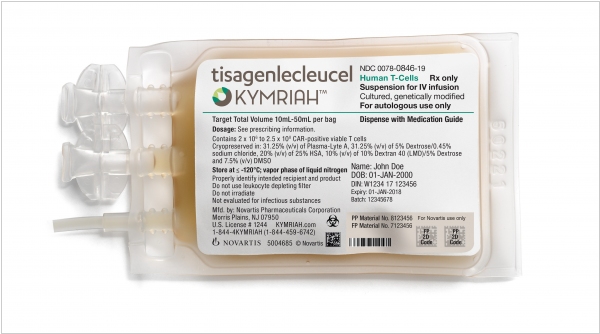
Технология CAR-T и препарат Kymriah (Кимрия) швейцарской компании Novartis, которая уже доказала свою эффективность в лечении острого лимфобластного лейкоза, была сертифицирована американским регулятором FDA (что еще раз подтверждает ее действенность). Суть технологии в том, что врачи берут образец белых кровяных телец пациента, а потом в лаборатории перепрограммируют их в убийц опухолей. Затем клетки возвращают в тело, где они быстро группируются и уничтожают раковые клетки. Конечно, стоимость такого лечения - не всем по карману - $475,000. Правда, Novartis обещает вернуть деньги, если организм пациента не отвечает на лечение.
2017. Наночастицы перепрограммируют Т-клетки прямо в организме для борьбы с лейкемией
2017. Лекарство Гливек показывает отличные результаты в лечении лейкоза
2016. Персонализированная вакцина остановила рак крови

Медицинский центр Beth Israel Deaconess, расположенный в Бостоне, провел успешные клинические испытания новой вакцины, изготавливаемой из собственных клеток пациента, которая предназначена для лечения острого миелоидного лейкоза. Вакцина использует технологию иммунотерапии, т.е. стимулирует собственные имунные Т-клетки для уничтожения опухоли. Испытания начались 4 года назад, когда 17 пациентам со средним возрастом 63 года начали вводить вакцину после сеансов химиотерапии. В результате 12 из них до сих пор показывают ремиссию. На фото - руководитель проекта - Дэвид Авиган.
2016. Технология Cellectis вылечила уже второго ребенка от лейкемии

Франко-американская компания Cellectis, похоже, заняла лидирующую позицию на многообещающем рынке иммунотерапии рака. В конце прошлого года ее технология TALEN (основанная на методе CAR-T) помогла вылечить годовалую девочку от лейкемии, а недавно они объявили о второй успешной операции, проведенной в том же лондонском госпитале. Смысл технологии в том, что ДНК иммунных клеток (Т-лимфоцитов) модифицируется в пробирке, а затем они вводятся в организм, где уничтожают поврежденные при лейкемии кровяные клетки. Есть еще три перспективных стартапа, разрабатывающих подобные технологии (Novartis, Juno Therapeutics и Kite Pharma). Но отличие технологии Cellectis в том, что она использует донорские Т-клетки, т.е. потенциально может создать универсальный и дешевый препарат, который можно быстро ввести любому пациенту.
2015. Генная инженерия и иммунотрапия спасли девочку от лейкемии
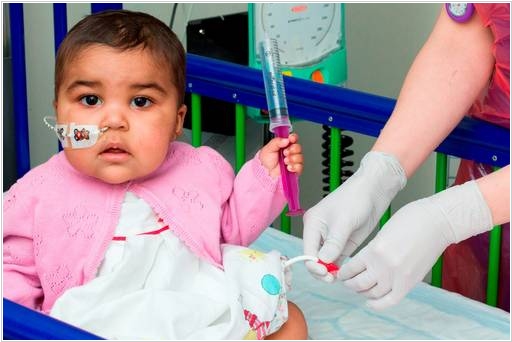
В Лондонской больнице Грейт-Ормонд-Стрит врачи использовали уникальный метод CAR-T для лечения лейкемии (рака крови) у маленькой девочки Лейлы (1 год). Химиотерапия и пересадка костного мозга ей не помогли, поэтому медики решились испробовать новый вид иммунотерапии. Они взяли иммунные клетки донора, генетически-модицифировали их так чтобы они распознавали и уничтожали раковые клетки и при этом сами не воспринимались иммунной системой, как чужеродные, и ввели их в организм девочки. Через три месяца Лейле снова пересадили костный мозг: здоровые иммунные клетки распознали генно-модифицированные клетки как чужеродные и уничтожили их. Таким образом, сейчас в организме девочки не осталось генетически модифицированных клеток. Пока о полном излечении Лейлы говорить рано, но она жива и хорошо себя чувствует. Полноценные клинические испытания этой технологии начнутся в 2016 году. Технология разработана французской биотехнологической компанией Cellectis.
2014. Создан искусственный костный мозг для выращивания стволовых клеток крови
Все клетки крови (эритроциты, лейкоциты. ) формируются из так называемых гемопоэтических стволовых клеток, которые, содержатся в костном мозге человека. И иногда человеку требуется замена этих стволовых клеток. Например, при лейкемии, когда собственные стволовые клетки превращаются в раковые. Или после лучевой терапии, когда собственные стволовые клетки погибают. В таких случаях проводят трансплантацию костного мозга, и это очень-очень дорогая операция, в основном из-за сложности поиска совместимого донора. В России с этим делом - вообще комедия. Вот было бы здорово, если б можно было взять у человека чуть-чуть стволовых клеток крови, размножить их в лаборатории, а потом ввести обратно в костный мозг. Именно над такой идеей работают ученые из нескольких ведущих научных центров Германии. И у них уже кое-что получилось. Они создали искусственную пористую структуру, имитирующую губчатое вещество кости в области кроветворного костного мозга. ***
2013. В Ханты-Мансийске проводят трансплантацию стволовых клеток при лечении рака крови
Югорский научно-исследовательский институт клеточных технологий, созданный четыре года назад, вроде-как успешно применяет свою технологию лечения рака крови с помощью стволовых клеток. На базе Сургутской ОКБ они провели уже 34 трансплантации стволовых клеток, и говорят, что все пациенты до сих пор живы. Кроветворные стволовые клетки НИИ получает от доноров (из костного мозга и пуповинной крови), проводят ДНК анализ (для определения совместимости) и хранит этот материал в своем криобанке. Затем стволовые клетки добавляют в кровь пациента каким-то уникальным методом. По словам Сергея Щукина, заместителя директора Департамента здравоохранения Югры, стоимость пересадки стволовых клеток на западе - порядка 420 тысяч долларов. А у нас по стране, хотя такие операции - редкость, но делаются они бесплатно, за счет средств бюджета.
Отвечаем на самые важные вопросы про лейкоз
" title="Показать лейкоз может исследование периферической крови
" itemprop="contentUrl">
Показать лейкоз может исследование периферической крови
Фото: Сергей Яковлев
В сентябре мы познакомились с архангелогородкой Вероникой Рожновской, жизнь которой изменилась, когда у её дочери Даши диагностировали лейкоз. Девочка в тот момент училась в пятом классе, а на недомогания врачи не обращали должного внимания. Специалисты отмечают, что рак крови действует тем агрессивнее, чем моложе организм, который поражает болезнь. На другие важные вопросы об этом раке отвечают профессор кафедры онкологии и медицинской радиологии Уральского государственного медицинского университета Сергей Берзин и гематолог из Уфы Нэлли Янтурина.
Лейкоз — опухолевое заболевание клеток крови. При лейкозе происходит патологическая трансформация лейкоцитов и их бесконтрольное деление. В итоге они замещают собой нормальные клетки костного мозга, из которых образуются циркулирующие в крови лейкоциты, эритроциты и тромбоциты.
При хронических лейкозах деление клеток идёт медленнее, и клиника тоже развивается с меньшей скоростью. Лейкозный клон током крови разносится по всей кроветворной ткани. Органами-мишенями, где откладываются метастазы, становятся почки и кости. Оседая в костной ткани, эти клетки, по-другому они называются миеломные, нарушают ее структуру. Это может проявляться частыми переломами, болью в позвоночнике, ребрах. Хронические лейкозы могут годами протекать без каких-либо явных отклонений в самочувствии, тогда выявить их можно только при исследовании крови.
Начало заболевания нередко протекает без выраженных симптомов. Больные отмечают общую слабость, утомляемость, неопределенную боль в костях, непостоянную температуру по вечерам в пределах 37,1–38 градусов. Но уже в этот период у некоторых больных можно обнаружить небольшое увеличение лимфатических узлов, селезенки. В анализе крови тоже будут изменения — повышение или снижение количества лейкоцитов, анемия.
Лейкоз может проявляться разнообразными симптомами. При острой форме пациенты могут жаловаться, что стали часто простывать, у них возникли инфекционные осложнения или синяки на теле, а кого-то будет беспокоить резкая потеря веса, появление шишек на теле или увеличение лимфоузлов.
Симптомы лейкоза неспецифичны, они таковы:
- слабость;
- головокружения;
- высокая температура без явных на то причин;
- боли в руках и ногах;
- кровотечения.
При замещении патологически размножающимися лейкоцитами других клеток крови на первое место выходят анемии и кровотечения из-за уменьшения числа других клеток крови — эритроцитов и тромбоцитов. Из-за накопления лейкоцитов в лимфоузлах, печени или селезёнке эти органы могут увеличиться, но обнаружить эти симптомы уже может только врач.
При лейкозе субстратом опухоли является костный мозг, который находится во всех трубчатых и плоских костях. Здесь же развиваются предшественники крови: эритроциты, лейкоциты и тромбоциты. Когда в ткани начинают развиваться опухолевые клетки, места для нормальных здоровых клеток крови просто не остается. Если в случае с раком желудка пораженный участок можно удалить, вовремя провести химиотерапию и добиться длительной ремиссии, то при раке крови такая тактика не приемлема.
Есть формы острого лейкоза, которые могут развиваться с первых дней жизни человека. Хроническим формам лейкоза подвержены люди старшего возраста. Чем моложе возраст, тем агрессивнее протекает болезнь, но при современных методиках лечения больной может жить до 5–7 лет. На течение хронического миелолейкоза (и это научно доказано) большое влияние оказывает состояние нервной системы больного — если есть стрессы, депрессии, люди сгорают буквально на глазах.
Лечение лейкоза — это достаточно длительный процесс. В среднем на достижение ремиссии при острых лейкозах уходит от 3 месяцев до 2–3 лет.
Первый и самый сложный этап в лечении острого лейкоза — это интенсивная химиотерапия, с помощью которой мы должны убить опухолевые клетки. Пациенты должны находиться в специальном асептическом блоке, в котором созданы стерильные условия, чтобы исключить их контакт с любой инфекцией. Больные в этот момент не имеют никаких собственных факторов защиты, потому что кроветворение у них пострадало от самой болезни и применяемых химиопрепаратов. Для закрепления результатов терапии после этапа восстановления (или поддержки ремиссии) принимается решение о необходимости трансплантации костного мозга.
Пересадку можно делать, если пациента ввели в ремиссию. Она бывает двух видов: аутотрансплантация, когда пересаживается костный мозг самого больного, и аллотрансплантация, в этом случае ткани забирают у донора.
В первом случае у пациента из вены берется периферическая кровь, из нее при помощи сепаратора извлекают стволовые клетки, консервируют и передают на хранение в банк. Затем пациенту проводят сильнейшую химиотерапию, а следом проводят пересадку — так же, через вену, вводят стволовые клетки, и они начинают творить новое потомство. Технически это выглядит как переливание крови. Пересадка может быть сделана и при хроническом лейкозе.
Аллотрансплантация дает хорошие результаты, если доноры — родные сестра или брат, у них самый близкий фенотип. Пересадка даже от двоюродных родственников не всегда бывает столь успешна, но все равно это шанс на то, что человек будет жить.
Лучшие доноры костного мозга — это мужчины в возрасте 30–40 лет, семейные, имеющие постоянное место работы. Желательно — на промышленном производстве, на заводах. Практика показывает, что именно такие люди относятся к донорству с наибольшей ответственностью.
Женщина тоже может стать донором костного мозга. Но здесь важно учесть, что после родов и беременностей в крови у женщин циркулируют антитела, и их лейкоциты уже настроены бороться с чужеродными антигенами. Поэтому результат пересадки может оказаться хуже.
Острый лейкоз - это агрессивное состояние, которое требует быстрой диагностики и лечения в течение нескольких дней после выявления.

Многопрофильная команда
Обычно для лечения используется междисциплинарная команда, включающая в себя:
гематолога (специалист по крови и сопутствующим заболеваниям);
невролога (при наличии поражения центральной нервной системы);
педиатра (специалисты по детским болезням, так как заболевание распространено среди детей);
клиническую онкологическую медсестру;
Три фазы лечения
Лечение проводится в три основных этапа, а именно:
Индукция. Она формирует начальную фазу лечения и используется для уничтожения лейкозных клеток в костном мозге. Также индукция помогает нормализовать клетки крови и облегчает симптомы рака.
Консолидация - эта фаза убивает оставшиеся лейкозные клетки, которые остались после фазы агрессивной индукции.
Поддержание - это заключительная фаза, которая включает в себя регулярные таблетки химиотерапии, которые следует принимать внутрь, чтобы предотвратить рецидив лейкемии.
Терапия используется в фазе индукции
Индукционная стадия лечения проводится в условиях стационара. Обычно вводят комбинацию пероральных и внутривенных химиотерапевтических препаратов, которые несут в себе риск дальнейшего снижения уровня крови. Это может привести к тяжелой анемии, инфекциям и риску неконтролируемого кровотечения.
Пациентам может потребоваться переливание крови и поддерживающая терапия для борьбы с этими серьезными побочными эффектами применения химиотерапевтических препаратов.
Химиотерапия приводит к ряду других побочных эффектов, которые проходят после завершения терапии. Они включает в себя тошноту, рвоту, диарею, потерю аппетита, язвы во рту, усталость, сыпь и выпадение волос.
Целевая химиотерапия
Это агенты, которые можно использовать у отдельных пациентов с определенными цитогенетическими паттернами.
Например, у пациентов с филадельфийской хромосомой (t9:22) могут помочь агенты, называемые ингибиторами тирозинкиназы, такие как иматиниб. Последний работает, блокируя сигналы, которые "говорят" раковым клеткам расти. Иматиниб можно принимать внутрь.
Терапия используется в фазе консолидации
После удаления большинства раковых клеток из организма в фазе индукции начинается фаза консолидации. Целью этого этапа является удаление и уничтожение любых остаточных раковых клеток в организме. Лечение предполагает регулярные инъекции химиотерапевтических препаратов. В отличие от фазы индукции эта фаза может проводиться амбулаторно и длиться несколько месяцев.
Терапия, используемая на этапе поддержания
Фаза поддержания направлена на предотвращение возврата рака. Она включает в себя прием регулярных доз таблеток для химиотерапии, а также регулярные осмотры у специалистов. Как правило, данная фаза длится около двух лет.
Другие методы лечения
Лучевая терапия может применяться в некоторых особых случаях. Она помогает уничтожить раковые клетки.
Трансплантация костного мозга и стволовых клеток. Лечение в основном включает применение агрессивной химиотерапии в очень высоких дозах для уничтожения всех раковых клеток и некоторых здоровых клеток костного мозга. После этого здоровые костный мозг или стволовые клетки переливаются для замены разрушенных клеток костного мозга.
Читайте также:
Встройте "Правду.Ру" в свой информационный поток, если хотите получать оперативные комментарии и новости:
Подпишитесь на наш канал в Яндекс.Дзен или в Яндекс.Чат
Добавьте "Правду.Ру" в свои источники в Яндекс.Новости или News.Google
Также будем рады вам в наших сообществах во ВКонтакте, Фейсбуке, Твиттере, Одноклассниках.
Использование модифицированных иммунных клеток самих пациентов позволило победить разновидность рака, ранее бывшую практически неизлечимой на поздних стадиях.

Специалисты из Центра изучения рака в Сиэтле (США) добились того, что 27 из 29 пациентов с запущенной лейкемией после курса иммунотерапии оказались в долговременной ремиссии. Ранее излечение таких больных на поздних стадиях заболевания практически не удавалось. Новая методика борьбы с раком использует модифицированные иммунные клетки, взятые у самого больного, что делает её значительно эффективнее всех других существующих аналогов. Соответствующее исследование опубликовано в Journal of Clinical Investigation.
При обычном течении острого лимфобластного лейкоза быстро делящиеся незрелые белые кровяные клетки окружают спинной мозг и не дают ему продуцировать здоровые кровяные клетки, без которых организм погибает. Собственные иммунные клетки человека, о бычно борющиеся с раковыми, при таком заболевании неэффективны. Дело в том, что опухолевые кл е тки исходно являются частью того же организма, отчего их поверхность покрыта в основном теми же белками, что и поверхность обычных клеток. Иммунные Т-лимфоциты, потенциально способные убить раковую клетку, п росто не могут от личить ее от нераковой и поэтому не атакуют .
Ч тобы справиться с проблемой, несколько лет назад был предложен принципиально новый способ антираковой иммунотерапи и с использованием специально "обученных" Т-лимфоцит ов. Для этого у пациента заб и ра е т ся образец этой разновидности иммунных клеток. В лаборатории его подвергают небольшой генетической модификации. В её ходе в геном встраивается участок, который отвечает за появление на поверхност и Т-лимфоцит а искусственн ого Т-лимфоцитн ого рецептор а, способн ого распознавать те белки раковой клетки, которые отличают её от здоровой. Такой участок называется химерным антигенным рецептором.

Микропрепарат костного мозга больного острой В-лимфоцитарной лейколастной лейкемией. Фото: Wikipedia
Для проверки эффективности этого метода с 2013 года в Центре изучения рака в Сиэтле (США) проводились клинические испытания, окончившееся в начале 2016 года. В них приняли участие 29 больных острым лимфобластным лейкозом на поздних стадиях. На них уже испытывались другие виды антираков о й терапии , однако они не дали никаких устойчивых результатов. Затем учёные взяли образцы Т-лимфоцит ов у всех пациентов и оснастили их искусственными рецепторами для распознавания мутировавших клеток.
Посл е этого модифицированные Т-лимфоцит ы ввели в кровоток каждого из пациентов , где они нач али размножаться делением . Модифицированные клетки с новыми распознающими рецепторами интенсивно самовоспроизводились внутри человеческого организма и быстро росли в числе . В силу многочисленности, их атаки на раковые клетки были систематическими и непрекращающимися. В итоге все мутировавшие клетки погибали за считаные недели после однократного ввода новых Т-лимфоцитов.
Из 29 пациентов на поздних стадиях острого лимфобластного лейкоза у 27 произошла устойчивая ремиссия — врачи не выявили признаков наличия раковых клеток в их спинно м мозге . Это необычный результат, поскольку такой вид рака на поздних стадиях считается практически неизлечимым. П рогноз для всех пациентов, подвергшихся новой иммунотерапии, предсказывал им считаные месяцы жизни.
Создатели новой методики иммунотерапии, полагают, что результат ы её клинического испытания станут важным шагом на пути внедрения модифицированных Т- лимфоцитов в о врачебную практику. Они отмечают, ч то такой метод является во многом более эффективным, чем радио- или химиотерапия. М одифицированные клетки иммунной системы самовоспроизводятся (их не надо вводить многократно), не имеют побочных последствий (токсических или радиационных) , свободно разносятся по всему организму и способны атаковать раковые клетки самостоятельно, без дальнейшего врачебного вмешательства. Всё это с н ижает вероятность рецидива. В перспективе новый метод может быть распространен и на другие разновидности рака, о сторожно полагают врач и .
30 июня 2020 года состоялась онлайн пресс-конференция, где ведущие эксперты области обсудили проблемы диагностики и лечения пациентов с редким заболеванием — острым миелоидным лейкозом с мутацией в гене FLT3, а также поговорили о возможностях инновационной таргетной терапии.
Острые миелоидные лейкозы (ОМЛ) — клональные опухолевые заболевания кроветворной ткани, связанные с мутацией в клетке-предшественнице гемопоэза, следствием которой становятся блок дифференцировки и бесконтрольная пролиферация незрелых миелоидных клеток. ОМЛ является следствием повреждения (мутации) в генетическом материале клоногенной кроветворной клетки. В результате этого происходят нарушение контроля за клеточным циклом, изменение процесса транскрипции и продукции ряда ключевых белков. Вследствие бесконтрольной пролиферации в отсутствие дифференцировки происходит накопление патологических клеток. Тот факт, что патогенез ОЛ связан с генетическими поломками, довольно часто подтверждается обнаружением различных хромосомных аберраций (транслокаций, делеций, инверсий и т. д.). В большинстве случаев конкретная причина возникновения ОМЛ остается неизвестной. Однако существует несколько предрасполагающих факторов, которые значительно увеличивают риск развития этого заболевания.
FLT3 — самый часто встречаемый вид мутации в генах при ОМЛ, его диагностируют примерно в 30 %[1] случаев. До настоящего времени мутацию FLT3 определяли как просто осложнение и серьезный сопутствующий риск-фактор при диагностике ОМЛ. Медиана выживаемости таких пациентов была крайне низкой. Теперь же в клинические рекомендации вошла новая первая таргетная терапия, препарат мидостаурин, для пациентов с впервые выявленным ОМЛ и мутацией в гене FLT3 — ингибиторы протеинкиназы [2]. В обновленных клинических рекомендациях 2020 года пациентам с впервые выявленным ОМЛ рекомендуется пройти тест на экспрессию и мутацию в генах. Это позволит более корректно определять тактику лечения и прогнозы.
В обновленных клинических рекомендациях 2020[3], которые готовятся к подписанию Минздрава, теперь указано, что пациентам с впервые выявленным ОМЛ рекомендуется пройти тест на экспрессию и мутацию в генах. От наличия или отсутствия мутаций в гене зависит тактика лечения, прогноз, а также показания к проведению трансплантации костного мозга. Этот шаг поможет внедрить индивидуальный подход в лечении пациентов, который уже давно признан специалистами здравоохранения как остро необходимый.
FLT3 — самый часто встречаемый вид мутации в генах при ОМЛ, его диагностируют примерно в 30% случаев [1]. До настоящего времени мутацию FLT3+ определяли как просто осложнение и серьезный сопутствующий риск-фактор при диагностике ОМЛ. Медиана выживаемости таких пациентов была крайне низкой [2,4]. Теперь же клинические рекомендации включают в себя еще один важный пункт, описывающий возможность добавления к стандартной программе лечения ОМЛ FLT3-ингибиторов (ингибиторов протеинкиназы) — мидостаурина [5].
Так, по результатам проведенного зарубежного клинического исследования RATIFY при применении препарата общая и бессобытийная выживаемость у FLT3+ пациентов с ОМЛ была более длительной. Продолжительность жизни без развития определенных нежелательных явлений (отсутствие полной ремиссии в течение 60 дней от начала терапии, прогрессирование заболевания или смерть) в группе мидостаурина составила в среднем 8,2 месяца, тогда как среди пациентов, получавших только стандартную химиотерапию — 3 месяца. До 82% пациентов с мутациями в гене FLT3+ испытывают рецидивы в течение 5 лет, тогда как лечение препаратом привело к уменьшению доли пациентов с рецидивом, при этом меньшее количество пациентов нуждается во 2-м цикле индукции, и больше пациентов, принимавших мидостаурин в рамках клинических исследований, оставались в состоянии полной ремиссии [6].
По мнению экспертов, произошел сдвиг всей парадигмы таргетного лечения пациентов с ОМЛ, существенно улучшить прогнозы которых удалось впервые за 25 лет.
Однако в свете позитивных изменений в лечении пациентов с ОМЛ некоторые вызовы остаются неотвеченными. Среди них — онконастороженность в работе врача первичного звена в отношении ОМЛ, ведь заболевание не имеет специфической симптоматики.
Еще в ряде насущных вопросов — оперативность проведения тестов на экспрессию и мутацию в генах при вновь выявленном ОМЛ, а также отсутствие финансирования таких анализов по системе ОМС. Это значит, что пациентам необходимо покрывать расходы самостоятельно либо обращаться в благотворительные фонды и пациентские организации, что не может не влиять на своевременность начала терапии.
Министерство здравоохранения представило перечень заявок для пополнения лекарственных перечней на 2021 год, прошедших документальную экспертизу. Предварительно на включение в перечень ЖНВЛП претендует 11 препаратов и среди них есть мидостаурин [7]. Заявки прошли документальную экспертизу и одобрены к рассмотрению. Окончательное решение об изменении лекарственных перечней на 2021 год будет принято на заседании специальной комиссии Минздрава.
Участники конференции отметили, что активное развитие онкогематологической сферы в России и появление новых подходов в лечении заболеваний требуют адекватной специализированной помощи, сочетающей в себе множество факторов. Среди них — готовность профильных ведомств и врачебного сообщества менять тактики терапии на более совершенные, а также повышение осведомленности о новых подходах в лечении и способах ее получения, как специалистов сферы здравоохранения, так и пациентов. Особенно важными эти факторы становятся, когда речь заходит о лечении такого сложного заболевания, как ОМЛ.
Рандомизированное клиническое исследование среди пациентов с впервые выявленным FLT3 + ОМЛ. Рандомизированное двойное слепое плацебо-контролируемое международное исследование III фазы. Общее число пациентов составляло 717. В одной группе (n = 360) пациенты получали препарат мидостаурин сперва в комбинации с индукционной и консолидирующей химиотерапией, а затем — в качестве поддерживающей монотерапии. Во второй группе (n = 357) пациенты получали индукционную и консолидирующую химиотерапию в комбинации с плацебо, а затем — поддерживающую монотерапию плацебо.
30 июня 2020 года состоялась онлайн пресс-конференция, где ведущие эксперты области обсудили проблемы диагностики и лечения пациентов с редким заболеванием — острым миелоидным лейкозом с мутацией в гене FLT3, а также поговорили о возможностях инновационной таргетной терапии.
Острые миелоидные лейкозы (ОМЛ) — клональные опухолевые заболевания кроветворной ткани, связанные с мутацией в клетке-предшественнице гемопоэза, следствием которой становятся блок дифференцировки и бесконтрольная пролиферация незрелых миелоидных клеток. ОМЛ является следствием повреждения (мутации) в генетическом материале клоногенной кроветворной клетки. В результате этого происходят нарушение контроля за клеточным циклом, изменение процесса транскрипции и продукции ряда ключевых белков. Вследствие бесконтрольной пролиферации в отсутствие дифференцировки происходит накопление патологических клеток. Тот факт, что патогенез ОЛ связан с генетическими поломками, довольно часто подтверждается обнаружением различных хромосомных аберраций (транслокаций, делеций, инверсий и т. д.). В большинстве случаев конкретная причина возникновения ОМЛ остается неизвестной. Однако существует несколько предрасполагающих факторов, которые значительно увеличивают риск развития этого заболевания.
FLT3 — самый часто встречаемый вид мутации в генах при ОМЛ, его диагностируют примерно в 30 %[1] случаев. До настоящего времени мутацию FLT3 определяли как просто осложнение и серьезный сопутствующий риск-фактор при диагностике ОМЛ. Медиана выживаемости таких пациентов была крайне низкой. Теперь же в клинические рекомендации вошла новая первая таргетная терапия, препарат мидостаурин, для пациентов с впервые выявленным ОМЛ и мутацией в гене FLT3 — ингибиторы протеинкиназы [2]. В обновленных клинических рекомендациях 2020 года пациентам с впервые выявленным ОМЛ рекомендуется пройти тест на экспрессию и мутацию в генах. Это позволит более корректно определять тактику лечения и прогнозы.
В обновленных клинических рекомендациях 2020[3], которые готовятся к подписанию Минздрава, теперь указано, что пациентам с впервые выявленным ОМЛ рекомендуется пройти тест на экспрессию и мутацию в генах. От наличия или отсутствия мутаций в гене зависит тактика лечения, прогноз, а также показания к проведению трансплантации костного мозга. Этот шаг поможет внедрить индивидуальный подход в лечении пациентов, который уже давно признан специалистами здравоохранения как остро необходимый.
FLT3 — самый часто встречаемый вид мутации в генах при ОМЛ, его диагностируют примерно в 30% случаев [1]. До настоящего времени мутацию FLT3+ определяли как просто осложнение и серьезный сопутствующий риск-фактор при диагностике ОМЛ. Медиана выживаемости таких пациентов была крайне низкой [2,4]. Теперь же клинические рекомендации включают в себя еще один важный пункт, описывающий возможность добавления к стандартной программе лечения ОМЛ FLT3-ингибиторов (ингибиторов протеинкиназы) — мидостаурина [5].
Так, по результатам проведенного зарубежного клинического исследования RATIFY при применении препарата общая и бессобытийная выживаемость у FLT3+ пациентов с ОМЛ была более длительной. Продолжительность жизни без развития определенных нежелательных явлений (отсутствие полной ремиссии в течение 60 дней от начала терапии, прогрессирование заболевания или смерть) в группе мидостаурина составила в среднем 8,2 месяца, тогда как среди пациентов, получавших только стандартную химиотерапию — 3 месяца. До 82% пациентов с мутациями в гене FLT3+ испытывают рецидивы в течение 5 лет, тогда как лечение препаратом привело к уменьшению доли пациентов с рецидивом, при этом меньшее количество пациентов нуждается во 2-м цикле индукции, и больше пациентов, принимавших мидостаурин в рамках клинических исследований, оставались в состоянии полной ремиссии [6].
По мнению экспертов, произошел сдвиг всей парадигмы таргетного лечения пациентов с ОМЛ, существенно улучшить прогнозы которых удалось впервые за 25 лет.
Однако в свете позитивных изменений в лечении пациентов с ОМЛ некоторые вызовы остаются неотвеченными. Среди них — онконастороженность в работе врача первичного звена в отношении ОМЛ, ведь заболевание не имеет специфической симптоматики.
Еще в ряде насущных вопросов — оперативность проведения тестов на экспрессию и мутацию в генах при вновь выявленном ОМЛ, а также отсутствие финансирования таких анализов по системе ОМС. Это значит, что пациентам необходимо покрывать расходы самостоятельно либо обращаться в благотворительные фонды и пациентские организации, что не может не влиять на своевременность начала терапии.
Министерство здравоохранения представило перечень заявок для пополнения лекарственных перечней на 2021 год, прошедших документальную экспертизу. Предварительно на включение в перечень ЖНВЛП претендует 11 препаратов и среди них есть мидостаурин [7]. Заявки прошли документальную экспертизу и одобрены к рассмотрению. Окончательное решение об изменении лекарственных перечней на 2021 год будет принято на заседании специальной комиссии Минздрава.
Участники конференции отметили, что активное развитие онкогематологической сферы в России и появление новых подходов в лечении заболеваний требуют адекватной специализированной помощи, сочетающей в себе множество факторов. Среди них — готовность профильных ведомств и врачебного сообщества менять тактики терапии на более совершенные, а также повышение осведомленности о новых подходах в лечении и способах ее получения, как специалистов сферы здравоохранения, так и пациентов. Особенно важными эти факторы становятся, когда речь заходит о лечении такого сложного заболевания, как ОМЛ.
Рандомизированное клиническое исследование среди пациентов с впервые выявленным FLT3 + ОМЛ. Рандомизированное двойное слепое плацебо-контролируемое международное исследование III фазы. Общее число пациентов составляло 717. В одной группе (n = 360) пациенты получали препарат мидостаурин сперва в комбинации с индукционной и консолидирующей химиотерапией, а затем — в качестве поддерживающей монотерапии. Во второй группе (n = 357) пациенты получали индукционную и консолидирующую химиотерапию в комбинации с плацебо, а затем — поддерживающую монотерапию плацебо.
Читайте также:

