Новое в лечении острого миелолейкоза
Современная стратегия химиотерапии острого лейкоза, разработанная 20—25 лет назад и претерпевшая за это время определенные изменения в плане интенсификации, к сожалению, уже не может принципиально изменить результаты лечения: ни частоты достижения ремиссий, ни долгосрочной выживаемости.
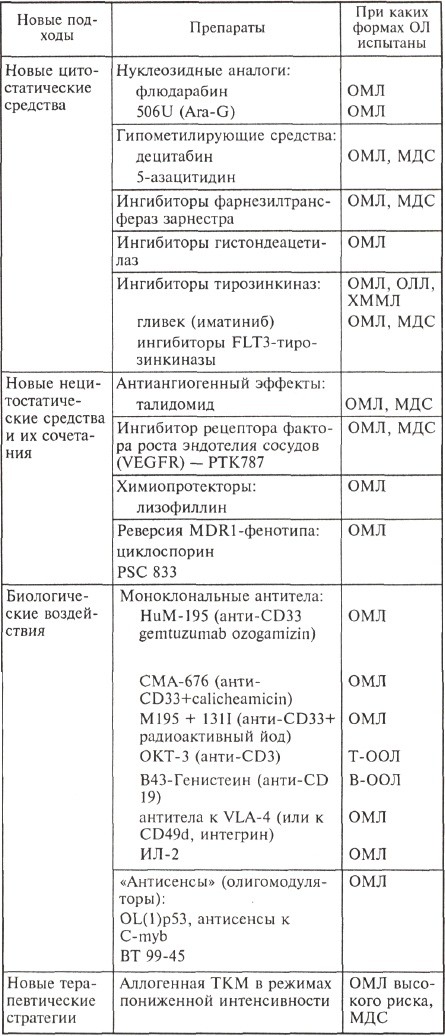
Эффективность стандартной химиотерапии, по-видимому, еще может быть повышена, но в основном благодаря усовершенствованию тактики выхаживания пациентов после цитостатического воздействия. Собственно антилейкемический потенциал самой стратегии химиотерапии уже исчерпан, поэтому все современные исследования в лейкозологии направлены на поиск и внедрение новых, порой не связанных с цитостатическими эффектами способов воздействия на лейкемические клетки. Основные направления этой работы отражены в таблице.
Данные, представленные в таблице, отражают лишь те новые подходы, которые были испытаны в клинических исследованиях I—II и даже III фаз. Безусловно, не перечислены еще многие исследовательские работы, в основном те, которые не вышли из рамок поисковых. К ним относится, например, так называемая вакцинация:
1) введение в организм больного собственных лейкемических клеток (аутологичная клеточная вакцина), в которые с помощью ретровирусов были введены гены определенных молекул (например, В7-1), являющихся мощными костимуляторами Т-клеточного ответа;
2) коммитирование и культивирование, а затем введение в организм больного собственных дендритных (антигенпрезентирующих) клеток, полученных из лейкемических, с целью усиления иммунного ответа на опухолевые антигены.
Традиционным направлением многих исследований является разработка новых противоопухолевых препаратов. Особого внимания заслуживают ингибиторы тирозинкиназ, в частности c-ABL-тирозинкиназа (Гливек). Этот препарат полностью изменил терапевтические подходы в лечении ХМЛ. В программах терапии острого лейкоза его используют в случае обнаружения химерного транскрипта BCR-ABL или t(9;22).
У 30 % больных острым миелоидным лейкозом выявляют мутации гена FLT3, продуктом которого является FLT3-тирозинкиназа. Проведены первые клинические испытания II фазы по применению ингибиторов FLT3 тирозинкиназы.
При использовании молекулы РКС412 были зафиксированы выраженные эффекты у больных с рефрактерным острым миелоидным лейкозом. Так, из 20 больных у одного достигнута полная ремиссия, у 6 отмечено значительное (более чем в 100 раз) уменьшение числа властных клеток в крови, у 7 больных оно составило на 50 % от исходного. Аналогичные эффекты наблюдались и при использовании другого ингибитора FLT3-тирозинкиназы - СЕР-701.
Ингибиторы гистондеацетилаз — это препараты, которые влияют на процесс транскрипции. Создано несколько молекул различных классов: производные бутировой кислоты — ВА (пивалоилоксиметил бутират, бутироилоксиалкиловые эфиры глутаровой и никотиновой кислот, бутироилоксиметиловые эфиры); диэтиловый эфир фосфорной кислоты; субероиланилидгидроксаминовая кислота (SAHA); циннамил гидроксамат LAQ824 и др.
Большинство из этих молекул демонстрирует высокую активность в лабораторных условиях на клеточных линиях острого лейкоза. Клинические исследования проводят лишь с единичными препаратами. Так, применение SAHA у больных с периферическими Т-клеточными лимфомами позволило у 5 из них получить частичную ремиссию, у 5 — стабилизацию. У 25 больных рефрактерным острым миелоидным лейкозом исследование I фазы по применению ингибитора гистондеацитилаз МС-275 было не столь эффективным — получены лишь незначительные гематологические эффекты.
Создается впечатление, что в скором времени из огромного числа синтезируемых ингибиторов гистондеацетилаз будут отобраны наиболее эффективные препараты.
В настоящее время проходят клинические испытания препараты из новой группы лекарственных средств — ингибиторы фарнезилтрансферазы. Основой для разработки использования этих препаратов стали исследования, свидетельствующие об увеличении частоты мутаций онкогена RAS у больных острым миелоидным лейкозом. RAS-протеины являются важным звеном в цепи передачи сигналов внутри клетки и становятся функционально активными после присоединения фарнезильтных остатков с помощью фарнезилтрансферазы.
Результаты первых клинических испытаний препарата типифарниба (R115 777, Зарнестра) свидетельствуют об его определенной активности: общий гематологический эффект отмечен у 37 % больных острым миелоидным лейкозом старше 60 лет.
Нуклеозидные аналоги завоевывают место в программах лечения не только острый миелоидный лейкоз и хронических лимфопролиферативных заболеваний, определенный оптимизм внушает эффективность некоторых из них при остром лимфобластном лейкозе. Так, арабинозилметоксигуанин (Ara-G или 506U), вводимый в дозе 40—50 мг/кг внутривенно 1 раз в день в течение 5 дней, позволил добиться полной ремиссии у 44 % и частичной ремиссии у 32 % больных с рецидивами Т-клеточного острого лимфобластного лейкоза.
Анализ работ по применению гипометилирующих агентов — 5-азацитидина и 5-аза-деоксицитидина (децитабина) — позволяет сделать заключение о более высокой эффективности децитабина. Его применение в дозе 50—75 мг/м2 в виде постоянной инфузии в 1—3-й день позволяет получить полную ремиссию у 30—37 % больных ОМЛ или МДС из группы высокого риска. При использовании децитабина в сочетании с антрациклинами или амсакрином полный ответ отмечен у 35 % больных ОМЛ из группы высокого риска. Следует подчеркнуть, что клинических исследований по изучению этих препаратов еще очень мало, и требуется время, чтобы реально оценить эффективность каждого из них.
Бесспорным является лишь тот факт, что эти средства обладают уникальным механизмом действия: помимо гипометилирующих эффектов (а гиперметилирование ДНК является признаком опухолевой устойчивости и прогрессии), они вызывают клеточную дифференцировку, активируют супрессорные гены и могут in vitro ингибировать пролиферацию клоногенных лейкемических клеток.
Очень интересным направлением в разработке новых противоопухолевых препаратов является создание средств, влияющих на ангиогенез. Талидомид как антиангиогенный препарат давно занял прочное место в лечении множественной миеломы, однако его эффективность при ОЛ и миелодисплазиях незначительна. К новым средствам относятся молекулы, ингибирующие рецепторы ростового фактора эндотелия сосудов (VEGFR). Показано, что ОЛ, при которых бластные клетки экспрессируют VEGFR в больших количествах, отличаются неблагоприятным прогнозом. В испытаниях I фазы исследователи отметили незначительную эффективность ингибитора VEGFR — PTK787 при минимальной токсичности.

Новое исследование выявило, что биосинтез гема способствует прогрессированию острого миелоидного лейкоза (ОМЛ) - агрессивной разновидности рака крови.
Ученые предложили подавлять продукцию гема для лечения лейкоза наряду с другими существующими методами терапии.
Только в 2014 году в США лейкемия поразила 387 тысяч человек, если верить статистике Национального института рака.
Среди всех видов рака крови острый миелоидный лейкоз считается одним из наиболее опасных и тяжело поддающихся лечению. За этот год американские врачи насчитали 21380 новых случаев ОМЛ, причем 10590 больных умерло, несмотря на впечатляющие возможности местной медицины.
Детская исследовательская больница Святого Иуды в Мемфисе ежегодно принимает на лечение около 500 маленьких пациентов с ОМЛ – это второй по распространенности рак у детей.
Исследование доктора Джона Шуеца из St Jude's Children Research Hospital пролило свет на патогенез смертельной болезни, что в будущем позволит существенно повысить выживаемость при ОМЛ. Независимые эксперты, опрошенные изданием MNT, называют это открытие не иначе как прорывом в онкогематологии.
Биосинтез гема подстегивает лейкоз
Гем – порфириновое соединение, которое используется для синтеза гемоглобина, главного переносчика кислорода в человеческой крови. В процессе клеточного дыхания гем отвечает за трансфер электронов.
Лишь недавно было обнаружено, что гем помогает лейкозным клеткам выживать в неблагоприятных условиях. На страницах JCI Insight команда доктора Шуеца утверждает: блокировав продукцию гема, можно сделать злокачественные клетки уязвимыми перед традиционными химиопрепаратами и уничтожить.
Доктор Шуец подчеркивает важность этого открытия, поскольку раньше не удавалось проследить четную связь между продукцией гема и жизнедеятельностью лейкозных клеток. Это совершенно новое направление.
Первым шагом в уникальном исследовании стал просмотр базы данных St Jude's, где хранятся детальные результаты анализов крови больных детей. Исследователи обнаружили закономерность: при особо агрессивном миелолейкозе активируется онкоген MYCN, играющий ключевую роль в делении и саморазрушении клеток.
Вторым, самым важным открытием стала активация гена UROD (уропорфириноген декарбоксилазы) – стимулятора продукции гема. У детей с агрессивной формой острого миелоидного лейкоза (ОМЛ) данный ген был избыточно активен, что явно указывает на связь между продукцией гема и прогрессированием острого миелобластного лейкоза.
По словам Шуеца, миелолейкоз, который сопровождается активизацией онкогена MYCN и повышенной экспрессией гена UROD, протекает крайне тяжело и чаще всего заканчивается смертью больных.
Было экспериментально доказано, что остановка биосинтеза гема при помощи генной терапии ведет к замедлению прогрессирования лейкемии и увеличивает эффективность химиопрепаратов.
Новые возможности для терапии острого миелоидного лейкоза (ОМЛ)
Блокировать продукцию гема оказалось проще, чем кажется – достаточно удалить ген MYCN и ключевой компонент его биосинтеза. Это приводит к накоплению молекул, которые токсичны для лейкозных клеток. Доклинические опыты на животных подтвердили целесообразность такого подхода: прогрессирование лейкемии замедлялось, выживаемость значительно возрастала.
Результаты уникального исследования можно применить и в других областях онкологии. Например, для лечения медуллобластомы и других опухолей, сопровождающихся избыточной продукцией гема.
Константин Моканов: магистр фармации и профессиональный медицинский переводчик
Исследование фазы 1b было опубликовано онлайн 12 января в онкологии Ланцет.
Исследование проводилось у 57 пожилых пациентов с ОМЛ, средний возраст 75 лет, для которых интенсивная химиотерапия не была вариантом.
Результаты показывают, что 61% пациентов достигли полной ремиссии (CR) или полной ремиссии с неполным восстановлением костного мозга (CRi). Девять из этих пациентов продолжали получать аллогенные трансплантации стволовых клеток, находясь в состоянии ремиссии, что указывает на то, что Венетоклакс с децитабином или азацитином может стать мостиком для целебной стратегии.
Д-р Müller-Tidow и Dr Schlenk также дают некоторые сведения о том, почему это исследование заслуживает внимания. Они указывают на то, что в отличие от других гематологических злокачественных новообразований для пациентов с ОМЛ не доступны новые варианты лечения для улучшения выживаемости и надежды на лечение.
Исследование было проведено у недавно диагностированных пациентов с гистологически подтвержденным острым миелоидным лейкозом, возраст которых составлял 65 лет и старше, имел прогнозируемую продолжительность жизни по меньшей мере 12 недель и не соответствовал стандартной индукционной химиотерапии, как определено исследователем.
Пациенты с цитогенетикой с благоприятным риском или активным участием центральной нервной системы были исключены.
Исследование включало фазу эскалации дозы и включало три группы (от A до C) пациентов - каждая группа с четырьмя когортами по меньшей мере трех пациентов в каждом. Пероральное введение venetoclax началось на 2-й день, с обязательным ежедневным скачком в дозе . В когортах с 1 по 4 в течение 20 дней вводили venetoclax в дозе 20 мг, 50 мг, 100 мг и 100 мг, чтобы достичь конечной дозы 400 мг, 800 мг, 800 мг и 1200 мг на 6-й день. Конечная доза была предоставлена для остальной части 28-дневного цикла.
В группе А децитабин 20 мг / м 2 вводили внутривенно в дни от 1 до 5 каждого цикла. В группе B азацитидин 75 мг / м 2 вводили внутривенно или подкожно в дни от 1 до 7 каждого цикла. Лечение продолжалось до прогрессирования заболевания или возникновения невыносимых побочных эффектов.
Пациенты группы С были зачислены на исследование взаимодействия препаратов, подробности которого уже опубликованы (Clin Ther. 2017, 39: 359-367). В этой группе в исследовании оценивалась комбинация венетоклакса плюс позаконазола, противогрибкового агента и децитабина.
Все пациенты получали профилактику против синдрома лизиса опухоли, начиная с 72 часов до введения. Синдром лизиса опухоли контролировали до дозирования и через 6 часов и 12 часов после дозирования для каждой эскалации дозы и через 24, 48 и 72 часа после введения максимальной дозы венециклакса. Все пациенты также принимали меры по оказанию поддержки и получали профилактические неазольные противогрибковые средства в соответствии с протоколом .
Первичные конечные точки были безопасностью, фармакокинетикой и определяли дозу venetoclax фазы 2.
Из 57 пациентов, включенных, 45 были в группах A (n = 23) и B (n = 22). Двенадцать пациентов были в группе C.
Медианное наблюдение за общей пробной популяцией составляло 12,4 месяца. Средний возраст составил 75 лет, у 21 (37%) пациентов была цитогенетика с низким риском, а у 8 (14%) было антецедентное гематологическое расстройство.
По данным авторов, Venetoclax хорошо переносится у этой пожилой популяции больных ОМЛ с низкой ранней смертностью. Пациенты в группах А и В имели сходные профили безопасности.
30-дневная и 60-дневная смертность составляли 7% и 16% соответственно и были связаны с такими причинами, как сепсис, бактериемия, инфекция легких и респираторная недостаточность. По словам доктора Поллии и его коллег, эти показатели ниже, чем можно было ожидать в популяции, сопоставимой с возрастом, которая получает интенсивную терапию и аналогична тем, которые наблюдаются при монотерапии децитабином или азацитидином.
Тромбоцитопения (47%), фебрильная нейтропения (42%) и нейтропения (40%) были наиболее распространенными побочными явлениями 3/4 степени, которые были связаны с прерыванием дозы у 51% пациентов. Снижение дозы Venetoclax, также из-за побочных эффектов, вызванных лечением, было зарегистрировано у 17%, 14% и 8% пациентов в группах A, B и C соответственно.
Желудочно-кишечные расстройства уровня 2 и цитопения были наиболее распространенными побочными явлениями, возникающими во всех группах. Следует отметить, что в когортах пациентов, принимавших 1200 мг венетоклакса, наблюдались частые желудочно-кишечные расстройства, включая тошноту (82%), диарею (64%), запор (55%) и рвоту (45%), которые ограничивали непрерывное дозирование и приводили к снижению дозы вплоть до прерывания.
В этом исследовании не наблюдалось никаких лабораторных или клинических событий синдрома лизиса опухоли, таких как те, которые были связаны с венотоклаксом при хроническом лимфоцитарном лейкозе. Этот потенциальный риск был смягчен требованием, чтобы все пациенты имели количество белых клеток 25 × 10 9 / л. Кроме того, не сообщалось о дозирующих токсичность. Несмотря на то, что максимальная переносимая доза не была достигнута, опыт применения дозы 1200 мг приводил к тому, что в качестве дозы фазы 2 рекомендовал венероклаксом 800 мг.
Исследование взаимодействия лекарственного препарата показало, что одновременное использование venetoclax (субстрат CYP3A) и posaconazole (сильный ингибитор CYP3A) увеличивало максимальную концентрацию плазмы венозно-кликса примерно в семь раз. Следовательно, у пациентов, получающих профилактику с позаконазолом, дозу венециклакса необходимо уменьшить примерно на 75%, отмечают авторы.
Тем не менее, пациенты в группах А и В не получали противогрибковые азолы, но альтернативные противогрибковые препараты, которые не являются ингибиторами CYP3A, а также эффективны.
Конечные точки клинической эффективности были одинаковыми во всех группах. Показатели CR и CRi составляли 61% для группы A, 59% для группы B и 67% для группы C. Среднее время для CR / CRi составляло 1,0, 1,2 и 0,9 месяца для групп A, B и C соответственно.
Аналогичные показатели были зарегистрированы для пациентов с ОМЛ, у которых были промежуточные группы риска (66%) и бедные (52%) цитогенетики. Ответы также были представлены пациентам.
Выживание не оценивалось отдельно для группы C. Средняя выживаемость медианных составила 12,3 месяца для всех пациентов, 15,2 месяца для групп A и B, 15,2 месяца для группы A и 14,2 месяца для группы B.
Это первое исследование для оценки эффективности и безопасности venetoclax в сочетании с децитабином или азацитидином у пожилых пациентов с недавно диагностированным острым миелоидным лейкозом. Исследование продолжается с фазой расширения, поэтому большее число пациентов будут лечиться этими комбинациями Венетоклакса.
Тем не менее, д-р Müller-Tidow и Dr Schlenk отмечают, что venetoclax также оценивается с другими препаратами для ОМЛ, такими как цитарабин.
Пероральная версия азацитидина доказанно продлевает жизнь пациентам в ремиссии.
Эпигенетический модификатор CC-486 представляет собой перорально доступную рецептуру хорошо известного инъекционного азацитидина (azacitidine) — пиримидинового нуклеозидного аналога цитидина (цитозин плюс рибоза). Противоопухолевая активность азацитидина, как считается, реализуется посредством двух механизмов. В низких дозах азацитидин (точнее, его метаболит) встраивается во вновь синтезируемые ДНК и ковалентно связывается с ДНК-метилтрансферазой (DNMT1) с последующим блокированием метилирования ДНК. Гипометилирование ДНК азацитидином способно реактивировать опухолевые супрессорные гены, до этого находившиеся в состоянии сайленсинга из-за гиперметилирования, в результате чего отмечаются противоопухолевые эффекты. Опухолевые клетки с присущими им бесконтрольными дифференцировкой и пролиферацией начинают реагировать на имеющиеся в организме сигнальные пути контроля над клеточным ростом — непролиферирующие клетки в целом нечувствительных к азацитидину.
Высокие дозы азацитидина проявляют прямую цитотоксичность в отношении ненормальных гематопоэтических клеток в костном мозге за счет встраивания его метаболита в ДНК и РНК, что отражается клеточной смертью.
Поскольку азацитидин является рибонуклеозидом, он с большей охотой внедряется в РНК, чем ДНК, хотя итоговый ингибирующий эффект оказывается сильнее в отношении синтеза новых ДНК, а не РНК. Напротив: тот же децитабин (decitabine), будучи дезоксирибонуклеозидом, проявляет сродство только к ДНК. Встраивание метаболита азацитидина в РНК приводит к дезагрегации полирибосом, накоплению рибосом 80S, снижению акцепторной активности тРНК-цитозин-5-метилтрансферазы (TRDMT1) и подавлению синтеза белков.
Особых проблем с выводом к ремиссии пациентов с острым миелолейкозом не существует. А вот то, как сохранить их в этом статусе, является весьма непростой задачей. Так, стандартная интенсивная индукционная химиотерапия обычно наделяет полной ремиссией приблизительно 60–80% больных не старше 60 лет и 40–60% старше 60 лет. Увы, в более чем половине случаев отмечается рецидив заболевания, что выступает основным препятствием на пути к выживанию в долгосрочной перспективе: выживаемость после рецидива укладывается в медианные пределы 3–12 месяцев. Да, трансплантация гемопоэтических клеток резко повышает шансы на благополучные клинические исходы, но она подходит далеко не всем пациентам. Несмотря на многочисленные попытки разрешить проблему, каких-либо подвижек за последние три десятка лет не наблюдалось. Однако пероральному азацитидину, удалось, похоже, невероятное.
В клинических исследованиях QUAZAR AML-001 (NCT01757535) фазы III (рандомизированных, двойных слепых, плацебо-контролируемых, многоцентровых, международных) приняли участие пациенты (n=472) в возрасте 55 лет и старше с острым миелоидным лейкозом, впервые диагностированным de novo или с предшествовавшим миелодиспластическим заболеванием или хроническим миеломоноцитарным лейкозом (CMML).
Испытуемые, заболевание которых характеризовалось средним или высоким цитогенетическим риском рецидива, должны были находиться в статусе CR/CRi не дольше четырех месяцев до рандомизации и не подходить для трансплантации гемопоэтических стволовых клеток. Участники получали CC-486 (300 мг ежедневно в течение первых 14 дней в рамках 28-дневных циклов) на фоне стандартной терапии либо только последнюю.
Исходные показатели пациентов: медиана возраста 68 лет (55–86), у 91% острый миелолейкоз de novo, 86% и 14% несли средний и высокий риск рецидива соответственно, 81% и 19% находились в статусе CR и CRi после индукционной химиотерапии, 80% прошли консолидирующую химиотерапию (45% один ее цикл и 31% два).
По прошествии медианных 41,2 месяца наблюдений (3 года и 5 месяцев) медиана общей выживаемости (OS) в группе перорального азацитидина вышла к 24,7 месяца — против 14,8 месяца в группе плацебо. Таким образом, экспериментальная поддерживающая терапия на 31% снизила риск смертельного исхода (отношение рисков [HR] 0,69 [95% ДИ: 0,55–0,86]; p=0,0009).
Наиболее распространенными побочными реакциями на применение перорального азацитидина оказались: тошнота (65% пациентов против 24% в контрольной группе), рвота (60% против 10%), диарея (50% против 22%), нейтропения (41% против 24%). С серьезными отрицательными явлениями столкнулись 34% и 25% больных, и по большей части это были инфекции (у 17% и 8%). Участие в клинических испытаниях ввиду побочных реакций прервали 13% и 4% пациентов.
Поддерживающая терапия при остром миелоидном лейкозе, в отличие от острого лимфобластного лейкоза (ALL), никогда не входила в терапевтический алгоритм для пациентов в статусе первой ремиссии. Тем более клинические испытания, реализующие такую задачу, проваливались. Так, например, голландские исследования HOVON97 (NTR1810, 2008-001290-15) фазы III (рандомизированные, открытые, плацебо-контролируемые), проверившие инъекционный азацитидин, отметились улучшением показателя RFS (HR 0,62 [95% ДИ: 0,41–0,95]; p=0,026) в сравнении с наблюдательным подходом за пожилыми (60 лет и старше) пациентами (n=116) с AML в статусе ремиссии после индукционной химиотерапии, однако не засвидетельствовали какого-либо продления общей выживаемости (HR 0,91 [95% ДИ: 0,58–1,44]; p=0,69). Более того, поскольку испытания были прекращены досрочно в связи с медленным набором участников, они показали, возможно, завышенный эффект инъекционного азацитидина на показатель RFS.
Опять же, инъекционный азацитидин требует от пациентов посещения лечебного учреждения 7 дней в месяц, или 84 дня в год. Пероральный азацитидин удобнее, поскольку может применяться самостоятельно. Фармакокинетический и фармакодинамический профили пероральной версии отличаются от таковых у инъекционного оригинала так, что реализует улучшенную экспозицию лекарственного соединения.
Что примечательно, приблизительно 40 участников QUAZAR AML-001, которые начались в 2013 году, всё еще остаются в режиме поддерживающей терапии: они уже прошли 80 ее циклов. Таким образом, весьма длительная (в данном случае семилетняя) поддерживающая терапия острого миелоидного лейкоза вполне осуществима. Конечно, говорить об излечении этого онкогематологического заболевания пока не приходится, однако сохранение безрецидивного статуса при приемлемом качестве жизни — важное достижение фармакотерапии.
Есть, впрочем, проблема, связанная как с комплаентностью, так и профилем безопасности. Пациентов, особенно пожилых, затруднительно убедить придерживаться поддерживающей терапии — фактически бесконечно, притом что токсичность азацитидина зачастую заставляет отказываться от препарата. Большинство пожилых больных не могут справиться с периодическими тошнотой, диареей и рвотой, даже если степень их выраженности незначительна.
Осталось проверить, каким окажется терапевтический эффект при максимально длительном назначении перорального азацитидина, а также провести сравнительный анализ данных пациентов без минимально остаточного заболевания (MRD) и с таковым.
Как бы то ни было, пероральный азацитидин однозначно изменит сложившуюся клиническую практику острого миелоидного лейкоза и, не исключено, впоследствии станет обязательным компонентом для каких-либо комбинированных терапевтических сочетаний: допустим, он может перволинейно назначаться совместно с сочетанием венетоклакса и какого-либо IDH-ингибитора.
Параллельно пероральный азацитидин пробует силы в клинических испытаниях среди пациентов с AML или MDS, уже прошедших трансплантацию гемопоэтических стволовых клеток.
Пероральный азацитидин также проходит множество клинических исследований, которые проверяют оправданность его применения при других онкогематологических заболеваниях, как то: диффузная B-крупноклеточная лимфома (DLBCL), фолликулярная лимфома (FL), трансформированная лимфома (TL), ангиоиммунобластная Т-клеточная лимфома (AITL), периферическая T-клеточная лимфома (PTCL).
- рефрактерной анемии (RA) или рефрактерной анемии с кольцевидными сидеробластами (RARS), если сопровождается нейтропенией, тромбоцитопенией или требует гемотрансфузий;
- рефрактерной анемии с избытком бластов (RAEB);
- рефрактерной анемии с избытком бластов на стадии трансформации (RAEB-T);
- хронического миеломоноцитарного лейкоза (CMML).
- MDS с промежуточным риском (уровня 2) или высоким риском;
- CMML с бластозом в костном мозге в пределах 10–29% и без миелопролиферативного заболевания;
- острый миелоидный лейкоз (AML) с бластозом в диапазоне 20–30% и многолинейной дисплазией;
- AML с более чем 30-процентным бластозом в костном мозге.
В последние годы фармотрасль неплохо продвинулась вперед в лечении, в том числе таргетном, острого миелоидного лейкоза — благодаря идентификации соответствующих онкодрайверных генетических маркеров. Изрядная гетерогенность заболевания с точки зрения патофизиологических мутаций заставляет рассматривать острый миелолейкоз как группу из фактически отдельных онкогематологических состояний. Подход нашел оптимальное решение в виде появления приличного числа новых лекарственных препаратов, нацеленных на специфические субпопуляции пациентов:
-->| Радиоперехваты круглых столов [8] |
| Радиомагазин-73 [505] |
Войти через uID
Заболевания, входящие в группу ХМПЗ, возникают в результате злокачественной трансформации полипотентной гемопоэтической стволовой клетки костного мозга и последующей клональной пролиферации клеток одной или нескольких линий миелопоэза, сохраняющих способность к дифференцировке.
По классификации ВОЗ выделяют группу истинных ХМПЗ и группу миелопролиферативных/миелодиспластических заболеваний (МПЗ/МДЗ).
К ХМПЗ относятся:
1. Хронический миелолейкоз (bcr/abl положительный)
2. Хронический нейтрофильный лейкоз
3. Хронический эозинофильный лейкоз/гиперэозинофильный синдром
4. Хронический идиопатический миелофиброз
5. Истинная полицитемия
6. Эссенциальная тромбоцитемия
7. Миелопролиферативное заболевание, неклассифицируемое.
В группу МПЗ/МДЗ входят:
1. Хронический миеломоноцитарный лейкоз
2. Атипическии хронический миелоидный лейкоз
3. Ювенильный миеломоноцитарный лейкоз.
В МКБ-10 ХМПЗ рассматривается в группе опухолевых заболеваний:
D45 — Полицитемия истинная;
D47.3 — Эссенциальная (геморрагическая) тромбоцитемия;
С92.1 — Хронический миелоидный лейкоз. Идиопатический миелофиброз.
ХРОНИЧЕСКИЙ МИЕЛОЛЕЙКОЗ
Эпидемиология. На долю ХМЛ приходится 15-20% всех случаев лейкозов у взрослых и 5% — у детей.
Заболеваемость ХМЛ составляет 15 новых случаев на 1 млн населения в год. Заболевание встречается преимущественно у лиц 30—70 лет, пик заболеваемости — 30—50 лет.
Мужчины и женщины страдают ХМЛ одинаково часто.
Этиология неизвестна, как и для всех опухолей.
К возможным этиологическим факторам относят малые дозы ионизирующего излучения, ряд химических веществ.
Патогенез. Пусковым моментом в развитии ХМЛ является соматическая мутация плюрипотентной гемопоэтической стволовой клетки крови. Основу мутации составляет перекрестная транслокация хромосомного материала между 9-й и 22-й хромосомами с образованием Ph-хромосомы и химерного онкогена bcr/abl на 22 хромосоме.
В отдельных случаях (частота их не превышает 5%) при стандартном цитогенетическом исследовании не удается обнаружить Ph-хромосому, в то время как молекулярно-генетическое исследование выявляет наличие онкогена bcr/abl.
Продуктом данного химерного гена при ХМЛ является белок р-210, являющийся тирозинкиназой с повышенной активностью, в результате чего нарушается нормальное функционирования клетки н ее злокачественная трансформация, бесконтрольная пролиферация гемопоэтических клеток.
В течении ХМЛ выделяют три фазы:
Хроническая (развернутая) — характеризуется пролиферацией клеток миелоидного ростка (гранулоцитарного, мегакарноцитарного) с сохраненной дифференцировкой клеток.
Стадия акселерации — характеризуется развитием резистентности к проводимой терапии и поя&чением нового клона злокачественных клеток с блоком дифференцировки на уровне бластных клеток.
В основе пояаления нового клона лежат вторичные мутации в опухолевых клетках.
Нарушение созревания приводит к увеличению в костном мозге и периферической крови количества незрелых клеток — бластов и промиелоцитов, бластный криз — характеризуется преобладанием клона с блоком дифференцировки над клоном клеток bcr/abl.
Костный мозг представлен большим количеством бластных клеток (эти клетки могут нести на своей цитоплазматической мембране маркеры, указывающие на их принадлежность как к миелоидному, так и к лимфоидному ростку).
Количество эритроцитов и НЬ в большинстве случаев находится в пределах нормы или несколько выше нее.
Количество тромбоцитов нормальное или повышенное. Все клетки крови имеют Ph-хромосому и ген bcr/abl.
Фаза акселерации (6—8 мес): появляются признаки прогрессирования лейкоза: лихорадка, боли в костях, нарастающая спленомегалия, у 25% больных — увеличение лимфатических узлов.
Гемограмма: лейкоцитоз (50—500)х10*9/л. Количество бластных клеток в периферической крови или костном мозге от 10 до 19% (по данным некоторых авторов — до 29%), количество бластов и промиелоцитов более 30%, характерны базофилия более 20%, нормохромная или гиперхромная анемия, персистирующий тромбоцитоз или тромбоцитопения. не связанная с терапией.
Появляются дополнительные хромосомные мутации (дополнительная Ph-хромосома, трисомия 8, изохромосома 17 и др.).
Бластный криз (средняя продолжительность фазы 3-6 мес): анемия, тромбоцитопения, признаки экстрамедулярных очагов кроветворения. Нарастают проявления геморрагического диатеза петехиально-пятнистого типа, связанного с тромбоцитопенией.
Характерны лихорадка, упорные боли в костях, быстропрогрессирующее истощение, быстрое увеличение селезенки и печени.
Гемограмма и миелограмма: количество бластов в костном мозге и периферической крови более 30%.
Диагностика. Морфологическое исследование крови и костного мозга подтверждает наличие миелопролиферативного процесса.
Диагноз ХМЛ подтверждается цитогенетическим исследованием, выявляющим наличие филадельфийской хромосомы и гена bcr/abl.
Разрешающая способность стандартного цитогенетического исследования — 5%, метода флюоресцентной гибридизации in situ (FISH) — 1 лейкемическая клетка на 200-500 нормальных.
Полимеразная цепная реакция используется как для диагностики, так и для мониторинга остаточной минимальной болезни.
Дифференциальная диагностика.
1. С лейкемоидными реакциями по нейтрофильному типу (нейтрофилы более 7,5x10*9/л — острые и хронические инфекции, неинфекционные хронические заболевания, ацидозы различной природы, на фоне терапии кортикостероидами, хронические гемолитические анемии).
2. Другие ХМПЗ и МПЗ/МДЗ.
3. С острыми лейкозами (в стадии бластного криза).
Критерием диагностики является наличие или отсутствие специфического для ХМЛ маркера Ph-хромосомы и bcr/abl.
Лечение. Несмотря на появление новых эффективных препаратов, таких как иматиниб, дазатиниб и нилотиниб, аллогенная трансплантация ГСК у детей и молодых больных (моложе 50 лет) по-прежнему является терапией выбора и позволяет излечить определенную группу больных.
Показатель выздоровления в группе больных с родственной аллогенной трансплантацией составляет 60%, с неродственной трансплантацией — около 50%.
При наличии у пациента потенциальных доноров необходимо решить вопрос о возможности аллогенной трансплантации, определяя уровень риска от трансплантации.
Наилучшие результаты показаны при ТГСК в хронической фазе, в первые 2 года после постановки диагноза.
Учитывая значительное снижение летальности при лечении гливеком (иматинибом), он может быть рекомендован всем больным в качестве первой линии терапии.
В хронической фазе доза гливека — 400 мг/день ежедневно, в фазе акселерации и бластного криза — 600—800 мг/день.
Гливек — ингибитор тирозинкиназы, механизм его действия заключается в блокировании активности белка р-210-bcr/abl-тирозинкиназы, играющей ключевую роль в патогенезе ХМЛ.
При назначении гливека в качестве первой линии терапии частота полных цитогенетических ответов через 12 мес лечения составляет 75—95%, в фазе акселерации — 24—17%, в фазе бластного криза - 16-7%.
Гидроксимочевина (гидреа, литалир) может назначаться в качестве первой линии терапии практически у всех больных для уменьшения массы опухоли на период обследования и решения вопроса о дальнейшей тактике лечения.
Доза гидреа определяется с учетом количества лейкоцитов и веса больного. При лейкоцитозе более 100х10*9/л — 50 мг/кг/день, в дальнейшем при снижении количества лейкоцитов дозу уменьшают: при лейкоцитозе (40-100)х10*9/л — 40 мг/кг/день, (20-40)х10*9/л - 30 мг/кг/день, (5-20)х10*9/л - 20 мг/кг/день.
Реаферон-а (Интрон А, Роферон А, Реаферон).
Применение реаферона позволяет увеличить сроки выживаемости по сравнению с химиотерапией (гидреа, бусульфан).
Оптимальная доза 5 млн/м2/день.
Для группы низкого риска 10-летняя выживаемость больных с полным цитогенетическим ответом составляет 100%, с большим цитогенетическим ответом — 76—78%, для остальных — 45—48%.
Бусульфан — в связи с появлением более эффективных для терапии ХМЛ препаратов, применение бусульфана в настоящее время ограничено. Необходимо отметить, что применение бусульфана в качестве первой линии терапии значительно ухудшает результаты трансплантации костного мозга.
Для терапии резистентных к гливеку пациентов в настоящее время используются и проходят стадию клинических исследований антитирозинкиназные препараты нового поколения дазатиниб и нилотиниб, по своей эффективности превышающие гливек.
Критерии гематологической ремиссии (оценивается по количеству лейкоцитов в периферической крови и выраженности спленомегалии): полная — лейкоциты 20х10*9/л, стойкая спленомегалия.
Критерии цитогенетического ответа (определяется по проценту выявляемых Ph-позитивных клеток в костном мозге): полный — Ph-позитивные клетки отсутствуют; большой — Ph—позитивные клетки 95%.
Прогноз.
Средняя продолжительность жизни пациентов в хронической фазе на фоне стандартной терапии составляет 5—7 лет и зависит от чувствительности к реаферону.
Трансплантация костного мозга позволяет излечить 50—60% больных, эффективность транслантации зависит от фазы заболевания.
Отдаленных результатов на терапии гливеком пока нет.
Читайте также:

