Новейшие технологии в лечении рака мочевого пузыря
2020. Gilead заплатила $4.9 млрд за перспективный иммуно-онкологический препарат
Компания Gilead Sciences купила за $4.9 млрд стартап Forty Seven, чьим основным активом является препарат Magrolimab - антитело против раковых клеток. Оно нацелено на рецептор CD47, который позволяет раковым клеткам избежать нападения иммунной системы. В данный момент Magrolimab проходит клинические испытания сразу по нескольким типам рака: неходжкинская лимфома, В-клеточная лимфома, колоректальный рак, рак яичек и мочевого пузыря. Говорят, препарат действительно показывает многообещающие результаты и такая огромная сумма, заплаченная за него - это серьезное подтверждение.
2018. Фармагигант Bristol-Myers Squibb инвестировал $3.6 млрд в TIL-иммунотерапию рака
Американская фармакомпания Bristol-Myers Squibb инвестировала $3.6 млрд в совместный проект со стартапом Nektar Therapeutics, целью которого является вывод на рынок технологии иммунотерапии рака NKTR-214. Эта технология использует метод TIL (Tumor Infiltrating Lymphocytes) и нацелена на 9 типов рака, включающих меланому, рак почек, рак легких, мочевого пузыря и трижды-негативного рака груди. На видео показано, как TIL клетки (включающие в себя T-лимфоциты и NK-лимфоциты) способствуют развитию воспаления опухоли и, соответственно, развитию иммунной реакции организма против рака. Препарат NKTR-214 способствует размножению этих TIL-клеток.
2016. Новое лекарство оказалось эффективным в борьбе с раком мочевого пузыря
Новый препарат для химиотерапии - атезолизумаб (торговое наименование Tecentriq) от американского фарма-гиганта Genentech - успешно прошел клинические испытания и был одобрен FDA. Он заставляет иммунную систему атаковать опухоли и эффективен против рака мочевого пузыря. До сих пор для лечения этого заболевания применяли препарат цисплатин, который вызывает много побочных эффектов. В ходе клинического исследования, которое прошло в центрах США, Канады и Европы, все больные хорошо переносили атезолизумаб. Пациенты испытывали лёгкую усталость, страдали от кожного зуда и диареи, но это гораздо менее серьёзные побочные эффекты, чем у цисплатина. При этом, у половины участников исследования в результате устойчивого иммунного ответа опухоли уменьшились или исчезли вовсе.
2014. Прорыв в лечении рака мочевого пузыря иммунотерапией
В 2013 году журнал Science назвал иммунотерапию рака прорывом года. И похоже, этот прорыв продолжает прорывать. Исследователи Лондонского института онкологии Бартса добились впечатляющих результатов в лечении рака мочевого пузыря с помощью иммунотерапевтического препарата MPDL3280A, разработанного швейцарским фармацевтическим гигантом Roche (вернее, его американской дочкой Genentech). Лекарство блокирует на поверхности раковых клеток белок, который помогает им избегать распознавания иммунной системой. Таким образом иммунные клетки человека уничтожают опухоль без всякой химии. Ранние результаты клинического исследования настолько многообещающи, что американский регулятор FDA присвоил препарату почетный статус терапии прорыва.

Ученые исследуют новые методы борьбы с онкологией
В ходе нового исследования было установлено, что иммунотерапия, направленная на активацию иммунных сил организма для борьбы с раком, не дает ожидаемого эффекта при воздействии на некоторые виды раковых опухолей мочевого пузыря по причине отсутствия в раковых новообразованиях иммунных клеток. Данные выводы получены благодаря изучению процессов взаимодействия на клеточном уровне и причин, исключающих попадание иммунных клеток в раковые опухоли, что позволяет определить правильный курс разработок для создания более эффективной терапии.
Как отметил доктор Мадс Даугаард, имеющий степень доцента урологии в UBC, на протяжении нескольких десятилетий ученые не могли разгадать механизм действия, благодаря которому раковые опухоли избегают атаки иммунной системы. Специалисты смогли определить клеточный сигнальный путь, от которого зависит регулирование работы иммунных клеток и их способность проникать в раковые опухоли.
Онкология мочевого пузыря занимает пятое место в Канаде по распространенности среди всех раковых заболеваний. На сегодня в клинической практике существует лишь один метод противораковой терапии с использованием химических препаратов на базе цисплатина., воздействующий на инвазивные опухоли. По достижению опухолью устойчивости специалистами одобрена только терапия контрольной точки в качестве курса лечения второй линии.
Атезолизумаб является препаратом, используемым в иммунотерапии. Медикамент способен усилить иммунную реакцию организма и является новым лидером в противораковой терапии при борьбе с онкологией мочевого пузыря. Однако он будет одобрен для использования в клинической практике лишь в течение 20 лет. Первичные результаты исследований показали прогресс, однако последующие результаты анализов пациентов свидетельствовали об эффективности лечения только в одном из пяти случаев. Причины неэффективности препарата в большинстве случаев до сих пор были не изучены.
В данном исследовании, в котором принимали участие доктор Даугаард и его коллеги, было установлено, что инвазивные опухоли мочевого пузыря некоторых типов способны блокировать внедрение иммунных клеток при задействовании клеточного сигнального пути, который носит название тропового активированного пероксисомом рецептором гамма или PPAR-y.
Как отметил профессор, активируя этот путь, опухоли блокируют доступ к иммунной системе, а без присутствия иммунных клеток в тканях опухолей противораковая терапия не дает ожидаемого эффекта. Теперь ученым стала известна причина отсутствия действенности лечения, и они направили свои усилия на поиск возможных решений и разработку новых методик воздействия.
Доктор с его коллегами уже сделали первые шаги на пути к созданию инновационного препарата, который будет способен воздействовать на PPRAR-Y-путь. Повышенная эффективность терапии ожидается благодаря комбинированному действию лекарственного препарата с иммунотерапией контрольного типа.
По мнению ученых, самым действенным лечением в борьбе с раком является активность иммунной системы организма пациента, что и является целью медиков.
В рамках нового исследования, проведенного .
В рамках научного исследования, результаты .
В рамках нового проведенного исследования, .
В.Ю. Старцев 1 , И.Н. Дыленок 2 , Т.Р. Джемилев 2
По данным мировой литературы, у 30 % больных раком мочевого пузыря (РМП) опухоль впервые выявляют в стадии инвазивного роста и еще в 30 % случаев немышечно-инвазивного рака мочевого пузыря опухоль прогрессирует в стенку мочевого пузыря, несмотря на адекватное лечение. При лечении больных мышечно-инвазивным РМП стандартно выполняют радикальную цистэктомию (РЦ) с удалением мочевого пузыря, регионарных лимфатических узлов и окружающих структур (матка или предстательная железа) с деривацией мочи [1].
Ближайшие и отдаленные результаты этого вмешательства связаны с высокой (30–61 %) частотой осложнений, а деривация мочи оказывает выраженное влияние на функцию мочевых путей, органов желудочно-кишечного тракта, половую функцию и снижает качество жизни пациента [2]. Больные после РЦ нуждаются в особом уходе медицинского персонала с высокой профессиональной подготовкой, что возможно в крупных специализированных центрах [3].
Цель данного исследования заключалась в проведении метаанализа данных о возможности сохранения мочевого пузыря, профиле токсичности и контроле состояния опухоли при использовании органосохраняющих технологий у больных неметастатическим мышечно-инвазивным РМП. В 80–90-х гг. XX столетия многие исследователи признавали, что органосохраняющее лечение больных мышечно-инвазивным РМП, включающее трансуретральную резекцию мочевого пузыря (ТУРМП), химиотерапию (ХТ) и/или лучевую терапию (ЛТ), приводит к однозначно худшим результатам с точки зрения локального контроля опухоли и долгосрочной общей и беспрогрессивной выживаемости [4].
Результаты исследований легли в основу документов, опубликованных в 2014 г. Группой онкологической радиационной терапии (RTOG), что стало важным вкладом в развитие методов сохранения мочевого пузыря как альтернативы РЦ [8]. С современных позиций, консервативный подход оправдан для двух групп пациентов: при расположении опухоли в пределах стенки мочевого пузыря (и при желании больного избежать агрессивной операции) и у пациентов с тяжелыми сопутствующими заболеваниями [9].
Сохранение мочевого пузыря для отдельных групп пациентов по сей день рассматривается в качестве альтернативы руководящим принципам ведущих научных сообществ (National Comprehensive Cancer Network (NCCN) и European Association of Urology (EAU)) [10, 11]. Цель органосохраняющего лечения больных мышечно-инвазивным РМП — сохранение высокого качества жизни, снижение угрозы потенциальной прогрессии опухоли или смертности после РЦ без ущерба для онкологического результата [12].
Мультимодальный подход при органосохраняющем лечении
Однако до сих пор не опубликованы рандомизированные исследования с проспективным сравнением результатов РЦ и ТМТ. Показатели эффективности БМТ значительно уступают результатам после полного цикла ТМТ [9]. Причиной отказа в проведении ХТ служат сопутствующие заболевания, однако потребность в комплексном подходе к пациентам пожилого возраста привлекает все больше внимания во всем мире.
Недостатки ТМТ включают частое выявление мышечно-инвазивного рецидива РМП в сохраненном мочевом пузыре (чаще в зоне первоначального расположения раковой опухоли), отсутствие лечебного вмешательства на регионарных лимфатических узлах, рост числа смертельных исходов у больных мышечно-инвазивным РМП после спасительной РЦ при прогрессировании опухоли или ее рецидиве после высокой дозы облучения органов малого таза [14].
Возможности сохранения мочевого пузыря у больных пожилого возраста
При ретроспективном анализе распространенности РМП у жителей Дании (2016) установлено, что заболеваемость мышечно-инвазивным РМП в 7–10 раз выше у пациентов старше 70 лет в сравнении с более молодыми людьми. Показатели смертности с течением времени снижались у пациентов всех возрастных групп, кроме 90-летних больных [16]. С учетом мировых данных внимание к сопутствующим заболеваниям и ментальному статусу больных мышечно-инвазивным РМП пожилого и старческого возраста имеет большое значение.
S. Poletajew et al. рекомендуют органосохраняющее лечение больным мышечно-инвазивным РМП при наличии следующих факторов: старческий возраст (в среднем — 78 лет), высокий индекс массы тела (свыше 25,7 кг/м2 ), низкий показатель гемоглобина (ниже 11,6 г/л), курение (72,1 %), интервал между первым проявлением болезни и установлением диагноза РМП свыше 60 дней [17]. В результате исследования эффективности органосохраняющего лечения у пациентов пожилого возраста (≥75 лет), проведенного R.H. Clayman et al., было установлено, что пяти- (60 %) и десятилетние (56 %) показатели раковоспецифической выживаемости такие же, как после РЦ [18].
С учетом общемировой тенденции старения населения ожидается возрастание численности пациентов с мышечно-инвазивным РМП, а значит, контингента пациентов с выраженной сопутствующей патологией и онкологическим диагнозом. В 2016 г. A. Erlich и A.R. Zlotta предложили алгоритм выбора лечения возрастных больных мышечно-инвазивным РМП (табл. 1) [19].
Таблица 1 Алгоритм органосохраняющего лечения пациентов пожилого возраста с мышечно-инвазивным раком мочевого пузыря [19]
S.J. Byun et al. ретроспективно изучили результаты органосохраняющего лечения 50 пациентов с мышечно-инвазивным РМП (средний возраст — 71,5 года): пятилетняя общая выживаемость и раковоспецифическая выживаемость составили 37,2 и 30,2 % соответственно [20]. При многофакторном анализе индекс G оказался статистически значимым показателем прогноза, что позволило представить графическую зависимость (рис. 1). Для принятия решения о предстоящем лечении, помимо возраста больного, необходим учет его работоспособности, производительности, качества жизни, социальных показателей и собственных предпочтений [21].
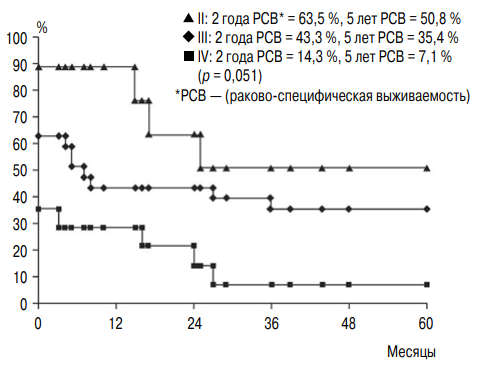
Рис. 1. Общая выживаемость больных мышечно-инвазивным раком мочевого пузыря с учетом степени злокачественности опухоли [20]
Хирургические технологии в программе органосохраняющего лечения
Во время выполнения ТУРМП, составной части ТМТ, стараются добиться максимальной резекции опухоли, поскольку оставление резидуальной ткани обычно сопровождается низким показателем раковоспецифической выживаемости [22]. Монотерапия ТУРМП продемонстрировала невысокую эффективность в нескольких исследованиях из-за высокой частоты развития локальных рецидивов в ближайшие (до полугода) сроки после операции [23, 24].
Следовательно, у пациентов с мышечно-инвазивным РМП следует предпочесть более агрессивное лечение с мультимодальным подходом. Для улучшения качества визуализации и снижения побочных эффектов терапии М.М. Garcia et al. (2014) предложили выполнять трансуретральную разметку границ опухоли с помощью специальных маркеров с микрозубчиками в подслизистом слое органа, в 5–7 мм от края резекции, что улучшает переносимость ЛТ [25].
Хирургическое лечение больных с распространением опухоли на соседние органы (Т 4) характеризуется невысокой (10–12 %) пятилетней общей выживаемостью [27]. Для таких пациентов наиболее предпочтителен мультимодальный подход или внутриартериальная химиотерапия.
Лучевая терапия в программе мультимодального лечения больных мышечно-инвазивным раком мочевого пузыря
S. Hafeez et al. сообщают, что при помощи предлучевого планирования конусной лучевой компьютерной томографии существует возможность подведения к опухоли СОД = 70 Гр с оптимальным уровнем воздействия и минимальным побочным эффектом (2 из 19 лучевых циститов через 5,3 месяца после ЛТ) [30].
В 2008–2014 гг. проведены исследования у больных мышечно-инвазивным РМП, позволившие улучшить ряд показателей после органосохраняющего лечения. Целью исследований было достижение максимальной эффективности лечения путем эскалации общей дозы ЛТ, использования нетрадиционных схем фракционирования, сокращения общего времени терапии, а также сочетания дистанционного излучения с интерстициальной брахитерапией и новыми методами ЛТ, радиосенсибилизаторами и гипертермией [32, 33].
Новое лечебное направление в радиологии — радиотерапия с модулированной интенсивностью, позволяетдостигать высоких результатов у пожилых (старше 75 лет) больных мышечноинвазивным РМП. L.J. Lutkenhaus et al. сообщили о полном опухолевом ответе у 87 % пожилых больных мышечно-инвазивным РМП (трехлетняя общая выживаемость — 44 %, признаков продолженного роста не обнаружено у 73 % больных за 36 месяцев наблюдения) при невысокой токсичности (недержание мочи и стула G ≥ 2 у 14 и 5 % пациентов соответственно) [31].
Современная химиотерапия в комплексном лечении больных мышечно-инвазивным раком мочевого пузыря
Поиск оптимального соотношения варианта введения и дозы химиопрепаратов, дающего возможность снизить проявления побочных эффектов и сохранить высокий опухолевый ответ, составляет одну из актуальных проблем онкоурологии [34, 35]. Местнораспространенный и диссеминированный РМП хорошо поддается воздействию системной ХТ на основе цисплатина [35].
Что касается сроков начала проведения ХТ при органосохраняющем лечении, до сих пор не получено окончательных данных, подтверждающих преимущество использования неоадъювантной или адъювантной химиотерапии. Полный лекарственный патоморфоз после неоадъювантной химиотерапии в 28 % случаев мышечно-инвазивного РМП отметили V.K. Pokuri и et al.: эффект зависел от морфологического типа строения опухоли. Так, у пациентов с переходноклеточной карциномой патоморфоз отмечался после трех курсов неоадъювантной химиотерапии [36].
Опухолевый ответ на ХТ на основе цисплатина наблюдается у 50–60 % пациентов с прогрессирующим мышечно-инвазивным РМП, но в ряде случаев отмечается химиорезистентность. Цитотоксический эффект платины опосредован необратимым повреждением ДНК, но экспрессия репарации ДНК белков (комплементарный фактор перекрестной репарации 1 (ERCC1) и ген восприимчивости 1 (BRCA1)) не связана с ответом на препараты платины [37].
Альтернативные подходы для прогнозирования чувствительности к платине с участием экспрессии нескольких генов в настоящее время изучаются. Так, в 2016 г. Е.А. Guancial et al. измеряли концентрацию платины в опухолевой ткани с использованием беспламенной атомно-абсорбционной спектрофотометрии (FAAS) и сравнивали с показателями в нормальном уротелии мочевого пузыря после применения комбинации неоадъювантной химиотерапии и РЦ [38].
Для установления причин химиорезистентности РМП исследовали цисплатин-резистентные клеточные линии РМП: были определены гены, вызывающие дерегуляцию РНК-последовательностей (секвенирование РНК) и метилирование ДНК [39, 40]. P. Sidaway проанализировал метилирование ДНК in vitro в опухолях 18 пациентов, получавших цисплатин. Было установлено, что промотор метилирования HOXA9 может служить потенциальным прогностическим биомаркером мышечно-инвазивного РМП, а децитабин сенсибилизирует резистентные опухоли у пациентов, получающих ХТ на основе цисплатина [41].
Полученные результаты, вероятно, послужат началом для изучения тканевых факторов, определяющих персонализированный подход у больных мышечно-инвазивным РМП при использовании ХЛТ. При нечувствительности к платине, а также у ослабленных пациентов с мышечно-инвазивным РМП используют и другие химиопрепараты, например из класса таксанов [35].
Еженедельные инъекции паклитаксела (80 мг/м2 ) удовлетворительно переносятся больными, наиболее выраженными проявлениями токсичности (Grade3–4) оказываются анемия, слабость (10 %) и боль (38 %), что чаще связано с костными метастазами РМП и требует проведения локальной ЛТ и пероральных болеутоляющих у взрослых и у пациентов детского возраста [42, 43].
Гемцитабин, антиметаболит пиримидина, демонстрирует выраженный эффект при системном использовании и низкую токсичность по сравнению с другими агентами. Дополнение курса ХТ вторым препаратом позволяет увеличить общую выживаемость больных мышечно-инвазивным РМП (p Рис. 2. Общая выживаемость больных мышечно-инвазивным раком мочевого пузыря после органосохраняющего лечения [33]
J. Nowak-Sadzikowska et al. провели полноценное исследование результатов органосохраняющего лечения у больных мышечно-инвазивным РМП, что дало возможность сформулировать выводы на основе наблюдения 73 пациентов в стадии pT2– 4aN0M0 [33]. За 67 месяцев наблюдения скончались 33 (45 %) пациента (в том числе 28 от прогрессирования РМП). Трех- и пятилетняя общая и раковоспецифическая выживаемость составила 65 и 52 %, 70 и 59 % соответственно.
Пятилетние показатели общей выживаемости в группе ТМТ — 59 %, в группе БМТ — 41 % (р = 0,0520) (рис. 2). Авторы сделали вывод о том, что в группе работоспособных пациентов с мышечно-инвазивным РМП (тяжелые сопутствующие заболевания с высоким риском радикального хирургического вмешательства) только у 6–19 % пациентов можно соблюсти все критерии комбинированного подхода [33].
В Канадском междисциплинарном центре по лечению РМП (MDBCC) 4,5 года наблюдали 112 пациентов с мышечно-инвазивным РМП (56 получали РЦ и 56 — ТМТ), в среднем в возрасте 68 лет. Около трети пациентов (29,5 %) имели стадию РМП cT3/cT4 [57]. Число случаев летальных исходов в группах РЦ и ТМТ составило 20 (35,7 %) и 22 (39,3 %) соответственно (по 13 случаев в результате прогрессии РМП), а пятилетняя раковоспецифическая выживаемость — 73,2 и 76,6 % соответственно (p = 0,49). Сделан вывод, что ТМТ позволяет достичь результатов выживаемости, сравнимых с таковыми для отобранных пациентов после РЦ.
Обсуждение и заключение
В отсутствие рандомизированных исследований трудно сравнивать возможность сохранения мочевого пузыря со стандартной РЦ из-за широкой гетерогенности отбора пациентов. В систематическом обзоре клинических ретроспективных и проспективных исследований, включавших 13 396 пациентов (2015), средняя пятилетняя общая выживаемость в группе ТМТ составила 57 %, тогда как в группах, получавших РЦ или РЦ и адъювантную химиотерапию, — 52 % (р = 0,04) и 53 % (р = 0,38) соответственно [7]. В результате вполне закономерен вопрос: можно ли продолжать игнорировать доказательства возможности органосохраняющего лечения пациентов с мышечно-инвазивным РМП [58]?
Итак, идеальный кандидат для сохранения мочевого пузыря — здоровый пациент с небольшой унифокальной опухолью (менее 5 см), без резидуальных изменений после ТУРМП, с отсутствием обструкции мочеточника или гидронефроза, без карциномы in situ (диагностированной с помощью биопсии подозрительных участков), в отсутствие признаков поражения тазовых лимфатических узлов [59]. До 15 % пациентов с мышечно-инвазивным РМП могут стать кандидатами для сохранения мочевого пузыря, а ТУРМП с сопутствующей ХЛТ можно рассматривать как оптимальный лечебный подход с позиции переносимости и эффективности [59].
Основными вариантами токсичности при ХЛТ остаются проблемы кроветворных, желудочно-кишечных органов и мочевыводящих путей. В ряде случаев при ХТ на основе цисплатина отмечается невропатия. Пятилетняя общая выживаемость больных, перенесших спасительную РЦ, не превышает 25–30 % [60].
Тем не менее признано возможным сохранение мочевого пузыря у отдельной, тщательно отобранной группы больных мышечно-инвазивным РМП, в частности, у престарелых пациентов и больных с выраженными сопутствующими заболеваниями, что позволяет сохранить качество жизни и самостоятельное мочеиспускание. Это является крайне важным моментом для данной гериатрической популяции.
Продолжаются исследования, касающиеся качества выполнения хирургического вмешательства, модификации дозы химиопрепаратов и лучевой энергии, а также экспрессии генома раковой клетки. Представляются перспективными рандомизированные исследования с целью сравнения результатов ТМТ и РЦ, что необходимо для выбора оптимального индивидуального метода лечения.
Злокачественные опухоли в мочевом пузыре образуются в результате бесконтрольного роста мутируемых клеток. Данное заболевание носит онкологический характер, имеет свою симптоматику и сложности в диагностировании и лечении. Точные причины такой патологии достаточно не изученные, однако некоторые факторы риска определены. Методы терапии болезни зависят от ее степени развитияи основываются на трех составляющих:
- оперативное удаление опухоли;
- терапия химическими препаратами;
- облучение.
При злокачественном новообразовании, даже после полного его излечения, всегда сохраняется вероятность на его рецидив, даже спустя несколе лет после удаления первичного образования.
Факторы, провоцирующие онкологию

Сегодня к причинам возникновения онкологии мочевого пузыря относят влияние нескольких негативных факторов, которые прямо или опосредованно приводят к мутации и беспорядочному делению клеток. Это прежде всего:
- курение;
- частые контакты с химическими препаратами и их производными;
- хронических цистит;
- постоянное использование мочевого катетера;
- наследственная предрасположенность;
- лучевая и химиотерапия (если в анамнезе рак другого вида);
- возраст после 65 лет.
Симптомы онкологии

Рак мочевого пузыря имеет следующие симптомы:
- кровяные выделения в моче;
- ржавый или темно-коричневый цвет урины;
- частые позывы к мочеиспусканию, которое сопровождается болью;
- слабость, потеря веса, температура тела 37.5 градусов;
- на третье, четвертой стадии появляется кашель, отдышка, желтуха.
При появлении обозначенных признаков необходимо сразу же обращаться к врачу для обследования. Диагностика рака мочевого пузыря требует совокупного подхода. Обязательно проведения лабораторных исследований мочи. Также назначают цистоскопию для изучения полости мочевого пузыря. Также, проводится дополнительная диагностика ультразвуком и методом компьютерной томографии. Также онколог назначает проведение бимануальной пальпации. Данный метод обследования выполняется под наркозом и при пустом мочевом пузыре. Доктор пальпирует пораженный орган у мужчин через прямую кишку, а у женщин через влагалище.
Стадии развития злокачественных образований и их лечение
- нулевая – говорит о наличии раковых клеток в полости мочевого пузыря, однако они не проросли в стенки и мягкие ткани;
- первая – опухоль повреждает стенки мочевого пузыря;
- вторая стадия характеризуется большей степенью поражения, опухоль распространилась в мышечный слой, однако значительно там не закрепилась;
- третья – наблюдается поражение мышц, жировой ткани, появляются метастазы, которые образуют вторичную опухоль на простате, в семенных пузырьках у мужчин, а также репродуктивных органах у женщин;
- четвертая стадия – последняя, при которой раком поражены не только мочевой пузырь, но и другие органы и лимфоузлы.
На первых трех стадиях шансов на выздоровление значительно больше, нежели на 3 и 4. Статистически отмечено, что рак мочевого пузыря чаще диагностируется у мужчин, нежели у женщин. Своевременная диагностика и правильно спланированное позволяет успешно лечить онкологию.
Лечение рака мочевого пузыря носит совокупный характер. Оно складывается из хирургического удаления злокачественного образования, использования химиопрепаратов и облучения. Методы лечения зависят от стадии болезни и присутствия сопутствующих показаний.
При 0 стадии лечить рак можно с помощью трансуретральной резекции опухоли. Она позволяет удалить новообразования без открытой операции, через мочеиспускательный канал. Также на этой стадии эффективно пользуются вакциной бцж. Это медицинский препарат, который используют в качестве иммунологической терапии рака, а также в профилактических целях в после операционный период. Бцж вводится через катетер в полость мочевого пузыря и действует именно на его слизистую оболочку изнутри. Препарат не эффективен при новообразованиях 2-4 стадиях. Бцж используют после трансуретральной резекции. Вакцина активно стимулирует иммунную систему, для эффективного угнетения раковых клеток. Существуют определенные правила применения бцж. Первое, это нужно значительно уменьшить употребление жидкости. Мочевой пузырь должен быть максимально пуст. Бцж вводится через катетер и выдерживается в полости на протяжении двух часов. Затем мочевой пузырь опорожняется естественным путем, после чего следует промыть (это нужно делать после каждого мочеиспускания на протяжении в дня) наружные половые органы. Терапия бцж проводится в течении полугода один раз в неделю. Затем показана щадящая иммунотерапия. Препарат бцж вводится раз в месяц в течении последующего года. Такая профилактика предупреждает возможные рецидивы. При лечении бцж возможны незначительные побочные эффекты (раздражение мочевого пузыря, кровяные примеси в моче, боль в суставах, сужение уретры). Однако они встречаются достаточно редко.
Бцж при раке мочевого пузыря выступает в качестве вспомогательного препарата, повышающего иммунную реакцию организма борьбу с раковыми клетками. Применять препарат можно только по назначению лечащего врача, после проведения комплексного обследования.
Бцж нельзя использовать если в истории болезни пациента присутствовал туберкулез, наблюдаются иммунодефицитные состояния, повреждена слизистая оболочка пузыря. А также, если после проведения туберкулезных проб, папула оказывается больше 17 мл.
Лечение рака мочевого пузыря проводят также с помощью введения химиопрепаратов непосредственно в его полость или внутривенно.
Полное хирургическое удаление мочевого пузыря на 0 стадии проводится только в случае многократных его поражений.
Диагностика рака на 0 стадии, позволяет проводить щадящую терапию, а это в большинстве случаев позволяет полностью его победить.
Первая стадия незначительно отличается от 0, да и лечение проводится по той же схеме, но при ней возникает высокая вероятность повторного рецидива рака, даже после полного его излечения. Поэтому, при такой опухоли прибегают к удалению органа.
На ІІ и ІІІ стадии избежать цистэкомии практически нет шансов. К тому проводиться частичное или полное хирургическое удаление и рядом расположенных пораженных органов. У мужчин – это простата, у женщин – матка, яичники, маточные трубы, часть влагалища. Обязательно проводится удаление лимфатических узлов. Химиотерапия и облучение проводят курсами при подготовке к операции и после удаления пораженных органов.
После удаления мочевого пузыря и других органов малого таза возможны осложнения в виде кровотечений и инфекционных болезней. К тому же удаления предстательной железы может привести к нарушению эрекции у мужчин, хотя в отдельных случаях хирургу удается сохранить нервы для поддержания эректильной функции. У женщин цистэктомия приводит к бесплодию и менопаузе.
После удаления мочевого пузыря, как у мужчин, так и женщин, выполняется его реконструкция.
На четвертой, последней стадии операции практически не проводят. Лечение, в основном направленно на облегчение симптомов и улучшение качества жизни.
На прогноз выживаемости влияет стадия болезни и размер злокачественного образования. Поэтому диагностика играет важную роль в борьбе с онкологическими заболеваниями.
Сегодня достаточно высококвалифицированно проводится лечение рака мочевого пузыря в Израиле и Германии. В заграничных онкоцентрах имеется современное оборудование и применяются новейшие методики. Диагностика занимает важное место в комплексе процедур, направленных на борьбу со злокачественными новообразованиями.
Лечение рака мочевого пузыря в Израиле характеризуется достаточно высоким прогнозом выживаемости. Этому способствует ранняя диагностика злокачественных образований и эффективные методы лечения. Они включают:
- цитоскопию;
- КТ, сканограмму;
- трансуретральную резекцию;
- цитологию.
Также сегодня используется современные разработки для обследования. Диагностика проводится сверхчуствительным УЗИ, с помощью которого можно определить стадию болезни, наличие метастазов и изменений в органах таза. Методом цистоэндосонографии определяют состояние новообразований на ранних стадиях. Фотодинамическая диагностика позволяет активно определять плоскоклеточный рак, даже на первых стадиях. Для обследования костной ткани проводят сцинтиграфию (сканирование костей).
Лечение рака мочевого пузыря в Израиле направлено не только на сохранение жизни пациенту, но и на ее качество. Рак мочевого пузыря подлежит удалению, при значительной степени поражения проводится цистэктомия. В результате под общим наркозом удаляется полностью мочевой пузырь и простата у мужчин, у женщин – репродуктивные органы. Обязательно удаляются и лимфатические узлы. После чего выполняются мероприятия для восстановления функций органа.
Кроме того сегодня используют новые разработки. Они позволяют действенно лечить онкологию мочевого пузыря на разных стадиях. Это методы:
- фотодинамики (в организм вводится специальное вещество, что накапливаясь в опухоли, способствует образованию особой формы кислорода, который губительно действует на раковые клетки);
- СИНЕРГО (воздействием специальных микроволн осуществляется подогрев стенок мочевого пузыря и проводится параллельный циркуляционный ввод химических препаратов);
- электрокоагуляции (опухоль подвергается воздействию высокочастотного электротока);
- лучевая терапия Rapidarc (строго направленное облучение пораженных клеток).
Современные методы обследования и лечения позволяют достигать высоких результатов при лечении злокачественных образований у мужчин, так и женщин на всех стадиях.
Онкологическая клиника в Германии дает большие прогнозы на успешное излечение от онкологии. Своевременная диагностика, новейшие технологии в лечении, профессиональные рекомендации (выполнение, которых строго обязательно) во время реабилитационного периода, позволяют пациенту навсегда забыть об онкологии.
Диагностика в Германии включает в себя целый комплекс обследований, которые позволяют выявить болезнь на ранних стадиях и увидеть полную картину недуга, для дальнейшего выбора схемы лечения.
Практически любая онкологическая клиника в Германии проводит следующие обследования:
- цитология;
- анализ мочи;
- пальпация;
- трансректальная и ультразвуковая диагностика;
- рентген.
Данные методы позволяют получить исчерпывающую информацию об опухоли. Онкологическая клиника в Германии располагает не только новейшим оборудованием, но и высокопрофессиональными кадрами. Опытные доктора на основе обследований точно поставят диагноз и подберут эффективное индивидуальное обследования с учетом особенностей организма у женщин и мужчин, а также в соответствии с возрастом пациента.
Лечение в Германии рака на ранних стадиях осуществляется с помощью внутрипузырной химиотерапии. Иногда ее применяют и после оперативного вмешательства. При тяжелых случаях применяют более радикальные меры, основываясь на новые методики и препараты. Важно отдавать себе отчет, что клиника в Германии – это комплекс услуг и возможностей, от бытовых условий до последних новинок и разработок в области онкологии. Такие возможности позволяют при радикальных методах в большинстве своем сохранить половые функции у мужчин и репродуктивные у женщин.
Стоимость лечения в Германии достаточно высокая. В ценовую категорию включают полный комплекс услуг, от диагностики до реабилитационного периода. Цена может немного отличатся, в зависимости от того, где именно в Германии расположена клиника и какими возможностями она обладает, а также какого уровня специалисты там работают.
Лечение рака в Германии – это реальный шанс на полное излечение. При выборе онкоцентра, ознакомьтесь с перечнем услуг, которые он предлагает, его возможностями и профилем. Любая клиника имеет рекомендации, которые размещены на официальных сайтах.
Читайте также:

