Неоперабельный рак и лучевая терапия

О неоперабельном раке говорят тогда, когда злокачественную опухоль не удается удалить при помощи хирургических методов. Обычно такие ситуации возникают при распространенном процессе на терминальных стадиях. При этом, первичный очаг может быть расположен практически в любом органе. В большинстве случаев рак является неоперабельным при наличии множественных метастазов или при расположении первичной опухоли в тех участках организма, куда невозможно сформировать операционный доступ.
- Статистика
- Как проявляется неоперабельный рак
- Разновидности неоперабельного рака в зависимости от локализации
- Примеры неоперабельного рака
- Лечение неоперабельного рака
Статистика
Несмотря на активное развитие диагностики, неоперабельный рак встречается достаточно часто. Эта особенность может быть связана с несколькими факторами:
- Некоторые виды рака склонны к длительному бессимптомному течению и проявляют себя только на последних стадиях, когда хирургическое лечение провести невозможно.
- Пациенты могут игнорировать характерные признаки рака и обращаются к врачам при серьезном ухудшении здоровья, что связано с прогрессированием и распространением опухолевого процесса.
- Существуют и такие формы рака, которые прогрессируют очень быстро и если лечение не проводится вовремя, то через несколько месяцев опухоль становится неоперабельной.
Рак может быть неоперабельным и по другим причинам, например, когда опухоль захватывает крупные сосуды или жизненно важные органы, либо, когда у пациента имеются противопоказания к операции.
В связи с этими обстоятельствами, в практике любого врача онколога регулярно встречаются неоперабельные виды рака самых различных органов. Традиционно статистика оценивает показатели пятилетней выживаемости и в этих случаях показатели самые неутешительные. Например, пять лет при неоперабельном раке головного мозга переживает лишь 1% пациентов, при раке печени – 6%, при раке матки – 7%, при раке простаты – около 15%.
Такие неутешительные показатели связаны с тем, что эффективное лечение провести невозможно. Существующие консервативные методы позволяют ненадолго продлить жизнь пациента или улучшить ее качество.
Как проявляется неоперабельный рак
Так как неоперабельные формы рака чаще всего встречаются на терминальных стадиях, то симптомы являются выраженными и в значительной степени влияют на состояние пациента. Точные проявления зависят от локализации и распространенности опухолевого процесса, однако можно выделить несколько симптомов, которые встречаются практически у каждого пациента:
- Сильная боль. Она сосредоточена в той области, где расположен первичный очаг рака. Болезненные ощущения не удается устранить при помощи обычных средств, помогают только препараты из группы наркотических анальгетиков.
- Выраженное истощение организма. Большинство пациентов теряют способность к передвижению и самообслуживанию, отмечается сильное снижение массы тела и слабость.
- Потеря аппетита, одышка, тошнота, рвота и другие неспецифические симптомы.
При метастазировании рака клиническая картина дополняется и другими признаками. В зависимости от поражения того или иного органа, среди симптомов могут отмечаться неврологические нарушения, патологические переломы, желтуха, нарушение функции почек и др.
Разновидности неоперабельного рака в зависимости от локализации
Отличительной чертой неоперабельного рака является быстрое увеличение в размерах и распространение на соседние ткани и органы, то есть инвазивный рост. В некоторых случаях первичный очаг может увеличиваться до гигантских размеров за относительно небольшой промежуток времени. При этом, сама опухоль может быть локализованной или распространенной:
Примеры неоперабельного рака
Неоперабельный рак может выявляться в самых разных органах. В качестве примеров можно привести наиболее распространенные локализации:
- Рак желудка. Является одним из самых частых видов неоперабельного рака. Хирургическое лечение провести невозможно в тех случаях, когда имеются отдаленные метастазы, выявляется прорастание опухоли в сосудистые и нервные пучки и соседние органы, или, когда у пациента отмечается выраженное истощение, при котором операция противопоказана.
- Неоперабельный рак головного мозга. Может располагаться в тех участках, куда невозможно сформировать доступ. Операцию не проводят и в тех случаях, когда имеется риск нарушения жизненно важных функций, либо если размеры опухоли очень большие. Не все неоперабельные опухоли головного мозга являются злокачественными. Встречаются и доброкачественные варианты.
- Неоперабельный рак легких. Хирургическое лечение не проводится, если опухоль прорастает в средостение, захватывает крупные сосуды и жизненно важные органы. Противопоказаниями к операции также являются сердечная и легочная недостаточность, которые достаточно часто выявляются у таких пациентов.
- Рак гортани. В отличие от других видов рака, эта локализация может быть неоперабельной даже на ранних стадиях, что связано с особенностями анатомии шеи. Во-первых, гортань располагается в труднодоступном месте для хирурга, а во-вторых, она окружена множеством жизненно важных сосудов, а также большим количеством мышц и нервов.
- Неоперабельный рак молочной железы. Этот вид встречается не так часто, несмотря на высокую распространенность рака молочной железы. Объясняется это тем, что женщины очень хорошо осведомлены о методах самообследования и характерных симптомах болезни. Однако в некоторых случаях все же выявляются запущенные формы, при которых операцию невозможно провести.
Кроме того, неоперабельным может быть рак поджелудочной железы, кишечника, щитовидной железы и других органов. Решение о проведении операции всегда принимается индивидуально, с учетом общего состояния пациента, распространенности и стадии опухолевого процесса.
Лечение неоперабельного рака
Несмотря на невозможность проведения радикального лечения, помочь пациенту можно консервативными методами. Безусловно, они не помогут избавиться от опухоли или существенно улучшить прогноз, однако изменить качество жизни в лучшую сторону и увеличить продолжительность жизни с их помощью можно. Среди консервативных методов терапии рака врачи могут предложить:
- Химиоэмболизацию. Метод предусматривает введение химиопрепаратов непосредственно в сосуды, питающие опухоль. В результате удается замедлить рост опухоли за счет одновременного блокирования кровотока и гибели клеток под действием химиопрепаратов.
- Полихимиотерапия. Часто применяется при распространенном опухолевом процессе. При назначении такого лечения необходимо учитывать общее состояние пациента, ведь химиопрепараты негативно влияют не только на раковые, но и на здоровые клетки организма. Сегодня в арсенале онкологов есть большое разнообразие препаратов для химиотерапии, что позволяет комбинировать их в разных сочетаниях и добиваться желаемого лечебного эффекта.
- Малоинвазивные операции. Применяются при условии, что пациент может перенести такое вмешательство. Малоинвазивные операции позволяют удалить небольшой очаг рака и облегчить симптомы. К таким методам относятся кибер-нож, криодеструкция, электродеструкция, радиочастотная абляция и др.
При неоперабельных формах рака назначается также и паллиативное лечение. Оно направлено на устранение симптомов, улучшение психологического и эмоционального состояния пациентов. В некоторых случаях паллиативное лечение можно проводить в домашних условиях, после получения рекомендаций от врача.
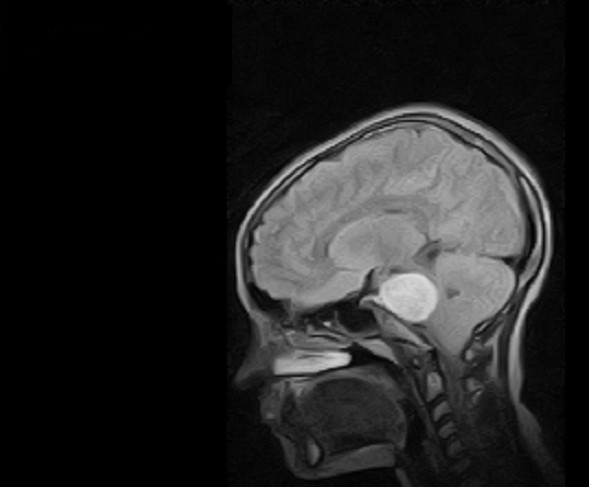
К неоперабельным опухолям головного мозга относят новообразования, удаление которых хирургическим путем связано с угрозой для жизни пациента, высоким риском его инвалидизации или резкого прогрессирования заболевания.
В том числе, такой диагноз может быть поставлен, если:
- опухоль расположена в труднодоступном месте (например, в области турецкого седла) или рядом с жизненно-важными центрами, такими, как сосудодвигательный (отвечает за работу сердца) либо дыхательный;
![]()
Неоперабельная опухоль в стволе головного мозга - в процесс вовлечены крупные сосуды или нервные волокна;
- новообразование имеет диффузное строение (например, фибриллярная астроцитома) и широко распространилось в окружающие ткани;
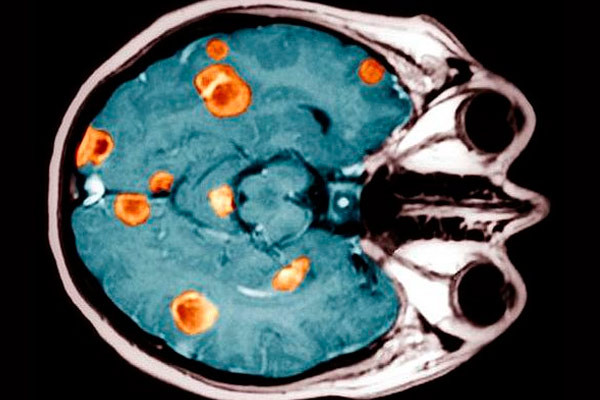
- обнаружен очаг больших размеров (свыше 7 см), удаление которого может спровоцировать появление метастазов или рост более агрессивной опухоли;
![]()
Множественные метастазы в головном мозге - в мозге определяются множественные первичные очаги или первичная опухоль с метастазами, которые после операции начинают усиленно расти и развиваться;
- имеются другие объективные факторы, принимаемые во внимание врачами при выборе тактики лечения.
Причины неэффективности химиотерапевтического и лучевого лечения устаревшими методами
В связи с особой организацией и функциями центральной нервной системы, эффективность облучения опухоли мозга на традиционных радиотерапевтических установках была крайне низкой, равно как и польза от приема химиопрепаратов предыдущего поколения. Происходило это потому, что:
- радиотерапевты не могли использовать достаточно высокие дозы ионизирующего излучения, так как оно разрушало не только опухоль, но и находящиеся на пути потока радиации здоровые ткани мозга;
- в распоряжении химиотерапевтов практически не было лекарств, обладающих способностью проникать через гематоэнцефалический барьер, действовать избирательно и не наносить существенного вреда.
С появлением в арсенале нейроонкологов новых технологий, оборудования и препаратов ситуация кардинальным образом изменилась.
Современные подходы к лечению больных с неоперабельными опухолями головного мозга
Решить проблему с эффективным и безопасным лучевым лечением позволило внедрение в клиническую практику радиохирургических аппаратных комплексов Гамма-нож и Кибер-нож, систем TrueBeam и Triology с инновационными линейными ускорителями, томотерапевтических установок с многолепестковыми коллиматорами, а также открытие центров протонной терапии.
Выбор наиболее подходящего метода, аппарата и схемы лечения определяется с учетом особенностей технологии, опухоли и больного.
- С помощью протонной терапии можно успешно лечить детей и подростков с неоперабельными опухолями мозга. При этом не только сводится к минимуму риск возникновения побочных эффектов непосредственно после процедуры, но и сохраняется возможность дальнейшего нормального развития центральной нервной системы ребенка в отдаленном периоде.
- Новое поколение установок Гамма-нож, таких как последняя модель аппарата производства шведской компании Elekta, позволяет обеспечить оптимальное распределение дозы радиации в тканях опухоли и повысить дозу при необходимости усиления разрушающего действия. При этом жесткое облучение не затрагивает прилегающие здоровые ткани, а также не требуется использование стереотаксической рамки, что повышает комфортность процедуры, расширяет ее возможности и снижает вероятность осложнений.
- С помощью Кибер-ножа специалисты получают возможность облучать более крупные опухоли, чем на гамма-ноже, а также новообразования неправильной формы.
- Установки True-Beam и Triology позволяют разрушать новообразования размером более 6 см.
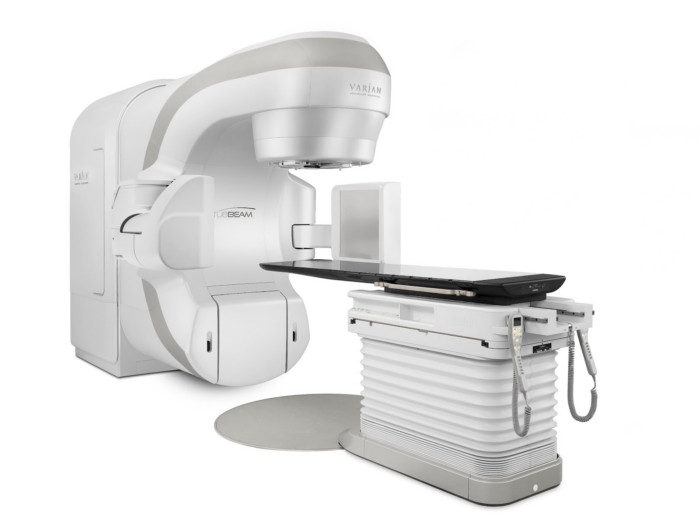
С помощью конформной лучевой терапии на установке TrueBeam STx можно быстро и эффективно разрушать неоперабельные новообразования большого размера и сложной формы
- При использовании метода томотерапии радиотерапветы могут прицельно облучать сразу несколько опухолевых узлов без ущерба для здоровых тканей мозга. Такие возможности не предоставляет ни одна другая технология.
Современные препараты и схемы лечения и щадяще. Это дает возможность свести к минимуму вероятность и тяжесть побочных эффектов химиотерапии. Кроме того, в последнее время были синтезированы лекарства, способные успешно преодолевать гематоэнцефалический барьер.
- В последние годы появилась возможность минимально инвазивной лазерной абляции опухолей головного мозга.
Используемая технология дает надежду значительному числу пациентов с глубокорасположенными/труднодоступными опухолями головного мозга, которым было отказано в оперативном лечении, поскольку оно имело неоправданно высокий риск повреждения жизненно важных отделов головного мозга.
При этом также снижается риск инфицирования, не требуется длительного пребывания в стационаре (1 день по сравнению с 5-10 днями после открытой операции на головном мозге), уменьшается время восстановления, практически не требуется удаления волос и почти не остается рубцов.
Таким образом, сегодня шанс на выход в ремиссию с сохранением качества жизни есть даже в самых тяжелых ситуациях – в том числе и у больных, ранее считавшихся безнадежными.
Немного о терминах и ошибочных выводах
Более того, в ряде случаев доброкачественные узлы могут доставлять не менее серьезные проблемы. Например, если они нарушают кровообращение, сдавливают центры нервной и нейрогуморальной регуляции.
Прогнозы
Эффективность лечения больных с неподлежащими удалению новообразованиями мозга зависит от ряда факторов, среди которых:
- степень злокачественности опухоли и другие особенности заболевания;
- технические возможности оборудования;
- квалификация специалистов – нейроонколога, радиолога, радиохирурга, химиотерапевта;
- общее состояние здоровья и самочувствие пациента;
- соблюдение рекомендаций в отношении дальнейшего образа жизни и графика контрольных профилактических обследований.
Если вам требуется второе мнение для уточнения диагноза или плана лечения, отправьте нам заявку и документы для консультации, или запишитесь на очную консультацию по телефону.

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Лучевая терапия при раке - это метод лечения с использованием ионизирующих излучений. В настоящее время около 2/3 онкологических больных нуждается в этом виде лечения.
Лучевая терапия при раке назначается только при морфологической верификации диагноза, ее можно применять в качестве самостоятельного или комбинированного метода, а также в комплексе с химиотерапевтическими препаратами. В зависимости от стадии опухолевого процесса, радиочувствительности новообразования, общего состояния больного лечение может быть радикальным или паллиативным.

[1], [2], [3], [4], [5], [6], [7], [8]
Код по МКБ-10
К кому обратиться?
Что такое лучевая терапия при раке?
В основе применения ионизирующих излучений для лечения злокачественных новообразований лежит повреждающее действие на клетки и ткани, приводящее к их гибели при получении соответствующих доз.
Радиационная гибель клеток прежде всего связана с поражением ДНК-ядра, дезоксинуклеопротеидов и ДНК-мембранного комплекса, грубыми нарушениями в свойствах белков, цитоплазмы, ферментов. Таким образом, в облученных раковых клетках происходят нарушения во всех звеньях метаболических процессов. Морфологически изменения злокачественных новообразований могут быть представлены тремя последовательными стадиями:
- повреждение новообразования;
- ее разрушение (некроз);
- замещение погибшей ткани.
Гибель опухолевых клеток и их резорбция происходят не сразу. Поэтому эффективность лечения точнее оценивают лишь через некоторый промежуток времени после его завершения.
Радиочувствительность является внутренним свойством злокачественных клеток. Все органы и ткани человека чувствительны к ионизирующему излучению, но чувствительность их неодинакова, она меняется в зависимости от состояния организма и действия внешних факторов. Наиболее чувствительны к облучению кроветворная ткань, железистый аппарат кишечника, эпителий половых желез, кожи и сумки хрусталика глаза. Далее по степени радиочувствительности идут эндотелий, фиброзная ткань, паренхима внутренних органов, хрящевая ткань, мышцы, нервная ткань. Некоторые из новообразований перечислены в порядке снижения радиочувствительности:
- семинома;
- лимфоцитарная лимфома;
- другие лимфомы, лейкоз, миелома;
- некоторые эмбриональные саркомы, мелкоклеточный рак легкого, хориокарцинома;
- саркома Юинга;
- плоскоклеточный рак: высокодифференцированный, средней степени дифференцировки;
- аденокарцинома молочной железы и прямой кишки;
- переходноклеточный рак;
- гепатома;
- меланома;
- глиома, другие саркомы.
Чувствительность любого злокачественного новообразования к излучению зависит от специфических особенностей составляющих ее клеток, а также от радиочувствительности ткани, из которой произошло новообразование. Гистологическое строение является ориентировочным признаком прогнозирования радиочувствительности. На радиочувствительность влияют характер роста, размер и длительность ее существования. Радиочувствительность клеток в разные стадии клеточного цикла неодинакова. Наиболее высокой чувствительностью обладают клетки в фазе митоза. Наибольшей резистентностью - в фазе синтеза. Наиболее радиочувствительные новообразования, которые происходят из ткани, характеризующейся высоким темпом клеточного деления, с низкой степенью дифференцировки клеток, экзофитно растущие и хорошо оксигенированные. Более устойчивы к ионизирующему воздействию высокодифференцированные, крупные, длительно существующие опухоли с большим числом устойчивых к облучению аноксических клеток.
Для определения количества поглощенной энергии введено понятие дозы излучения. Под дозой понимают количество энергии, поглощенной в единице массы облученного вещества. В настоящее время в соответствии с Международной системой единиц (СИ) поглощенная доза измеряется в греях (Гр). Разовая доза - количество энергии, поглощенной за одно облучение. Толерантным (переносимым) уровнем дозы, или толерантной дозой, называют дозу, при которой частота поздних осложнений не превышает 5 %. Толерантная (суммарная) доза зависит от режима облучения и объема облучаемой ткани. Для соединительной ткани это значение принято равным 60 Гр при площади облучения 100 см 2 при облучении ежедневно по 2 Гр. Биологическое действие излучения определяется не только величиной суммарной дозы, но и временем, в течение которого она поглощается.
Как проводится лучевая терапия при раке?
Лучевая терапия при раке подразделяется на две основные группы: методы дистанционного и методы контактного облучения.
- Дистанционная лучевая терапия при раке:
- статическая - открытыми полями, через свинцовую решетку, через свинцовый клиновидный фильтр, через свинцовые экранирующие блоки;
- подвижная - ротационная, маятниковая, тангенциальная, ротационно-конвергентная, ротационная с управляемой скоростью.
- Контактная лучевая терапия при раке:
- внутриполостной;
- внутритканевой;
- радиохирургический;
- аппликационный;
- близкофокусная рентгенотерапия;
- метод избирательного накопления изотопов в тканях.
- Сочетанная лучевая терапия при раке - сочетание одного из способов дистанционного и контактного облучения.
- Комбинированные методы лечения злокачественных новообразований:
- лучевая терапия при раке и хирургическое лечение;
- лучевая терапия при раке и химиотерапия, гормонотерапия.
Лучевая терапия при раке и ее эффективность может быть повышена путем усиления радиопоражаемости опухоли и ослабления реакций нормальных тканей. Различия в радиочувствительности новообразований и нормальных тканей называют радиотерапевтическим интервалом (чем выше терапевтический интервал, тем большая доза излучения может быть подведена к опухоли). Для увеличения последнего существует несколько способов селективного управления тканевой радиочувствительностью.
- Вариации дозы, ритма и времени облучения.
- Использование радиомодифицирующего действия кислорода - путем избирательного повышения радиочувствительности новообразования ее оксигенациеи и путем снижения радиочувствительности нормальных тканей созданием в них кратковременной гипоксии.
- Радиосенсибилизация опухоли с помощью некоторых химиопрепаратов.
Многие противоопухолевые препараты действуют на делящиеся клетки, находящиеся в определенной фазе клеточного цикла. При этом, кроме прямого токсического влияния на ДНК, они замедляют процессы репарации и задерживают прохожде-ние клеткой той или иной фазы. В фазе митоза, наиболее чувствительной к излучению, клетку задерживают винкаалкалоиды и таксаны. Гидроксимочевина тормозит цикл в фазе G1, более чувствительной к этому виду лечения по сравнению с фазой синтеза, 5-фторурацил - в S-фазе. В результате в фазу митоза одновременно приходит большее число клеток, и за счет этого усиливается повреждающее действие радиоактивного излучения. Такие препараты, как платина, при сочетании с ионизирующем воздействием тормозят процессы восстановления повреждений злокачественных клеток.
- Избирательная локальная гипертермия опухоли вызывает нарушение процессов пострадиационного восстановления. Сочетание радиоактивного облучения с гипертермией позволяет улучшить результаты лечения по сравнению с самостоятельным воздействием на новообразование каждого из этих способов. Такое сочетание используют при лечении больных меланомой, раком прямой кишки, молочной железы, опухолями головы и шеи, саркомами костей и мягких тканей.
- Создание кратковременной искусственной гипергликемии. Снижение рН в опухолевых клетках приводит к повышению их радиочувствительности за счет нарушения процессов пострадиационного восстановления в кислой среде. Поэтому гипергликемия обусловливает значительное усиление противоопухолевого действия ионизирующего излучения.
Большую роль в повышении эффективности такого метода лечения, как лучевая терапия при раке играет использование неионизирующих излучений (лазерное излучение, ультразвук, магнитные и электрические поля).
В онкологической практике лучевая терапия при раке используется не только как самостоятельный метод радикального, паллиативного лечения, но и значительно чаще как компонент комбинированного и комплексного лечения (различные комбинации с химио-, иммунотерапией, хирургическим и гормональным лечением).
Самостоятельно и в сочетании с химиотерапией лучевая терапия при раке чаще всего применяется при раке следующих локализаций:
- шейка матки;
- кожа;
- гортань;
- верхние отделы пищевода;
- злокачественные новообразования полости рта и глотки;
- неходжкинские лимфомы и лимфогранулематоз;
- неоперабельный рак легкого;
- саркома Юинга и ретикулосаркома.
В зависимости от последовательности применения ионизирующих излучений и оперативных вмешательств различают пред-, после- и интраоперационные методы лечения.
Предоперационная лучевая терапия при раке
В зависимости от целей, с которыми ее назначают, различают три основные формы:
- облучение операбельных форм злокачественных новообразований;
- облучение неоперабельных или сомнительно операбельных опухолей;
- облучение с отсроченным селективным оперативным вмешательством.
При облучении зон клинического и субклинического распространения опухоли перед оперативным вмешательством прежде всего добиваются летального повреждения наиболее высокозлокачественных пролиферирующих клеток, большая часть которых расположена в хорошо оксигенированных периферических участках новообразования, в зонах ее роста как в первичном очаге, так и метастазах. Летальные и сублетальные повреждения получают и неразмножающиеся комплексы раковых клеток, благодаря чему снижается их способность к приживлению в случае попадания в рану, кровеносные и лимфатические сосуды. Гибель опухолевых клеток в результате ионизирующего воздействия приводит к уменьшению размеров опухоли, отграничению ее от окружающих нормальных тканей за счет разрастания соединительнотканных элементов.
Указанные изменения в опухолях реализуются только при использовании в предоперационном периоде оптимальной очаговой дозы излучения:
- доза должна быть достаточной для того, чтобы вызвать гибель большей части клеток опухоли;
- не должна вызывать заметных изменений в нормальных тканях, приводящих к нарушению процессов заживления послеоперационных ран и увеличению послеоперационной смертности.
В настоящее время наиболее часто используют две методики предоперационного дистанционного облучения:
- ежедневное облучение первичной опухоли и регионарных зон в дозе 2 Гр до суммарной очаговой дозы 40 - 45 Гр в течение 4 - 4,5 недель лечения;
- облучение аналогичных объемов в дозе 4 - 5 Гр в течение 4 - 5 дней до суммарной очаговой дозы 20 - 25 Гр.
В случае применения первой методики операцию обычно выполняют спустя 2 - 3 недели после окончания облучения, а при использовании второй - спустя 1 - 3 дня. Последняя методика может быть рекомендована только для лечения больных с операбельными злокачественными опухолями.
Послеоперационная лучевая терапия при раке
Назначают ее в следующих целях:
Послеоперационная лучевая терапия при раке обычно делается при раке молочной железы, пищевода, щитовидной железы, матки, фаллопиевых труб, вульвы, яичников, почки, мочевого пузыря, кожи и губы, при более распространенных формах рака органов головы и шеи, новообразованиях слюнных желез, раке прямой и толстой кишки, опухолях эндокринных органов. Хотя многие из перечисленных опухолей не являются радиочувствительными, этот вид лечения может уничтожить остатки опухоли после операции. В настоящее время расширяется применение органосохраняющих операций, особенно при раке молочной железы, слюнных желез и прямой кишки, при этом требуется радикальная послеоперационная ионизирующее лечение.
Лечение целесообразно начинать не ранее чем спустя 2 - 3 недели после оперативного вмешательства, т.е. после заживления раны и стихания воспалительных изменений в нормальных тканях.
Для достижения лечебного эффекта необходимо подведение высоких доз - не менее 50 - 60 Гр, а очаговую дозу на область неудаленной опухоли или метастазов целесообразно увеличивать до 65 - 70 Гр.
В послеоперационном периоде необходимо облучать зоны регионарного метастазирования опухоли, в которых не производили оперативное вмешательство (например, надключичные и парастернальные лимфатические узлы при раке молочной железы, подвздошные и парааортальные узлы при раке матки, парааортальные узлы при семиноме яичка). Дозы излучения могут быть в пределах 45 - 50 Гр. Для сохранения нормальных тканей облучение после операции нужно проводить с использованием метода классического фракционирования дозы - 2 Гр в сутки или средними фракциями (3,0 - 3,5 Гр) с добавлением суточной дозы на 2 - 3 фракции с интервалом между ними 4 - 5 часа.
Интраоперационная лучевая терапия при раке
В последние годы вновь повысился интерес к использованию дистанционного мегавольтного и внутритканевого облучения опухоли или ее ложа. Преимущества этого варианта облучения заключаются в возможности визуализации опухоли и поля облучения, удаления из зоны облучения нормальных тканей и реализации особенностей физического распределения быстрых электронов в тканях.
Эта лучевая терапия при раке применяется в следующих целях:
- облучение опухоли перед ее удалением;
- облучение ложа опухоли после радикальной операции или облучения остаточной ткани опухоли после нерадикальной операции;
- облучение нерезектабельной опухоли.
Однократная доза излучения на область ложа опухоли или операционной раны составляет 15 - 20 Гр (доза 13 + 1 Гр эквивалентна дозе 40 Гр, подведенной в режиме 5 раз в неделю по 2 Гр), которая не влияет на течение послеоперационного периода и вызывает гибель большинства субклинических метастазов и радиочувствительных клеток опухоли, которые могут диссеминировать во время операции.
При радикальном лечении основная задача заключается в полном уничтожении опухоли и излечении заболевания. Радикальная лучевая терапия при раке состоит в лечебном ионизирующем воздействии на зону клинического распространения опухоли и профилактическом облучении зон возможного субклинического поражения. Лучевая терапия при раке, проводимая преимущественно с радикальной целью, применяется в следующих случаях:
- рак молочной железы;
- рак полости рта и губы, глотки, гортани;
- рак женских половых органов;
- рак кожи;
- лимфомы;
- первичные опухоли мозга;
- рак предстательной железы;
- нерезектабельные саркомы.
Полное удаление опухоли чаще всего возможно на ранних стадиях заболевания, при небольших размерах опухоли с высокой радиочувствительностью, без метастазов или с единичными метастазами в ближайшие регионарные лимфатические узлы.
Паллиативная лучевая терапия при раке используется для максимального снижения биологической активности, торможения роста, уменьшения размеров опухоли.
Лучевая терапия при раке, проводимая преимущественно с паллиативной целью, применяется в следующих случаях:
- метастазы в кости и головной мозг;
- хроническое кровотечение;
- рак пищевода;
- рак легкого;
- для снижения повышенного внутричерепного давления.
При этом уменьшаются тяжелые клинические симптомы.
- Боль (боли в костях при метастазах рака молочной железы, бронхов или предстательной железы хорошо поддаются коротким курсам).
- Обструкция (при стенозе пищевода, ателектазе легкого или сдавлении верхней полой вены, при раке легкого, сдавлении мочеточника при раке шейки матки или мочевого пузыря паллиативная лучевая терапия часто дает положительный эффект).
- Кровотечение (вызывает большую тревогу и обычно наблюдается при распространенном раке шейки и тела матки, мочевого пузыря, глотки, бронхов и полости рта).
- Изъязвление (лучевая терапия может уменьшить изъязвление на грудной стенке при раке молочной железы, на промежности при раке прямой кишки, устранить неприятный запах и таким образом улучшить качество жизни).
- Патологический перелом (облучение больших очагов в опорных костях как метастатической природы, так и первичных при саркоме Юинга и миеломе может предупредить перелом; при наличии перелома лечению должна предшествовать фиксация пораженной кости).
- Облегчение неврологических нарушений (метастазы рака молочной железы в ретробульбарную клетчатку или сетчатку регрессируют под влиянием этого вида лечения, которая обычно также сохраняет зрение).
- Облегчение системных симптомов (миастения, обусловленная опухолью вилочковой железы, хорошо реагирует на облучение железы).
Когда лучевая терапия при раке противопоказана?
Лучевая терапия при раке не проводится при тяжелом общем состоянии больного, анемии (гемоглобин ниже 40%), лейкопении (менее 3- 109/л), тромбоцитопении (менее 109/л), кахексии, интеркуррентных заболеваниях, сопровождающихся лихорадочным состоянием. Противопоказана лучевая терапия при раке при активном туберкулезе легких, остром инфаркте миокарда, острой и хронической печеночной и почечной недостаточности, беременности, выраженных реакциях. Из-за опасности кровотечения или перфорации этот вид лечения не проводят при распадающихся опухолях; не назначают при множественных метастазах, серозных выпотах в полости и выраженных воспалительных реакциях.
Лучевая терапия при раке может сопровождаться возникновением как вынужденных, неизбежных или допустимых, так и недопустимых неожиданных изменений здоровых органов и тканей. В основе этих изменений лежит повреждение клеток, органов, тканей и систем организма, степень которого в основном зависит от величины дозы.
Повреждения по тяжести течения и времени их купирования подразделяют на реакции и осложнения.
Реакции - изменения, возникающие в органах и тканях в конце курса, проходящие самостоятельно или под влиянием соответствующего лечения. Они могут быть местными и общими.
Осложнения - стойкие, трудно ликвидируемые или остающиеся постоянно нарушения, обусловленные некрозом тканей и замещением их соединительной тканью, самостоятельно не проходят, требуют длительного лечения.
Читайте также: