Неоперабельная опухоль печени лечение

Печень – паренхиматозный орган, наиболее часто поражаемый злокачественными новообразованиями. В структуре злокачественных новообразований печени выделяют две основные формы: первичный рак печени и метастатическое поражение. Метастатический рак печени встречается гораздо чаще первичного [4]. Среди всех первичных злокачественных новообразований печени частота ГЦР достигает 95%. ГЦР является существенной проблемой общественного здравоохранения, занимая 5-е место по распространенности, 3-е по числу летальных исходов среди злокачественных новообразований печени и 1-е место среди причин смерти у больных с циррозом печени [1].
Цирроз печени независимо от этиологии – основной фактор риска развития ГЦР. По статистике, ГЦР возникает у 3–5% больных циррозом печени, причем значительно чаще у мужчин. Нередки случаи гепатоцеллюлярной карциномы при алкогольном циррозе печени, гемохроматозе, аутоиммунном гепатите, наследственной недостаточности α1-антитрипсина, хронической HCV-инфекции, а также при некоторых редких наследственных заболеваниях (наследственная тирозинемия, нарушение обмена гликогена) [3].
Золотым стандартом лечения больных со злокачественными новообразованиями печени являются резекция печени и в более редких случаях трансплантация печени. Однако, к моменту диагностики радикальное удаление опухоли возможно лишь у 5-15 % больных. Вместе с тем, более чем у 70-90% пациентов после радикальной резекции в течение 3-5 лет развивается рецидив заболевания, из них повторную резекцию удается выполнить не более чем у 10% [5].
С целью улучшения отдаленных результатов лечения больных нерезектабельными опухолями печени в клиническую практику были внедрены рентгенэндоваскулярные методики. К ним относятся: химиоинфузия в печеночную артерию, химиоэмболизация и масляная ХЭПА, радиоэмболизация.
Питание опухолей печени на 90-95% осуществляется за счет артериальной крови, в то время как нормальная паренхима имеет двойное кровоснабжение: 70% из воротной вены и лишь 30% из печеночной артерии. Исходя из этого, окклюзия печеночной артерии, кровоснабжающей опухоль, приводит к ишемическому некрозу опухолевых клеток, оставляя сохранными здоровые гепатоциты [5].
ХЭПА микросферами основана на введении в артерии, питающие опухоль, эмболизата, состоящего из микросфер и адсорбированного на них химиопрепарата. Методика обладает следующими достоинствами: селективное воздействие на опухолевую ткань; время элиминации химиопрепарата с поверхности микросфер составляет от 1 недели до 2 месяцев в зависимости от размера микросфер; хемотоксичность практически отсутствует, так как концентрации химиопрепарата в системном кровотоке низкие, поэтому возможно одномоментное введение больших доз химиопрепарата; ишемия опухоли посредством микросфер, при этом можно регулировать ее глубину, подбирая размер микросфер [2].
Предлагаем вниманию читателей описание клинического случая ХЭПА микросферами у пациентки с неоперабельным ГЦР, проведенной в отделении рентгенохирургических методов диагностики и лечения Республиканского кардиологического диспансера г. Чебоксары.
У пациентки Д., 78 лет, в апреле 2017 года на ультразвуковом исследовании органов брюшной полости (УЗИ ОБП) было выявлено очаговое образование печени, с целью дообследования была направлена в Республиканский клинический онкологический диспансер г. Чебоксары.
Из сопутствующих заболеваний: хронический вирусный гепатит С, гипертоническая болезнь 2 ст., атеросклероз аорты, варикозная болезнь нижних конечностей.
Рентгенография легких: рентгенологических признаков онкопатологии легких не обнаружено.
Магнитно-резонансная томография головного мозга: МР-признаки кистозно-глиозных изменений в лобной доле справа. Очаги энцефаломаляции в лобно-теменных отделах с обеих сторон дисциркуляторного характера. Заместительная смешанная гидроцефалия на фоне атрофических изменений вещества головного мозга.
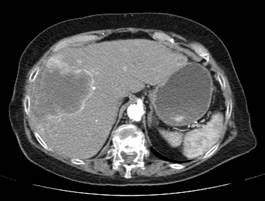
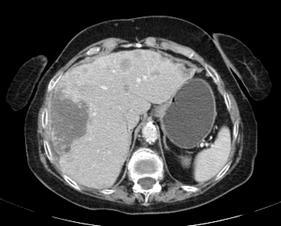
Компьютерная томография органов брюшной полости (КТ ОБП) от 19.08.2017: в правой доли печени определяется большое гиподенсное образование примерными размерами 123х57х95 мм без четких контуров, более четко выявляемое при контрастировании. Здесь же в печени определяется множество образований различных размеров до 24 мм (Рис.1).
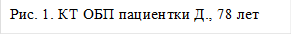
УЗИ ОБП от 18.08.2017: Ультразвуковые признаки незначительного увеличения размеров печени на фоне диффузно-очаговых изменений (образование правой доли печени, множественные метастазы). Диффузные изменения паренхимы поджелудочной железы.
УЗИ щитовидной железы и периферических лимфатических узлов (ЛУ): Признаки очаговых образований обеих долей щитовидной железы. УЗ-патологии периферических ЛУ на момент осмотра не выявлено.
УЗИ органов малого таза: УЗ-образование в проекции левого яичника, свободная жидкость в позадиматочном пространстве.
Эзофагогастродуоденоскопия: Варикозное расширение вен пищевода 1 степени (в виде флебэктазии). Недостаточность кардии 2 степени. Дуодено-гастральный рефлюкс.
Колоноскопия: Дивертикулы сигмовидной кишики.
Эхокардиография: Атеросклеротические изменения стенок аорты с переходом на створки аортального клапана (АоК). Кальциноз АоК степени. Регургитация на АоК 0-1 степени. Увеличение массы миокарда левого желудочка.
Электрокардиография: Синусовый ритм 70 в минуту, нормальное положение электрической оси сердца.
Маммография: Сосудистые кальцинаты обеих молочных желез.
Гистологическое исследование от 21.08.2017: Гистологическая картина наиболее соответствует псевдожелезистому варианту гепатоцеллюлярной карциномы.
Биохимический анализ крови от 15.08.2017: С-реактивный белок – 25 мг/л, аланинаминотрансфераза- 12,5 ЕД/л, аспартатаминотрансфераза – 27,9 ЕД/л, щелочная фосфатаза- 156,6 Ед/л, гаммаглутамилтрансфераза – 88,8 Ед/л, билирубин прямой – 6,2 мкмоль/л, билирубин общий – 17,4 мкмоль/л, альбумин – 42,7 г/л, креатинин – 59,4 мкмоль/л, мочевина – 6,7 ммоль/л, общий белок – 77 г/л, глюкоза – 7,65 ммоль/л.
Онкомаркеры от 15.08.2017: Альфа-фетопротеин - 9,9 Ме/мл. Раковый эмбриональный антиген - 14,63 нг/мл.
Антитела к НCV – положительные, HBsAg – не обнаружены.
После проведенных обследований был выставлен диагноз: ГЦР печени Т3aN0M0, стадия 3а. Пациентка была направлена на оперативное лечение: ХЭПА гепасферами с доксирубицином 50 мг сначала правой, затем левой печеночной артерии.
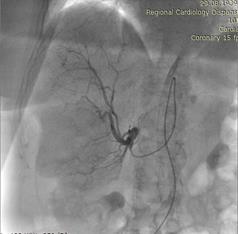
Под местной анестезией выполнена пункция правой бедренной артерии (Рис.2). По Сельдингеру установлен интродьюсер 5 Fr. В устье чревного ствола введен висцеральный диагностический катетер. Выполнена целиакография, анатомия артерий печени типичная. Произведена селективная катетеризация правой печеночной артерии дистальнее устья пузырной артерии (Рис.3). По катетеру проведен микрокатетер с микропроводником. Далее по микрокатетеру произведена химиоэмболизация правой печеночной артерии гепасферами 30-60 мкм насыщенными 50 мг доксирубицина (Рис.4). Проведена контрольная ангиография, признаков непреднамеренной эмболизации других ветвей не выявлено. Наблюдается характерная картина эмболизации сосудистого русла - картина "обгоревшего дерева" (Рис.5).
Через 6 недель выполнена химиоэмболизация левой печеночной артерии аналогичным способом.


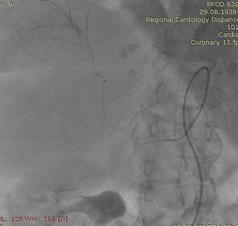
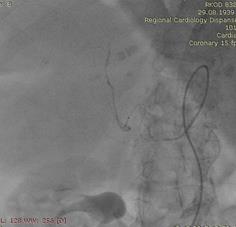

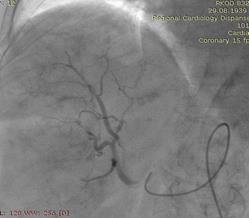

Выполнена контрольная КТ ОБП от 05.12.17: В структуре печени сохраняются множественные диффузные гиподенсные очаги (№15-20), более в правой доле печени – с наличием массивного узла в С5, С6, С8 сегментах размерами 102х70 мм, округлой овальной формы (Рис.6).
Таким образом, ХЭПА микросферами с доксирубицином является эффективным и относительно безопасным методом лечения при нерезектабельных новообразованиях печени. Селективное воздействие химиопрепарата на опухолевые клетки в сочетании с ишемическим эффектом эмболизации афферентных сосудов позволяет замедлить дальнейшее распространение опухолевого процесса и добиться регресса. Кроме того, данный метод лечения улучшает показатели общей выживаемости пациентов, что подтверждается исследованием японских ученых под руководством K. Takayasu et al., по результатам которого однолетняя выживаемость составила 82%, трехлетняя - 47%, пятилетняя – 26% и семилетняя – 16% [6].
Рентгенэндоваскулярная химиоэмболизация артерий печени является методом выбора лечения больных с неоперабельным ГЦР и характеризуется малой инвазивностью, высокой селективностью воздействия и низкой печеночной и системной токсичностью. Данный метод позволяет добиться стабилизации или регресса опухолевого процесса, а также улучшить показатели выживаемости пациентов с нерезектабельным первичным раком печени.
Одним из самых крупных и уникальных органов человека считается печень, представляющая собой массу гепатоцитов (клетки), пронизанных кровеносными синусоидами. Эта железа играет важную роль в пищеварении, обмене веществ, очищении от токсинов. Можно сказать, что она является центральным органом химической поддержки внутренней среды и физиологических функций организма. Поэтому любая патология и, тем более опухоль печени, несут угрозу здоровью или жизни человека.
Основные факты о печени
Орган расположен под диафрагмой справа, окружен брюшиной, покрыт глиссоновой капсулой, которая разветвляется в паренхиме. Разделяется железа на 2 крупные доли. Все процессы обмена веществ происходят только благодаря ферментам, которые синтезируют гепатоциты.
Приток кислорода идет по печеночной артерии, которая питает ткани. Собирает кровь из всего ЖКТ и селезенки воротная вена (портальная). Она имеет обходные протоки и соединяется с кишечными венами. Благодаря этим анастамозам железа играет огромную роль в бесперебойной работе почек, сердца и других жизненно важных органов.

Что такое опухоли печени
Многие новообразования развиваются из одной клетки. Вся остальная масса атипичных единиц является клональной по происхождению. Между началом воздействия неблагоприятного агента и развитием опухоли проходит довольно длительный период. За это время видоизмененные клетки приобретают новую генетическую информацию.
Вирусы или иные канцерогенные факторы увеличивают риск прогрессии патологических процессов. В результате начинается рост трансформированных клеток уже с другой ДНК. Опухоли могут иметь доброкачественный и злокачественный характер. Исходят они из эпителиальной, соединительной и паренхиматозной ткани, протоков или сосудов.
Благодаря портальной вене, печень является излюбленным местом для метастазов из других органов. Часто атипичные клетки попадают из желчного пузыря, кишечника, желудка. Злокачественные образования (код МКБ С 22.0 – С 22.9) встречаются значительно реже, чем доброкачественные опухоли. По статистике, женщины болеют раком печени реже, чем мужчины.
Классификация
Опухоли различны по происхождению и особенностям роста. Чтобы спрогнозировать дальнейшее развитие патологии, подобрать адекватное лечение и вести диспансерное наблюдение за больным, врачу необходимо дифференцировать новообразования. Наиболее приемлема гистологическая классификация ВОЗ раковых опухолей.
В первую группу входят образования из эпителиальной ткани:
- Гепатоцеллюлярные: гепатобластома, печеночно-клеточный рак (карцинома).
- Холангиоцеллюлярные: цистоаденокарцинома, холангиокарцинома.
Ко второй группе относятся мезенхимальные опухоли:
![]()
Из кровеносных сосудов: ангиосаркома, эпителиоидная и неопластическая гемангиоэндотелиома.- Фибросаркома.
- Лейомисаркома.
- Фиброзная гистиоцитома.
- Неходжинская лимфома.
- Недифференцированная эмбриональная саркома.
- Саркома Капоши.
Третью группу представляют смешанные эпителиальные новообразования, а к четвертой относится метастатический рак.
Доброкачественная опухоль печени также классифицируется по происхождению:
- Эпителиальные: аденома, билиарный папиломатоз.
- Мезенхимальные: гемангиома, лимфангиома, фиброма, миксома, ангиомиолипома.
- Опухолевидные образования: кисты непаразитарного генеза, фокальная узелковая гиперплазия, пелиоз.
Причины развития и факторы риска
На развитие новообразований влияют различные патологические факторы. Рост злокачественных опухолей провоцируют химические соединения, среди которых наиболее агрессивными являются:
- красители, которые используют в цветной печати;
- нитриты и нитраты;
- мышьяк, асбест;
- продукты жизнедеятельности плесневых грибов (афлотоксины);
- диоксин.
Причина рака также связана с онкогенной вирусной инфекцией. Гепатиты В, С, Д нередко заканчиваются гепатоцеллюлярной карциномой. Среди факторов риска также выделяют:
- Нарушение питания человека, алкоголизм, белковая недостаточность, дефицит витаминов В.
![]()
Глистные инвазии: описторхоз, шистозомиаз, клонорхоз, эхинококкоз.- Инфекции: малярия, сифилис, туберкулез.
- Возраст старше 40 лет.
Доброкачественные образования часто имеют нейроэндокринную этиологию. Например, у женщин, принимающих эстрогенопрогестативные противозачаточные препараты, риск возникновения аденом или фокальной узловой гиперплазии увеличивается. Реже появляются опухоли на фоне приема анаболиков. Патанатомия поликостоза связана с врожденными аномалиями протоковой системы печени.
Особенности развития опухолей у детей
У ребенка опухоли встречаются относительно редко. У маленьких детей их обнаруживают чаще в правой доле печени. К предрасполагающим факторам относятся:
- врожденные пороки развития;
- гепатит и цирроз новорожденных;
- влияние токсичных веществ во время беременности: алкоголь, соли тяжелых металлов;
- прием будущей мамы препаратов, которые влияют на ферментную активность печени;
- облучение во время беременности.
Обычно развиваются доброкачественные образования из эпителиальной ткани (гемангиома). Протекает заболевание без ярких признаков. Только при крупных или множественных опухолях появляется характерная клиника печеночных патологий:
- гепатомегалия;
- желтуха;
- сосудистый шум;
- боли в животе.
Иногда развивается сосудистая недостаточность. Множественные гемангиомы сочетаются с диффузным неонатальным гемангиоматозом, поражающим мозг, дыхательную и пищеварительную систему. В стадии разрастания опухоль представляет угрозу для жизни новорожденного.

Патологическая анатомия гепатоцеллюлярной карциномы позволяет ее отличить от других новообразований. Ее клетки имеют крупные митохондрии и микроворсинки на плазменной поверхности мембраны. Эта форма рака часто развивается на фоне лимфобластного лейкоза. Прогноз в большинстве случаев неблагоприятный.
Гепатобластомы обнаруживают в грудном возрасте. Такие опухоли возникают в сочетании с врожденным отклонением – синдромом Беквита-Вейдемана или аденоматозным полипозом.
Внимание! В зависимости от стадии, на которой была выявлена патология и общего состояния ребенка, прогноз выживаемости составляет в среднем 50%.
Симптомы и признаки
Симптомы опухолей печени на ранних стадиях практически не проявляются. Компенсаторные возможности организма обуславливают сохранение функций железы. Развиваясь, новообразования маскируются под воспалительные заболевания гепатобилиарной системы. У пациента могут возникать лишь общие признаки: недомогание, повышение температуры, головная боль. В зависимости от качества опухоли и скорости ее роста, со временем присоединяется и характерная симптоматика.
Рак начинается с признаков интоксикации. Больной человек жалуется на снижение аппетита, раздражительность, сонливость, повышенную утомляемость. По мере прогрессирования патологии появляются болевые ощущения справа, увеличение печени, спленомегалия. Анализы крови указывают на снижение уровня глюкозы, гемоглобина и повышение концентрации трансаминаз и билирубина.
Сдавливание воротной вены приводит к портальной гипертензии и развитию асцита. Пациент быстро теряет вес, при этом у него сильно увеличивается живот. На коже брюшной стенки отчетливо прорисовываются вены, на ногах появляются отеки.
Такие признаки обычно говорят о последних стадиях рака, за исключением случаев, когда новообразование расположено возле крупных желчных протоков. К поздним симптомам относятся желтуха, рвота, понос, склонность к кровотечениям, истощение.
Вторично возникают нарушения функций других органов (паранеоплазии). Наиболее часто проявляются кожные изменения: пигментация, сухость, зуд. Иногда еще до диагностирования злокачественной опухоли у больного в области подмышек, внутренней поверхности бедер или на шее возникают черные ороговевающие пятна. Такое заболевание называют сосочковой дистрофией кожи. К другим изменениям относятся гормональные нарушения и энцефалопатия.
Особенности клинической картины доброкачественных опухолей связаны с их медленным ростом. Пациенты долгое время не подозревают о наличии патологии. Проявления болезни становятся заметны при увеличении образований. У человека возникает чувство тяжести справа, отрыжка, метеоризм.
В редких случаях растущая опухоль приводит к асциту. Например, гемангиома может занять всю брюшную полость и полностью заменить ткани железы. Тотальное разрушение паренхимы при некоторых видах новообразований вызывает печеночную недостаточность.
Симптомы гамартомы проявляются потерей аппетита, болью, диспепсическими расстройствами, нарушением дыхания. При фокальной узловой гиперплазии возникают признаки хронического воспаления: периодические ноющие боли и тошнота. Однако в большинстве случаев заболевание протекает бессимптомно.
Диагностические процедуры
При доброкачественных образованиях лабораторные методы исследования общего анализа крови не показывают отклонений. Лишь в некоторых случаях определяется повышенная активность печеночных ферментов. Основным методом диагностики являются:
- УЗИ;
- рентгенологические методы, КТ с контрастным усилением;
- МРТ.
С целью классификации опухоли печени и проведения дифференциальной диагностики назначают дополнительные способы:
![]()
цветное дуплексное сканирование;- исследование желудочно-кишечного тракта;
- ангиография;
- гепатосцинтиграфия;
- лапароскопия с биопсией.
При раке основным биохимическим маркером является высокий уровень щелочной фосфатазы. Компьютерная томография с контрастом позволяет дифференцировать первичную опухоль от метастазов. С помощью биопсии определяют морфологические изменения паренхимы. Точную локализацию очага устанавливают при селективной целиакографии или радиоизотопном сканировании.
На основании данных диагностики врачи делают заключение о возможности удаления новообразования и дальнейшего комбинированного лечения. При операбельности пациента проводят консилиум с хирургами, химиотерапевтами и анестезиологами.
Методы лечения
Лечение опухолей печени зависит от типа и стадии образования. В большинстве случаев необходима хирургическая операция, при которой проводят резекцию пораженных участков. При увеличении образования у новорожденных показана лучевая терапия или назначение глюкокортикостероидов. При раке врач принимает решение об оптимальном способе лечения:
- Радикальный. Полная ликвидация всех очагов первичной гепатоцеллюлярной карциномы.
- Паллиативный. Терапия сводится к задержке роста образования и продлению жизни пациента.
- Симптоматический метод. Не предусматривает противоопухолевого эффекта, поскольку его применяют на поздних стадиях уже ослабленным пациентам.
Сложность хирургического лечения заключается в угрозе кровотечений. Резекцию выполняют в пределах здоровых тканей. Оперативное вмешательство требует применения специальных технических средств, которые позволяют снизить риск послеоперационных осложнений. К таковым относятся:
- ультразвуковой хирургический аспиратор, который снижает кровопотерю во время вмешательства и зону некроза;
- водоструйный скальпель для рассечения паренхимы;
- коагулятор и клеящие препараты для остановки капиллярного кровотечения.

Радикальную операцию проводят только при сохранной функции железы или небольших размерах образования. На ранних стадиях карциномы показана трансплантация печени. Малоинвазивным способом является локальная деструкция, при которой в опухолевый узел вводят препараты, разрушающие очаг (этанол). Применяются также следующие методы:
- Микроволновая коагуляция – локальное воздействие энергией сверхвысоких частот.
- Лазерная деструкция (физическое уничтожение опухоли).
- Чрескожная радиочастотная термоабляция. Электрический ток высокой частоты подается через электрод и вызывает некроз образования. Крупные очаги разрушаются после нескольких сеансов.
- Криохирургия при размерах образования менее 5 см (замораживание жидким азотом). Проведение метода требует оперативного доступа, поэтому есть риск развития осложнений.
Обширные резекции нецелесообразно проводить пациентам с сердечной и почечной недостаточностью и при циррозе. Вторичный рак также не лечится оперативно. Метастазы говорят о неизлечимости болезни. Только если очаг единичный, возможно его удаление при условии тотального устранения первичной опухоли.
Внешнее облучение малоэффективно, но проводится при массивном поражении паренхимы. В этом случае удается несколько снизить болевой синдром. Для доставки радиоизотопов разработан метод внутриартериального пути введения. Это останавливает рост опухоли, но существенного влияния на прогноз не оказывает.
При отсутствии возможности провести операцию или при отказе пациента от хирургического вмешательства назначают химиотерапию. Лечение проводят цитостатиками. В большинстве случаев препараты вводят непосредственно в артерии, которые питают карциному. Метод называют химиоэмболизацией.
Такое введение обеспечивает создание в пораженном участке постоянной и высокой концентрации лекарственного препарата. Одновременно снижается его токсическое влияние на организм. Способ сочетает цитостатическое и ишемическое действие. Эффективность терапии зависит от особенностей кровоснабжения злокачественного очага, времени контакта препарата с атипичными клетками. При частичном или полном некрозе опухоли говорят о положительной динамике.

Препараты, подавляющие рост новообразования, влияют и на здоровые ткани. В связи с этим могут появиться нежелательные реакции: алопеция, тошнота, рвота, понос. У детей часто возникает аллергия, стоматит, воспаление поджелудочной железы. При выраженных побочных действиях химиопрепараты вводить прекращают.
По показаниям также назначают:
Больному обеспечивают полноценное питание. Из народных средств можно принимать витаминные отвары, мочегонные или желчегонные сборы. Все препараты, в том числе и растительного происхождения, прописывает врач. Альтернативные способы терапии онкологических болезней не приводят к выздоровлению.
Прогноз на выздоровление
При доброкачественных опухолях в печени прогноз в основном благоприятный. Но в некоторых случаях новообразование может малигнизироваться. При огромных разрастаниях также есть риск осложнений: разрыв капсулы и кровоизлияние в область брюшины. Такое состояние часто приводит к смерти пациента.

Прогноз также зависит от наличия сопутствующих поражений печени. При циррозе или вирусном гепатите даже после операции средняя выживаемость составляет от 3 до 5 лет. Если пациент обратился за помощью на последней стадии рака, врачи прогнозируют ему жить около 4 месяцев. Больному прописывают только симптоматическое лечение.
Трансплантация печени на первых стадиях карциномы увеличивает шансы на выздоровление до 50%. Однако стоит учитывать, что после операции возможны осложнения:
- невозможность нормализовать функции трансплантата;
- инфекционные поражения в связи с большими дозами иммунодепрессантов;
- отторжение.
Радикальное устранение очагов продлевает жизнь от года до пяти лет. Химиотерапия увеличивает выживаемость при условии, что пациент будет лечиться системно. Крайне редко случаются спонтанные регрессии или ремиссии карциномы.
Профилактические меры
От развития онкологических заболеваний не застрахован никто, но предотвратить их можно, если выполнять несложные рекомендации. Устраняя негативные факторы, человек обеспечивает сохранность здоровья печени:
- Отказаться от вредных привычек, воздерживаться от распития алкогольных напитков.
- Ограничить контакт с вредными химическими веществами и гепатотоксичными лекарственными препаратами.
- Правильно питаться.
- Во время беременности избегать облучения.
- Лечить хронические заболевания органов ЖКТ.
- Проходить ежегодно медицинское обследование.
- Проводить профилактику глистных инвазий.
- Делать прививки от вирусного гепатита В.
К вторичной профилактике рака относится лечение интерферонами. Лекарства назначают пациентам с хроническими гепатитами В, С, Д. Противовирусная терапия снижает риск возникновения опухолей. Выбор препаратов, дозировку и курс лечения определяет гепатолог или инфекционист.
Если печень опухла, что делать в этой ситуации должен решать врач. Рак можно предотвратить или излечить, если вовремя обратиться за квалифицированной помощью. Самолечение приводит к непоправимым последствиям и летальному исходу.

О неоперабельном раке говорят тогда, когда злокачественную опухоль не удается удалить при помощи хирургических методов. Обычно такие ситуации возникают при распространенном процессе на терминальных стадиях. При этом, первичный очаг может быть расположен практически в любом органе. В большинстве случаев рак является неоперабельным при наличии множественных метастазов или при расположении первичной опухоли в тех участках организма, куда невозможно сформировать операционный доступ.
- Статистика
- Как проявляется неоперабельный рак
- Разновидности неоперабельного рака в зависимости от локализации
- Примеры неоперабельного рака
- Лечение неоперабельного рака
Статистика
Несмотря на активное развитие диагностики, неоперабельный рак встречается достаточно часто. Эта особенность может быть связана с несколькими факторами:
- Некоторые виды рака склонны к длительному бессимптомному течению и проявляют себя только на последних стадиях, когда хирургическое лечение провести невозможно.
- Пациенты могут игнорировать характерные признаки рака и обращаются к врачам при серьезном ухудшении здоровья, что связано с прогрессированием и распространением опухолевого процесса.
- Существуют и такие формы рака, которые прогрессируют очень быстро и если лечение не проводится вовремя, то через несколько месяцев опухоль становится неоперабельной.
Рак может быть неоперабельным и по другим причинам, например, когда опухоль захватывает крупные сосуды или жизненно важные органы, либо, когда у пациента имеются противопоказания к операции.
В связи с этими обстоятельствами, в практике любого врача онколога регулярно встречаются неоперабельные виды рака самых различных органов. Традиционно статистика оценивает показатели пятилетней выживаемости и в этих случаях показатели самые неутешительные. Например, пять лет при неоперабельном раке головного мозга переживает лишь 1% пациентов, при раке печени – 6%, при раке матки – 7%, при раке простаты – около 15%.
Такие неутешительные показатели связаны с тем, что эффективное лечение провести невозможно. Существующие консервативные методы позволяют ненадолго продлить жизнь пациента или улучшить ее качество.
Как проявляется неоперабельный рак
Так как неоперабельные формы рака чаще всего встречаются на терминальных стадиях, то симптомы являются выраженными и в значительной степени влияют на состояние пациента. Точные проявления зависят от локализации и распространенности опухолевого процесса, однако можно выделить несколько симптомов, которые встречаются практически у каждого пациента:
- Сильная боль. Она сосредоточена в той области, где расположен первичный очаг рака. Болезненные ощущения не удается устранить при помощи обычных средств, помогают только препараты из группы наркотических анальгетиков.
- Выраженное истощение организма. Большинство пациентов теряют способность к передвижению и самообслуживанию, отмечается сильное снижение массы тела и слабость.
- Потеря аппетита, одышка, тошнота, рвота и другие неспецифические симптомы.
При метастазировании рака клиническая картина дополняется и другими признаками. В зависимости от поражения того или иного органа, среди симптомов могут отмечаться неврологические нарушения, патологические переломы, желтуха, нарушение функции почек и др.
Разновидности неоперабельного рака в зависимости от локализации
Отличительной чертой неоперабельного рака является быстрое увеличение в размерах и распространение на соседние ткани и органы, то есть инвазивный рост. В некоторых случаях первичный очаг может увеличиваться до гигантских размеров за относительно небольшой промежуток времени. При этом, сама опухоль может быть локализованной или распространенной:
Примеры неоперабельного рака
Неоперабельный рак может выявляться в самых разных органах. В качестве примеров можно привести наиболее распространенные локализации:
- Рак желудка. Является одним из самых частых видов неоперабельного рака. Хирургическое лечение провести невозможно в тех случаях, когда имеются отдаленные метастазы, выявляется прорастание опухоли в сосудистые и нервные пучки и соседние органы, или, когда у пациента отмечается выраженное истощение, при котором операция противопоказана.
- Неоперабельный рак головного мозга. Может располагаться в тех участках, куда невозможно сформировать доступ. Операцию не проводят и в тех случаях, когда имеется риск нарушения жизненно важных функций, либо если размеры опухоли очень большие. Не все неоперабельные опухоли головного мозга являются злокачественными. Встречаются и доброкачественные варианты.
- Неоперабельный рак легких. Хирургическое лечение не проводится, если опухоль прорастает в средостение, захватывает крупные сосуды и жизненно важные органы. Противопоказаниями к операции также являются сердечная и легочная недостаточность, которые достаточно часто выявляются у таких пациентов.
- Рак гортани. В отличие от других видов рака, эта локализация может быть неоперабельной даже на ранних стадиях, что связано с особенностями анатомии шеи. Во-первых, гортань располагается в труднодоступном месте для хирурга, а во-вторых, она окружена множеством жизненно важных сосудов, а также большим количеством мышц и нервов.
- Неоперабельный рак молочной железы. Этот вид встречается не так часто, несмотря на высокую распространенность рака молочной железы. Объясняется это тем, что женщины очень хорошо осведомлены о методах самообследования и характерных симптомах болезни. Однако в некоторых случаях все же выявляются запущенные формы, при которых операцию невозможно провести.
Кроме того, неоперабельным может быть рак поджелудочной железы, кишечника, щитовидной железы и других органов. Решение о проведении операции всегда принимается индивидуально, с учетом общего состояния пациента, распространенности и стадии опухолевого процесса.
Лечение неоперабельного рака
Несмотря на невозможность проведения радикального лечения, помочь пациенту можно консервативными методами. Безусловно, они не помогут избавиться от опухоли или существенно улучшить прогноз, однако изменить качество жизни в лучшую сторону и увеличить продолжительность жизни с их помощью можно. Среди консервативных методов терапии рака врачи могут предложить:
- Химиоэмболизацию. Метод предусматривает введение химиопрепаратов непосредственно в сосуды, питающие опухоль. В результате удается замедлить рост опухоли за счет одновременного блокирования кровотока и гибели клеток под действием химиопрепаратов.
- Полихимиотерапия. Часто применяется при распространенном опухолевом процессе. При назначении такого лечения необходимо учитывать общее состояние пациента, ведь химиопрепараты негативно влияют не только на раковые, но и на здоровые клетки организма. Сегодня в арсенале онкологов есть большое разнообразие препаратов для химиотерапии, что позволяет комбинировать их в разных сочетаниях и добиваться желаемого лечебного эффекта.
- Малоинвазивные операции. Применяются при условии, что пациент может перенести такое вмешательство. Малоинвазивные операции позволяют удалить небольшой очаг рака и облегчить симптомы. К таким методам относятся кибер-нож, криодеструкция, электродеструкция, радиочастотная абляция и др.
При неоперабельных формах рака назначается также и паллиативное лечение. Оно направлено на устранение симптомов, улучшение психологического и эмоционального состояния пациентов. В некоторых случаях паллиативное лечение можно проводить в домашних условиях, после получения рекомендаций от врача.
Читайте также:




