Научные статье по лечение рака молочной железы

Рак молочной железы (РМЖ) на протяжении многих лет в структуре онкологической заболеваемости и смертности среди женского населения Российской Федерации продолжает занимать лидирующую позицию [1]. На 2013 год абсолютное число заболевших злокачественными новообразованиями в мире 12,7 млн, и РМЖ занял второе место после рака легкого [2]. С 1980 по 2012 г. абсолютное число заболевших злокачественными новообразованиями на территории Российской Федерации составило 59,5 на 100 тыс. человек [3]. По мнению некоторых ученых, рост заболеваемости РМЖ связан с изменениями факторов репродуктивного риска, увеличением продолжительности жизни, пагубными привычками [4; 5]. В настоящее время диагностика и лечение РМЖ достигли высокого уровня, однако прогрессирование опухолевого процесса и отдаленное метастазирование свидетельствуют о неблагоприятном прогнозе для этих больных. Последние годы ознаменовались появлением новых современных методов, использование которых позволяет осуществлять раннюю диагностику этой патологии. Диагноз метастатического поражения зачастую устанавливается после появления симптоматики и подтверждается с помощью таких современных методов, как мультиспиральная компьютерная томография (МСКТ), магнитно-резонансная томография (МРТ), позитронно-эмиссионная томография (ПЭТ-КТ). Главной причиной летального исхода большинства онкологических больных является развитие рецидива и отдаленных метастазов, ежегодно выявляемых в 30-40% наблюдений, при этом метастатический РМЖ является наиболее частой причиной смертности среди женщин моложе 55 лет [6]. Особенностью РМЖ является достаточно высокий процент гематогенного и лимфогенного метастазирования. Частота метастазирования в значительной степени зависит от особенностей гистологического типа первичной опухоли. Так, частота гематогенного церебрального метастазирования рака молочной железы c гиперэкспрессией HER2/neu достигает 28-43%, при отрицательном статусе стероидных гормонов и без экспрессии белка HER2/neu - 55%, при гормон-позитивном типе опухоли - 11%, а легочные метастазы при РМЖ по частоте возникновения занимают второе место и обнаруживаются в 29,4% наблюдений [2].
Порог двухлетней выживаемости преодолевают лишь 8% больных с церебральными метастазами РМЖ, а пятилетняя выживаемость немногим превышает 2%. Значимую роль в прогнозе выживаемости носит характер метастазирования, определяющий эффективность химиотерапевтического лечения. Однако качество жизни данной категории пациентов в течение всего периода времени в существенной степени зависит от выбранной тактики лечения [7]. Методами локального лечения являются хирургическое удаление метастазов и лучевая терапия, а системным – химиотерапия. На сегодняшний день остается неопределенной роль хирургического компонента в лечении больных РМЖ с внутрилегочными метастазами и метастазами в головной мозг. Наиболее значимыми прогностическими факторами при лечении данной категории больных с использованием хирургического метода являются: количество метастазов, характер оперативного вмешательства, длительность безрецидивного периода, состояние внутригрудных лимфатических узлов и локализация вне жизненно важных зон головного мозга [8]. Целесообразность лечения метастазов РМЖ в головной мозг и легкие не подвергается никакому сомнению, несмотря на его паллиативный характер, так как удается продлить жизнь больных более чем на 6 месяцев [9]. Стандартное лечение метастазов рака молочной железы в головной мозг включает лучевую терапию, неи?рохирургическое лечение, химиотерапию и зависит от гистологического типа первичного источника метастазирования. Появление таких новейших методов лечения, как гамма-нож (облучение четко ограниченным сфокусированным пучком), существенно улучшает прогноз заболевания [10]. В настоящее время чередование различных схем цитотоксической, гормональной, таргетной терапии и применение новых хирургических технологий позволяют добиться улучшения непосредственных и отдаленных результатов лечения и сохранения удовлетворительного качества жизни [11]. Оптимальная продолжительность терапии у больных метастатическим РМЖ с объективными регрессиями или стабилизацией до сегодняшнего дня не определена. Считалось, что поддерживающая пролонгированная терапия может улучшить качество жизни и увеличить время до прогрессирования заболевания, однако не влияет на выживаемость [12].
Концепция неизлечимости метастатического РМЖ в наши дни определяет выбор тактики лечения этого заболевания, главной целью которого являются максимальное продление жизни пациентки и облегчение симптомов болезни.
Представляем клинический случай больной раком молочной железы с метастатическим поражением головного мозга, множественными метастазами обоих легких.
В октябре пациентка А., 46 лет обратилась в поликлинику по месту жительства с жалобами на новообразование в правой молочной железе, обнаруженное самостоятельно. Больная направлена на консультацию к онкологу. При осмотре: молочные железы симметричные; в левой молочной железе фиброзно-кистозные изменения; в верхнем наружном квадранте правой молочной железы по передней аксиллярной линии груднои? клетки определяется округлой формы, плотное, ограниченно смещаемое новообразование диаметром 2 см; симптомы площадки, умбиликации и Ке?нига – отрицательные. Регионарные лимфатические узлы не пальпируются.
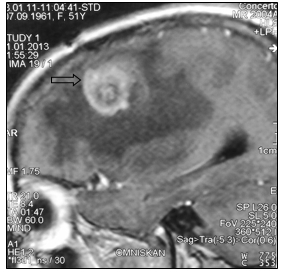
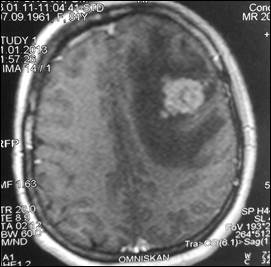
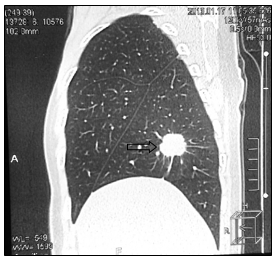
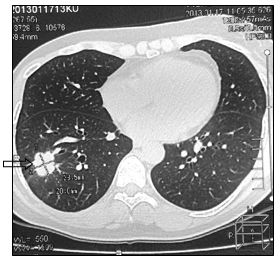
При маммографии молочные железы полусферическои? формы, симметричные. Контуры кожи и соски желез не изменены. Ретромаммарное пространство не затемнено. В верхненаружном квадранте правой молочнои? железы лоцируется округлой формы без четких контуров образование размером 2,0 см - диагностическая категория BI-RADS (Breast Imaging Reporting and Data System): справа – 4; слева – 1. По данным ультразвукового исследования молочных желез, в правой молочнои? железе по переднеи? аксиллярнои? линии в проекции VII межреберья визуализируется очаговое образование сниженнои? эхогенности, неоднороднои? структуры, без четких контуров, с признаками инфильтративного роста, с вертикальнои? ориентациеи? максимальнои? оси размером 19,0х20,0 мм. Кровоток интранодулярныи?, визуализируется единичныи? питающии? сосуд (Ri (resistive index) – 0,63). В правой подмышечной области лоцируется группа измененных лимфатических узлов, максимальным размером 14 мм. При ультразвуковом исследовании органов брюшной полости и малого таза данные о метастазах не выявлены. Выполнена тонкоигольная аспирационная биопсия новообразования правой молочной железы. По данным цитологического исследования – инвазивный рак молочной железы. Установлен диагноз: рак правой молочной железы сT1cN1M0, IIa. Пациентке 1 ноября 2007 г. выполнена радикальная мастэктомия правой молочной железы по Madden с лимфодиссекцией D2. В послеоперационном периоде выполнено иммуногистохимическое исследование. Сформулирован окончательный диагноз: инвазивный дольковый солидно-альвеолярный рак правой молочной железы pT1cN1M0, IIa, умеренной степени злокачественности - 7 баллов, ER- (0), PR- (0), HER2/neu-(3+). Назначено комплексное лечение: системная терапия по схеме FAC 6 курсов (фторурацил 500 мг/м2, доксорубицин 50 мг/м2, циклофосфамид 500 мг/м2 1 раз в 21 день) и курс лучевой гамма-терапии на зоны регионарного метастазирования (СОД 49,5 Гр) и послеоперационный рубец (СОД 50 Гр). С декабря 2007 по январь 2013 года больная находилась под диспансерным динамическим наблюдением у онколога в поликлинике по месту жительства. При проведении очередного контрольного обследования в январе 2013 г. при МРТ головы отмечено прогрессирование заболевания в виде появления единичных метастатических поражений левой лобной доли головного мозга и нижней доли правого легкого (рис. 1, 2).
а
б
Рис. 1. МР-томограммы больной А., 51 год, с метастазом в левую лобную долю (стрелка):
а – сагиттальная плоскость; б – горизонтальная плоскость (объяснение в тексте)
а
б
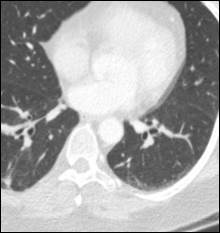
Рис. 2. КТ-картина метастаза в нижнюю долю правого легкого (стрелка):
а – сагиттальная плоскость; б – горизонтальная плоскость (объяснение в тексте)
Консилиумом врачей принято решение об оперативном лечении. 06.02.2013 г. выполнена костно-пластическая трепанация черепа, удаление опухоли левой лобной доли головного мозга. Гистологическое заключение удаленного препарата: метастаз низкодифференцированной аденокарциномы (рис. 3)
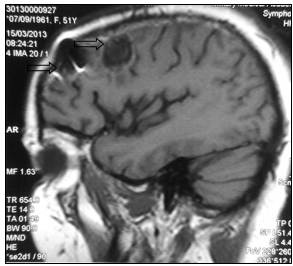
а
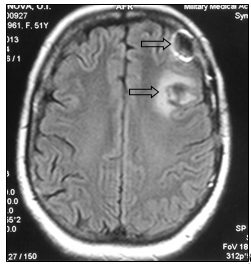
б
Рис. 3. МР-картина послеоперационных отечно-глиозных изменений в левой лобной доле (стрелка): а – сагиттальная плоскость; б – горизонтальная плоскость (объяснение в тексте)
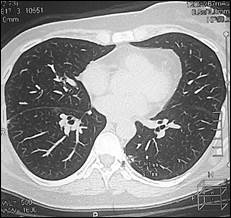
Далее проведена системная химиотерапия доцетакселом (80 мг/м2). На фоне 2 циклов 2 линии в мае 2013 г. установлено прогрессирование заболевания в виде увеличения размеров существующего метастаза в нижней доле правого легкого с 20х24х21 до 22х28х25 мм и появления нового метастаза нижней доли левого легкого 7х11х8 мм (рис. 4).
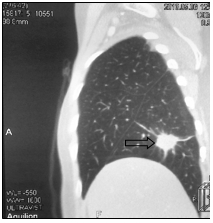
а
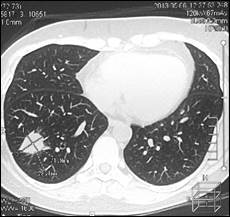
б
в
Рис. 4. Компьютерная томография от 05.06.2013 г., признаки прогрессирования в виде увеличения размеров метастазов в нижней доле правого легкого и нижней доле левого легкого: а – метастаз в нижнюю долю правого легкого (стрелка), сагиттальная плоскость; б – горизонтальная плоскость; в - метастаз в нижнюю долю левого легкого (объяснение в тексте)
В связи с неэффективностью проводимой системной терапии принято решение о назначении 3 линии ПХТ (капецитабин 1250 мг/м2+герцептин 2 мг/кг). На фоне 12 циклов 3 линии химиотерапии достигнута стабилизация процесса. Однако при контрольном обследовании спустя год отмечено прогрессирование в виде увеличения размеров метастазов в нижней доле правого легкого с 22х28 до 32х28 мм и нижней доле левого легкого с 7х11 до 11х11 мм (рис. 5).
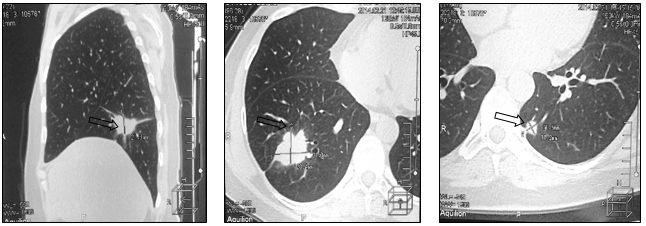
Рис. 5. Компьютерная томография больной А., 52 года, прогрессирование заболевания в виде увеличения размеров опухоли (стрелка): а – метастаз в нижнюю долю правого легкого, сагиттальная плоскость; б – горизонтальная плоскость; в - метастаз в нижнюю долю левого легкого (объяснение в тексте)
В связи с прогрессированием заболевания произведена смена системной химиотерапии на гемцитабин 1250 мг/м2. 4 линия ПХТ позволила стабилизировать онкологический процесс на протяжении 6 месяцев. При контрольном обследовании в июле 2014 г. выявлено новое метастатическое поражение верхней доли левого легкого, размеры других образований не изменились по сравнению с предыдущим исследованием (рис. 6).
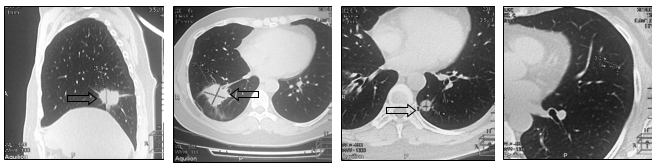
Рис. 6. Компьютерная томография (07.2014 г.), прогрессирование в виде метастатического поражения верхней доли левого легкого, размеры других образований не увеличились (стрелка): а – метастаз в нижнюю долю правого легкого, сагиттальная плоскость;
б – горизонтальная плоскость; в - метастаз в нижнюю долю левого легкого; г – метастаз в верхнюю долю левого легкого (объяснение в тексте)
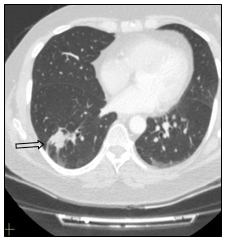
Произведена очередная смена системной химиотерапии. Назначена монохимиотерапия по схеме паклитаксел (260 мг/м2). Проведено 38 циклов с частичным регрессом заболевания - уменьшение размеров метастазов легких. В настоящее время пациентка продолжает получать назначенное лечение. Общая продолжительность жизни составляет 10 лет (рис. 7, 8).
а
б

в
Рис. 7. Компьютерная томография больной А., 55 лет, с метастазами в легкие (стрелка): а – горизонтальная плоскость; б – очаговое уплотнение легочной ткани нижней доли левого легкого; в – уменьшение очагового уплотнения легочной ткани верхней доли левого легкого (объяснение в тексте)
а
б
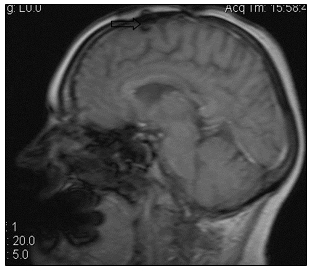
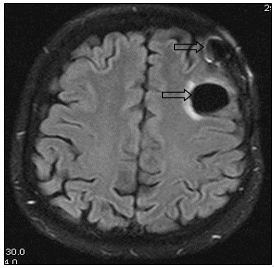
Рис. 8. МР-томограммы больной А., 55 лет, МР-картина послеоперационных кистозно-глиозных изменений в левой лобной доле (стрелка): а – сагиттальная плоскость; б – горизонтальная плоскость (объяснение в тексте)
Метастазирование злокачественных опухолей является одной из важнейших проблем современной онкологии. По данным литературы, пятилетняя выживаемость при метастатическом раке молочной железы составляет 0,6–5%, а десятилетняя 0,3–1,2%. Лекарственное лечение РМЖ является ключевым составляющим комплексной терапии. При раннем операбельном РМЖ применение адъювантной системной терапии позволяет улучшить результаты лечения, повышая при этом общую и безрецидивную выживаемость больных, а при метастатическом РМЖ является основным методом лечения, способствующим добиться выраженного клинического эффекта в виде полной или частичной ремиссии различной продолжительности у 40-70% больных. Но и при достижении полной клинической ремиссии в случае метастатического РМЖ остается риск рецидива заболевания и возникновения лекарственной персистентности. В свою очередь сложность лечения рецидивов и метастазов РМЖ осложняется результатами ранее проведенной терапии, включающей облучение, неоадъювантную и адъювантную терапию, что приводит к развитию резистентности опухолевых клеток к цитостатическим препаратам и к снижению функциональных резервов печени, сердечно-сосудистой системы, костномозгового кроветворения.
Данное наблюдение демонстрирует возможность комплексного лечения инвазивного долькового солидно-альвеолярного рака молочной железы с локализацией метастазов в головной мозг и легкие. В описанном клиническом случае создается одна из наиболее важных и трудных для врача проблема выбора терапии. Следует отметить, что значительным моментом является наличие большого числа противоопухолевых препаратов и различных схем полихимиотерапии, обладающих различной степенью активности.
Сегодня метастатический РМЖ продолжает оставаться неизлечимым заболеванием и рассматривается как хронический процесс, который требует достаточно длительного лечения с периодической сменой одного вида терапии на другой. У части больных появилась возможность увеличения длительности ремиссии, выживаемости и улучшения ее качества посредством комбинации методов противоопухолевого лечения. Характерной чертой современных исследовании? продолжает оставаться стремление к индивидуализации терапии, в истоках которой лежит более глубокое понимание молекулярно-биологических основ канцерогенеза и применение новейших достижении? науки, в том числе нанотехнологии?. Поэтому представляет интерес поиск критериев отбора больных распространенным раком молочной железы, чувствительным к проведению противоопухолевого лечения.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В статье рассматривается проблема мастопатии и риска рака молочной железы (РМЖ) с позиции трех специалистов: акушера-гинеколога, гинеколога-эндокринолога и онколога.
Представлены данные об эпидемиологии мастопатии и РМЖ, популяционные риски развития РМЖ, причины, предрасполагающие к мастопатии, и факторы риска РМЖ. Обсуждаются понятия мастопатии и масталгии. Подробно описаны клиническая симптоматика, методы физикального осмотра пациенток с нераковыми заболеваниями молочных желез (МЖ), включающие пальпацию МЖ и регионарных лимфоузлов. Представлены правила маммологического скрининга, предложенные Международной ассоциацией специалистов репродуктивной медицины. Среди инструментальных методов диагностики используются маммография, УЗИ, пункции узловых образований и подозрительных участков и цитологическое исследование пунктата.
Особое внимание уделено нарушениям гормонального баланса, поскольку МЖ является не только органом-мишенью для большого количества гормонов (в первую очередь половых) и факторов роста, но и местом локального биосинтеза и метаболизма половых гормонов.
В статье объяснена важность морфологического исследования ткани МЖ у женщин с подозрением на РМЖ и приведены примеры гистологических картин предраковых состояний. Описаны механизмы действия патогенетической терапии с приведением в качестве примеров некоторых лекарственных препаратов.
Ключевые слова: мастопатия, рак молочной железы, постменопауза, гиперэстрогенемия, Мамоклам.
Для цитирования: Керчелаева С.Б., Сметник А.А., Беспалов В.Г. Мастопатия и профилактика рака молочной железы как междисциплинарная проблема // РМЖ. 2016. № 15. С. 1018–1025.
Для цитирования: Керчелаева С.Б., Сметник А.А., Беспалов В.Г. Мастопатия и профилактика рака молочной железы как междисциплинарная проблема. РМЖ. Мать и дитя. 2016;15:1018-1025.
Mastopathy and breast cancer prevention as interdisciplinary problem
Kerchelaeva S.B. 1 , Smetnik A.A. 2 , Bespalov V.G. 3
1 Pirogov Russian National Research Medical University, Moscow
2 Scientific Center for Obstetrics, Gynecology and Perinatology named after academician V.I. Kulakov, Moscow
3 Research Institute of Oncology named after N.N. Petrov, St.-Petersburg
The paper addresses the problem of mastopathy and the risk of breast cancer (BC) from the position of three specialists: obstetrician and gynecologist, endocrinologist and oncologist.
The data on mastopathy and BC epidemiology; population risks for BC; causes, predisposing to mastopathy and BC, and risk factors for BA is provided. The concept of mastopathy and mastalgia is discussed. Clinical symptoms, methods of physical examination for non-cancerous (benign) breast conditions , including palpation of breast and regional lymph nodes, are provided. The paper presents breast screening program proposed by International Federation of Fertility Societies. Instrumental diagnostic methods include mammography, ultrasound, puncture of nodules and suspicious sites, punctate cytology.
Special attention is paid to hormonal imbalance, since breast is not just the target organ for a large number of hormones (especially sex hormones) and growth factors, but a local place for sex hormones' biosynthesis and metabolism.
The paper explains the importance of morphological examination of breast tissue in women with suspected BC and gives examples of precancerous conditions' histology. Mechanisms of action of pathogenic therapy are discussed with focus on some drugs.
Key words: mastopathy, breast cancer, postmenopause, hyperestrogenemia, Mamoklam.
For citation: Kerchelaeva S.B., Smetnik A.A., Bespalov V.G. Mastopathy and breast cancer prevention as interdisciplinary problem // RMJ. 2016. № 15. P. 1018–1025.
В статье освещена междисциплинарная проблема мастопатии и профилактики рака молочной железы

Проблема заболеваний молочной железы (МЖ) остается актуальной не только в России, но и во всем мире, поскольку распространенность как доброкачественных, так и злокачественных поражений МЖ растет повсеместно. Частота мастопатии в популяции российских женщин достигает 50–60%. Нельзя недооценивать роль мастопатии в развитии рака молочной железы (РМЖ), хотя в целом она не рассматривается как предрак или стадия онкологического процесса в МЖ, однако многие ее формы существенно повышают риск развития РМЖ. Не вызывает сомнений междисциплинарность мастопатии как проблемы. Так, согласно приказу МЗ РФ № 572н от 2012 г., медицинскую помощь женщинам с целью выявления заболеваний МЖ оказывает врач акушер-гинеколог. Патогенетическое же лечение мастопатии должно быть направлено на нормализацию гормонального баланса в организме женщины, прежде всего баланса половых гормонов, что является сферой интересов эндокринологов. При подозрении на очаговую или злокачественную патологию МЖ необходима консультация онколога-маммолога. Также порой требуется вмешательство других специалистов для коррекции заболеваний, которые повлекли развитие мастопатии, например, заболеваний печени, нервной системы и т. д. Таким образом, одну пациентку могут вести сразу несколько специалистов, взаимодействуя и дискутируя между собой. Поэтому в данной публикации мы обсудим мастопатию с позиции трех экспертов: акушера-гинеколога, гинеколога-эндокринолога и онколога, которые выскажут свои взгляды на патогенез и лечение мастопатии, ее роль в развитии РМЖ и тактику ведения пациенток с данной патологией.
Взаимосвязь этиологии и патогенеза мастопатии и РМЖ
Существует 4 группы доказательств связи мастопатии с РМЖ: 1) у мастопатии и РМЖ общие факторы риска; 2) патогенез мастопатии и РМЖ имеет общие черты, ключевую роль играет относительная или абсолютная хроническая гиперэстрогения; 3) при мастэктомии в связи с РМЖ в тканях МЖ часто обнаруживают морфологические проявления мастопатии и предраковые изменения; 4) у больных РМЖ чаще была предшествующая мастопатия [36].
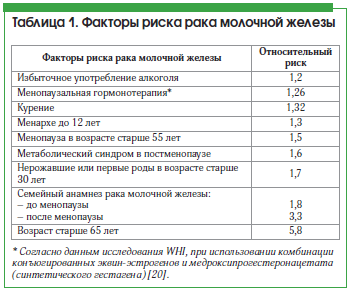
РМЖ – полиэтиологическое заболевание, идентифицировано более 80 факторов риска РМЖ, которые можно разделить на 5 групп: половые и возрастные, генетические, репродуктивные, гормональные и обменные, внешней среды и стиля жизни. Мастопатия – также полиэтиологическое заболевание, а основные факторы риска РМЖ и мастопатии совпадают [37]. Если РМЖ в большинстве случаев развивается в постменопаузальном возрасте, то пик заболеваемости мастопатии приходится на возраст 30–50 лет, т. е. данная патология предшествует развитию РМЖ. Кровные родственники, больные РМЖ; носительство мутантных генов, отвечающих за репарацию ДНК и биосинтез половых гормонов, являются одновременно факторами риска и РМЖ, и мастопатии. Большинство репродуктивных факторов риска одинаковы для РМЖ и мастопатии: раннее менархе, низкая частота родов, поздние первые роды, отсутствие или короткий период грудного вскармливания, искусственные аборты, высокая рентгеновская плотность маммограмм в позднем репродуктивном возрасте. Гормональные и обменные факторы риска в большинстве одинаковы для РМЖ и мастопатии: гиперэстрогения, гиперпролактинемия, гипотиреоз; гиперпластические заболевания гениталий и гинекологические заболевания, связанные с нарушениями гормонального баланса; ожирение, сахарный диабет, болезни печени. Из факторов внешней среды и стиля жизни одинаковы для РМЖ и мастопатии нарушения питания в виде избытка жиров, калорий, животных белков, алкоголя, недостатка овощей и фруктов, пищевых волокон, витаминов и минералов; депрессия, нарушения сна, работа в ночные смены; сниженная физическая активность.
Мастопатию можно считать биомаркером гормонального неблагополучия на уровне организма и локального неблагополучия в ткани МЖ. Множественные факторы риска нарушают гормональный баланс в организме женщины, вызывают гиперэстрогению и гиперпролиферацию эпителия в ткани МЖ, что приводит к развитию мастопатии, а при наличии врожденных или приобретенных повреждений генов – РМЖ.
Риск РМЖ у больных мастопатией
Мастопатия является и самостоятельным фактором риска РМЖ. В эпидемиологических когортных исследованиях при сроках наблюдения за женщинами от 6 до 20 лет установлено, что относительный риск РМЖ (в сравнении с частотой РМЖ в общей популяции, с женщинами без мастопатии, с непролиферативной мастопатией) при мастопатии без пролиферации эпителия статистически недостоверно, но в некоторых исследованиях и статистически достоверно, повышается в 1,27–2,23 раза; при мастопатии с гиперплазией без атипии достоверно повышается в 1,53–3,58 раза; при мастопатии с атипичной гиперплазией достоверно повышается в 2,03–10,35 раза [38]. Dyrstad S.W. et al. провели метаанализ 32 эпидемиологических ретроспективных и проспективных исследований о связи мастопатии с риском РМЖ; относительный риск РМЖ при непролиферативных формах мастопатии статистически недостоверно повышался до 1,17, при пролиферативных формах без атипии – достоверно повышался до 1,76, при пролиферативных формах с атипией – до 3,93 [39].
К предраковым изменениям МЖ относят протоковую атипичную гиперплазию и карциному in situ, дольковую атипичную гиперплазию и карциному in situ, склерозирующий аденоз, радиальный рубец [40]. Основные формы предрака МЖ приведены на рисунке 1.
В таблице 2 указывается степень риска РМЖ при мастопатии по данным R.J. Santen и R. Mansel [40].

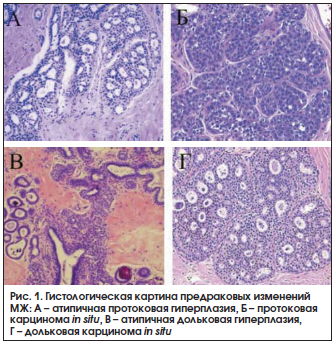
Коллегия американских патологов рекомендовала подразделять женщин с мастопатией на 3 категории в зависимости от выявленных при биопсии МЖ морфологических изменений: 1) непролиферативная – риск РМЖ не повышен и равен популяционному; 2) пролиферативная без атипии – риск РМЖ повышен в 1,5–2 раза по сравнению с популяцией; 3) пролиферативная с атипией – риск РМЖ повышен в 4–5 раз по сравнению с популяцией [41]. При биопсии МЖ и морфологическом обследовании примерно у 5% женщин с мастопатией выявляется атипическая гиперплазия [42].
Лечение мастопатии и профилактика РМЖ
Стандартов лечения мастопатии на сегодняшний день нет. К общим недостаткам большинства применяемых сегодня средств можно отнести невысокую эффективность, побочное и токсическое действие, необходимость применения в виде комплекса с другими средствами, нацеленность только на облегчение патологической симптоматики, а не на более серьезную задачу – профилактику РМЖ. Поэтому актуальной является проблема создания специальных лекарственных средств для лечения мастопатии. С учетом характера данной патологии такие средства должны быть эффективными, безопасными, пригодными для длительного применения, направленными на профилактику РМЖ. Патогенетическое лечение мастопатии относят к первичной и вторичной профилактике РМЖ [43, 44].
В настоящее время для патогенетического лечения мастопатии существуют лишь единичные препараты. Например, лекарственный препарат Мамоклам, который производят из липидной фракции бурой морской водоросли Laminaria; действующими веществами Мамоклама являются органический йод, полиненасыщенные жирные кислоты омега-3 типа, хлорофилл. Мамоклам разрешен для медицинского применения в качестве лекарственного средства для лечения мастопатии. В эпидемиологических исследованиях показано, что все 3 действующих вещества Мамоклама снижают риск развития РМЖ. В клинических исследованиях доказано, что Мамоклам вызывает регрессию масталгии, ослабляет предменструальное нагрубание МЖ, вызывает регрессию уплотнений и кист в МЖ, снижает маммографическую плотность, нормализует процессы пролиферации эпителия МЖ, нормализует менструальный цикл и баланс тиреоидных и половых гормонов [45–47].
Патогенетическое лечение мастопатии должно быть направлено на нормализацию гормонального баланса в организме женщины, прежде всего баланса половых гормонов; на уменьшение гиперэстрогении как на системном уровне, так и на уровне рецепторного аппарата клеток в ткани МЖ; на подавление процессов гиперпролиферации железистого эпителия МЖ. Основным действующим веществом Мамоклама является йод в органически связанной форме (в составе аминокислот). При поступлении в организм в дозах, превышающих суточную потребность, йод накапливается в тканях МЖ и оказывает прямое действие на патогенетические пути развития мастопатии: подавляет пролиферацию эпителия, индуцирует апоптоз и дифференцировку клеток, снижает чувствительность ткани МЖ к эстрогенам; в щитовидной железе формируются йодолипиды, которые оказывают антиоксидантное действие и контролируют клеточную пролиферацию в МЖ; йод также опосредованно влияет на состояние МЖ, нормализуя баланс тиреоидных и половых гормонов, уменьшая местную гиперэстрогению в тканях МЖ [48–50]. Показано, что при лечении мастопатии йодом в дозах, превышающих суточную потребность, нормализуется архитектоника тканей МЖ [51]. Длительный прием йода в дозах, превышающих суточную потребность, возможен только для органического йода, который содержится в Мамокламе. Другой компонент Мамоклама – полиненасыщенные жирные кислоты омега-3 типа также влияют на патогенетические пути развития мастопатии: формируют структуру и определяют вязкость клеточных мембран, регулируют клеточные сигналы, нормализуют баланс эстрогенов, в результате чего уменьшают гиперэстрогению и ослабляют пролиферацию клеток в ткани МЖ [52].
Выводы
1. К группе повышенного онкологического риска женщины, страдающие мастопатией, могут быть отнесены после оценки всех индивидуальных факторов риска и морфологического анализа тканей МЖ.
2. Решающим в оценке степени риска развития РМЖ у больных мастопатией является морфологическое исследование ткани МЖ, полученной при биопсии. Риск РМЖ не повышается или является минимальным при непролиферативных формах мастопатии, при пролиферативной форме без атипии риск возрастает в 2 раза, при пролиферативной с атипией – в 4 раза и достигает наиболее высоких цифр (до 12 раз) при протоковой или дольковой карциноме in situ.
3. Своевременная диагностика и патогенетическое лечение мастопатии не только улучшают качество жизни, но и должны быть направлены на профилактику РМЖ. Мамоклам – эффективный и безопасный лекарственный препарат для патогенетического лечения мастопатии, при длительном применении Мамоклам снижает риск РМЖ.
Читайте также:

