Мультидисциплинарный подход в лечении больных раком прямой кишки
В НИИ онкологии им. Н.Н. Петрова выбор тактики лечения больных раком прямой кишки осуществляется мультидисциплинарной командой в составе хирурга-проктолога, патоморфолога, специалиста лучевой диагностики, радиолога и клинического онколога.
Хирургическое отделение абдоминальной онкологии НИИ онкологии им. Н.Н. Петрова тесно взаимодействует с другими подразделениями института. В лечении больных колоректальным раком широко используются комбинированные и комплексные методы лечения.
В России растет заболеваемость колоректальным раком. Специалисты НИИ онкологии видят возможности улучшения результатов лечения данной категории больных в повсеместном внедрении и стандартизации мультидисциплинарного подхода.
5-летняя выживаемость больных раком прямой кишки колеблется от 30% в развивающихся до 66% в развитых странах. Скорее всего такая существенная разница в результатах лечения больных обусловлена именно наличием или отсутствием мультидисциплинарной программы лечения. В частности, в Великобритании после разработки и внедрения клинических рекомендаций ассоциации колопроктологов удалось повысить общую выживаемость с 27 до 55%.
Общепризнанным стандартом хирургического лечения больных раком прямой кишки является методика TME (Total mesorectal excision), то есть полное удаление опухоли с резекцией прямой кишки вместе с окружающей клетчаткой, содержащей лимфатические узлы.
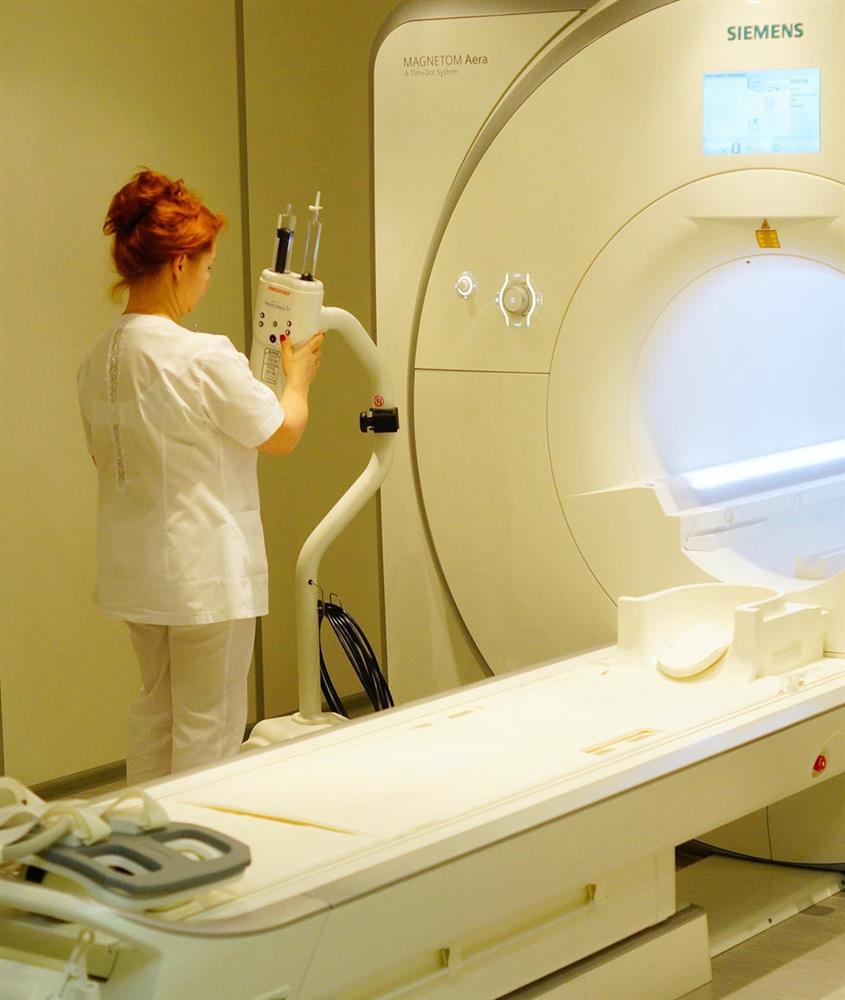
У пациентов с II и III стадией заболевания результаты хирургического лечения в значительной степени неоднородны. Существенно ухудшают прогноз наличие метастазов в лимфатических узлах, инвазия опухоли в жировую клетчатку и др. В этих случаях необходимо применение дополнительных способов воздействия на опухоль.
Требуются точные диагностические методы оценки состояния лимфоузлов и степени распространения опухоли. Выбор тактики лечения рака прямой кишки основывается на данных магнитно-резонансной томографии и ТРУЗИ. Очевидно, что в мультидицсциплинарной команде по лечению рака прямой кишки необходим специалист лучевой диагностики.
История лучевого лечения рака прямой кишки началась еще в начале XX века. Но до сих пор нет однозначного ответа на вопрос о том, когда нужно проводить лучевую терапию.
Предоперационная радиотерапия:
- снижает вероятность рецидивов более эффективно, чем послеоперационная
- увеличивает риск послеоперационных осложнений.
- ее применение требует надежных методов диагностики и правильного клинического стадирования заболевания, что возможно только в крупных современных онкоцентрах.
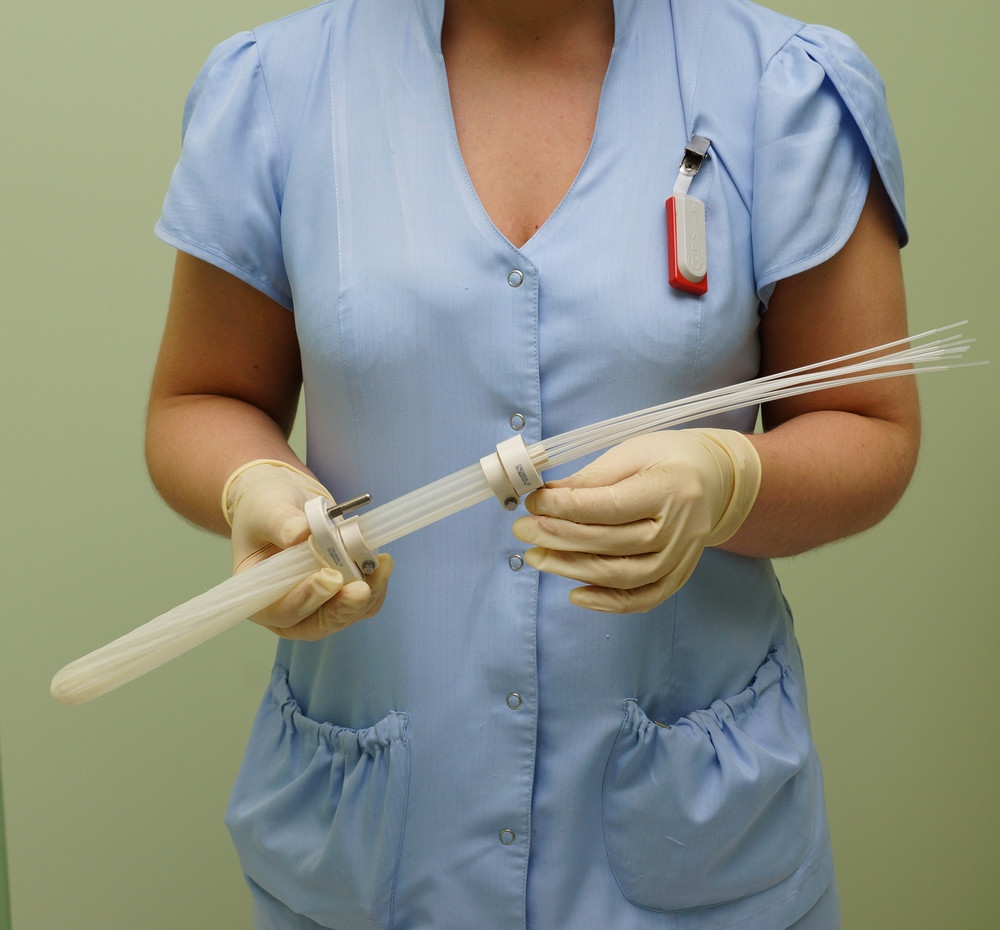
Существуют две основные методики предоперационной радиотерапии рака прямой кишки: концентрированная лучевая терапия, которая проводится в течение 5 дней крупными фракциями ежедневно и пролонгированный курс меньшими дозами в течение 22 - 24 дней.
Послеоперационная радиотерапия:
- проводится на основании гистологии, то есть по более объективным показаниям
- снижает вероятность хирургических осложнений
- недостатком считается необходимость подведения более высоких доз
Интраоперационная лучевая терапия - методика, основанная на облучении ложа опухоли во время хирургической операции. В этом случае можно подвести к опухоли высокие дозы более результативно, чем при дистанционной лучевой терапии.
Внедрение неоадьювантной химиолучевой терапии позволило значительно снизить частоту рецидивов, повысило общую и безрецидивную выживаемость больных.
Химиотерапия позволяет добиться значительного регресса у большинства больных раком прямой кишки, ее применение дает значительное уменьшение размеров опухоли, а в некоторых случаях достигается ее полное исчезновение.
Большие успехи достигнуты в химиолучевом лечении аденокарцином прямой кишки: в 20 -25% наблюдается полное исчезновение опухоли. Это позволяет в некоторых случаях обойтись без хирургического вмешательства вообще, либо выполнить щадящую, органосохранную операцию.
Развитие хирургии рака прямой кишки в отношении улучшения отдаленных результатов лечения достигло предельного уровня. Дальнейшее совершенствование хирургических методик в основном направлено на улучшение качества жизни больных и минимизацию травмы.
В крупных онкологических центрах вопросы стратегии и тактики лечения решаются индивидуально для каждого пациента мультидисциплинарной командой специалистов. Комплекс мер дает возможность уменьшить объем предполагаемой операции, либо вообще избежать ее.
Полный текст:
- Аннотация
- Об авторе
- Список литературы
- Cited By
Краеугольным камнем в выборе лечебной тактики следует считать отношение опухоли к собственной фасции прямой кишки. Даже применяя современные хирургические методики, большинство опухолей прямой кишки ниже переходной складки брюшины следовало бы лечить используя предоперационную лучевую терапию. Предоперационная лучевая (х/л) терапия позволяет уменьшить частоту местных рецидивов и создать условия для увеличения числа сфинктеросохранающих операций. Степень регресса опухоли после химиолучевой терапии напрямую коррелирует с выживаемостью и частотой местных рецидивов. Регресс опухоли создает предпосылки для избавления больного с опухолью прямой кишки от послеоперационных осложнений и летальности, связанных с выполнением обширных радикальных операций. Использование стандартизированных систем для оценки степени регресса опухоли может предоставить ценную информацию центрам, специлизирующимся на лечении больных с данной патологией. МРТ малого таза является весьма эффективным инструментом в первичной оценке степени местнорегионарного распространения рака прямой кишки, включая отношение к мезоректальной фасции. Сложности в прогнозировании полного патологического регресса опухоли с помощью МРТ связаны, прежде всего, с проблемой дифференциальной диагностики между постлучевыми и опухолевыми изменениями кишечной стенки и окружающих тканей. Мультидисциплинарный подход обеспечивает точность стадирования и способствует выработке оптимальной лечебной тактики у больных раком прямой кишки.
Правосудов Игорь Витальевич – ФГБУ НИИ онкологии им. Н.Н. Петрова Минздрава РФ, Санкт Петербург, pravosudov@rambler.ru, тел.: +7 (921) 957-80-52
1. Злокачественные новообразования в России в 2004 году (заболеваемость и смертность) / под ред. В. И. Чиссова, В. В. Старинского. – М.: Антиф, 2005. – 258 с.
2. Sauer R., Becker H., Hohenberger W. et al. Preoperative versus postoperative chemoradiotherapy for rectal cancer. N Engl J Med 2004; 351 (17): 1731–1740.
3. Vauthey J. N., Marsh R. W., Zlotecki R. A. et al. Recent advances in the treatment and outcome of locally advanced rectal cancer. Ann Surg 1999; 229 (5): 745–754.
4. Kapiteijn E., Marijnen C. A.M., Nastegaal I. D. et al. Preoperative radiotherapy combined with total mesorectal excision for resectabl rectal cancer. N Engl Med 2001; 345: 638–646.
5. Perez R. O., Habr-Gama A., Proscurshim I. et al. Local excision for ypT2 rectal cancer-much ado something. J Gastrointest Surg 2007; 11: 1431–1440.
6. Chan A. K., Wong A., Jenken D., et al. Posttreatment TNM staging is a prognostic indicator of survival and recurrence in tethered or fixed rectal carcinoma after preoperative chemotherapy and radiotherapy. Int J Radiat Oncol Biol Phys 2005; 61: 665–677.
7. Kim D. W., Kim D. Y., Kim T. H., et al. Is T classification still correlated with lymph node status after preoperative chemoradiotherapy for rectal cancer? Cancer 2006; 106: 1694–1700.
8. Stipa F., Chessin D. B., Shia J., et al. A pathologic complete response of rectal cancer to preoperative combined-modality therapy results in improved oncological outcome compared with those who achieve no downstaging on the basis of preoperative endorectal ultrasonography. Ann Surg Oncol 2006; 13: 1047–1053.
9. Quirke P., Dixon M. F. The prediction of local recurrence in rectal adenocarcinoma by histopathological examination. Int J Colorectal Dis 1988; 3 (2): 127–131.
10. Wittekind Ch., Compton C., Quirke P. et al. A uniform residual tumour classification. Integration of the R classification and the circumferential margin status. Cancer 2009; 115: 3483–3488.
11. Capirci C., Valentini V., Cionini L. et al. Prognostic value of pathologic complete response after neoadjuvant therapy in locally advanced rectal cancer: long-term analysis of 566 ypCR patients. Int J Radiat Oncol Biol Phys 2008; 72 (1): 99–107.
12. Rоdel C., Martus P., Papadoupolos T. et al. Prognostic significance of tumor regression after preoperative radiotherapy for rectal cancer. J Clin Oncol 2005; 23 (34): 8688–8696.
13. Chen C. C., Lee R. C., Lin J. K. et al. How accurate is magnetic resonance imaging in restaging rectal cancer in patients receiving preoperative combined chemoradiotherapy? Dis colon rectum 2005; 48 (4): 722–728.
14. MERCURY study group. Diagnostic accuracy of preoperative magnetic resonance imaging in predicting curative resection of rectal cancer: prospective observational study. B.M.J. 2006; 333 (7572): 779–784.
15. Smith N. J., Barbahano Y., Norman A. R. et al. Prognostic significance of magnetic resonance imaging-detected extramural vascular invasion in rectal cancer. Br. J. Surg. 2007; 95 (2): 229–236.
16. Eisenhauer E. A. et al. New response evalution criteria in solid tumors: revised RECIST guideline (version 1.1). Eur. J. Cancer 2009; 45 (2): 228–47.
17. Blomqvist L., Machado M., Rubio C. et al. Rectal tumour staging: MR imaging using pelvic phased-array and endorectal coils-vs endoscopic ultrasonography // Eur. Radiol. – 2000. – Vol. 10, № 4. – P. 653–660.
18. Habr-Gama A., Perez R. O., Nadalin W. et al. Operative versus nonoperative treatment for stage 0 distal rectal cancer following chemoradiation therapy: long-term results. Ann.Surg. 2004; 240: 711–717.
19. Правосудов И. В., Алиев И. И., Шулепов А. В. с соавт. Мультидисциплинарный подход к лечению больных раком прямой кишки: оценка клинического и патологического ответа у больных, получавших предоперационную химиолучевую терапию. Онкологическая колопроктология 2012; № 1: 7–11.
20. Fuchsjager M. H., Maier A. G., Schima W. et al. Comparison of transrectal sonography and double – contrast MR imaging when staging rectal cancer. Am. J. Roentgenol. 2003; 181 (2): 421–427.
21. Theodoropoulos G., Wise W. E., Padmanabhan A. et. al. T-level downstaging and complete pathologic response after preoperative chemoradiation for advanced rectal cancer results in decreased recurrence and improved disease-free survival. Dis. Colon Rectum 2002; 45: 895–903.
22. Garcia-Aguilar J. Hernandez de Anda E., Sirivongs P. et al. A pathologic complete response to preoperative chemoradiation is associated with lower local recurrence and improved survival in rectal cancer patients treated by mesorectal excision. Dis. Colon Rectum 2003; 46: 298–304.
23. Crane C. H. Skibber J. M. Birnbaum E. H., et al. The addition of continuous infusion 5-FU to preoperative radiation therapy increases tumour response, leading to increased sphincter preservation in locally advanced low rectal cancer. Int.J.Radiat. Oncology Biol. Phys. 2003; 57: 84–9.
24. Guillem J. G. Chessin D. B. Shia J. et al. Clinical examination following preoperative chemoradiation for rectal cancer is not a reliable surrogate endpoint. J. Clin. Oncol. 2005; 23: 3475–9.
25. Hoffmann K. T., Rau B., Wust P. et al. Restaging of locally advanced carcinoma of the rectum with MR imaging after preoperative radio-chemotherapy plus regional hyperthermia. Strahlenther Oncol. 2002; 178 (7): 386–392.
26. Maier A. G., Barton P. P., Neuhold N. R. et al. Peritumoral tissue reaction at transrectal US as a possible cause of overstaging in rectal cancer: histopathologic correlation. Radiology 1997; 203 (3): 785–789.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Международное медицинское сообщество в марте традиционно стремится привлечь внимание к росту заболеваемости раком ободочной и прямой кишки и повысить осведомленность людей о проблеме. Это важно потому, что вовремя выявленный колоректальный рак излечим. При постановке диагноза на ранней стадии 9 из 10 пациентов могут быть спасены.

- Алексей Викторович, кто и почему заболевает колоректальным раком?
- Этимология данного вида рака, как и многих других онкозаболеваний, до сих пор неясна. Есть предрасполагающие факторы, или факторы риска. Это прежде всего наличие в анамнезе пациента доброкачественного образования толстой кишки (есть такое понятие, как трансформация или перерождение доброкачественного образования в злокачественное). В зоне риска также пациенты с язвенным колитом и болезнью Крона. Чаще других подвержены заболеванию и те, у кого в анамнезе у родственников есть подобные новообразования. Существует фактор генетической предрасположенности, виды наследственного колоректального рака - это семейный аденоматоз толстой кишки и синдром Линча. Эти заболевания передаются по наследству от родителей детям, и пациенты составляют особую группу, поскольку заболевание развивается у них еще в подростковом и даже детском возрасте. В меньшей мере, но тоже играют роль экологические факторы, факторы питания. По данным мультицентрового исследования, проведенного в США, доказано, что курение - один из предрасполагающих факторов к развитию не только рака легких и желудка, но и кишечника.
Основную группу наших пациентов составляют граждане от 60 лет и старше, еще недавно на них приходилось до 95% случаев заболеваний. Но сейчас колоректальный рак стал молодеть, это тренд последнего десятилетия, появляются пациенты от 40 до 50 лет, их где-то 10%.
- Как проявляется заболевание и как ставится диагноз?
- Ранних клинических проявлений колоректальный рак практически не имеет, чем он и коварен, чем и обусловлена его поздняя диагностика. Начальные проявления заболевания дают о себя знать чаще всего болью в животе, появлением крови в кале, отмечается чередование поносов и запоров. На поздних стадиях появляются анемия, потеря массы тела. Онконастороженность у наших пациентов немного притуплена, из-за чего болезнь часто выявляется на 3-й и 4-й стадиях, когда уже проявляются первые симптомы. Поздние симптомы – это кишечная непроходимость, сопровождающаяся отсутствием самостоятельного стула, выраженным дефицитом веса, кахексией.
В диагностике колоректального рака золотым стандартом признана колоноскопия - эндоскопическое исследование толстой кишки и терминального отдела подвздошной кишки при помощи специального гибкого эндоскопа. Только она дает возможность при малейших подозрениях взять у пациента биопсию для верификации выявленных образований. А вспомогательными методами могут быть компьютерная и магнитнорезонансная томография, ирригоскопия и ультразвуковое исследование. В качестве скрининга может использоваться исследование кала на скрытую кровь. Есть еще онкомаркеры - раково-эмбриональный антиген (РЭА) и СА19.9. Но они не всегда коррелируют с наличием опухоли, то есть могут давать как ложноотрицательные, так и ложноположительные результаты. Поэтому онкомаркеры обычно используются для диагностики возможного рецидива у пациентов, которым уже был установлен диагноз и проведено комплексное лечение.
- Каковы показатели смертности и выживаемости от колоректального рака?
- Если лечение включено на ранней стадии, то полное излечение достигается в 97-99% случаев, если больной обращается на 2-й стадии, то в 90-95%. На 3-й стадии результат будет значительно хуже: в зависимости от вида опухоли и ее гистологического строения – около 60-70%, и уже высока частота рецидивов заболевания. При 4-й стадии прогноз еще хуже, выживаемость невысокая и зависит от количества метастазов, характера течения заболевания, характера опухоли.
В нашей стране годичная летальность от колоректального рака все еще высока - в некоторых субъектах достигает 60-65%. И смертность от заболевания высока. Если в год у нас регистрируется около 60 тыс. случаев, то и смертность составляет где-то 50-60 тыс. случаев. Но это не годичная летальность. Половину составляют люди, которым поставили диагноз меньше года назад, а вторая половина - это те, у кого рецидивы возникли на поздних стадиях, они прожили больше года, но все равно пополнили этот список.
- Как лечат этих больных? Какие новые методики применяются?
- Лечение колоректального рака прежде всего хирургическое. Хирургический этап лечения может выполняться врачами-онкологами или колопроктологами. Есть комплексное лечение, включающее предоперационную лучевую терапию, которая особенно актуальна при лечении рака прямой кишки. Есть и комплексная дооперационная и послеоперационная химиотерапия. Дооперационная используется для уменьшения объемов самой опухоли или метастазов. Чаще всего опухоль метастазирует в печень и легкие, и химиотерапия позволяет уменьшить размеры поражения этих органов и открывает возможность радикального удаления метастазов. Что касается послеоперационной комплексной химиотерапии, ее используют при метастатическом колоректальном раке у пациентов с 3-й и 4-й стадиями или когда есть риск развития метастазов. В последние годы активно применяется персонифицированный индивидуальный подход, исследуется эпителиально-мезенхиальный переход, иммуногистохимическое типирование опухоли, по которому с применением четких прогнозирующих критериев определяется, будет опухоль метастазировать или нет. При средних и высоких рисках метастазирования проводится послеоперационная химиотерапия. Если же риск низкий, ее не применяют, поскольку химиотерапия сама по себе токсична, не говоря уже о том, что стоит недешево.
В последние годы в практику широко внедряются лапароскопические технологии. Вместе с лапароскопией стали применяться люминесцентные методы. Это специальное свечение в узком спектре света, при котором видна зона анастомоза, а также метастазы, которые могут быть не обнаружены на глаз и пропущены хирургом. Очень важно их увидеть, потому что увеличивается радикализм операции и снижается риск возможного рецидива. Среди эндоскопических технологий – трансанальная эндомикрохирургия и радикальное удаление опухоли через гибкий эндоскоп, которое можно делать, не совершая разрезы, а внутрипросветно. Но такая технология чаще применяется для колоректального рака на первой стадии.
- Как финансируется лечение и какова его стоимость?
- Общая стоимость лечения колоректального рака на 1-2 стадиях колеблется от 80 до 200 тысяч рублей. Лечение на 3-й стадии дороже - 300-500 тысяч, а на 4-й сумма достигает уже от 500 тысяч до 1,5 миллиона рублей. Названные цифры – это то, во сколько обходится государству лечение каждого пациента. Практически 100% больных получают необходимое лечение в рамках Программы государственных гарантий бесплатного оказания гражданам медицинской помощи. Часть средств получаем по программам ВМП из ОМС, часть идет по программе дополнительного лекарственного обеспечения, которое закупается за бюджетные средства.
- Дайте, пожалуйста, рекомендации: что должно насторожить врача первичного звена при осмотре пациента с колоректальным раком? И каким должно быть взаимодействие врачей разных специальностей в борьбе против этого заболевания?
- На самом деле на данный момент уже выстроена система организации такой помощи, включающая врачей-онкологов, колопроктологов, радиологов, эндоскопистов, химиотерапевтов, ну и в меньшей степени врачей общей практики и некоторых других специальностей.
Мультидисциплинарный подход – ключевой момент в успешности диагностики и лечения рака толстой кишки. По хирургии колоректального рака мы проводили пять лет назад исследование и выяснили, что органосохраняющие операции при раке прямой кишки в основном делают как раз специалисты-колопроктологи, а не онкологи. Последние делают в основном радикальную операцию с удалением сфинктерного аппарата без дальнейшей возможности реконструктивно-восстановительных операций. Поэтому такое взаимодействие очень важно.
Злокачественное новообразование в толстой кишке сегодня не является приговором. Это заболевание можно победить и вернуться к полноценной жизни. Главное — вовремя распознать болезнь, поставить диагноз и сразу же приступить к лечению.
Толстая кишка включает в себя слепую кишку, все ободочные кишки (восходящая, нисходящая, поперечная, сигмовидная), прямую кишку и анус. Ее длина составляет от полутора до двух метров. Злокачественная опухоль может возникнуть в любом из отделов толстой кишки.
Диагноз — рак толстой кишки
Опасность заболевания заключается в том, что на начальном этапе опухоль обычно не дает о себе знать. Растет она тоже достаточно медленно: чтобы увеличиться в два раза, новообразованию требуется до трех лет. Если говорить о расположении опухоли, то в 60% зарегистрированных случаев она находится в прямой кишке, в 15–20% — в сигмовидной кишке, в 10% — в слепой кишке, остальная доля приходится на другие отделы толстой кишки. Опухоль, как правило, бывает одиночная, лишь в 2–3% случаев наблюдаются множественные новообразования.
Неутешительная статистика
Каждый год в мире диагностируют около 600 тысяч случаев образования злокачественных опухолей в кишечнике. В России зафиксировано 239 тысяч человек, имеющих этот диагноз. От этого заболевания в нашей стране умирает 36 тысяч человек в год. Часто причиной такого исхода становятся поздняя диагностика и упущенное время. Около 70% пациентов с диагнозом рак толстой кишки впервые обращается к врачу уже на последней стадии.
При подозрении на рак толстой кишки проводится целый ряд диагностических исследований.
Первичные данные могут быть получены после пальпации живота врачом на приеме, перкуссии брюшной полости, пальцевом исследовании прямой кишки, гинекологическом исследовании. К наиболее информативным методам диагностики относится колоноскопия (эндоскопическое исследование, позволяющее визуализировать с помощью камеры состояние всех отделов толстой кишки) и ирригоскопия (рентгенография брюшной полости с применением контрастного вещества). С целью оценки метастатического процесса выполняется УЗИ органов брюшной полости и позитронно-эмиссионная томография (ПЭТ-КТ).
Лабораторная диагностика рака толстой кишки предполагает исследование общего анализа крови, кала на скрытую кровь, определение раково-эмбрионального антигена (РЭА), мониторинг концентрации онкомаркера СА 19-9.
При типизации заболевания принято опираться на Международную классификацию опухолей кишечника, утвержденную в 1976 году.
Клеточное строение опухоли не всегда одинаково. Исходя из специфики клеток, определяют тип рака толстой кишки. Самый распространенный — аденокарцинома, она состоит из железистой ткани и встречается в 75–80% случаев. Разросшаяся ткань перекрывает просвет кишечника, вызывая непроходимость. В запущенной стадии крупная опухоль может разрушить стенку кишки и вызвать внутреннее кровотечение. При аденокарциноме диагностируют мукоидный, слизистый или коллоидный рак. В остальных 20–25% случаев фиксируют мукоцеллюлярный, или перстневидноклеточный, рак. Такое название возникло из-за сходства строения клеток с формой перстня: узкий ободок с клеточным ядром. Он часто встречается у молодых людей и склонен к быстрому метастазированию. В редких случаях отмечают недифференцированную и неклассифицируемую формы рака.
По форме выделяют следующие типы опухоли:
- Эндофитная — не имеет четких границ, растет в толще стенки кишки.
- Экзофитная — овальная или круглая, растет в просвет кишки.
- Блюдцевидная — сочетает особенности эндофитной и экзофитной опухолей и имеет форму опухоли-язвы.
Согласно Международной классификации опухолей кишечника в развитии рака толстой кишки выделяют четыре стадии.
- I стадия рака толстой кишки — опухоль очень мала (размером с узелок) и локализуется в пределах слизистой и подслизистой оболочек, не выходит за пределы толстой кишки. В 74% случаев больные вылечиваются.
- II стадия — новообразование увеличивается, но еще не дает метастазов. Опухоль прорастает в стенку кишечника, но не выходит за его пределы. Прогноз излечения — 60–70%.
- III стадия — опухоль значительно увеличивается и может распространиться на всю толщину стенки кишки. При этом на этапе А еще нет метастазов, возможность излечения в этот период достигает 74%. А вот на этапе В уже появляются метастазы и процент излечения снижается до 40%.
- IV стадия рака толстой кишки — опухоль имеет большие размеры и затрагивает ближайшие органы. Как правило, метастазы прорастают в печень, легкие, костную ткань, органы мочевыделительной системы. На этом этапе прогнозы плохие, выживает только около 6% пациентов.
Чаще всего рак толстой кишки метастазирует в печень. Это обусловлено особенностями венозного оттока от кишечника, который осуществляется через систему воротной вены печени. Пятилетняя выживаемость у пациентов с метастазами рака толстой кишки в печени без специфического лечения не превышает 2%.
В зависимости от размера и расположения опухоли, особенностей ее клеточного строения и общего состояния пациента подбирается метод терапии. Возможны три подхода к организации лечения. Первый — операция — к ней прибегают, если опухоль не распространилась за пределы толстой кишки. Второй — радиотерапия (если обнаружен метастаз в малом тазу). К химио- и таргетной терапии обращаются, когда опухоль вышла за пределы кишечника и дала множественные метастазы. Рассмотрим каждый из методов более подробно.
Хирургическое лечение — очень эффективно на первой и второй стадиях заболевания, а также в начале третьей, когда еще нет метастазов. Если на третьей стадии есть близко расположенные метастазы, то рекомендуется радиотерапия, после которой решается вопрос о целесообразности операции.
Опухоль удаляют вместе с пораженными тканями и регионарными лимфатическими узлами — для предупреждения метастазирования.
При проведении операций по удалению злокачественных опухолей прямой кишки в большинстве случаев используется малоинвазивный лапароскопический метод ТЭМ (трансанальная эндоскопическая микрохирургия), обеспечивающий щадящее вторжение в организм пациента. В ходе процедуры используется специальный операционный ректоскоп. Стоит отметить, что проведение подобной операции требует высочайшей квалификации хирурга.
Преимущества данного метода операции заключаются в точном иссечении тканей опухоли, низком проценте рецидивов, быстром выздоровлении (одна ночь в больнице — относительно семи дней госпитализации при проведении операции обычным способом, то есть через переднюю брюшную стенку).
В особых случаях (если удаляется прямая кишка и сфинктер) операцию делают в несколько этапов: сначала убирают опухоль, затем формируют колостому (выводят наружу участок толстой кишки). Хирургическое лечение может сочетаться с лучевой терапией и химиотерапией.
Радиотерапия — это метод, при котором используется ионизирующее облучение области малого таза. К такому воздействию очень чувствительна аденокарцинома. Наиболее эффективно лечение в случаях, когда опухоль имеет четкие границы. В результате облучения клетки гибнут и опухоль уменьшается, исключается вероятность воспаления тканей и распространения опасных клеток по организму. Лучевую терапию назначают и после операции — чтобы избавить организм от оставшихся раковых клеток. Курсы облучения обычно не повторяются из-за недопустимости повторного облучения.
Химиотерапия направлена на уменьшение размера и скорости роста злокачественной опухоли. Метод также применяют перед операцией или лучевой терапией, он эффективен и для уничтожения микрометастазов, появившихся до или после удаления опухоли. Химиотерапию используют после хирургического вмешательства во избежание рецидива болезни. Чаще всего процедура представляет собой капельное введение препаратов. Химиотерапия при данном заболевании успешно проводится с помощью фторурацила. Также при раке толстой кишки назначают иринотекан, который показывает свою эффективность даже в тех случаях, когда фторурацил не способен помочь. Хорошо себя зарекомендовали в борьбе с раком толстой кишки и такие действующие вещества, как капецитабин и фторафур. Подобрать нужный препарат и назначить необходимый курс лечения может только врач. Нужно быть готовыми к неизбежным последствиям терапии: тошноте, рвоте, повреждению слизистых оболочек желудочно-кишечного тракта (стоматит и диарея), гибели части клеток крови.
Жизнь продолжается!
После операции с выведением колостомы многим людям тяжело восстановиться — они испытывают серьезные психологические проблемы. Но нормальная жизнь с колостомой возможна. Главное — соблюдать правила ухода за ней, грамотно питаться и следовать рекомендациям врача.
После перенесенного рака прямой кишки организм пациента заметно ослабевает. Химиотерапия, лучевое лечение и хирургическое вмешательство также сказываются на общем состоянии больного. Поэтому во время восстановительного периода очень важно выполнять все предписания врача, соблюдать режим дня, диету, избегать физических и психологических нагрузок, обратить внимание на продолжительность и качество сна. Также важно принимать необходимые препараты и витамины, являться на плановые осмотры и вовремя сдавать назначенные анализы. Все это позволит как можно скорее вернуться к привычному образу жизни. Если же не соблюдать приведенные выше рекомендации, вероятность рецидива значительно возрастает.
Что касается профилактики рака толстой кишки, то ее методы довольно просты. Прежде всего, следует обязательно включать в свой ежедневный рацион свежие овощи и фрукты, причем необязательно экзотические — морковь, капуста, редька, репа, яблоки отлично подойдут. Они богаты витаминами, минеральными веществами и клетчаткой, что способствует очищению кишечника и предотвращает возникновение в нем застойных явлений. Также важно каждый день употреблять первые блюда, не переедать, регулярно опорожнять кишечник.
При возникновении воспалительных заболеваний толстой кишки (колитов) — их нужно вовремя лечить, а полипы — удалять. Если у кого-то из близких родственников диагностирован рак толстой кишки, необходимо наблюдаться у гастроэнтеролога, так как болезнь может носить наследственный характер. После 50 лет рекомендуется ежегодно посещать гастроэнтеролога в профилактических целях.
Таким образом, при внимательном отношении к состоянию кишечника патологических процессов можно избежать. Если же диагностирован рак толстой кишки — это не повод для отчаяния. Современный уровень медицины позволяет справиться с этим диагнозом.
На этот вопрос отвечает Анвар Йулдашев, врач-колопроктолог, хирург, онколог, кандидат медицинских наук:
«Эффективность лечения онкологических заболеваний зависит в первую очередь от оборудования и квалификации врачей. Высокий уровень оснащенности и качества медицинских услуг может предложить Институт онкологии Европейского медицинского центра (ЕМС).
Наше лечебное учреждение в настоящий момент является одной из крупнейших в России частных онкологических клиник. Мы выполняем лечение рака толстой кишки по европейским и американским стандартам, о чем свидетельствует наличие международной аккредитации JCI.
В штате Института онкологии — врачи России, Израиля, США и Западной Европы, имеющие большой опыт практической работы в ведущих европейских клиниках. Наши специалисты способны оказать помощь пациентам на любом этапе — при диагностировании, мониторинге и обнаружении процесса метастазирования. Решение о тактике лечения принимается совместно врачами смежных областей — онкологом, кардиологом, хирургом-онкологом, радиологом, колопроктологом, лучевым диагностом, патоморфологом. Это позволяет учесть все нюансы состояния пациента и подобрать щадящие методы лечения.
Мы оказываем весь комплекс диагностических и лечебных процедур пациентам с онкологическими заболеваниями:
- Клиническая лабораторная и инструментальная диагностика.
- Радионуклидная диагностика.
- Химиотерапия (используются новейшие противоопухолевые препараты).
- Хирургическое лечение любой сложности, включая роботассистированные операции.
- Лучевая терапия и радиохирургия опухолей толстой кишки и метастазов на новейшем оборудовании (США).
- Услуги по медицинской реабилитации пациента, перенесшего операцию, химиотерапию, лучевую терапию.
- Паллиативная медицинская помощь.
- Патронаж на дому.
Наша клиника оснащена современной системой (производства США) для проведения лучевой терапии, она позволяет проводить лечение злокачественных новообразований любого объема и формы в короткие сроки. Высокая точность на каждом этапе лечения помогает защитить здоровые ткани и дает возможность пациенту сразу же после сеанса вернуться к привычному образу жизни.
В Институте онкологии ЕМС проводятся различные виды операций на органах брюшной полости, включая высокотехнологичные операции с применением роботической системы. Оперативные вмешательства осуществляются как в плановом порядке, так и экстренно.
Экстренная госпитализация в клинику может быть выполнена в любое время суток, перевозка обеспечивается из всех регионов России и проходит в соответствии с мировыми стандартами комфорта (при необходимости может быть задействован воздушный транспорт). Наши автомобили обеспечены современным медицинским оборудованием, что делает возможным оказание неотложной помощи и проведение реанимационных мероприятий.
Уровень оснащенности отделения реанимации и интенсивной терапии Института онкологии ЕМС позволяет принимать пациентов с самыми сложными заболеваниями и даже в критическом состоянии.
Стационар нашей клиники обеспечивает комфорт европейского уровня и питание по индивидуальному меню с учетом медицинских показаний. Предусмотрена возможность круглосуточного посещения пациентов, в том числе и находящихся в реанимации.
- медицинскую деятельность — на основании лицензии ЛО-77-01-019876, выданной Департаментом здравоохранения города Москвы 10 апреля 2020 года;
- высокотехнологичную медицинскую деятельность — на основании лицензии ФС-99-01-009514, выданной Федеральной службой по надзору в сфере здравоохранения 25 апреля 2018 года.
Читайте также:

