Молекулярные препараты при лечении рака
Последние научные разработки в области ядерной медицины предусматривают альтернативы дополнительного лечения, особенно для больных неоперабельным раком. Подобное лечение имеет свойство целенаправленного на раковую ткань лечения и позволяет продлить жизнь и повысить её качество.
Лечение отталкиваясь от свойства раковых клеток
Современный подход к лечению рака чаще всего оценивается под названием "целенаправленное лечение". Цель этого лечения это раковые клетки. Имеющие свойство анормального размножения, раковые клетки отличаются от здоровых клеток в связи с разными белками которые находятся на оболочки клетки или с некоторыми молекулами которые находятся внутри клетки. В последние годы, с помощью специальных молекул, которые способны определить характеристику или слабые стороны раковых клеток, разрабатываются новые целенаправленные (умные) методы лечения. Эти специальные молекулы, которые способны находить раковые образования, вводятся в организм через рот или через вену.
Молекулярные технологии нацелены на раковую ткань
Если имеется молекула которая имеет свойство целевого направления на раковую клетку, отталкиваясь от назначенного лечения возможно загрузить в молекулу лекарство, атом или другие уничтожающие агенты. С помощью лечебных агентов загруженных в молекулу-носителя возможно будет целенаправленно уничтожить зараженную ткань на клеточном уровне. Таким образом возможно будет использовать более высокие дозы с минимальным повреждением здоровых тканей.
Новые альтернативы лечения для неоперабельных больных
Молекулярное лечение является новым оружием в борьбе с раком. Подобное лечение даёт ещё один шанс неоперабельным пациентам или пациентам, которые испробовали все остальные методы лечения. Для болезней на более распространённых стадиях, подобное лечение используется в качестве последнего удара по раковым клеткам. Но по мере накопления опыта, в дальнейшем возможно будет использовать подобное лечение на более ранних стадиях заболевания.
Использование молекулы-носителя при сканирование
Сканирование раковых клеток распространенных по всему организму происходит на основании той же логики что и при лечении. Загруженные в молекулу-носителя специальные агенты, которые добываются отталкиваясь от свойства раковых клеток, направляются в область ракового распространения и таким образом позволяют определить распространение заболевания по всему организму. Если сравнивать с предыдущими методами сканирования, молекулярное сканирование позволяет добиться более успешных результатов в качестве анализирования распространения заболевания. С помощью одного и того же метода, возможно использовать агенты позволяющие определять распространение заболевания и одновременно лечить его. Подобные агенты называются тераностические агенты (латинское сочетание слова лечение и диагностика). Подобные агенты помимо лечения так же позволяют более эффективно определить распространение лекарственного препарата по организму и ход заболевания.
Метод эффективно используется при раке простаты (предстательной железы)
Новые молекулярные методы лечения и диагностики начали использоваться, и со временем будут чаще использоваться, при лечении и диагностики рака простаты. В крови имеется раковый показатель более известный как ПСА. После установления диагноза рака простаты, с помощью методов сканирования определяется стадия заболевания. Методы сканирование при раке простаты используют один и тот же путь что и молекулярные целенаправленные методы лечения. Используя белок ПСМА, который специфичен для рака простаты, был создан метод сканирования под названием ПЭТ-КТ. ПСМА ПЭТ-КТ позволяет определить наличие метастазов и таким образом предотвратить ненужные вмешательства и лечения больным с раком простаты. Помимо этого, пациентам с метастазирующим и невосприимчивыми к стандартному лечению заболеванием, возможно провести целенаправленное лечение с использованием высоко энергичного атома лютеций 177. При раке простаты помимо лютеция недавно начали использовать молекулярное лечение с радием 223. С радием 223, возможно нацеливаться на костные метастазы гормонально устойчивого рака простаты. Исследования доказали, что с помощью лечения радием 223 возможно продлить срок выживаемости больным раком простаты с распространенными костными метастазами.
Атомные шарики при лечении рака
При раке печени возможно уничтожить раковую ткань с помощью радиоактивных микрошариков которые внутривенно запускаются в зараженную область. Подобный метод лечения называется радиоэмболизация или лечение радио-микрошариками и проводится совместно со специалистами таких областей медицины как, ядерная медицина, радиология и медицинская онкология. Лечение возможно использовать, как и при раке печени так же и при метастазах в печень от другой первичной опухоли. В лечении используются микрошарики начиненные радиоактивным веществом с высокой энергией; yttrium-90. Радиоактивные микрошарики внутривенно вводятся в область, питающую раковую опухоль с помощью ангиографии. Таким образом, микрошарики способны уничтожить раковые клетки и областные распространения с помощью радиоактивных лучей. Подобное лечение способно остановить рост заболевания, сократить опухоль в размерах и повысить срок выживаемости. Лечение больше всего предпочитается в случаях, когда больной испробовал все имеющиеся лечения и когда опухоль не подлежит хирургическому вмешательству. Для проведения лечения радиоактивными микрошариками такие показатели как возраст, физическое состояние больного, состояние печени, распространение заболевания имеют очень важное значение.
Лечение продлевает продолжительность жизни при нейроэндокринным типе рака
При лечении нейроэндокринных разновидностей рака, так же возможно использовать радиоактивные методы лечения. Подобное лечение называется пептид-рецепторная радионуклидная терапия (ПРРТ). Нейроэндокринные опухоли (НЭО) состоят из пептид рецепторов соматостатина и могут образоваться в таких органах как желудок, поджелудочная железа, кишечник, щитовидная железа и лёгкие. Перед началом лечения с помощью ПЭТ-КТ определяется распространение рецепторов по опухоли и их количество. Помимо этого так же определяется распространение заболевания (метастазирование) по всему организму и устанавливается доза лечения. Во время лечения, радиоактивные пептиды внутривенно вводятся в организм и целенаправленно прикрепляясь к раковым клеткам, уничтожают их за счёт радиоактивных лучей. После лечения пациентам возможно будет необходимо несколько дней остаться в больнице. Обычно подобное лечение продолжается 3-5 курсов. Подобное лечение проводится при неоперабельных, обширно метастазирующих и не подлежащим химиотерапевтическому лечению опухолях. С помощью подобного лечения, из трёх пациентов у одного бывает возможно получить положительный эффект и у половины пациентов бывает возможно остановить рост заболевания.
Лечение радиоактивным йодом рака щитовидной железы
Лечение радиоактивным йодом (атомное лечение) является самым известным и часто используемым радионуклидным лечением при раке щитовидной железы. Лечение используется уже долгие годы и является лечением, чья надежность и эффективность была неоднократно доказана. Подобное лечение проводится после оперативного лечения пациентам с диагноз рака щитовидной железы. После того как вся щитовидная железа удаляется хирургическим вмешательством, радиоактивный йод накопляется в остаточных раковых клетках и с помощью радиоактивных лучей позволяет уничтожить оставшиеся микроскопические клетки. Так же при рецидиве заболевания, при необходимости лечение проводится с более высокими дозами. Радиоактивный йод применяется оральным путём в качестве капсулы или жидкости.
Радиоактивные лечения бывают эффективны при некоторых опухолей детского возраста
Возможно использовать вещества связанные с радиоактивным йодом под названием МИБГ, для лечения одной из опухолей детского возраста, невробластомы. МИБГ имеет похожие свойства с пептидом под названием норепинефрин, который используется раковыми клетками. МИБГ связывается с радиоактивным йодом и вводится в организм внутривенным путём. Подобное лечение, целенаправленно уничтожая раковые клетки, помогает 1/3 пациентам с неоперабельным заболеванием на распространенной стадии. Лечение МИБГ так же может быть эффективным у подходящих пациентов с диагнозом нейроэндокринного рака.
Использование при лимфоме (рак лимфатических узлов)
При раке лимфатических узлов (лимфоме) который не реагирует на другие онкологические методы лечения, радионуклидная терапия может быть альтернативным методом лечения. Подобное лечение возможно применить для подходящих больных лимфомой низкой степени. Связанные с Yttrium-90 или Йод-131 антикоры под названием CD20, целенаправленно направляются к антикорам находящимся в раковых клетках и на микроскопическом уровне уничтожают их методом высокодозными радиоактивными лучами. С помощью данного метода больше чем у половины пациентов, чьё заболевание сопротивляется другим методам онкологического лечения, возможно добиться положительный ответ.
Не травмирует больных
Атомные методы лечения не наносят сильный вред здоровым тканям и таким образом не травмируют больных как химиотерапия и радиотерапия. Во время лечения радиотерапией, радиоактивные лучи помимо раковой ткани так же затрагивают и приносят вред здоровым тканям. При атомных лечениях облучение не затрагивает весь организм. С помощью свойства целенаправленного влияния, только раковая опухоль и её окружность подвергается облучению и таким образом возможно в значительной степени защитить здоровые ткани организма. Но важно принять меры защиты тех мест откуда будет выходить не использованная часть атома.
Видимая часть айсберга
Ядерная медицина не используется при каждой разновидности рака. Ядерная медицина является быстро развивающийся областью медицины и используется при лечении таких заболеваний как; нейроэндокринные опухоли, некоторые разновидности лимфомы, рак печени, диффузный токсический зоб, рак щитовидной железы, некоторые разновидности опухолей детского возраста, специально выбранные больные раком простаты. Для того что бы правильно принять решение о лечении, пациент начиная с диагностики должен оценивается многопрофильной командой состоящей из специалистов разных областей медицины. Учитывая достигнутые успехи, будет правильно назвать сегодняшние достижения видимой частью айсберга.
Процесс лечения онкологических заболеваний очень долгий и сложный. Единого лекарства против рака пока не существует, но комбинация различных препаратов при онкологии позволяет добиться торможения роста опухоли, снятия болевого синдрома и общего улучшения состояния пациента.
Роль лекарственных препаратов в терапии онкозаболеваний
Современные препараты при лечении рака решают несколько задач, потому и назначаются они чаще всего комплексно. Одни лекарства от рака разрушают пораженные клетки, другие останавливают их рост и предотвращают возникновение новых раковых клеток. На поздних стадиях активно применяются обезболивающие препараты, а также средства, которые сами по себе никак не влияют на рост опухоли, но улучшают общее состояние человека, снимая неприятную симптоматику.
Химиотерапия — высокотехнологичный и эффективный способ лечения онкологических заболеваний, пусть и не лишенный недостатков. Препараты для химиотерапии подавляют рост раковых клеток или уничтожают их, однако многие их них воздействуют также и на здоровые клетки. Из-за этого химиотерапия переносится тяжело, а пациенты после каждого курса нуждаются в реабилитации. Побочными эффектами препаратов для химиотерапии являются рвота и тошнота, выпадение волос, снижение массы тела, ухудшение иммунитета, постоянное чувство усталости, нарушение свертываемости крови.
Специалисты различают цитостатическую и цитотоксическую химиотерапию. Они различаются по механизму воздействия на клетки. Цитостатические препараты замедляют размножение клеток опухоли. Цитотоксические убивают пораженные клетки, вследствие чего начинается некроз опухоли.
К препаратам для химиотерапии относятся следующие группы средств:
- Алкилирующие агенты . Эти лекарства против рака разрушают белки, ответственные за формирование ДНК раковых клеток. Самые распространенные препараты этой группы — средства на основе действующего вещества циклофосфамид.
- Препараты платины. Этот благородный металл токсичен. Препараты платины обладают тем же действием, что и алкилирующие агенты, а именно — разрушают ДНК раковых клеток. Цитостатические средства алкилирующего типа действия широко используются для лечения рака.
- Антиметаболиты. Они воздействуют на генетический аппарат клетки, убивая ее при делении. Наиболее известными антиметаболитами являются препараты на основе гемцитабина.
- Антрациклины. Эти препараты образуют свободные радикалы, повреждающие ДНК больных клеток. Самые известные представители группы антрациклинов — средства с действующим веществом даунорубицин.
- Таксаны нарушают процесс деления раковых клеток. Препараты на основе паклитаксела — самые распространенные в этой группе.
- Винкалкалоиды разрушают цитоскелет раковых клеток, что приводит к их гибели. Относятся к мягким средствам химиотерапии, так как раковые клетки гораздо более чувствительны к воздействию этого препарата, чем здоровые. В этой группе выделяют средства с действующими веществами винбластин и винкристин.
При лечении многих видов опухолей хорошие результаты дает применение гормональных препаратов. Они наиболее эффективны при лечении гормонозависимых опухолей — рака молочной железы, матки, простаты, а также при опухолях поджелудочной железы, почек, при меланомах.
Эстрогенсодержащие препараты назначаются для подавления андрогенов (например, при раке простаты), а андрогенсодержащие, наоборот, подавляют выделение эстрогенов. Препараты последней группы назначают при таких видах онкологии, как рак молочной железы и т.д.
Несмотря на эффективность, у гормональных препаратов много минусов — они способны ослаблять действие химиотерапевтических препаратов, при долгом лечении у многих больных вырабатывается резистентность к подобным средствам.
Некоторые виды рака развиваются вследствие деятельности вирусов (например, вируса папилломы человека). Кроме того, организм, ослабленный агрессивной химиотерапией, подчас не может самостоятельно защитить себя от вирусных инфекций. Именно поэтому в комплексной терапии рака используются и противовирусные лекарства, в частности — препараты на основе тилорона и их аналоги.
К ферментам относятся активные белковые соединения, которые способны разрушать аминокислоты, необходимые для роста клеток опухоли. Для лечения опухолей применяют аргиназу, аспаргиназу и некоторые другие ферменты. Эффективность такой терапии под вопросом, так как резистентность вырабатывается очень быстро: человеческая иммунная система начинает вырабатывать антитела к ним. Однако исследования показывают, что ферментотерапия значительно смягчает последствия химиотерапии.
При лечении рака большое внимание уделяется не только воздействию на саму опухоль, но и улучшению качества жизни пациента, в частности — борьбе с болью. Чаще всего боль вызывается ростом опухоли, но иногда болевой синдром — побочный эффект некоторых лекарств от рака.
Выбор обезболивающих препаратов зависит от стадии болезни. ВОЗ разработала трехступенчатую схему, которая предполагает переход ненаркотических анальгетиков к слабым опиатам, а затем — к сильным опиатам. Эта схема позволяет добиться заметного улучшения состояния у 9 из 10 пациентов.
- Адъювантные средства . Эти лекарства не являются обезболивающими в строгом смысле слова, однако они уменьшают побочные эффекты сильных опиоидов и усиливают их болеутоляющее действие (к примеру, клонидин). Определенный эффект дают и антидепрессанты.
- Ненарктотические анальгетики . Это первый шаг в снятии болевого синдрома при онкологических заболеваниях. Для этих целей применяются препараты на основе парацетамола, а также нестероидные противовоспалительные препараты (ибупрофен).
- Слабые опиаты . К этим средствам относятся кодеин, трамадол и некоторые другие. Это сильнодействующие препараты, которые тем не менее отличаются хорошей переносимостью. Они дают особенно заметный эффект в сочетании с ненаркотическими анальгетиками.
- Сильные опиаты . В случаях, когда боль становится слишком сильной и иные средства не помогают, врач назначает сильные опиаты на основе морфина, фентанила и т.д. Они воздействуют напрямую на ЦНС, подавляя нервные импульсы.
Онкологические заболевания распространены очень широко, количество больных раком увеличивается с каждым годом, причем врачи отмечают, что рак молодеет — все чаще этот диагноз ставится людям, не достигшим и 40 лет. Все это делает исследования в области разработки новых препаратов от рака приоритетом для международного фармацевтического сообщества. Исследования проводятся постоянно, и уже есть определенные результаты.
Возможно, уже через несколько лет подобные вакцины станут доступными, а таргетная терапия разовьется достаточно, чтобы полностью заменить химиотерапию. Однако пока эти направления являются экспериментальными.

Успехи современной клинической онкологии неоспоримы. Все более сложные операции, новые препараты, эффективные методы обезболивания и устранения мучительных симптомов. Мы в нашем блоге достаточно рассказывали о том, как сегодня можно продлить и облегчить жизнь пациентам даже на последних стадиях болезни.
Но, тем не менее, тысячи онкологических больных во всем мире ежедневно узнают, что опухоль, которая вчера поддавалась определенному лечению – сегодня снова растет или дает метастазы. Врачи регулярно оказываются в тупике: все положенные лекарства и методы лечения перепробованы, и эффективных для данного пациента – не осталось.
Однако даже из этого тупика можно найти выход. С развитием генетики и молекулярной биологии в руках онкологов оказался новый способ изучить опухоль, чтобы найти в ней уязвимые места.
Для этого используют молекулярно-генетическое тестирование – определение особенностей ДНК раковых клеток. Метод сложный технически, дорогой, требует специфических знаний от врача.
Исследование занимает 3 недели, стоит от 250 до 670 т.р. В результате врач получает отчет в 30 страниц сложной информации, которой он еще должен уметь воспользоваться. Но пациентам, которые уже было перестали надеяться, это дает дополнительное время жизни.
Сегодня мы хотим рассказать о том, как делается молекулярно-генетическое тестирование, в каких случаях оно может помочь пациенту и какие знания дает врачу.
Мы все – мутанты, это норма. Но некоторые мутации приводят к раку
Для этого все соматические клетки (те, из которых состоит организм), кроме эритроцитов, беспрестанно делятся.
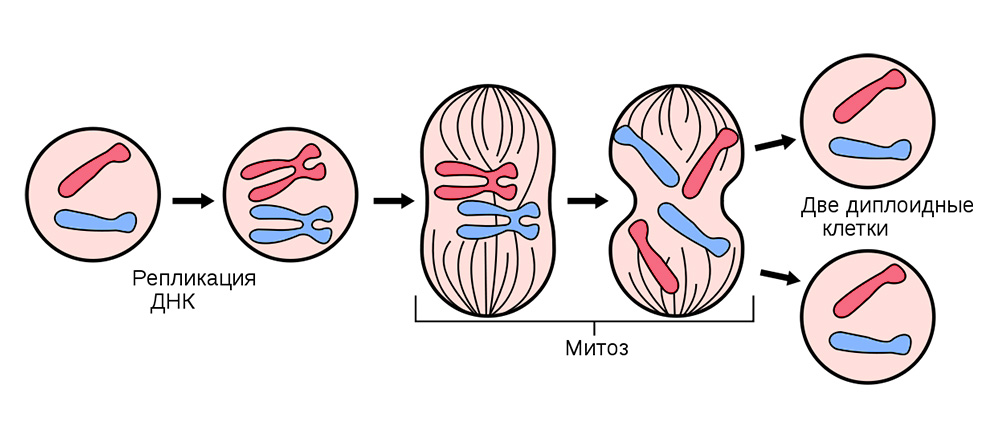
Деление соматических клеток происходит во всех органах и тканях
Иногда в процессе деления получаются сбои – мутации. То нить ДНК порвется, то скопируется с ошибкой, то участки хромосом перемешаются. Влиять на это может сотня факторов: от стресса и табачного дыма до воздействия радиации.
Мутации можно разделить на 4 вида.
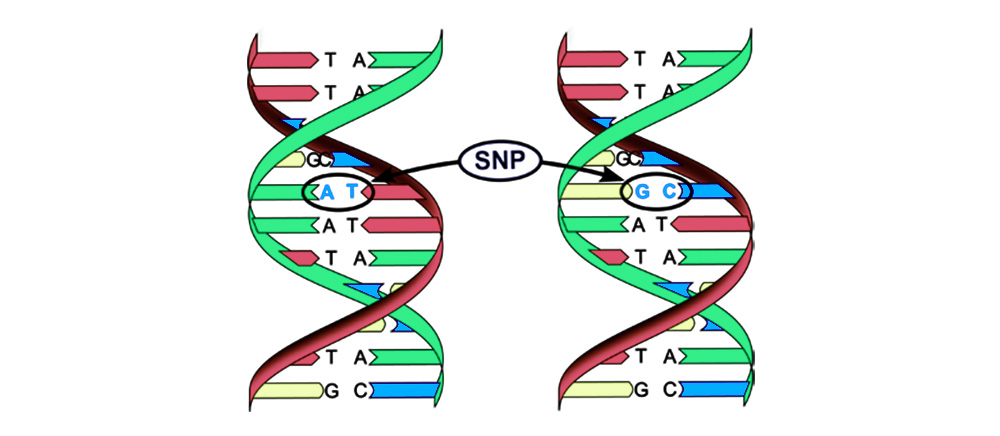
2. Хромосомные аберрации.
Делеция – утрата участка хромосомы. Происходят из-за обрыва концевого участка или разрыва ДНК сразу в двух местах. Всё – этот ген в хромосоме больше не экспрессируется.
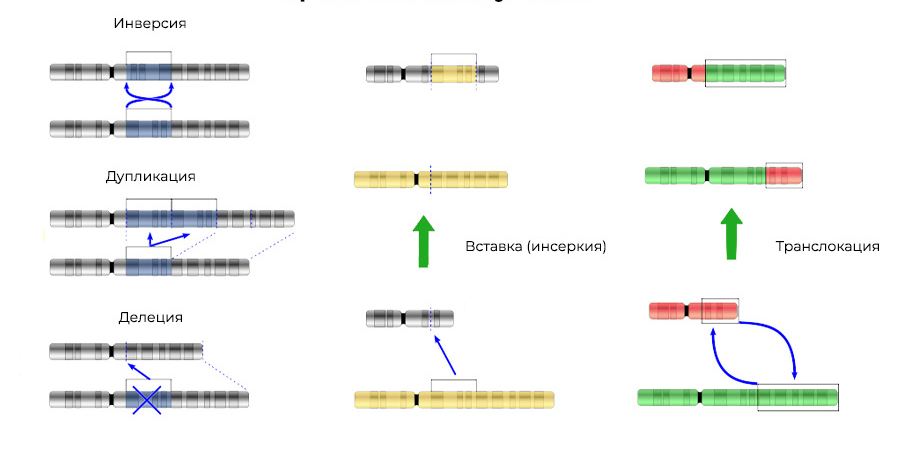
Мутации изменяют не только структуру участка ДНК, но и порядок этих участков
Злокачественную клетку от нормальной отличает нарушение клеточного цикла.
Клеточный цикл (жизнь клетки от деления до деления/гибели) строго регулируется работой специальных белков: киназы, циклины, факторы роста и транскрипционные факторы – в каждой живой клетке их десятки, и у каждого своя узкоспециальная, но важная функция.
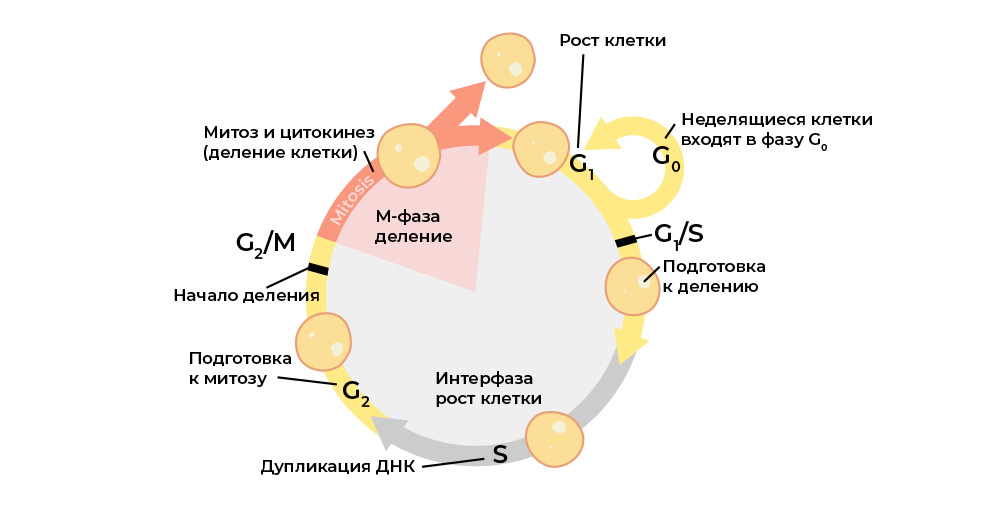
Каждый этап клеточного цикла контролируется белками-регуляторами
Таких значимых генов, изменения в которых могут привести к канцерогенезу (возникновению рака) – две больших группы.
Из тех, что наиболее хорошо изучены и у всех на слуху:
- EGFR, ALK, BRAF – немелкоклеточный рак легкого;
- BRAF – меланома;
- HER2 – рак молочной железы (РМЖ);
- KRAS – колоректальный рак.
Причем, мутации этих генов бывают обнаружены при нескольких видах опухолей. Например, повышенная экспрессия HER2 обнаруживается не только при РМЖ, но и при раке легкого и желудка.
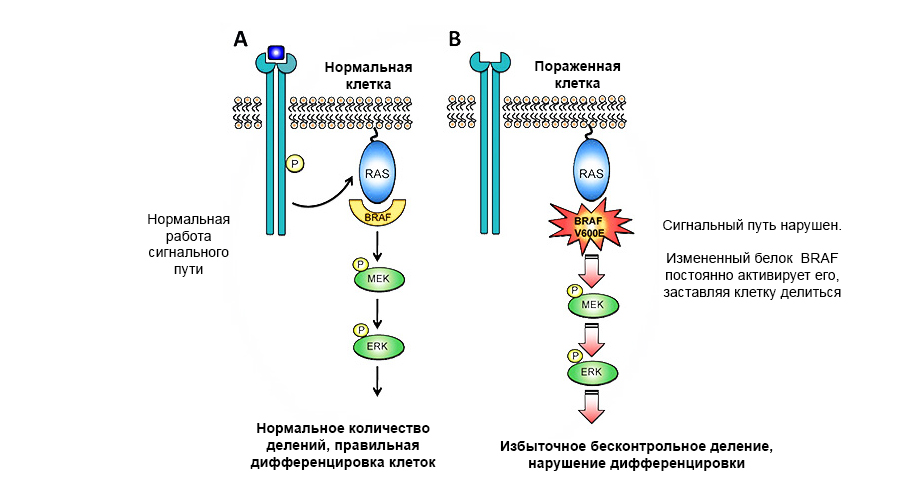
Мутация в протоонкогене белка BRAF приводит к неконтролируемому росту опухоли.
Гены-супрессоры опухоли (антионкогены) – напротив, могут подавить рост опухолевых клеток или участвуют в репарации (починке) поврежденной ДНК. А вот инактивация генов-супрессоров в результате мутации – резко увеличивает вероятность появления злокачественной опухоли.
Всего изучено влияние нескольких десятков протоонкогенов и опухолевых супрессоров на канцерогенез.
Зачем столько сложностей и как они продлевают жизнь пациентам
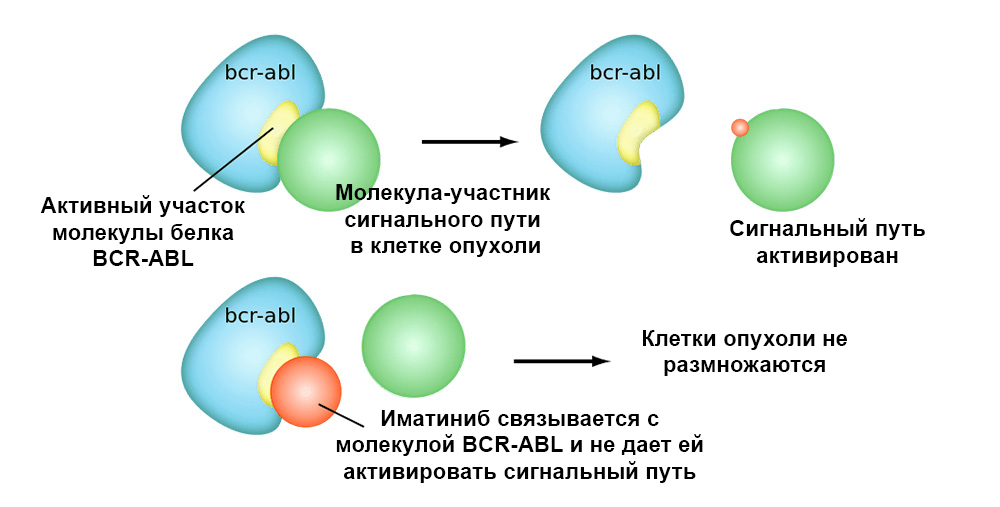
Иматиниб связывается с активным участком молекулы белка BCR-ABL, и блокирует его способность взаимодействовать с остальными молекулами в цепочках сигнальных путей.
Так что таргетные препараты имеют 2 важных преимущества перед классической химиотерапией.
Но и лечение для него должно быть соответствующее – индивидуально подобранное для конкретного пациента – на основе того, что мы определяем мутации в его опухолевых клетках.
В совсем недалеком прошлом злокачественные опухоли можно было классифицировать только по гистологии, то есть в зависимости от того, в каком органе они возникли, и как выглядели раковые клетки под микроскопом.
- узнаем чувствительность опухоли к препаратам;
- выясним, есть ли у опухоли устойчивость к определенным лекарствам;
- обнаружим генетические особенности, которые дают гиперчувствительность к препаратам;
- подберем новое лечение, если опухоль перестала отвечать на стандартную терапию;
обнаружим опухоль/метастаз на очень ранней стадии – по обрывкам ее ДНК в крови; - можем прогнозировать благоприятное или агрессивное течение заболевания.
Образцом выступает чаще всего ткань опухоли, либо взятая во время операции по удалению первичного очага, либо биопсия – микроскопический кусочек опухоли берут специальной тонкой длинной иглой.
Можно поискать ДНК опухолевых клеток в крови – тогда нужна так называемая жидкостная биопсия, две пробирки с кровью по 8,5 мл.
При биопсии мы часто сталкиваемся с тем, что многие пациенты боятся вообще трогать опухоль – опасаются, что ее это спровоцирует на рост. На сегодня не доступны какие-либо исследования, которые бы показали такую взаимосвязь. Конечно, биопсию надо выполнять правильно. У нас чаще всего врачи при заборе биоптата помечают место входа иглы: либо делают маленькую татуировочку (есть и такой инструмент ), либо скобку (хирургическую) ставят. Если потом понадобится операция, они иссекают весь этот ход, где была игла – от кожи до опухоли – так мы делаем шанс распространения раковых клеток за пределы опухоли еще меньше.
Далее образцы отправляются в лабораторию молекулярно-генетически исследований.
Причем применяют сразу несколько методов: секвенирования нового поколения (NGS), секвенирование по Сэнгеру и метод флуоресцентной гибридизации (FISH). Вместе они позволяют прочесть всю последовательность ДНК опухоли, выяснить драйверные мутации – то есть те, которые запустили злокачественный процесс и теперь могут быть мишенью для таргетной терапии – и даже визуализировать весь кариотип (хромосомный набор).
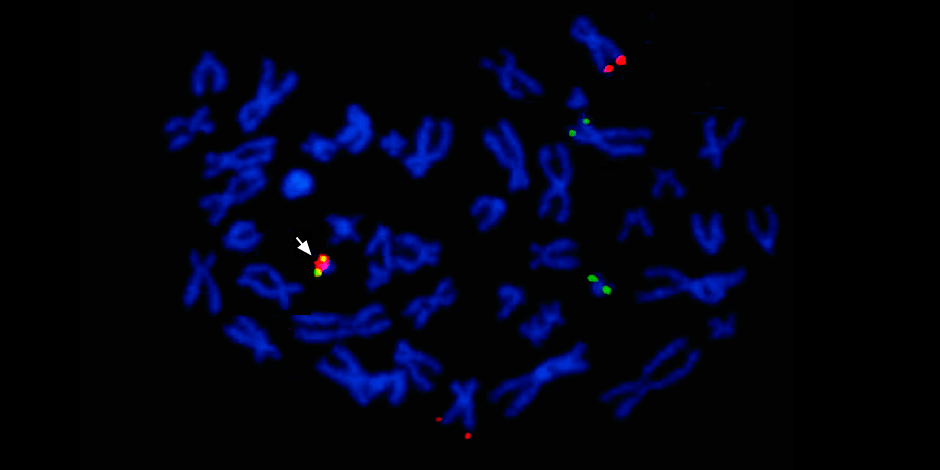
Под стрелкой слева – слияние красного и зеленого сигнала – свидетельство о слияния генетического материала хромосом 9 и 22 с образованием химерной филадельфийской хромосомы.
Кроме того, в полном молекулярно-генетическом исследовании обязательно определяют микросателлитную нестабильность (MSI, microsatellite instability) – нарушение в работе механизма репарации ДНК, которые приводят к быстрому накоплению мутаций в клетках. Этот фактор позволяет делать прогноз по поводу дальнейшего течения заболевания.
После получения молекулярно-генетического профиля опухоли – начинается его анализ
Специальные программы обрабатывают полученные результаты и составляют рекомендации автоматически. Но затем эти рекомендации обязательно вручную курируются командой экспертов. В анализе участвуют генетики, биоинформатики, врачи-онкологи, иммунологи и химиотерапевты. На этом этапе обязательно происходят уточнения и дополнения.
В итоге, в первой части отчета прописаны все найденные мутации в опухоли пациента, и таргетные препараты, которые будут наиболее эффективны в данном случае. Указана таргетная терапия, одобренная для данного типа опухолей с обнаруженными мутациями, и таргетная терапия, которая одобрена для лечения других типов рака с теми же мутациями. У нас в практике были случаи, когда назначались препараты именно второго порядка, off-label – и хорошо действовали.
Далее сотрудники лаборатории проводят огромную работу по мониторингу научных исследований, которые могут быть значимы в случае с данным пациентом.
Во второй части отчета находится обзор существующих на тот момент исследований с подробными данными о частоте встречаемости данной мутации, о действии разных препаратов и о возможности использовать тот или иной вид таргетной терапии при выявленных мутациях. Это помогает составить хотя бы приблизительный прогноз для пациента.
В третьей части отчета собраны актуальные клинические исследования, в которых пациент может принять участие, чтобы получить экспериментальное лечение. Это самый последний запасной способ, но знать о нем все подробности – полезно для спокойствия пациента.

Отчет получается довольно увесистым – 30 страниц захватывающего чтения
В этом случае молекулярно-генетическое исследование и дает нам понимание, какой препарат будет эффективен против данной опухоли, именно с этим набором мутаций. Назначение такого препарата позволяет выиграть главный для онкопациента ресурс – время.
Проблемы методики
Опухоли неоднородны. Они состоят из разных клеток, которые могут отличаться весьма значительно. И, например, в 80% клеток опухоли мутация определенного гена присутствует, а 20% клеток поделились с другим распределением хромосом – и остались немутировавшими. Да, мы назначаем препарат по результатам молекулярно-генетического теста, и против 80% опухолевых клеток он сработает эффективно, но для оставшихся 20% нужно будет придумывать другое лечение.
Некоторые виды рака более-менее гетерогенны, например, РМЖ. А некоторые опухоли, такие как саркомы, напоминают по структуре винегрет. Это затрудняет и диагностику, и лечение: нельзя заранее узнать, в какой части опухоли какие клетки, сколько их видов, как сильно они отличаются. И нельзя, грубо говоря, взять 10 образцов из разных мест опухоли – по ним придется сделать 10 отдельных генетических исследований.
До 30% таргетных и иммунопрепаратов в России назначается без соответствующего обоснования – без исследований генетики опухоли. И часть этих лекарств оказывается пустой тратой средств бюджета и денег пациента, потому что назначать таргетное лечение без понимания генетики опухоли – это рулетка: зарегистрировано более 600 препаратов. Например, для рака молочной железы есть пять протоколов лечения, в зависимости от мутации гена HER2/Neu.
В западной медицине определение генетического профиля опухоли уже становится стандартом лечения. Для российских онкопациентов молекулярно-генетические тестирования – все еще редкий случай, к сожалению – для бюджетной медицины это пока дорого. Но есть надежда, что все изменится к лучшему. Если сейчас оно стоит 600 тыс. руб., то 5 лет назад стоило больше миллиона – технология становится все проще и совершеннее, а, значит, популярнее и доступнее. Здесь время работает на нас.
Поэтому мало просо сделать генетический тест, нужно уметь понять результаты и сделать верные выводы. Мы с коллегами чаще всего сначала изучаем отчет сами (бывает, приходится посидеть над ним дома, в тишине после работы) – а потом еще и собираем консилиум, принимаем коллегиальное решение.
Но хорошие истории пациентов, честно говоря, всегда мотивируют лучше всего.
Сейчас у нас есть пациентка, 48 лет, с рецидивирующей глиобластомой (агрессивная опухоль мозга). К нам она попала после того, как прошла две линии терапии в государственном онкоцентре. Там все делали правильно, проводили лучевую терапию и назначали таргетный препарат, но опухоль все равно вернулась. Женщине отвели полгода жизни.
Мы предложили ей полное молекулярно-генетическое тестирование. Да, оно стоит 600 тыс. рублей, сокращенный вариант, за 250, в ее случае не подошел – нужно было расширенное тестирование, с максимально полным набором мутаций.
Но по результатам обследования назначили ей препарат, который предназначен обычно для лечения немелкоклеточного рака легкого. Он эффективен против опухолей с мутацией EGRF – у нашей пациентки глиобластома была именно с этой мутацией.
Женщина ходит к нам лечиться и наблюдаться уже 4 года. Это в 5 раз дольше, чем при стандартной терапии. Причем, она самостоятельна, живет эти 4 года обычной жизнью, ходит на работу и собирается дождаться внуков.
Читайте также:

