Микробиологи о раке и лечении
— Пётр Михайлович, не могли бы вы рассказать, в чём заключается суть вашего метода?
— Есть вирусы, которые могут подавлять рак. Они обладают онколитическими свойствами. И они безвредны для здоровья человека. Этот способ лечения практически не даёт побочных эффектов. Возможно только кратковременное повышение температуры, что является положительным признаком, говорящим о том, что вирус в организме прижился и оказывает реакцию. Это легко снимается обычными жаропонижающими средствами.
— Когда метод станет широко применяться в практической медицине?
— Сейчас основная наша задача — сертифицировать те препараты, которые у нас есть. Эта работа поддерживается Минздравом и Минобрнауки. У нас есть несколько грантов, по которым мы испытываем эти препараты. Мы делаем новые варианты онколитических вирусов с усиленными свойствами. Скоро должны начаться доклинические испытания в институте имени Смородинцева в Санкт-Петербурге. Мы уже передали туда препараты. Врачи говорят, что на испытания уйдёт месяцев пять-шесть. Учитывая ситуацию с коронавирусом, я думаю, что в начале 2021 года испытания могут быть закончены и тогда мы уже сможем договариваться с клиниками о проведении клинических испытаний.
— Что собой представляет препарат, который должен пройти испытания?
— Препарат — это живой вирус, который выращивается на культурах клеток. Это лекарство нового типа, которого не нужно много. Важно, чтобы он попал в организме в те клетки, которые чувствительны к нему. А дальше он сам размножается. То есть лекарство само себя воспроизводит уже в том месте, где оно нужно. Это раствор, 100 млн вирусных частиц в 1 мл. Но самая большая проблема в этом лечении — это способ доставки вируса в опухоль, в случае с глиобластомой — в мозг, в ту область, где находится опухоль.
Если препарат ввести просто внутривенно, то очень небольшая часть вируса может попасть в опухоль. В кровотоке есть неспецифические факторы, которые этот вирус быстро инактивируют. Кроме того, в мозгу есть гематоэнцефалический барьер, который препятствует попаданию туда всяких нежелательных агентов, в том числе и вирусов. Поэтому вирусу очень трудно добраться до опухоли.
— Как вы смогли решить эту проблему?
Эти клетки, как торпеды, идут в очаги воспалений, где находится опухоль. Там вирус выходит из них и начинает убивать опухолевые клетки. Этот метод мы уже отработали на нескольких пациентах. Есть хорошие примеры, когда на МРТ или КТ видно, как опухоль уменьшается и исчезает. Но это происходит не у всех.
— Почему же одни и те же вирусы не справляются с одними и теми же видами опухолей?
— Дело в том, что каждый конкретный вирус нашей панели действует только на 15—20% пациентов. Остальные оказываются к вирусу устойчивы. Однако у нас есть много разных вирусов, и мы можем подобрать свой для любого пациента. Но для этого нужно иметь живые клетки пациента.
Сейчас мы разрабатываем такие тесты, которые могут по обычной биопсии быстро показать, к какому вирусу опухоль будет чувствительна. Это очень сложная работа. Возможно, в будущем специальные клинические лаборатории будут получать от пациентов все необходимые материалы и в режиме конвейера проводить тестирование, подбирать препараты и далее — лечение.
Но сейчас к нам обращаются те, кому уже никто не может помочь. Некоторые из них лечатся у нас по полгода и более. Если идёт стабилизация и видно, что опухоль не растёт, мы делаем перерыв до тех пор, пока рост не возобновится. Но есть случаи, когда рост не возобновляется. У нас есть пациент, который живёт уже четыре года, притом что шансов у него не было. Глиобластома — это смертельное заболевание, средняя продолжительность жизни с ним — 12—15 месяцев с момента постановки диагноза.
— Прежде всего должен сказать, что пока это экспериментальное лечение. Когда Макаров доложил об этом методе на совещании у президента, мне кажется, он не рассчитывал на то, что это вызовет такой резонанс. Сейчас меня буквально атакуют письмами десятки больных с просьбой помочь.
Мне кажется, что не стоило рассказывать про Заворотнюк. Я знаю, что родные Анастасии долгое время вообще не комментировали её состояние и не хотели, чтобы в прессе поднимали этот вопрос. Сам я Анастасию ни разу не видел. Ко мне обращались её близкие с просьбой о помощи. Я сказал, что мы могли бы на первом этапе протестировать её клетки.
Дело в том, что во время операции были забраны живые клетки опухоли и переданы в один из институтов, где их удалось вывести в культуру клеток, чтобы они делились в пробирке. Мы взяли их и протестировали на чувствительность к нашим онколитическим вирусам, которые мы рассматриваем как средство лечения глиобластомы. Обнаружилось, что из 30 вирусов 7—8 вполне подходящие. И на этом этапе мы остановились, потому что муж Анастасии Пётр Чернышов сказал, что сейчас ситуация более-менее спокойная, если будет крайняя необходимость, они к нам обратятся. Это всё, что касается Заворотнюк.
Но всё это мы делали и делаем в очень ограниченном масштабе. Сейчас, когда всё выплеснулось в СМИ, мы просто не справимся с таким валом пациентов.
— Можете ли вы прокомментировать связь между ЭКО и появлением глиобластомы? Есть такие исследования?
— Как я понимаю, этот вопрос опять поднят историей Заворотнюк. В данном случае у неё было ЭКО. Но это никак не говорит о том, что есть какая-то связь. Во-первых, ЭКО не так много делают и глиобластомы — это 1% всех опухолей. Глиобластома встречается не только у женщин. Я думаю, что никакой связи нет. Ведь как может воздействовать ЭКО? Повышается уровень половых гормонов. Но тех гормонов, которые достаточно физиологичные, и так всегда есть в организме. Они просто появляются в другое время и в другой дозе. И вряд ли могут оказать влияние именно на глиальные клетки, с тем чтобы они переродились.
— В мире ведутся подобные исследования по лечению глиобластомы? Что вам известно об этом?
— Мы не первые, кто проверяет вирусы на глиобластоме. Сейчас это очень горячая тема во всём мире. И разные вирусы тестируют для лечения разной онкологии во многих странах. Я знаю один случай, который начали лечить в 1996 году вирусом болезни Ньюкасла, это птичий вирус. И больной до сих пор живёт с глиобластомой. Это опубликованные данные. И есть ещё несколько случаев лечения с помощью рекомбинантных вирусов герпеса.
В прошлом году вышла нашумевшая работа о том, что 20% больных глиобластомой могут быть вылечены вакциной рекомбинантного вируса полиомиелита.
Но нейрохирурги — люди консервативные. Они ни за что не согласятся даже в порядке эксперимента проводить такие опыты на людях. Потому что они очень сильно рискуют, если будет осложнение. Поэтому мы должны дождаться доклинических испытаний, с тем чтобы потом убедить их опробовать схему с прямым введением вируса прямо в опухоль.
— А кто и когда впервые заметил действие вируса на раковые клетки?
— Ещё в начале ХХ века учёные заметили, что опухолевые клетки особенно хорошо размножают вирусы. После инфекционных вирусных заболеваний у некоторых больных при разных видах рака наблюдались ремиссии. И уже тогда возникла мысль о том, что в будущем можно будет лечить онкобольных с помощью вирусов.
В 1950-е годы в Америке проводились эксперименты по лечению рака безнадёжных больных с помощью патогенных вирусов. Считалось, что это меньшее зло по сравнению с самим раком. И тогда были получены положительные результаты. Но поскольку многие больные умирали от инфекционных заболеваний, возник очень большой резонанс. Врачи, которые начали это делать, дискредитировали всю эту область на долгие годы. Были введены дополнительные этические правила. Само упоминание о том, что вирусом можно лечить рак, стало табу.
В 1990-е годы уже стало понятно, как устроены вирусы, структура их генома. Учёные научились вносить изменения в геном вирусов, чтобы сделать их безвредными. И тогда во всём мире начался бум разработки препаратов на основе вирусов для лечения рака. Но тут новая беда. Этому стали сопротивляться фармацевтические компании. Потому что это совершенно другой способ лечения, который подрывает базу их благосостояния.
В начале 10-х годов нашего века многие небольшие компании разрабатывали препараты, которые потом проходили какие-то клинические испытания, были показаны какие-то многообещающие свойства. Но фармацевтические компании скупали эти разработки и практически прекращали деятельность этих небольших стартапов.
— Удалось ли кому-нибудь преодолеть фармацевтическое лобби и зарегистрировать препарат?
— Сейчас в мире зарегистрировано три препарата онколитических вирусов. Один препарат разрешён к использованию в США для лечения злокачественных меланом. Ещё один рекомбинантный аденовирус — в Китае, и один энтеровирус — в Латвии. Но, в общем-то, каждый из этих препаратов находит пока очень ограниченное применение, из-за того что все они действуют только на часть пациентов.
— Пётр Михайлович, а как давно вы ведёте свои исследования?
— Всю жизнь, ещё с 1970-х годов. Мне выпало такое время, когда мы вначале практически ничего не знали о вирусах. И по мере того, как мы что-то узнавали, мы вносили какой-то вклад в эту науку и сами учились. И я начинал как раз с вирусов. Потом переключился на проблему рака — фундаментальные механизмы деления клеток: как нормальная клетка превращается в рак. А потом снова вернулся в вирусологию.
Должен сказать, что и мои родители были вирусологами, они занимались противополиомиелитной кампанией. Моя мать в 1970-е годы изучала, как у детей образуются антитела к полиомиелитной вакцине, и она обнаружила, что у многих детей не образуются антитела. Оказалось, что в кишечнике у детей в это время шла бессимптомная инфекция другого безвредного энтеровируса. И он вызывал неспецифическую защиту от вируса полиомиелита. Поэтому вакцинный полиовирус не мог индуцировать антитела у этих детей. Эти безвредные вирусы были выделены из кишечника здоровых детей. И на их основе были созданы живые энтеровирусные вакцины, которые испытывались для того, чтобы предотвращать какие-то ещё неизвестные инфекции.
И вот мы решили возобновить тот подход, который был предложен моей мамой, когда используется панель энтеровирусов. Оказалось, что те больные, которые нечувствительны к одному вирусу, могут быть чувствительны к другому. Возникла идея подбора вируса под пациента. Мы разработали целую панель собственных вирусов, которые могут также обладать усиленными свойствами. Мы продолжаем эту разработку.
— Ваши вирусы могут побеждать рак. А есть вирусы, которые вызывают развитие опухоли?
— Да. Например, рак шейки матки в 95% случаев вызывается вирусом папилломы. Сейчас уже есть даже вакцины против онкогенных папилломовирусов 16—18-го серотипа, которые применяются для девочек, чтобы не заболевали раком шейки матки. Но это самый большой пример. У большинства видов рака сейчас можно полностью исключить вирусную природу.
— Вы используете естественные вирусы или конструируете их?
— У нас разные есть вирусы. Как я говорил, первая панель была выделена из кишечника здоровых детей. Это природные непатогенные вирусы, которые, кстати говоря, хорошо защищают детей от многих вирусных инфекций. Кроме того, мы делаем синтетические и рекомбинантные вирусы, когда мы вводим определённые изменения в их состав, которые усиливают их онколитические свойства.
— На планете есть ещё места, где может быть очень много вирусов, о которых мы ещё и понятия не имеем. Например, те, что живут в океанских глубинах. Как вы считаете, если вдруг кто-то возьмётся за изучение океана именно с точки зрения вирусов, там могут найтись полезные для вас?
— Да, и сейчас это тоже очень горячая тема. Когда разработали метод секвенирования геномов, ДНК, РНК, то возник соблазн: профильтровать сточные воды, океанические воды, из прудов, морей. Уже пробурили скважину в Антарктиде к древнему озеру, чтобы посмотреть, что там, выделить оттуда биологические компоненты и секвенировать их. И оказывается, что нас окружает огромное количество вирусов, которые абсолютно безвредны. И такое впечатление, что наше исходное представление о вирусах как о чём-то вредном и вызывающем только болезни неверно. Болезнетворный вирус — скорее исключение, чем правило.
Обе бабушки будущего инженера-химика Стефани Каллер умерли от рака кишечника практически одновременно. Всю жизнь они питались здоровой пищей, именно той, которую рекомендуют онкологи в качестве профилактики рака. Однако богатая овощами и ферментированными продуктами диета не спасла их от смертельного заболевания. Этот факт так поразил Каллер, что в итоге стал предметом ее исследовательских работ в области микробиома.
Микробиом и раковая опухоль

Один из самых актуальных вопросов в современных исследованиях рака - определяет ли качество и разнообразие бактерий кишечника человека, будут ли люди успешно реагировать на лечение рака?
Исследование образцов кала пациентов с раком молочной железы и легких, обнаружило отсутствие в их микробиоме важных бактерий. Отсутствие определенных кишечных микробов, в основном бактерий Firmicutes может снижать эффективность лекарств, блокирующих питающие раковые клетки белки и способствующие ответной реакции иммунной системы на злокачественные клетки.
Вместе со своим коллегой-инженером-химиком Стивом Ван Дином Каллер основала Persephone Biome для изучения взаимосвязи между кишечными бактериями и раком. Компания названная в честь Персефоны, греческой богини растительности планирует тестировать определенные кишечные микробы и определить, улучшают ли они функцию ингибиторов рака. Часть изысканий посвящена клеточной терапии CAR-T, в которой используются собственные иммунные клетки пациентов, генетически спроектированные для лечения раковых опухолей.
Цель работы учёных:
- создание терапевтических средств из смеси определённых кишечных бактерий для превращения лиц, не отвечающих на химиотерапию, в респондеров;
- восстанавление микробиома после лечения антибиотиками;
- коррекция микробиома, нарушенного неправильным питанием.
Полезные кишечные микробы могут отсутствовать и у здоровых людей, но больные раком и люди с ослабленной иммунной системой страдают от их отсутствия больше.
Таблетки с бактериями
Считается, что 70% иммунных клеток находятся в кишечнике, который часто называют «вторым мозгом". Исследователи изучили идею об обмене кишечных бактерий человека и даже использовали трансплантации фекальной микробиоты для успешного лечения людей, страдающих воспалительными заболеваниями кишечника. За последнее десятилетие было проведено множество исследований, изучающих роль микробиома во всем: от депрессии и аутизма до сердечной недостаточности и болезни Паркинсона.

Следующий шаг - клинические испытания на людях, рассматривающие возможность предоставления пациентам недостающих бактерий кишечника в виде спор от доноров с благоприятными микробиомами. Другая часть испытания будет тестировать таблетки, полученные из кишечных бактерий выживших после рака, опухоли которых исчезли после приема ингибиторов раковых клеток. Исследователи планируют отслеживать образ жизни пациентов, включая потребление продуктов и клетчатки, чтобы найти связь между показателями ответа на лекарства от рака, разнообразием кишечника и диетой. Авторы проекта надеются, что инструменты генетического секвенирования позволят изучить штаммы бактерий, а также диагностировать опухоли и выбрать правильные методы лечения.
Тем временем, множество исследователей, пытаются привлечь внимание к самому большому препятствию в их работе: отсутствию образцов кала. Ученым нужны образцы фекалий от больных раком, выживших после рака, людей с раковым заболеванием в семье и всех остальных. Их трудно получить, т.к. люди думают, что это грубо и неприлично. Для того, чтобы сломать этот стереотип, участникам проекта вру. [читать полную версию]
Российский медико-биологический вестник имени академика И.П. Павлова, №1, 2015 г., стр. 155
БАКТЕРИОЛОГИЧЕСКИЕ ИССЛЕДОВАНИЯ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ
(РЕТРОСПЕКТИВНЫЙ ОБЗОР)
Б.В. Рубцов
Микробиологическое изучение опухолей
Микробиологические исследования злокачественных опухолей в СССР
Подводя итог рассмотрению ранних работ по бактериологии онкологических заболеваний можно сделать вывод о том, что злокачественные онкологические
заболевания человека и животных ассоциированы с бактериальной инфекцией. В опухолях и крови больных с высокой частотой (80%-90%) обнаруживается некий
"полиморфный микроб" или группа микроорганизмов, имеющих сходные культуральные и биологические свойства. Таксономическая принадлежность этих
микроорганизмов до конца не определена, однако, по данным отечественных микробиологов они относятся к коринеморфным бактериям. В наше время этот
вопрос может быть легко решен с помощью молекулярно-генетических методов.
Роль этих микроорганизмов в процессе канцерогенеза до сих пор не известна. Часть исследователей объясняют их постоянное присутствие в опухолях
вторичной бактериальной колонизацией (бактериальной инвазией) и отводят имлишь патогенетическое значение в развитии опухолевого процесса.
В то время как другие авторы продемонстрировали возможность индуции злокачественных опухолей у лабораторных животных, заражая их культурой
микроорганизмов, выделенных из опухолей и крови онкологических больных. Эти результаты имеют большое научное и практическое значение, поскольку
указывают на возможную этиологическую роль бактериального фактора в процессе онкогенеза.
В завершение хотелось бы выразить надежду, что приведенные в обзоре сведения заострят внимание отечественных исследователей на проблеме связи между
бактериальными факторами и канцерогенезом. Возобновление таких исследований может привести к разработке новых методических подходов к лечению
онкологических заболеваний.
1. Браунштейн А.П. Значение бластомицетов в происхождении злокачественных опухолей / А.П. Браунштейн // Русский врач. – 1906. – № 13. – С. 381.
2. Влаев Г.М. Дальнейшие исследования и наблюдения относительно происхождения и сывороточного лечения злокачественных опухолей / Г.М. Влаев //
Врачебная газета. – 1903. – С. 40-43; 48-49.
3. Голосова Т.В. Выделение и идентификация микроорганизмов из крови и костного мозга больных острым лейкозом / Т.В. Голосова, В.А. Мартынова,
Г.В. Осеченская // Пробл. гематологии и переливания крови. – 1969. – №4. – С. 25-29.
4. Затула Д.Г. Микробиологические аспекты изучения злокачественных опухолей / Д.Г. Затула. – Киев: Наукова думка, 1976. – 239 с.
5. Коротнев А. Rhopalocephalus canceromatosus / А. Коротнев // Врач. – 1893. – № 2. – С. 23.
6. Кочеткова В.А. Микрофлора лимфатических узлов при осложнениях у больных раком легких / В.А. Кочеткова, Н.Д. Гарин // Вопр. онкологии. –
1964. – № 11. – С. 3-7.
7. Кочеткова В.А. До питання про мiкрофлору лiмфатичних вузлiв та пухлин онкологiчних хворих / В.А. Кочеткова // Мiкробiол. журн. – 1974.
– Т. 36, №3. – С. 333-340.
8. Крестовникова В.А. Микробиологическое изучение раковых опухолей / В.А. Крестовникова; под ред. Г.П. Калина. – М.: Медгиз, 1960. – 188 с.
9. Крестовникова В.А. Природа раково�
1. РАЗНОСЧИК ПАПИЛЛОМ
Что делать:
Хорошая новость: предраковое состояние, вызванное ВПЧ, сейчас успешно лечится. Поэтому главная задача — вовремя обнаружить такие изменения. Для этого применяются специальные медицинские тесты, в частности, женщинам рекомендуется регулярно делать так называемый ПАП-тест (исследование мазка с поверхности шейки матки). Он входит в бесплатную диспансеризацию по полису ОМС, делается раз в 3 года, но при наличии ВПЧ №16 и №18 врач-гинеколог, как правило, назначает более частый график обследования (так же бесплатно по полису ОМС).
2. ОХОТНИК ЗА ПЕЧЕНЬЮ
Еще одна группа вредителей, способных вызвать рак — вирусы гепатитов В и С. Заразиться ими можно при незащищенных половых контактах, а также, например, при пирсинге или маникюре, если косметологические салоны игнорируют правила санобработки инструментов. У больных гепатитом В при отсутствии лечения в 10 – 20% случаев развивается цирроз печени, который примерно у 10% пациентов переходит в рак. Гепатит С, если его не лечить, приводит к раку печени у 25%, то есть у каждого четвертого (по данным Европейской ассоциации по изучению печени, EASL).
Что делать:
Имейте в виду, что от гепатита В существует вакцина, которая гарантирует защиту печени от опасного вируса. В нашей стране с 1996 г. она включена в Национальный календарь профилактических прививок (НКПП), делается бесплатно всем малышам, а также вакцинироваться могут взрослые в возрасте до 55 лет, не привитые от гепатита В ранее.
3. УБИЙЦА ИММУНИТЕТА
- Наша иммунная система играет большую роль в распознавании, атаке и уничтожении новообразованных раковых клеток. Если человек заражается ВИЧ , то иммунитет, подорванный вирусом, может позволить новым раковым клеткам выжить достаточно долго, чтобы вырасти в серьезную, опасную для жизни опухоль, - поясняет онколог Дмитрий Олькин. Известно, что ВИЧ-инфекция связана с повышенным риском развития рака шейки матки, саркомы Капоши , а также рядом гематологических онкозаболеваний.
Что делать:
4. ОПАСНЫЙ ГЕРПЕС
HHV-8 передается, как и остальные виды герпеса — при половых контактах, через слюну при поцелуях, при пользовании общей посудой. Инфекция живет в организме человека всю жизнь, но у большинства людей все-таки обходится без развития рака, радует наш эксперт. Однако если иммунитет сильно ослаблен — подорван ВИЧ или после пересадки органов, то риск возникновения саркомы Капоши резко повышается.
Что делать:
Стараться соблюдать правила гигиены: не пить из одного стакана, избегать незащищенных половых контактов с партнерами, чье состояние здоровья вам не известно. При ослаблении иммунитета (при ВИЧ, после трансплантации) строго соблюдать рекомендации врача.
5. ВИРУС ЭПШТЕЙНА-БАРР
Эта инфекция повышает риск развития рака носоглотки, некоторых видов лимфом, а также рака желудка. Онкозаболевания, спровоцированные вирусом Эпштейн - Барра (ЭБВ), чаще встречаются в Африке и Юго-Восточной Азии , уточняет Дмитрий Олькин. К счастью, немногие люди с ЭБВ заболевают раком.
Что делать:
Пациентам с ЭБВ рекомендуется пролечивать инфекцию в период обострений, а также регулярно проходить диспансеризацию и вовремя лечить обострения любых хронических болезней, не запуская их.
- Если у человека в желудке живет бактерия Helicobacter pylori (H pylori), она может вызвать гастрит и язву желудка. В случае язвы может возникнуть воспаление, повреждающее внутренний слой желудка, и некоторые из таких воспалений ведут к раку, - поясняет эксперт.
Что делать:
7. ХРОНИЧЕСКИЕ ВОСПАЛЕНИЯ
Что делать:
Вовремя лечиться, не запуская воспаления, чтобы они не переходили в хроническую форму.
Семиглазова Т.Ю. 1,2 , Бриш Н.А. 1 , Галунова Т.Ю. 1 , Бернацкий А.С. 1 , Семиглазов В.В. 1,3 , Балдуева И.А. 1,2 , Проценко С.А. 1
Современная концепция симбиотических взаимоотношений между макроорганизмом и микробиотой кишечника не вызывает сомнений. На состав микробиоты прежде всего влияют факторы окружающей среды, генетические и иммунные факторы организма хозяина. Дисбиоз кишечника может привести к доминированию некоторых видов бактерий, способствующих активации механизмов канцерогенеза и развитию злокачественных опухолей толстой кишки за счет хронического воспаления или местной иммуносупрессии. В эру иммуноонкологии роль кишечной микробиоты в формировании ответа на иммунотерапию злокачественных новообразований представляет большой интерес для медицинского сообщества. Учитывая, что состав кишечной микробиоты является индивидуальным для каждого человека, ее исследование как нельзя лучше вписывается в набирающую силу концепцию персонализированного медицинского подхода.
Ключевые слова: кишечная микробиота, иммунотерапия, checkpoint-ингибиторы, антибиотикотерапия.
Роль кишечной микробиоты в различных аспектах лечения онкологических заболеваний с каждым годом становится все более значимой темой для медицинского сообщества. Это имеет свое отражение в количестве научных публикаций: при поиске работ, содержащих указание на связь состава микробиома с онкологическими заболеваниями, представлено более 1500 статей. Разрабатываются новые методы использования микроорганизмов в диагностике, лечении и прогнозировании отдельных злокачественных новообразований. Изучением роли количественного и качественного состава микрофлоры в формировании ответа на различные терапевтические агенты в настоящее время занимаются исследователи во многих странах мира. Большой интерес представляют научные работы, посвященные области иммунотерапии онкологических заболеваний. Также определение состава кишечной микробиоты является одной из перспективных задач, которая в будущем позволит оценивать клинический ответ на применение таргетных препаратов.
СИМБИОТИЧЕСКИЕ ВЗАИМООТНОШЕНИЯ
МАКРООРГАНИЗМА И МИКРОБИОТЫ КИШЕЧНИКА
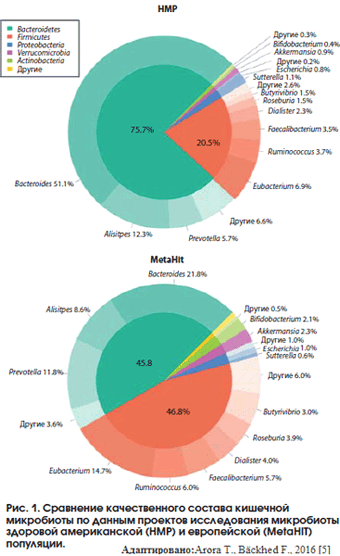
Микробиом желудочно-кишечного тракта в представлении современной науки рассматривается как гетерогенный набор разнообразных микроорганизмов, количественно и качественно отличающийся у каждого индивида и играющий значительную роль в биохимическом, метаболическом и иммунном гомеостазе макроорганизма, а также представляющий собой неспецифический барьер от экзогенных факторов агрессии. Условия среды в толстой кишке способствуют нормальной жизнедеятельности микроорганизмов, и численность 36000 видов бактерий достигает пиковых значений – 10 10 -10 13 КОЕ/мл (1011 бактерий на грамм кишечного содержимого) именно в этом отделе кишечника 2. Анаэробные бактерии преобладают над аэробами в соотношении 1000:1 2. На основании данных научных исследований общей популяции в Америке (клиническое исследование HMP) и в Европе (клиническое исследование MetaHIT) было показано, что доминантными типами микроорганизмов в составе микробиоты являются Bacteroidetes и Firmicutes 4.
Колонизация желудочно-кишечного тракта микроорганизмами начинается сразу же после рождения, а точнее уже при прохождении плода через родовые пути матери 7. На разнообразие микробиома оказывает влияние большое количество факторов, таких как диета, половая и этническая принадлежность 10. Способ родоразрешения при этом оказывается очень важным фактором, который обусловливает получение новорожденным первичной микробиоты. В нескольких зарубежных исследованиях доказана корреляция между кесаревым сечением и становлением иммунной системы 18. Это означает, что состав комменсальной микрофлоры может играть роль в иммунном ответе и, таким образом, возможно, определяет уровень восприимчивости организма к различным заболеваниям [8, 19]. Дисбиоз кишечника, как проявление нарушения равновесия в бактериальной экосистеме, приводит к превалированию количества некоторых видов бактерий над другими. Это может с большой степенью вероятности способствовать активации механизмов канцерогенеза и, как следствие, возникновению злокачественных новообразований 23.
Следует учитывать, что кишечный микробиом – модифицируемая единица, что может быть залогом хороших результатов восстановления благоприятного микробиоценоза у онкологических больных. С началом развития методов иммунотерапии в последние годы стала рассматриваться также тема роли кишечной микробиоты в формировании ответа на воздействие различных классов противоопухолевых препаратов. Результаты достаточно большого количества исследований показывают, что при внесении бактериальных образцов от доноров в организм пациентов, страдающих от онкологических заболеваний, стимулируется рост собственной микробиоты у реципиентов, увеличение ее разнообразности, что в свою очередь повышает способность организма осуществлять контроль над механизмами канцерогенеза 27. Это дает основание дальнейшему исследованию корреляции между использованием иммунотерапевтических методов лечения злокачественных новообразований и значением состава микрофлоры кишечника. Некоторые исследователи говорят о том, что микробиота кишечника оказывает влияние на распространенность опухоли и, следовательно, продолжительность жизни пациентов путем воздействия на процессы молекулярного окислительного стресса 33 и системную генотоксичность периферических лейкоцитов [31], что приводит к снижению активности процессов системного воспаления, играющего основную роль в развитии злокачественных новообразований.
Учитывая, что состав кишечной микробиоты индивидуален для каждого отдельного человека, можно говорить о том, что необходимость его изучения соответствует принципам персонализированной медицины.
КИШЕЧНАЯ МИКРОБИОТА КАК МОДУЛЯТОР ОТВЕТА
НА ИММУНОТЕРАПИЮ ЗЛОКАЧЕСТВЕННЫХ ОПУХОЛЕЙ
Мнение о том, бактерии каких преимущественно типов могут опосредовать наилучший ответ на противоопухолевую иммунотерапию, до сих пор не стало единым. Имеются данные о том, что наиболее выраженную эффективность показывают анти-PD-1-препараты, применяющиеся для пациентов, у которых обнаруживается преобладание бактерий рода Ruminococcaceae в фекальных образцах [43]. Однако исследователи других крупных лабораторий сообщают о том, что относительное превалирование Clostridiales [38] связано с более высокой эффективностью проводимой терапии, а также есть сведения, говорящие, что у когорт пациентов с преобладанием Faecalibacterium значительно повышает показатель выживаемости без прогрессирования (PFS) [44]. При этом пациенты, в образцах которых отмечалось повышенное содержание Bacteroidales, имели меньшую PFS по сравнению с группой пациентов со сниженным количеством этих бактерий в образцах.
В противоположность вышеупомянутым результатам имеется мнение, что эффективность анти-CTLA-4-терапии взаимосвязано с наличием в составе кишечной нормобиоты различных представителей рода Bacteroidales. На базе мышиных моделей, для того чтобы убедиться в связи доминирования Bacteroidales spp. с противоопухолевым эффектом анти-CTLA-4-препаратов, были выполнены повторные колонизации желудочно-кишечного тракта фекальными образцами, полученными от доноров и содержащими изоляты представителей рода Bacteroidales. На основании полученных данных было установлено, что заселение кишечника сочетанием B. fragilis и Burkholderia cepacia было связано с более выраженной эффективностью анти-CTLA-4-препаратов, в отличие от всех других использованных изолятов [38]. По мнению авторов, формирование ответа на иммунотерапию могло быть обусловлено Akkermansia muciniphila, так как эти бактерии являются комменсалами, и их присутствие в фекальных образцах было чаще связано с наилучшим клиническим исходом заболевания [38].
В нескольких научных исследованиях было установлено, что повышение количества бактерий рода Bifidobacterium в составе кишечного микробиома формирует Т-клеточный противоопухолевый ответ [37, 39-40]. Также было показано, что обладание комменсальной флорой с превалированием рода Bifidobacterium может обусловливать повышение активности противоопухолевого иммунитета, что тем самым улучшает эффект анти-PD-L1-терапии [37].
И, конечно же, оценка взаимосвязи ответа на анти-CTLA-4-препараты с количественным и качественным составом микробиома кишечника в настоящее время также имеет большую ценность. Анализ ряда зарубежных исследований показал, что имеются веские доказательства наличия изменений на уровне рода микроорганизмов сразу же после инициации лечения злокачественных новообразований с применением CTLA-4-ингибиторов. Так, было зафиксировано быстрое уменьшение представительства как Bacteroidales, так и Burkholderiales, с относительным преобладанием содержания Clostridiales при использовании ипилимумаба [38, 46].
Из всего вышеизложенного можно сделать заключение, что CTLA-4-ингибиторы могут влиять на количественный состав рода Bacteroides spp. в кишечнике, обладающего иммуногенными свойствами, что, в свою очередь, влияет на эффективность препаратов данной группы.
Эффективность иммунотерапии онкологических заболеваний
в условиях предшествующей антибиотикотерапии
Из проанализированных данных следует, что наиболее выраженный эффект иммунотерапии злокачественных опухолей возможно ожидать у пациентов, имеющих более широкое представительство микроогранизмов в составе микробиома кишечника. Следовательно, встает вопрос о пользе изучения влияния антибиотиков, которое они оказывают на эффективность применения методов иммунотерапии онкологических заболеваний, например, checkpoint-ингибиторов. Тот факт, что использование антибактериальных препаратов влечет за собой резкое изменение количественного и качественного состава микробиоты, как патогенной, так и комменсальной, на настоящее время доказан во множестве исследований 48. Антибиотики, независимо от пути введения их в организм, изменяют гомеостатическое равновесие бактериальной флоры кишечника 51, что существенно влияет на метаболизм всей совокупности микроорганизмов. В недавнем времени было установлено, что бактерии имеют значительное влияние на дифференцировку стволовых клеток. В свою очередь антимикробные препараты, изменяя состав микробиоценоза кишечника, приводят к различным модификациям путей развития клеток и, как следствие, к нарушениям физиологии на всех уровнях жизнедеятельности макроорганизма [52].
Кишечная микробиота играет важную роль в формировании иммунного ответа хозяина, поэтому необходимо учитывать то, что изменения ее состава могут приводить к негативным последствиям для макроорганизма [53]. Это было показано в ряде исследований, результаты которых говорят о том, что имеется определенная связь между составом микробиома и риском развития некоторых аутоиммунных заболеваний 53. Согласно имеющимся данным нескольких доклинических исследований, микробиота влияет на активность ингибиторов иммунных контрольных точек, а применение антибактериальных препаратов широкого спектра действия приводит к снижению эффекта от их применения 57. Существует мнение, что отрицательный эффект антибиотикотерапии на фоне использования checkpoint-ингибиторов связан исключительно с элиминацией комменсальной флоры.
На ежегодном международном урологическом симпозиуме (Орландо, Флорида), который был проведен в феврале 2017 года, были представлены результаты ретроспективного анализа данных 80 пациентов (Lisa Derosa et al., 2017) [56], установившие отчетливое снижение эффективности применения checkpoint-ингибиторов у больных почечно-клеточным раком, подвергшихся эмпирической или этиологической антибактериальной терапии за месяц до начала специального лечения.
Читайте также:

