Мелкоклеточный рак легкого лучевая терапия

Симптомы мелкоклеточного рака легкого
Мелкоклеточный рак почки на ранних стадиях протекает бессимптомно. Наиболее распространенные признаки данного заболевания появляются на более поздней стадии. К ним относится:
- гематурия,
- боли в поясничной области,
- прощупывание опухоли,
- повышение артериального давления.
Диагностика мелкоклеточного рака легкого
К наиболее эффективным методам диагностики данного заболевания относится:
- рентгенологическое исследование,
- флюорография,
- микроскопия мокроты,
- компьютерная томография,
- бронхоскопия.
Лечение мелкоклеточного рака
Как и для других видов рака, для лечения мелкоклеточного рака используются три основных метода:
- оперативное вмешательство,
- лучевая терапия,
- химиотерапия.
Как правило, оперативное вмешательство показано больным МРЛ на ранних этапах.
Лучевая терапия может обеспечить существенный регресс опухоли в 70 % случаев, но, как и в случае с оперативным лечением, облучение не эффективно при использовании в монорежиме, так как это не препятствует образованию отдаленных метастазов.
Химиотерапия представляет наиболее действенный метод лечения мелкоклеточного рака легкого. Наилучшие результаты достигаются от одновременного применения нескольких - 2-3-х, реже – 4-х и более активных препаратов. Подобные комбинации препаратов называются полихимиотерапией.
На выбор терапевтического лечения мелкоклеточного рака легкого влияет в первую очередь распространенность ракового процесса. Существует две формы заболевания - локализованная и распространенная.
Локализованная форма мелкоклеточного рака легкого хорошо поддается лечению. Статистика результатов ее лечения данной формы МРЛ имеет следующие показатели:
- эффективность лечения – в 65-90 % случаев,
- регресс опухоли - в 45-75 % случаев,
- двухлетняя выживаемость составляет 40-50 %;
- пятилетняя выживаемость составляет около 10%.
Проведение химиотерапии в 2-4 курса является основой в лечении локализованной формы МРЛ. Лучевую терапию следует начинать на фоне химиотерапии: либо во время, либо после 1-2 курсов. Если у больного наблюдается полная ремиссия, целесообразно проведение облучения головного мозга. Это необходимо и потому, что МРЛ отличается высокой вероятностью, порядка 70%, метастазирования в головной мозг.
Больным распространенным МЛР предписано лечение посредством комбинированной химиотерапии. В данном случае облучение целесообразно производить только при наличии таких показаний, как при метастатическом поражении:
- костей,
- головного мозга,
- надпочечников,
- лимфатических узлов,
- средостения наряду со сдавливанием верхней половой вены.
МРЛ довольно хорошо поддается лечению лучевой терапией и химиотерапией, но чувствительность к лечению нередко нивелируется высоким уровнем возникающих рецидивов. Поэтому пациентам, которым по медицинским показаниям отказано в проведении хирургической операции, назначается классическая лучевая терапия, которая, в свою очередь, не позволяет провести эскалацию дозы из-за побочных эффектов.
Гипофракционированная стереотаксическая лучевая терапия, представленная на российском рынке новейшей высокотехнологичной разработкой — радиохирургической роботизированной системой КиберНож. Она позволяет увеличить суммарную дозу на патологический очаг и, как следствие, увеличить вероятность локального контроля опухоли и выживаемость пациентов.
КиберНож позволяет проводить стереотаксическую радиохирургию опухолевых образований без ограничения дыхания пациента. Система слежения за дыханием Synchrony синхронизирует движение робота с дыханием пациента, и, соответственно, с движением мишени. Погрешность позиционирования мишени при такой работе системы снижается до 1 (!) мм.
В каждом отдельном случае стоимость определяется на основании показаний к лечению, необходимого количества фракций и плана лечения разработанного врачом радиационным онкологом и медицинским физиком.
| Стоимость лечения | |
| Рак легкого (от 370 000) |
Точная стоимость лечения определяется только после консультации с врачом
- О центре
- Специалисты
- Новости
- Партнеры
- Отзывы
- Запись на приём
- Стоимость лечения
- Консультация
- Диагностика
- FAQ
- Статьи
- Аппарат Кибернож
- Уникальность системы
- Показания к лечению
- Противопоказания
- Как происходит лечение
- Сравнение методов
- Дистанционная
- Комбинированное лечение
- Лечение
- Опухоли головного мозга
- Рак легкого
- Рак печени
- Рак почки
- Рак предстательной железы
- Рак носоглотки
- Опухоль спинного мозга
- Опухоль ЦНС у детей
- Рак поджелудочной железы
- Опухолевое поражение костей
- Метастазы
- Невралгия тройничного нерва
- Пяточная шпора
Мелкоклеточный рак легкого относится к числу радиорезистентных, и более чем в 80% случаев наблюдается полная регрессия первичной опухоли. После облучения в умеренной дозе (40-50 Гр в течение 4-5 недель) может отмечаться полная регрессия даже больших первичных опухолей с признаками лимфоаденопатии в области ворот и средостения.
Одно время радиологи проявляли интерес к схеме ежедневного двухкратного (гиперфракционированного) облучения, хотя в рандомизированных исследованиях ее преимущества не удалось продемонстрировать.
Обычно вначале опухоль реагирует на облучение, однако в пределах поля часто возникают рецидивы, и не всегда удается достигнуть контроля над ростом локального образования. Как и следует ожидать, это можно сделать при облучении в более высоких дозах, хотя при этом усиливаются токсические эффекты, особенно если наряду с облучением назначают химиотерапию.
В нескольких рандомизированных исследованиях была проверена эффективность совместного назначения химио- и лучевой терапии. Больные, получавшие курс химиотерапии, были разделены на две группы, одной из которых проводили облучение грудной клетки.
Группы были слишком малочисленны для того, чтобы показать достоверные различия между ними, однако повторный анализ данных по каждому больному показал, что 3-летняя выживаемость больных в группе, получавшей химио- и лучевую терапию, увеличилась на 5% (с 7% до 12%), что эквивалентно 60%-му относительному увеличению выживаемости. При совместном назначении химио- и лучевой терапии развиваются сильные токсические осложнения.
Тем не менее лучевая терапия широко используется в тех случаях, когда опухолевый процесс носит ограниченный характер, состояние больных удовлетворительное, и они хорошо реагируют на химиотерапию. Первые рандомизированные исследования не выявили существенных преимуществ комбинированного применения химио- и лучевой терапии. Также оставался невыясненным вопрос об оптимальном времени начала облучения.
Хотя в исследованиях из Канады утверждалось о преимуществах раннего облучения, это не подтвердилось другими данными, и при проведении метаанализа не было показано различий по продолжительности жизни больных в зависимости от времени начала облучения.
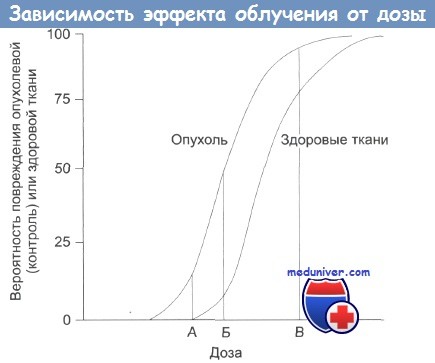
Зависимость терапевтического эффекта от дозы облучения.
А — нижняя безопасная доза;
Б — увеличение дозы: растет поражение здоровых тканей;
В — наивысшая вероятность успешного лечения, но и высокая вероятность поражения здоровых тканей, многочисленные побочные эффекты, некоторые из которых могут проявиться в отдаленном будущем
Итак, возможность назначения больным лучевой терапии необходимо предусматривать при следующих обстоятельствах:
1. При локализованной опухоли, частично или полностью чувствительной к химиотерапевтическим препаратам
2. При локальных рецидивах
3. При наличии синдрома верхней полой вены, который не снимается химиотерапевтическими препаратами.
Часто лучевая терапия оказывает выраженное паллиативное действие при мелкоклеточном раке легкого, и ее назначают при болях в костях и при обнаружении метастазов в головном мозге. По данным клинического обследования, у 25% больных с мелкоклеточным раком легкого в головном мозге обнаруживаются метастазы, а по данным аутопсии они присутствуют у двух третей больных.

Во многих случаях эффективно облучение головного мозга в дозе 20 Гр, назначаемой пятью фракциями в неделю. Эта доза хорошо переносится больными, и нет необходимости назначать более продолжительные режимы. Такой же режим облучения обычно назначают при обнаружении в костях метастазов, причиняющих больным сильные боли.
При болезненных метастазах в кости, которые часто обнаруживаются при мелкоклеточном раке легкого, оценивалась эффективность назначения больным профилактического облучения головы. Метаанализ данных, полученных в двух крупномасштабных рандомизированных исследованиях, показал, что при назначении этой процедуры частота развития в мозге метастазов снижается с 40% до уровня, составляющего менее 10%.
Однако это лишь незначительно влияло на продолжительность жизни больных. Таким образом, профилактическое облучение головы ослабляет болевой синдром при метастазировании опухоли в головной мозг. В то же время после облучения головы проявляются признаки острого токсического эффекта (спутанность мыслей, чувство беспокойства, провалы в памяти) и в дальнейшем развивается неврологическая симптоматика. Правда, это наблюдается достаточно редко.
Обычно рекомендуется назначать профилактическое облучение головы больным, которые хорошо реагировали на химиотерапию. У больных, для которых химиотерапия оказалась неэффективной, назначение этой процедуры может привести к снижению продолжительности жизни.
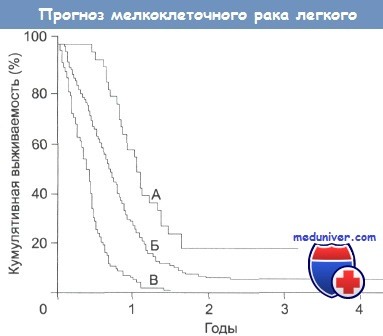
Значение прогностических факторов при мелкоклеточном раке легкого:
А — Больные характеризуются хорошим общим состоянием; результаты биохимических анализов в норме.
В — Больные с плохим общим состоянием; результаты более двух биохимических анализов отличаются от уровня нормы.
Б — Построено по данным разницы между первой и второй группой.
В мировой статистике среди всех злокачественных опухолей рак легкого занимает первое месте по показателям смертности. Пятилетняя выживаемость больных составляет 20%, то есть четверо из пяти пациентов умирают в течение нескольких лет после установления диагноза.
Сложность заключается в том, что начальные стадии бронхогенного рака трудно диагностировать (его не всегда можно увидеть на обычной флюорографии), опухоль быстро формирует метастазы, вследствие чего становится нерезектабельной. Около 75% случаев впервые установленного диагноза – это уже рак с метастатическими очагами (местными или отдаленными).
Лечение рака легких – актуальная проблема во всем мире. Именно неудовлетворенность специалистов результатами лечения мотивирует к поиску новых методов воздействия.
Основные направления
Выбор тактики напрямую зависит от гистологического строения опухоли. Принципиально выделяют 2 основных типа: мелкоклеточный рак легкого (МРЛ) и немелкоклеточный (НМРЛ), куда входят аденокарцинома, плоскоклеточный и крупноклеточный рак. Первая форма является наиболее агрессивной, рано образует метастатические очаги. Поэтому в 80% случаев применяют медикаментозное лечение. При втором гистологическом варианте — основной метод — хирургический.
Операция. В настоящее время, является единственным радикальным вариантом воздействия.

Таргетная и иммунотерапия. Относительно новые методы лечения. Основаны на целенаправленном точном воздейвлиянии на клетки опухоли. Не все случаи рака легкого подходят для такого лечения, только некоторые типы НМРЛ с определенными генетическими мутациями.
Лучевая терапия. Назначается пациентам, которым не показана операция, а также в составе комбинированного метода (предоперационное, послеоперационное облучение, химиолучевая терапия).
Симптоматическое лечение — направлено на облегчение проявлений болезни – кашля, одышки, боли и других. Применяется на любом этапе, является основным в терминальной стадии.
Хирургическое вмешательство
Оперативное лечение показано всем больным с немелкоклеточным раком легкого с 1 по 3 стадию. При МРЛ с 1 по 2 ст. Но, учитывая тот факт, что выявляемость на раннем этапе развития выявляемость новообразований крайне низкая, то хирургическое вмешательство проводится не более чем в 20% случаев.
Основные виды операций при раке легкого:
- Пульмонэктомия – удаление всего органа. Наиболее частый вариант хирургического лечения, выполняемый при центральном расположении (с поражением главных бронхов) опухоли.
- Лобэктомия – удаление доли, показанием является наличие периферического образования, исходящего из мелких воздухоносных путей.
- Клиновидная резекция – удаление одного или нескольких сегментов. Проводится редко, чаще у ослабленных больных и при доброкачественных новообразованиях.
Противопоказания для операции:
- Наличие отдаленных метастазов.
- Тяжелое общее состояние, декомпенсированные сопутствующие заболевания.
- Хронические патологии легких с имеющейся дыхательной недостаточностью.
- Близкое расположение опухоли к органам средостения (сердцу, аорте, пищеводу, трахее).
- Возраст старше 75 лет.
Перед операцией проводится подготовка больного: противовоспалительное, общеукрепляющее лечение, коррекция нарушений основных функций организма.
Операция чаще выполняется открытым методом (торакотомия), но возможно удаление доли органа и торакоскопическим доступом, что менее травматично. Вместе с тканью легкого удаляются и регионарные лимфоузлы.
После операции обычно проводится адъювантная химиотерапия. Возможно также проведение хирургического лечения после предоперационной (неоадъювантной) химиолучевой терапии.
Химиотерапия
По данным ВОЗ, химиотерапия при раке легких показана 80% больным. Химиопрепараты – это лекарства, которые либо блокируют метаболизм опухолевых клеток (цитостатики), либо напрямую отравляющие опухоль (цитотоксическое вохдействие) в результате чего деление их нарушается, карцинома замедляет свой рост и регрессирует.
Для лечения злокачественных опухолей легкого в качестве первой линии применяются препараты платины (цисплатин, карбоплатин), таксаны (паклитаксел, доцетаксел), гемцитабин, этопозид, иринотекан, циклофосфамид и другие.
Для второй линии — пеметрексед (алимта), доцетаксел (таксотер).
Применяют обычно комбинации из двух препаратов. Курсы проводятся с интервалом в 3 недели, количество — от 4-х до 6. При неэффективности 4-х курсов лечения первой линии применяются схемы второй линии.
Лечение химиопрепаратами более 6-ти циклов нецелесообразно, так как их побочные эффекты будут превалировать над пользой.
Цели химиотерапии при раке легких:
- Лечение больных с распространенным процессом (3-4 стадии).
- Неоадъювантная предоперационная терапия для уменьшения размеров первичного очага, воздействия на регионарные метастазы.
- Адъювантная послеоперационная терапия для профилактики рецидивов и прогрессии.
- В составе химиолучевого лечения при неоперабельной опухоли.
Различные гистологические типы опухолей обладают неодинаковым ответом на лекарственное воздействие. При НМРЛ эффективность химиотерапии колеблется от 30 до 60%. При МРЛ ее результативность достигает 60-78%, причем у 10-20% больных достигается полный регресс новообразования.
Химиотерапевтические препараты действуют не только на опухолевые клетки, но и на здоровые. Побочных эффектов от такого лечения обычно не избежать. Это выпадение волос, тошнота, рвота, диарея, угнетение кроветворения, токсические воспаления печени, почек.
Такое лечение не назначаются при острых инфекционных заболеваниях, декомпенсированных заболеваниях сердца, печени, почек, заболеваниях крови.
Таргетная терапия
Это относительно новый и перспективный метод лечения опухолей с метастазами. Если стандартная химиотерапия убивает все быстроделящиеся клетки, то таргетные препараты избирательно действуют на конкретные целевые молекулы, способствующие размножению раковых клеток. Соответственно они лишены тех побочных действий, которые мы наблюдаем в случае с обычными схемами.
Однако таргетная терапия подходит не всем, а только пациентам с НМРЛ при наличии определенных генетических мутаций в опухоли (не более 15% от общего числа больных).
Применяется такое лечение у пациентов с 3-4 стадиями рака чаще в комбинации с химиотерапией, но может выступать и как самостоятельный метод в случаях, когда химиопрепараты противопоказаны.
Широко применяются в настоящее время тирозинкиназные ингибиторы EGFR гефинитиб (иресса), эрлотиниб (тарцева), афатиниб, цетуксимаб. Второй класс таких препаратов – это ингибиторы ангиогенеза в опухолевой ткани (авастин).
Иммунотерапия
Это наиболее перспективный метод в онкологии. Основная его задача – усилить иммунный ответ организма и заставить его побороть опухоль. Дело в том, что раковые клетки подвержены различным мутациям. Они образуют на своей поверхности защитные рецепторы, которые препятствуют распознаванию их иммунными клетками.
Ученые разработали и продолжают разрабатывать препараты, блокирующие эти рецепторы. Это моноклональные антитела, которые помогают иммунной системе победить чужеродные опухолевые клетки.
Лучевая терапия
Лечение ионизирующим излучением направлено на повреждение ДНК раковых клеток, в результате чего они перестают делиться. Для такого лечения применяются современные линейные ускорители. При раке легкого проводится в основном дистанционная лучевая терапия, когда источник излучения не соприкасается с телом.
Лучевое лечение применяется у пациентов как с локализованным, так и с распространенным раком легкого. При 1-2 стадии выполняется пациентам с противопоказаниями к операции, а также у неоперабельных больных. Чаще проводится в комбинации с химиотерапией (одновременно или последовательно). Химиолучевой метод — основной в лечении локализованной формы мелкоклеточного рака легкого.
При метастазах в головной мозг МРЛ лучевая терапия является также основным методом лечения. Облучение применяется и как способ облегчить симптомы при сдавлении органов средостения (паллиативное облучение).
Предварительно опухоль визуализируется с помощью КТ, ПЭТ-КТ, на коже пациента наносятся метки для направления лучей.
В специальную компьютерную программу загружаются изображения опухоли, формируются критерии вохдействия. Во время процедуры важно не двигаться и задерживать дыхание по команде врача. Проводятся сеансы ежедневно. Существет гиперфракционная интенсивня методика, когда сеансы проводят каждые 6 часов.
Основные отрицательные последствия лучевой терапии: развитие эзофагита, плеврита, кашель, слабость, затруднение дыхания, редко – поражение кожи.

Воздействие происходит из нескольких положений, потоки излучения сходятся в ткани опухоли с точностью до миллиметра, не затрагивая здоровые структуры. Эффективность метода при некоторых опухолях достигает 100%.
Основные показания для системы Кибер-нож – это НМРЛ 1-2 стадии с четкими границами размером до 5 см, а также единичные метастазы. Избавиться от таких опухолей можно за один или несколько сеансов. Процедура безболезненная, бескровная, выполняется амбулаторно без наркоза. При этом не требуется строгая фиксация и задержка дыхания, как при других методах облучения.
Принципы лечения немелкоклеточного рака легкого
Стадия 0 (интраэпителиальная карцинома) – эндобронхиальное иссечение или открытая клиновидная резекция.
- I ст. — хирургическое лечение или лучевая терапия. Применяется сегментарная резекция или лобэктомия с иссечением медиастинальных лимфатических узлов. Лучевое лечение проводится пациентам с противопоказаниями к операции или отказавшимся от нее. Наилучшие результаты дает стереотаксическая радиотерапия.
- II ст. НМРЛ – хирургическое лечение (лобэктомия, пульмонэктомия с лимфаденэктомией), неоадъювантная и адъювантная химиотерапия, лучевая терапия (при неоперабельности опухоли).
- III ст. – хирургическое удаление резектабельных опухолей, радикальная и паллиативная химиолучевая терапия, таргетная терапия.
- IV ст. – комбинированная химиотерапия, таргетная, иммунотерапия, симптоматическое облучение.
Принципы лечения мелкоклеточного рака легких по стадиям
Для лучшего определения подходов к лечению онкологи делят МРЛ на локализованную стадию (в пределах одной половины грудной клетки) и обширную стадию (распространившуюся за пределы локализованной формы).
При локализованной стадии применяется:
- Комплексная химиолучевая терапия с последующим профилактическим облучением головного мозга.
Наиболее часто для химиотерапии используют препараты платины в комбинации с этопозидом (схема ЕР). Проводится 4-6 курсов с интервалом 3 недели. - Лучевое лечение, проводимое одновременно с химиолечением, считается предпочтительнее их последовательного применения. Оно назначается с первым или вторым курсом ХТ.
- Стандартный режим облучения – это ежедневно, 5 дней в неделю по 2 Гр на сеанс в течение 30-40 дней. Облучается сама опухоль, пораженные лимфоузлы, а также весь объем средостения.
- Гиперфракционный режим – это два и более сеанса облучения в сутки в течение 2-3 недель.
- Хирургическая резекция с адъювантной химиотерапией для пациентов с 1-й стадией.
При правильном и полном лечении локализованной формы МРЛ в 50% случаев достигается стойкая ремиссия.
При обширной стадии МРЛ основным методом является комбинированная химиотерапия. Наиболее эффективная схема – это EP (этопозид и препараты платины), могут быть использованы и другие комбинации.
- Облучение применяется при метастазах в головной мозг, кости, надпочечники, а также как метод паллиативного лечения при сдавлении трахеи, верхней полой вены.
- При положительном эффекте от химиотерапии проводится профилактическое краниальное облучение, оно снижает частоту метастазов в головной мозг на 70%. Суммарная доза – 25 Гр (10 сеансов по 2,5 Гр).
- Если после одного-двух курсов химиотерапии опухоль продолжает прогрессировать, продолжать ее нецелесообразно, пациенту рекомендуется только симптоматическое лечение.
Антибиотики при раке легкого
У больных раком легкого отмечается снижение местного и общего иммунитета, вследствие чего на измененной легочной ткани довольно легко может возникнуть бактериальное воспаление – пневмония, которая осложняет течение заболевания. На этапе лечения цитостатиками и облучением также возможна активация любой инфекции, даже условно-патогенная флора может вызвать тяжелое осложнение.
Поэтому антибиотики при раке легкого применяются довольно широко. Назначать их желательно с учетом бактериологического исследования микрофлоры.
Симптоматическое лечение
Симптоматическое лечение применяется на любых стадиях рака легкого, но на терминальном этапе оно становится основным и называется паллиативным. Такое лечение направлено на облегчение симптомов заболевания, улучшения качества жизни пациента.
- Облегчение кашля. Кашель при раке легкого может быть сухим надсадным (он обусловлен раздражением бронхов растущей опухолью) и влажным (при сопутствующем воспалении бронхов или легочной ткани). При сухом кашле применяются противокашлевые средства (кодеин), при влажном – отхаркивающие. Облегчают кашель также теплое питье и ингаляции с минеральной водой и бронхолитическими средствами через небулайзер.
- Уменьшение одышки. С этой целью применяются препараты эуфиллина, ингаляции бронхолитиков (сальбутамола, беродуала), кортикостероидные гормоны (беклометазон, дексаметазон, преднизолон и другие).
- Оксигенотерапия (ингаляция дыхательной смеси, обогащенной кислородом). Уменьшает одышку и симптомы гипоксии (слабость, головокружение, сонливость). С помощью концентраторов кислорода оксигенотерапию можно осуществлять и дома.
- Эффективное обезболивание. Пациент не должен испытывать боль. Анальгетики назначаются по схеме усиления препарата и увеличения дозы, в зависимости от их эффекта. Начинают с нестероидных противовоспалительных средств и ненаркотических анальгетиков, затем возможно применение слабых опиатов (трамадол), и постепенно переходят к наркотическим препаратам (промедол, омнопон, морфин). Обезболивающие группы морфина обладают также противокашлевым эффектом.
- Удаление жидкости из плевральной полости. Рак легкого часто сопровождается выпотным плевритом. Это утяжеляет состояние больного, усугубляет одышку. Жидкость удаляют путем торакоцентеза – прокола грудной стенки. Для уменьшения скорости повторного накопления жидкости применяют мочегонные препараты.
- Дезинтоксикационная терапия. Для уменьшения выраженности интоксикации (тошноты, слабости, лихорадки) проводят инфузионную поддержку солевыми растворами, глюкозы, метаболических и сосудистых препаратов.
Кровоостанавливающие средства при кровотечении и кровохарканье. - Противорвотные лекарства.
- Транквилизаторы и нейролептики. Они усиливают действие анальгетиков, уменьшают субъективное ощущение одышки, снимают тревогу, улучшают сон.
Заключение
Рак легкого – заболевание в большинстве случаев с неблагоприятным прогнозом. Однако лечить его можно на любой стадии. Целью может быть как полное выздоровление, так и замедление прогрессирования процесса, облегчение симптомов и улучшение качества жизни, как при любом хроническом заболевании.
Высокая скорость роста опухоли и раннее метастатическое распространение объясняют недостаточные результаты, достигнутые в прошлом для этой формы рака при использовании хирургического или лучевого метода лечения, даже при локализованной форме опухоли.
В настоящее время химиотерапия (XT) является основным системным методом лечения, а лучевая терапия (ЛТ) может добавляться к XT для улучшения локального контроля или профилактического облучения головного мозга.
Цель ЛТ состоит в том, чтобы предотвратить локальный рецидив, увеличить свободный от болезни интервал и в конечном счете улучшить выживаемость.
В мета-анализе Pignon, основанном на индивидуальных данных 2140 пациентов, 3-летняя выживаемость повысилась от 8,9 % после XT до 14,3 % после ЛТ + XT, но при этом увеличилась токсичность.
Облучение грудной клетки — партнер в лечении ограниченного мелкоклеточного рака легкого (MPЛ), но еще требует изучения ряд факторов, таких как вид лекарства, выбор времени начала лучевой терапии, схема, доза облучения и фракционирование.
Цисплатин и этопозид стали стандартной схемой химиотерапии для локализованного МРЛ, потому что они могут легко сочетаться с одновременной ЛТ. Кроме того, эти лекарства в эксперименте расширяют воздействие излучения на опухоли, но не на нормальную легочную ткань.
Однако цисплатин увеличивает реакции слизистых глотки и пищевода, и при одновременной ЛТ грудной клетки III степень эзофагита часто ограничивает возможности объединенного подхода лечения, особенно методики ускоренного облучения.
По вопросу выбора определенного времени, когда начинать лучевую терапию, были получены противоречивые данные. В Канадском национальном институте рака (NCI) пациенты получали 3 цикла XT (схема CAV чередовалась с цисплатин + этопозид) в сочетании с ЛТ (40 Гр), подводимых одновременно с первым циклом (раннее облучение, 3-я неделя) или с последним циклом XT (позднее облучение, 15-я неделя).
Период безрецидивного и общего выживания был значительно выше в группе с ранним облучением. Напротив, в другом исследовании облучение грудной клетки (50 Гр за 6 недель) было проведено с 1-м или 4-м циклом химиотерапии по схеме САР (циклофосфамид, доксорубицин, цисплатин). При раннем начале ЛТ дозы XT были уменьшены. При прослеживании 5 лет лучшие результаты были получены при проведении 4 циклов XT.
Другая проблема состоит в том, чтобы определить оптимальную схему использования 2 методов: последовательную, одновременную или чередование. Были проведены 2 рандомизированных исследования.
В анализе EORTC сравнивались альтернирующая схема (чередовались недельные курсы лучевой терапии с курсами химиотерапии по схеме циклофосфамид, доксорубицин и этопозид) и последовательный подход (облучение было поставлено в конце XT). Не было выявлено различий в ответе или выживании в 2 группах, но чередующаяся схема была более токсичной.
Суммарная доза терапии
Локальные неудачи остаются главным спорным вопросом многих испытаний. Какова должна быть суммарная доза при МРЛ?
В обзоре Choi и Carey 2,5-летняя выживаемость увеличилась с 16 % после 30 Гр до 63 % после 50 Гр. Только одно испытание изучало вопрос суммарной дозы радиации. После оценки ответа на XT больные с эффектом были рандомизированы на 2 группы: получившие 25 Гр за 10 фракций или 37,5 Гр за 15 сеансов.
Частота местных рецидивов при наблюдении 2 года уменьшилась с 80 % после 25 Гр до 69 % для более высокой дозы облучения. Радиобиологические характеристики МРЛ предполагают, что схема ускоренного гиперфракционирования (больше чем одна фракция подводится каждый день) может быть эффективна для преодоления проблемы репопуляции клеток и способности клеток к репарации.
Исследования сравнили ежедневный план облучения 1,8 Гр до суммарной дозы 45 Гр с ускоренным гиперфракционированным облучением (2 фракции по 1,5 Гр каждый день в течение 3 нед до суммарной дозы 45 Гр). В обеих группах цисплатин и этопозид вводился одновременно.
Острая токсичность была выше с 2 фракциями в день, особенно острые эзофагиты, однако имелось четкое преимущество в выживаемости. Выживаемость 2-, 3- и 5-летняя была 40,8, 26,7 и 20 % соответственно для одной фракции в день и 46,6, 31 и 28 % для 2 фракций. Облучение двумя фракциями в день вело к лучшему локо-региональному контролю, но частота локальных неудач (остаточной опухоли) осталась довольно высокой (36 %).
Последние 10 лет у больных локализованным МРЛ используется химиолучевая терапия с включением этопозида, цисплатина, винкристина, таксанов и облучения грудной клетки дозами 40-45 Гр, подводимых за 15 дней лечения. При этом особое внимание уделяется выбору объемов грудной клетки при планировании ЛТ.
До 90-х гг. XX века для определения объема облучения рака легкого использовались данные рентгеновских исследований и международные рекомендации по методикам ЛТ.
Например, у больных с локализованной формой МРЛ широко применяли методики облучения, используемые при заболевании Ходжкина. В объем облучения включали первичную опухоль, все средостение, оба корня легких. Основной способ подведения доз был статический, с двух встречных фигурных полей.
Одновременно облучали шейно-надключичные зоны с двух сторон с одного переднего поля, с узким блоком по центру в случаях профилактического лечения. После достижения суммарных очаговых доз в пределах 40 Гр уменьшали размеры полей до рентгенологически определяемых границ опухоли и продолжали лечение до 50-66 Гр. При паллиативном характере лучевой терапии ограничивались первой частью курса.
Такой подход при раке легкого, особенно при МРЛ, определялся с учетом характера рецидивов, частоты поражения лимфатических узлов, выявляемых по данным аутопсий, во время операций. Однако использование больших объемов при облучении грудной клетки способствовало появлению постлучевых изменений легких, органов средостения у большинства больных, что ухудшало их качество жизни.
С развитием и внедрением новых методов диагностики и планирования ЛТ появились рекомендации об уменьшении объема облучения до границ определяемой опухоли +1,5-2 см вокруг.
Предложено исключать противоположный корень, часть средостения и надключичные области из зоны профилактического облучения, что осуществлялось в прежних программах.
Исключение из объема облучения лимфатических узлов было обосновано следующим образом:
• только 33 % узлов нормального размера содержат клетки рака;
• современная химиотерапия может контролировать эти узлы;
• на самом деле эти узлы (корень и средостение) получают некоторые дозы, достаточные для их контроля;
• определение стадии заболевания с использованием позитронно-эмисионной томографии (ПЭТ) может уточнить активность этих узлов и определить, какие из них можно не облучать.
В настоящее время при всех формах рака легкого при планировании химиолучевой терапии мы не включаем в зону 80-90 % изодозы неизмененные лимфатические узлы средостения, определяемые при компьютерной томографии (КТ) грудной клетки (рис. 1а, б).

Рис. 1а. На КТ-слайсах контуры опухоли в легком (красный цвет), увеличенные лимфатические узлы в средостении (желтый цвет), А — ателектаз

Рис. 1б. Схема полей при облучении МРЛ, прежняя и современная (голубым цветом заштрихованы области экранировки части легкого). Внутри полей облучения красным цветом представлен контур опухоли, желтым — метастазы в средостении
При распространенных формах МРЛ основным методом лечения является XT. Лучевая терапия первичной опухоли используется при выраженном ответе на XT для закрепления эффекта в грудной клетке или с паллиативной целью для уменьшения тягостных легочных симптомов. Лучевой метод широко применяется в паллиативном лечении метастазов в головной мозг, кости, надпочечники и другие органы и ткани.
Паллиативная лучевая терапия не влияет на общую выживаемость больных МРЛ, при ее осуществлении разовые и суммарные дозы, объем облучения определяются только тяжестью симптомов, прогнозируемыми сроками жизни больного.
В.A. Горбунова, А.Ф. Маренич, 3.П. Михина, О.В. Извекова
Читайте также:

