Лучевая терапия рака шейки матки рекомендации
Лучевая терапия при РШМ состоит из ДЛТ и ХТ (препараты платины) с последующей брахитерапией или самостоятельной ДЛТ и брахитерапией.
Адъювантная ЛТ или ХЛТ проводится по аналогичным принципам планирования объемов облучения и фракционирования, применяющимся в самостоятельных программах.
- Пациенткам с РШМ по показаниям, с учетом стадии заболевания и желания пациентки рекомендовано проводить ХЛТ: ДЛТ в суммарной дозе 45 - 50 Гр, одновременно с ХТ (еженедельно >= 5 циклов цисплатина** 40 мг/м2) с последующей брахитерапией или ЛТ самостоятельно, без ХТ [133, 135].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 2)
Комментарий: разовая доза ДЛТ в России принята 2 Гр за фракцию, в мировой практике - 1,8 Гр за фракцию в режиме облучения 5 раз в неделю.
Общее время проведения ХЛТ/ЛТ не должно превышать 7 - 8 недель. Прерывания курса лучевой терапии не допускается. Проведение ХЛТ или ЛТ в адъювантном режиме целесообразно проводить не позднее, чем через 60 дней после хирургического лечение. У пациенток с РШМ T1b1 стадии низкого и промежуточного риска прогрессирования (без выявленного поражения лимфатических узлов на этапе диагностики и/или лимфоваскулярной инвазии по результатам патолого-анатомического операционного материала) может быть целесообразным сокращение объема облучения малого таза (без включения общих подвздошных лимфатических узлов) Продолжительность курса ДЛТ не должна превышать 5 - 6 нед.
Предварительно проводится топометрическая подготовка пациентов с использованием данных КТ, МРТ и ПЭТ, а также гинекологический осмотр. МРТ является преимущественным методом визуализации мягких тканей органов малого таза в целях определения степени распространенности опухолевого процесса в малом тазу, а также характера вовлечения опухолевой инфильтрации в параметральных областях. Для определения наличия региональных метастатически измененных лимфатических узлов в неоперабельных случаях ПЭТ является вспомогательным методом исследования.
В случаях противопоказаний к введению цисплатина** альтернативой является введение карбоплатина или фторурацила**. Возможно рассматривать и самостоятельную ДЛТ при противопоказаниях к введению химиопрепаратов.
При проведении ДЛТ предпочтительным является использование минимум 3D-конформного облучения или ЛТ с модуляцией интенсивности дозы (IMRT), которая представляет собой более конформное дозовое распределение в объеме с минимальным воздействием на окружающие нормальные органы [26, 29 - 32].
Необходимо учитывать объемы облучения: GTV (первичная опухоль), CTV-T (включает локальную микроскопическую опухолевую инфильтрацию в первичном очаге, матке (в случаях хирургического лечения - ложе удаленной опухоли, культю влагалища), параметрии, верхней трети влагалища, крестцово-маточных связках), CTV-N (региональные лимфатические узлы - запирательные внутренние, наружные и общие подвздошные и верхние пресакральные), CTV-PTV (границы отступа для CTV-T составляют 15 - 20 мм, для CTV-N - 7 - 10 мм) в целях достижения наилучшего клинического эффекта.
У пациенток с РШМ при метастатическом поражении парааортальных лимфатических узлов верхнюю границу поля облучения следует располагать, как минимум, до уровня сосудов почечных ножек или по крайней мере на 2 см выше от пораженного парааортального лимфатического узла до суммарной дозы.
Расширенные поля облучения включают парааортальную область как область высокого риска прогрессирования при метастатическом поражении тазовых лимфатических узлов до уровня сосудов почечных ножек (обычно включает L2).
Облучение проводится одновременно с облучением малого таза.
В случае поражения регионарных лимфатических узлов возможно увеличение суммарной дозы на эту область в виде интегрированного или последовательного буста до 55 - 60 Гр.
Конформное облучение (такое как IMRT, стереотаксическое облучение) не заменяет применение брахитерапии в рутинной клинической практике лечения пациенток с распространенными формами РШМ. Проведение ЛТ, корректируемой по изображениям (IGRT), рекомендуется как оптимальный вариант IMRT. Требуется тщательный подход в деталях оконтуривания всех клинических объемов, органов риска, укладки пациента на столе, учитывается движение органов во время дыхания, возможная деформация мягких тканей вследствие распространения опухолевого процесса в малом тазу, а также тщательное дозиметрическое планирование квалифицированным медицинским физиком. Применение IGRT обеспечивает точную воспроизводимость запланированного распределения дозы, нивелирования погрешностей, связанных с подвижностью "мишени" и окружающих нормальных тканей, что в свою очередь позволяет уменьшить отступы при планировании объема облучения и снизить лучевую нагрузку на органы риска.
- Адъювантная (дополнительная) брахитерапия рекомендуется пациенткам в случаях высокого риска рецидива РШМ во влагалище, параметрии и проводится с учетом принципов планирования брахитерапии под визуальным контролем [52, 117].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
Комментарий: При отсутствии технической возможности использования технологии IMRT с визуальным контролем возможно проведение самостоятельной 3D-конформной ДЛТ или ХЛТ (с применением цисплатина**) +/- облучение парааортальной области в сочетании с 2D-брахитерапией. Следует придерживаться тех же принципов выделения клинических объемов, фракционирования, продолжительности курса ЛТ. Для локального буста на область лимфатических тазовых узлов целесообразно применять последовательный буст после окончания курса 3D-конформной ЛТ.
Для 2D-брахитерапии контроль расчета дозы остается по точке A. Суммарная доза в точке A должна быть >= 75 Гр (EQD2) при малых CTV-THR ( 4 см). В отчетности необходимо отмечать максимальный размер CTV-THR. Рекомендуемые точки ограничения для 2D-брахитерапии и объемы 3D для прямой кишки, мочевого пузыря, влагалища, сигмовидной кишки должны основываться на опубликованных клинических рекомендациях [52].
- У пациенток с РШМ при наличии показаний рекомендовано проводить брахиотерапию под визуальным контролем с использованием МРТ [86 - 87].
Уровень убедительности рекомендаций - A (уровень достоверности доказательств - 1)
Альтернативными методами визуального контроля могут быть КТ и УЗИ.
Внутриполостная ЛТ (брахитерапия) занимает определяющий и обязательный этап лечения, при котором заданный локальный объем облучения получает максимальную дозу воздействия, практически эквивалентно равную общей дозе, достигнутой от дистанционного этапа облучения. Таким образом, проведение брахитерапии является основным методом в локальном контроле над РШМ [52].
- При брахитерапии учитываются объемы для мишени: резидуальный (остаточный) объем опухоли шейки матки GTV-Tres (после этапа ХЛТ), адаптивный клинический объем опухоли высокого риска CTV-THR (включает всю шейку матки и остаточную опухолевую инфильтрацию), а также клинический объем промежуточного риска CTV-TIR.
- Брахитерапия проводится в конце (на 4 - 5-й неделе при малых объемах опухоли) или после (при больших объемах опухоли) ХЛТ.
- Внутриполостная и комбинированная внутриполостная/внутритканевая лучевая терапия проводится под общей анестезией. При выявлении на момент проведения брахитерапии остаточной опухолевой инфильтрации в параметрии, а также распространения опухоли за пределы шейки матки, например во влагалище, тело матки или прилегающий орган, эти мишени включаются в CTV-THR. [52]
Суммарные дозы облучения при брахитерапии эквивалентны 40 - 45 Гр, подводимые в режиме классического фракционирования дозы (EQD2). Таким образом, суммарные дозы полного курса ЛТ, включающего ДЛТ и брахитерапию, составляют 85 - 90 Гр (EQD90) на CTV-THR (при суммарных дозах 45 Гр от ДЛТ), >= 60 Гр (D98) на CTV-TIR, >= 90 Гр (D98) на GTV-Tres с учетом стандартных ограничений (опубликованных для 2D- и 3D-планирования) на прямую кишку, мочевой пузырь, сигмовидную кишку. Точка A должна являться отправной точкой для оптимизации плана облучения, хотя точка A трансформировалась в отчетность значений распределения дозы по объемам.
- Для пациенток с отдаленными метастазами при РШМ (IVB стадии) рекомендуется рассмотреть проведение ЛТ по индивидуальному плану [85]
Уровень убедительности рекомендаций - C (уровень достоверности доказательств - 4)
Рак шейки матки не имеет известных наследственных факторов, и вызывается инфекцией вируса папилломы человека, точнее, его онкогенными подтипами 1 и 18. В России максимальное количество заболевших 22,3%, младше 39 лет. Один из методов лечения – лучевая терапия при раке шейки матки.
Общие принципы
Метод основан на том, что ионизирующее излучение гораздо сильнее влияет на клетки, которые активно делятся и растут. Именно из таких клеток и состоит злокачественная опухоль. Поэтому доза излучения, оказывающаяся губительной для такой ткани, оказывает гораздо меньшее воздействие на здоровые ткани и органы.

Лучевая терапия рака шейки матки редко проводится изолированно. Как самостоятельный метод лечения ее используют только на относительно ранних стадиях; начиная от IA2 – когда глубина роста опухоли более 3 мм но не превышает 5, а распространенность в ширину до 7мм и заканчивая стадией IIA1 – когда опухоль меньше 4 см. Даже на этих стадиях приоритет отдают операции, а облучение подключается когда операция противопоказана из-за сопутствующих болезней пациентки.
Во всех остальных случаях радиотерапия выступает адъювантным – дополнительным к операции – методом лечения. Приходится помнить, что сочетание лучевой терапии и хирургического лечения повышает вероятность осложнений после операции.
На более поздних стадиях, когда операция уже неэффективна, основным методом лечения становится химиолучевая терапия, как следует из названия, это сочетание цитостатических средств и облучения.
Варианты лучевой терапии
Лучевая терапия при раке шейки матки может быть наружной и внутриполостной.
При наружной лучевой терапии РШМ источник излучения – специальный аппарат. Расположение источника излучения тщательно высчитывается – традиционно использовалась рентгенограмма таза в 2-х проекциях, сейчас более точным считается КТ. Излучение охватывает не только расположение опухоли, но область маточных связок, лимфоузлов, клетчатку вокруг матки внутреннюю поверхность таза. Это позволяет захватить участки возможного метастазирования раковых клеток, в том числе и микроскопические метастазы, которые невозможно выявить никакими методами. Сама по себе процедура совершенно безболезненна.
Наружная лучевая терапия рака шейки матки часто сочетается с внутриполостной терапией, при которой специальный аппликатор – источник излучения подводится непосредственно к опухоли. Перед тем, как подавать излучение, расположение аппликатора обязательно проверяют с помощью МРТ. Как правило, внутриполостное облучение при раке шейки матки проводится под наркозом или спинномозговой анестезией. Основной участок его воздействия – непосредственно первичная опухоль, области возможных метастазов захватываются реже. Именно поэтому оба метода используются непременно в комплексе.
Продолжительность курса лучевой терапии при раке, по клиническим стандартам лечения, не должна превышать 6-7 недель. Это снижает вероятность появления осложнений.
Лучевая терапия противопоказана при:
- тяжелой сопутствующей патологии (сердечно-сосудистая, почечная, печеночная недостаточность);
- уменьшении количества кровяных клеток – анемия (эритроциты), лейкопения (лейкоциты), тромбоцитопения (тромбоциты);
- длительном повышении температуры;
- распаде опухоли.
Последствия радиотерапии
Лучевая терапия – это большая нагрузка на организм. Поэтому нормальна повышенная утомляемость и слабость. Для уменьшения этих явлений незадолго до начала курса облучения рекомендуется перейти на питательную высококалорийную пищу, и обязательно пить много воды.
Как уже упоминалось, излучение сильнее всего воздействует на быстро делящиеся клетки. Кроме опухолевых клеток, такими свойствами обладают эпителиальные клетки, в том числе клетки слизистой оболочки кишечника и мочевого пузыря. Последствия облучения – слизистая истончается и легко травмируется, что проявляется примесью крови в моче и кале.
Другие возможные последствия лучевой терапии рака шейки матки:
Восстановление после лучевой терапии рака
Как ни банально это звучит, но основой восстановления должно стать правильное питание и здоровый образ жизни. Питание обязательно должно содержать легкоусваиваемый белок, лучше из рыбы и молочных продуктов, мясо лучше ограничить. Овощи и фрукты обеспечат организм клетчаткой, нормализующей моторику кишечника. Обязательно нужно пить не менее 2 литров воды в день (если нет патологии почек).
Обязательно необходимо контролировать состояние крови – как минимум раз в три месяца нужно делать общий анализ, если появляются отклонения от нормы, нужно обратиться к врачу.

Интимная жизнь после лучевой терапии возможна, если сохранилось влечение (зависит от того, насколько остались сохранны яичники после радиотерапии) и влагалище не деформировано рубцовыми сужениями. Иначе может понадобиться интимная пластика. В любом случае, возобновление половых контактов возможно только после прекращения кровотечений (если они возникли во время облучения) и с разрешения врача.
Несмотря на возможные осложнения – лучевая терапия, особенно в сочетании с химиотерапией, довольно эффективный метод лечения. Рак шейки матки рецидивирует после сочетанной лучевой терапии не чаще чем в 6,7%, а появления отдаленных метастазов – 5,8%. Наиболее чувствителен к лучевой терапии плоскоклеточный рак шейки матки, наихудшие прогнозы при недифференцированном раке.
Рак шейки матки является одним из наиболее часто встречаемых злокачественных новообразований у женщин. Он возникает из плоского многослойного эпителия, покрывающего шейку матки. По типу опухоли рак шейки матки делится на:
- плоскоклеточный рак (70-80 % случаев);
- аденокарциному (10-20 % случаев);
- низкодифференцированный рак (примерно 10% случаев).
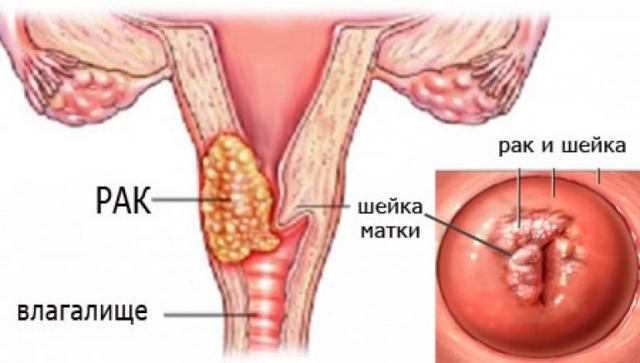
Факторы риска возникновения рака шейки матки:
- Вирус папилломы человека
- Раннее начало половой жизни (до 16 лет)
- Ранние роды
- Частая смена половых партнеров
- Курение
- Аборты
- Воспалительные заболевания половых органов
- Длительный прием гормональных контрацептивов
- Нарушение иммунитета
- Возраст от 40 до 50 лет (однако, рак шейки матки в мире молодеет и встречается у женщин в возрасте от 25 до 29 лет).
В настоящее время доказана прямая связь между раком шейки матки и вирусом папилломы человека (ВПЧ). Он выявляется более чем у 95% больных. ВПЧ типов 16, 18, 31, 33, 35 или 39, вызывают рак шейки матки. Передается ВПЧ преимущественно половым путем.
Профилактика:
- Предупреждение ранней половой жизни
- Отказ от курения
- Использование презервативов
- Исключение частой смены половых партнеров
- Вакцинация от ВПЧ (желательный возраст 10 – 25 лет, до начала половой жизни)
- Регулярные медосмотры у гинеколога с забором мазка на цитологию, а также кольпоскопия для выявления предраковых заболеваний шейки матки и ранних стадий рака шейки матки, которые могут быть полностью излечены.
Симптомы рака шейки матки. Что должно Вас насторожить?
Ранние стадии рака шейки матки протекают без проявления каких-либо симптомов, но если вы наблюдаете следующие изменения, необходимо обратиться к врачу:
- Выделения из влагалища беловатые с примесью крови
- Кровеносные выделения после полового акта или подъема тяжестей, возможно с неприятным запахом
- Кровотечение между менструациями
- Боли в нижней части живота, области крестца, поясницы
- Нарушение мочеиспускания, дефекации, боли в ногах, отек ног (при прогрессировании опухоли).
Каждый из вышеописанных симптомов может быть вызван другой причиной. Но для исключения возможности возникновения рака шейки матки, нужно пройти обследование у гинеколога.
Диагностика
Диагностика начинается с визита к гинекологу, который проведет осмотр шейки матки на предмет наличия изменений, возьмет мазок на цитологическое исследование (тест Папаниколау) и проведет кольпоскопию с помощью специального оптического прибора (кольпоскопа), увеличивающего в разы исследуемую область, для выявления видимых патологических очагов. При этом может браться небольшой кусочек ткани – биопсия – для гистологического анализа.
В случае подтверждения рака – проведение дополнительных исследований (КТ, МРТ, УЗИ органов малого таза) для определения стадии опухолевого процесса, т.е. уточнение размеров, локализации и распространенности заболевания.
Лечение
Что влияет на выбор типа лечения, подходящий именно ВАМ?
- Стадия опухолевого процесса.
- Наличие или отсутствие других заболеваний. Будьте честны с доктором. Некоторые заболевания являются противопоказанием для проведения того или иного вида лечения.
- Ваш возраст.
- Риск осложнений от того или иного вида лечения.
Хирургический метод лечения
Как правило, хирургическое лечение применяется на ранних стадиях заболевания, когда процесс максимально локализован и не требует дополнительной терапии. Но, в случае наличия сопутствующих заболеваний, являющихся противопоказанием к операции, очень успешно используют лучевую терапию.
Во время операции может быть удалена часть шейки матки вместе с опухолью, а при более распространенных заболеваниях целиком шейка матки и сама матка.
Лучевая терапия
При лечении рака шейки матки используется два вида лучевой терапии: дистанционная и внутриполостная. Часто эти два вида терапии применяются в сочетании. В этом случае, дистанционная лучевая терапия направлена на область тазовых лимфатических узлов, а внутриполостная – а первичный опухолевый очаг.
В 75% случаев рака шейки матки лучевая терапия является основным или единственным методом лечения.
Стандартом дистанционной радиотерапии является конформная лучевая терапия, которая подразумевает облучение опухоли в пределах ее границ. Перед лечением пациент проходит топометрическую подготовку, в ходе которой с помощью КТ, МРТ или ПЭТ определяют конфигурацию и точную локализацию новообразования, вовлечение соседних анатомических структур, метастазирование в лимфатические узлы.
Дистанционно облучают не только первичную опухоль, если она не была удалена хирургически, но и окружающие ее ткани — параметрий, крестцово-маточные связки региональные лимфатические узлы.
Внутриполостное облучение, или брахитерапия рекомендована как обязательный этап лечения. Суть метода заключается в имплантации радиоактивного препарата непосредственно в ткани, например, в культю влагалища. При этом локальный объем облучения, который обеспечивается одной процедурой, практически эквивалентен общей дозе, полученной при дистанционной терапии.
Современные аппараты лучевой терапии позволяют облучить пораженную зону, не затрагивая близ расположенные здоровые органы и ткани. Это дает возможность избежать поздних лучевых реакций и сохранить качество жизни после перенесенного лечения. Во время облучения происходит постепенное воздействие на пораженную область определенной дозы радиации, в результате чего раковые клетки гибнут.
Одним из таких современных аппаратов является аппарат томотерапии TomoTherapy серии TomoHD, который благодаря своим конструктивным особенностям и заложенным в него физическим характеристикам позволяет максимально конформно подвести лечебную дозу радиации и минимизировать лучевое воздействие на мочевой пузырь, прямую кишку, яичники, сохраняя их функции. Отсутствие лучевых повреждений ведет к лучшей переносимости лечения, быстрому восстановлению организма и сохранению качества жизни.
Стоимость лечения рака шейки матки
| Наименование услуги | Цена, руб. | Ед. измерения |
|---|---|---|
| Консультация врача онколога радиотерапевта | 0 | шт. |
| Консультация врача детского онколога | 0 | шт. |
| Повторная консультация специалистов | 500 | шт. |
| Топометрия на специализированном компьютерном томографе первичная | 15 000 | процедура |
| Топометрия на специализированном компьютерном томографе повторная | 7 000 | процедура |
| Дозиметрическое планирование лучевой терапии (томотерапии) первичное | 20 000 | шт. |
| Дозиметрическое планирование лучевой терапии (томотерапии) повторное | 7 000 | шт. |
| Лучевая терапия (томотерапия), включая IMGRT (*) | 223 000 | курс |
| Лучевая терапия (томотерапия) стереотаксическая радиохирургия(*) | 250 000 | курс |
| Лекарственная сопроводительная терапия: внутривенные введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 1 000 | процедура |
| Лекарственная сопроводительная терапия: внутримышечное введение в процедурном кабинете (без учета стоимости лекарственных препаратов) | 200 | процедура |
| Топометрическая разметка | 750 | процедура |
Вид лучевой терапии и количество сеансов курса определяется врачебной комиссией индивидуально для каждого пациента исходя из локализации, нозологии опухоли и с учетом анамнеза.
Химиотерапия
Химиотерапия для лечения рака шейки матки, как правило, применяется при распространенных метастатических процессах. Чаще она используется в сочетании с лучевой терапией для усиления радиочувствительности опухоли.
Часто задаваемые вопросы
Сколько стоит курс лечения?
Курс лечения вместе с предлучевой подготовкой стоит 258 000 рублей. Есть возможность оформления рассрочки на весь период лечения.
Есть ли онлайн-консультация?
Для жителей других регионов, а также для тех, кому визит к врачу затруднителен, наш центр предоставляет возможность бесплатной онлайн - консультации.
Документы, которые необходимы для получения онлайн-консультации?
Для получения консультации о возможности получения томотерапии, вам необходимо направить нам все имеющиеся у вас медицинские выписки и обследования, включая гистологическое заключение. Направление на бесплатную консультацию не требуется.
Возможно ли лечение детей?
Томотерапия наиболее благоприятна для лечения детей, так как лучевая терапия проходит щадящим методом, не задевая здоровые органы и ткани развивающегося ребенка.
На какой стадии можно применять лучевую терапию?
В современной онкологии возможности лучевой терапии применяются очень широко на любой стадии. Однако каждому пациенту требуется индивидуальный подход, так как выбор тактики и плана лечения зависит от многих факторов: расположения опухоли, сопутствующих заболеваний, возраста и общего состояния пациента. Поэтому для получения информации о возможности лечения, необходимо получить консультацию врача-радиотерапевта.
СМОТРЕТЬ ДРУГИЕ КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
Год утверждения 2018
Профессиональные ассоциации
- Ассоциация онкологов России Российское общество клинической онкологии
Оглавление
1. Краткая информация
Рак шейки матки (РШМ) – злокачественная опухоль, исходящая из слизистой оболочки шейки матки.
РШМ имеет спорадический характер.
Не связан с известными наследственными синдромами.
Причина - онкогенные подтипы ВПЧ 16/18.
- при высокой частоте РШМ в государстве - у 10-20% женщин;
- при низкой частоте РШМ в государстве - у 5-10%.
В мире ежегодно РШМ:
- диагностируется 528 тысяч;
- смертность 266 тысяч.
В России в 2012 году:
- 15 427 новых случаев;
- доля в структуре ЗНО 5,3% (5 место);
- прирост с 2007 г. 12,2%;
- максимальный прирост в группе 15-39 лет - 22,3%;
- в структуре смертности от ЗНО 4,7% (8 место);
- 1-годичная летальность 17%;
- максимальная смертность группе 15-39 лет 21,1%.
C53 Злокачественное новообразование шейки матки
C53.0 Внутренней части
C53.1 Наружной части
C53.8 Поражение шейки матки, выходящее за пределы одной и более вышеуказанных локализаций
C53.9 Шейки матки неуточненной части
Опухоли из плоского эпителия:
Плоcкоклеточные интраэпителиальные поражения (поражение плоского эпителия (SIL)):
- 8077/0 поражение плоского эпителия легкой степени (LSIL))
- 8077/2 поражение плоского эпителия тяжелой степени (HSIL))
8070/3 Плоскоклеточный рак
- 8071/3 ороговевающий;
- 8072/3 неороговевающий;
- 8052/3 папиллярный;
- 8083/3 базалоидный;
- 8051/3кондиломатозный;
- 8051/3веррукозный;
- 8120/3 плоскоклеточно-переходноклеточный;
- 8082/3 лимфоэпителиальный;
Опухоли из железистого эпителия:
- 8140/2 Аденокарцинома in situ;
- 8140/3 Аденокарцинома:
- 8140/3Эндоцервикальная аденокарцинома, обычный типа;
- 8480/3 Муцинозная:
- 8482/3 желудочного типа;
- 8144/3 кишечного типа;
- 8490/3 перстневидноклеточного типа;
- 8263/3 Виллогландулярная;
- 8380/3Эндометриоидная;
- 8310/3 Светлоклеточная;
- 8441/3Серозная;
- 9110/3Мезонефральная;
- 8574/3 Аденокарцинома смешанная с нейроэндокринной карциномой;
Другие эпителиальные опухоли:
- 8560/3 Железисто-плоскоклеточный рак;
- 8015/3стекловидноклеточный рак;
- 8096/3 Аденобазальный рак;
- 8200/3 Аденокистозный рак;
- 8020/3 Недифференцированный рак
- Нейроэндокринные опухоли:
- Нейроэндокринные опухоли низкой степени злокачественности
- 8240/3карциноид;
- 8249/3 атипичный карциноид;
Нейроэндокринные опухоли высокой степени злокачественности
- 8041/3 мелкоклеточный нейроэндокринный рак;
- 8013/3 крупноклеточный нейроэндокринный рак;
Степени дифференцировки РШМ:
- G1 – высокодифференцированная
- G2 – умереннодифференцированная
- G3 – низкодифференцированная или недифференцированная
- Gх – невозможно определить степень дифференцировки
Диагноз устанавливается только на основании гистологического исследования.
РШМ стадируется клинически до начала специальной терапии и никогда не изменяется.
При затруднении точного определения стадии устанавливается более ранняя.
Морфологические находки при хирургии не изменяют клиническую стадию, но отмечаются в TNM.
Стадирование по классификации FIGO (2009г.) и TNM (7 изд, 2009г.)
2. Диагностика
Сбор жалоб и анамнеза для выявления факторов, влияющих на выбор тактики.
Дисплазия и преинвазивный РШМ не имеют патогномоничных клинических проявлений и диагностируются только морфологически.
- физикальный осмотр,
- гинекологический осмотр,
- ректовагинальное исследование.
- Развернутый клинический анализ крови
- Развернутый биохимический анализ крови с показателями функции печени, почек
- Анализ крови на онкомаркер SCC (при плоскоклеточном раке)
- Исследование свёртывающей системы крови
- Общий анализ мочи.
Биопсия всех подозрительных участков шейки матки, одной цитологии для диагноза недостаточно.
Выскабливание цервикального канала
Конизация при необходимости.
Расширенная кольпоскопия для определения наиболее измененного участка шейки и его биопсии.
Цистоскопия:
- при опухоли шейки более 4 см,
- при переходе опухоли на передний свод влагалища,
- при наличии жалоб.
Ректороманоскопия:
- при опухоли шейки матки более 4 см,
- при переходе опухоли на задний свод влагалища,
- при наличии жалоб.
УЗИ брюшной полости, забрюшинного пространства, малого таза и шейно-надключичной области.
Рентгенография грудной клетки.
МРТ малого таза с контрастированием (точность определения глубины инвазии 71-97%)
КТ малого таза и забрюшинного пространства с контрастированием при невозможности МРТ.
ПЭТ или ПЭТ-КТ наиболее информативна для выявления метастазов.
Рентгенография костей скелета или остеосцинтиграфия при подозрении на метастазы.
МРТ или КТ головного мозга с контрастированием при подозрении на метастазы в ЦНС.
Морфологическое заключение после удаления:
1. Гистологический тип опухоли;
2. Степень дифференцировки опухоли
3. Размеры опухоли;
4. Глубина инвазии опухоли
5. Толщина шейки матки в месте наибольшей инвазии опухоли
6. Опухолевые эмболы в кровеносных и лимфатических сосудах
7. Опухоль в крае резекции влагалища, параметриев, по границе резекции шейки матки (при конизации/ампутации или трахелэктомии)
8. Переход опухоли на влагалище
9. Опухолевое поражение параметрия справа, слева
10. Общее число удаленных и поражённых тазовых лимфоузлов справа, слева;
11. Общее число удаленных и поражённых лимфоузлов параметрия справа, слева
12. Общее число удаленных и поражённых поясничных лимфоузлов
13. Переход опухоли на тело матки
14. Метастатическое поражение яичников
15. Прорастание опухоли в стенку мочевого пузыря, прямой кишки (при выполнении экзентерации или резекции смежных органов)
16. Степень лечебного патоморфоза первичной опухоли и метастазов в лимфоузлах в случае предоперационной терапии.
Дополнительное обследование при подготовке к лечению:
- эхокардиография,
- холтеровское мониторирование,
- исследование ФВД,
- УЗДГ сосудов шеи и нижних конечностей,
- забор мазков с шейки матки и из канала шейки матки,
- забор аспирата из полости матки,
- цервикогистероскопия,
- раздельное диагностическое выскабливание полости матки и цервикального канала,
- экскреторная урография,
- МРТ / КТ брюшной полости с контрастным усилением,
- ирригоскопия,
- колоноскопия,
- диагностическая лапароскопия,
- ренография,
- консультации специалистов (уролога, терапевта, эндокринолога, невролога и др.).
3. Лечение
Тяжелая дисплазия (CIN III) и внутриэпителиальный РШМ (рак in situ)
- Конизация шейки с последующим выскабливанием оставшейся части цервикального канала и, по показаниям, полости матки.
РШМ IA1 ст. (инвазия ≤ 3 мм и ≤7 мм по горизонтали)
- Конизация шейки матки с последующим выскабливанием оставшейся части цервикального канала и, по показаниям, полости матки.
- Экстирпации матки I типа при сопутствующей гинекологической патологии или отсутствии необходимости сохранения репродуктивной функции.
- Реконизация при дисплазии или клетках рака в краях резекции шейки матки или в соскобе из оставшейся части цервикального канала.
- При невозможности реконизации лечат как IB1 ст. РШМ.
- Модифицированная расширенная экстирпация матки II типа при глубине инвазии в строму до 3 мм, раковых эмболах в сосудах.
РШМ IA2 ст. (инвазия>3 мм и ≤ 5 мм и ≤ 7 мм по горизонтали)
- Модифицированная расширенная экстирпации матки II типа.
- ЛТ при противопоказаниях к хирургическому лечению.
- Широкая конизация шейки матки с экстраперитонеальной или лапароскопической тазовой лимфаденэктомией либо расширенная трахелэктомия тип II при необходимости сохранения детородной функции.
РШМ IB1 и IIА1 ст. (опухоль
- Расширенная экстирпация матки III типа.
- ЛТ / химиолучевая терапия по радикальной программе.
- Комбинации операции с ЛТ достоверно увеличивает частоту осложнений, поэтому не показана.
- Обязательная поясничная лимфодиссекция при метастазах в тазовых лимфоузлах.
- Адъювантное лечение проводят в зависимости от факторов риска прогрессирования.
- Расширенная трахелэктомия тип III при необходимости сохранить детородную функцию.
- ЛТ/ химиолучевая терапия по радикальной программе не более 6-7 недель. при невозможности хирургии.
Группы риска прогрессирования после расширенной экстирпации матки:
- высокий - при одном факторе высокого риска (метастазы в ЛУ, поражение параметрия или опухоль в краях резекции влагалища) адъювантное ХЛТ с ЛТ + еженедельно цисплатин 40 мг/м 2 ; при метастазах в поясничных ЛУ - облучение расширенным полем
- промежуточный - при отсутствии факторов высокого риска, но при 2-х из 3-х факторов (инвазия более 1/3 миометрия шейки; инвазия сосудов; опухоль более 4 см) - адъювантная ЛТ.
- низкий -при отсутствии факторов высокого риска, но при 1 из 3 факторов (инвазия более 1/3 миометрия шейки; инвазия сосудов; опухоль более 4 см) адъювантное лечениене показано.
IB2 и IIА2 стадий РШМ
- Расширенная экстирпация матки III типа - стандарт.
- Поясничная лимфодиссекция при метастазах в тазовых лимфоузлах.
- Адъювантное лечение как при IB1 и IIА1 ст. РШМ.
- Облучение расширенным полем при метастазах в поясничных лимфоузлах.
- Химиолучевое лечение по радикальной программе: сочетанная ЛТ + еженедельно цисплатин 40 мг/м 2 – альтернатива экстирпации.
- Адъювантная гистерэктомия после химиолучевой терапии не рекомендуется.
- Неоадъювантная ХТ препаратами платины с последующей расширенной экстирпацией матки III типа – альтернатива стандарту.
IIВ–IVA стадий РШМ
- Химиолучевое лечение по радикальной программе не более 6-7 недель: сочетанная ЛТ + еженедельно цисплатин 40 мг/м2 – стандарт.
- Хирургического вмешательства при IIB ст. РШМ - 1 этап комбинированного лечения или после неоадъювантной ХТ при благоприятном прогнозе. При метастазах в ЛУ транспозиция яичников из зоны облучения.
- Экстраперитонеальная лимфаденэктомиия с последующим ХЛТ по радикальной программе при метастазах в тазовые и/или поясничные ЛУ.
- Облучение расширенным полем при метастазах в поясничных лимфоузлах.
- Альтернатива ХЛТ при IVA ст. – экзентерация малого таза и редко - передняя/задняя экзентерация.
Отдаленные метастазы (IVВ ст. РШМ)
- Системная платиносодержащая ХТ.
- Возможна ЛТ по индивидуальному плану.
Рецидив
Экзентерация малого таза и редко передняя/задняя экзентерация при центральном рецидиве:
- вовлекающем мочевой пузырь и/или прямую кишку,
- не переходящем на стенку таза,
- при отсутствии диссеминации по брюшине,
- без регионарных и отдаленных метастазов.
Расширенная экстирпация матки после ЛТ/ХЛТ по радикальной программе, если размер рецидивной опухоли в шейке матки не превышает 2 см.
Паллиативное лечение при триаде - односторонние отек нижней конечности, ишиалгия и блок мочеточника в большинстве случаев диагностируется переход опухоли на стенку таза, не подлежащий хирургическому лечению.
Конформная ЛТ - стандарт при проведении курса дистанционного облучения.
Планируемый объем облучения включает:
- первичную опухоль (при отсутствии хирургического этапа);
- параметральную область;
- крестцово-маточные связки;
- оптимальный уровень резекции влагалища – более 3 см от опухоли;
- группу тазовых лимфатических узлов;
- при отсутствии метастазов в подвздошных ЛУ облучаются группа наружных, внутренних подвздошных и запирательные лимфатические узлы;
- при метастазах в подвздошных и/или парааортальных ЛУ - верхняя граница поля достигать уровня L1–L2, или с учетом уровня поражения группы параортальных лимфатических узлов, соответственно, верхняя граница поля может достигать уровня Th12.
При микроскопических метастазах в региональных ЛУ при РОД 2 Гр достаточна СОД до 46 Гр.
При поражении региональных ЛУ увеличение СОД на 10-15 Гр в виде локального буста.
При облучении парааортальной областиIMRT и другие методологии конформного облучения помогают уменьшению дозовых нагрузок на кишечник и другие органы риска.
Конформное облучение (IMRT) при распространенных формах РШМ не заменяет брахитерапии.
Для конформного облучения и методологии IMRT определены:
- GTV - определяемый опухолевый объем,
- CTV - клинический объем мишени, включающий GTV,
- PTV - планируемый объем мишени,
- OAR - органы риска,
- DVH - гистограммы доза-объем.
Внутриполостное облучение (брахитерапия) - определяющий и обязательный этап лечения, проведение контактного облучения - основной прогностический фактор в локальном контроле РШМ.
Внутриполостное облучение проводят после полного курса ДГТ, при хорошей регрессии опухоли и формировании шейки - на 4-5 неделе облучения в дни, свободные от дистанционного облучения.
Методика сочетанной лучевой терапии по радикальной программе, СОД сочетанной ЛТ:
- в точке А 80–90 Гр,
- в точке В 60 Гр.
1. Дистанционная лучевая терапия
Конформная ЛТ малого таза и зон регионарного метастазирования СОД 46-50 Гр при РОД 2 Гр ежедневно 5 раз в неделю.
1. Внутриполостная лучевая терапия (на брахитерапевтических аппаратах): HDR ( 192 Ir, 60 Co)
Дозиметрическое планирование исходя из технического оснащения клиники:
- Осуществляемое по 2D изображениям.
- Осуществляемое по 3D изображениям.
- Ни один режим фракционирования не показал преимуществ.
Через 21–28 дней после хирургического вмешательства методика послеоперационной СЛТ:
1. ДГТ на ложе опухоли и зоны регионарного метастазирования РОД 2 Гр ежедневно 5 раз в неделю, СОД 46-50 Гр (4-польное, IMRT).
1. Внутриполостная лучевая терапия (на брахитерапевтических аппаратах): HDR ( 192 Ir, 60 Co) РОД 3–5 Гр. 2–3 раза в неделю, СОД 21–25 Гр.
АХТ при IB—IIВ ст. в группе высокого риска прогрессирования – цисплатин 40 мг/м 2 1 раз в неделю до 6 недель на фоне ЛТ.
ХЛТ по радикальной программе при IB—IVA ст. - цисплатин 40 мг/м 2 1 раз в неделю до 6 недель на фоне ЛТ.
Роль АХТ после химиолучевого лечения по радикальной программе не ясна, возможны на фоне ЛТ по радикальной программе цисплатин 40 мг/м 2 + гемцитабин 125 мг/м 2 еженедельно и 2 курса АХТ после окончания ЛТ цисплатин 50 мг/м 2 1 день + гемцитабин 1000 мг/м 2 1 и 8 дни с интервалом в 3 недели.
При IB2 и IIА2 (опухоль >4 см) и IIB ст. возможна 2-3 курса неоадъювантной ХТ: паклитаксел 175 мг/м² + цисплатин 75 мг/м² или карбоплатин AUC 6 в 1 день с интервалом 3 недели.
При IVВ ст. РШМ или при прогрессировании заболевания - системная ХТ до 6 курсов по режимам:
- цисплатин 50 мг/м 2 1 раз каждый 21 день (не проводится при анамнезе ХЛТ);
- цисплатин 50 мг/м 2 1 день + 5-фторурацил 500 мг/м 2 1-3 дни с интервалом в 21 день;
- паклитаксел 175 мг/м² + цисплатин 75 мг/м² 1 день с интервалом 3 недели, (при анамнезе ЛТ на малый таз возможна редукция цисплатина до 60 мг/м 2 и паклитаксела до 150 мг/м 2 , с последующим повышением при удовлетворительной переносимости);
- паклитаксел 175 мг/м 2 + карбоплатин AUC 5–6 1 день с интервалом 3 недели;
- цисплатин 50 мг/м 2 1 день + топотекан 0,75 мг/м 2 1– 3 дни с интервалом 3 недели;
- цисплатин 50 мг/м 2 1 день + ифосфамид 5000 мг/м 2 24-часовая инфузия с месной 400 мг/м 2 3 раза в день в 1 день каждые 3 недели;
- цисплатин 50 мг/м 2 1 день + гемцитабин 1000 мг/м 2 1 и 8 дни с интервалом 3 недели;
- цисплатин 40 мг/м 2 1 и 8 дни + иринотекан 60 мг/м 2 1 и 8 дни с интервалом 3 недели;
- паклитаксел 175 мг/м 2 1 день + топотекан 0,75 мг/м 2 1-3 дни с интервалом 3 недели (при невозможности применения платины).
Добавление к ХТ бевацизумаба 15 мг/кг с интервалом 3 недели до прогрессирования.
При прогрессировании РШМ на одной линии ХТ возможна 2-я линия:
- митомицин 7,5 мг/м 2 1 раз в 6 недели;
- иринотекан 125 мг/м 2 1, 8, 15 дни с интервалом 3 недели;
- гемцитабин 1000 мг/м 2 1, 8, 15 дни с интервалом 3 недели;
- доцетаксел 75 мг/м 2 с интервалом 3 недели;
- капецитабин 2500 мг/м 2 1-14 дни с интервалом 3 недели.
При интервале от последней ХТ более 6 месяцев возможны платиносодержащие режимы.
Возможно добавление бевацизумаба 15 мг/кг к режимам ХТ.
При рецидиве в малом тазу (без отдаленных метастазов) с анамнезом ЛТ, возможны:
1. системная ХТ;
2. экзентерация малого таза;
3. симптоматическая терапия.
При рецидиве в малом тазу (без отдаленных метастазов) без ЛТ, возможны:
1. химиолучевая терапия;
2. экзентерация малого таза.
При прогрессировании РШМ (при наличии отдаленных метастазов) с анамнезом ХЛТ монотерапия цисплатином менее эффективна, чем комбинация цитостатиков.
4. Реабилитация
Общие принципы реабилитации после хирургических вмешательств и/или ХТ и/или ЛТ.
5. Профилактика
1 раз в 3 месяца в течение первых 2 лет, каждые 6 месяцев в течение 3-го и 4-го года, затем ежегодно:
- анализ крови на SCC (при плоскоклеточном раке),
- осмотр гинеколога и взятие мазков на цитологическое исследование,
- УЗИ брюшной полости, забрюшинного пространства и малого таза
ежегодно рентгенография органов грудной клетки;
при росте SCC, появлении жалоб или находок при гинекологическом осмотре или УЗИ – углубленное обследование (КТ/МРТ брюшной полости и малого таза, рентгенография/КТ грудной клетки).
Читайте также:

