Лучевая терапия плоскоклеточного рака головы и шеи
Специалисты отделения опухолей головы и шеи НМИЦ онкологии имени Н.Н. Петрова подготовили ответы на самые частые вопросы пациентов, проходящих лучевую терапию. Они рассказали, с какими побочными эффектами можно столкнуться во время этого длительного и непростого лечения, как их избежать или облегчить.
Что такое лучевая терапия? В каком случае она назначается?
Лучевая терапия (радиотерапия, облучение) — современный метод лечения с помощью ионизирующего излучения. В качестве ионизирующего излучения в зависимости от видов и задач лучевой терапии могут быть использованы разные виды лучей (рентгеновские или гамма-лучи). Они вызывают сходные биологические эффекты в клетках и тканях, определяя лечебное действие облучения.

Количество полученного облучения называется дозой и измеряется в греях (Гр). Доза облучения при разных типах лучевой терапии назначается индивидуально с учётом многих факторов — особенностей как самого заболевания (вид, стадия, локализация), так и пациента.
Лучевая терапия проводится только при наличии показаний в результате взвешенного решения. При этом специалисты всегда руководствуются важной целью — оказать наилучшую помощь пациенту в лечении его заболевания. Обязательно оцениваются риски и выгоды, устанавливается соотношение пользы и вреда от облучения.
Всегда ли возникают осложнения?
Многие пациенты волнуются, ожидая тяжёлых осложнений от лучевого лечения. Следует помнить, что каждый человек — индивидуален. Нежелательные эффекты могут быть почти незаметными или временными, не все из них будут у конкретного пациента.
Но надо помнить, что как у любого метода лечения, у лучевой терапии есть побочные эффекты. Большинство из них возникает постепенно обычно к концу второй недели облучения. Они делятся на ранние лучевые реакции и поздние лучевые реакции, проявляются в органах, расположенных непосредственно в поле облучения.
Во время лечения могут проявиться тошнота, снижение аппетита, покраснения на коже, потеря концентрации внимания, выпадение волос, слабость и прочее.
Какие осложнения при проведении лучевой терапии у пациентов с опухолями головы и шеи бывают и как с ними справиться?
Проблемы с питанием и потеря веса
Для успешного прохождения лечения необходимо качественно и сбалансировано питаться. Лечение – не время диет для похудения. В этот период организм нуждается в дополнительной энергии для борьбы с болезнью. К сожалению, именно в этот момент возникают побочные эффекты, из-за которых принимать достаточное количество пищи не получается, что и ведёт к потере веса и нарушению работы всех органов и систем организма.
В далеко зашедших случаях приходится прерывать лучевую терапию. Поэтому пациенту необходимо очень внимательно отнестись к своему рациону, количеству и качеству съедаемой пищи в день.
Какие проблемы могут возникать?
Они разные, но встречаются почти у всех:
- снижение или потеря аппетита,
- нарушение вкусовых ощущений и запаха,
- сухость во рту,
- тошнота,
- нарушение глотания,
- боль в ротовой полости.
Что может помочь?
Принимайте пищу дробно. По 6-8 раз в день. Порции должны быть небольшие, а еда негорячая.
Не допускайте длительных перерывов без пищи. Всегда имейте под рукой то, чем можно перекусить.
Не ешьте бесполезной, пустой еды. Каждый кусочек должен нести пользу. Выбирайте высококалорийные продукты, богатые белком.

Переходите на мягкую или измельчённую пищу. Можно самостоятельно использовать блендер.
Не отчаивайтесь, если любимое блюдо перестало быть вкусным, ищите альтернативные варианты. Это временное явление, после лечения вкус еды постепенно вернётся.
Пейте достаточное количество жидкости.
Контролируйте свой вес: взвешивайтесь каждые два дня.
Не употребляйте алкоголь, он раздражает и дополнительно сушит слизистую рта. Алкоголь оказывает общее токсическое действие на организм.
Каждый день необходимо наблюдать за собой. Если наступает момент, когда количество потребляемой пищи и жидкости заметно уменьшилось, а вышеперечисленные советы не помогают, не надо скрывать это от лечащего врача.
В этом случае он назначит дополнительно специализированное питание и инфузионную терапию.
В некоторых ситуациях лечащий врач принимает решение установить назогастральный зонд, и тогда питание происходит через него, а ротовая полость изолируется от контакта с пищей, это даёт возможность сохранить целостность слизистых оболочек в ротовой полости, не происходит травматизация обожжённых тканей. Многие пациенты боятся и всячески избегают этой процедуры, но, по отзывам тех, кому пришлось с этим столкнуться, зонд — это спасение. Как, чем и в каком режиме питаться через зонд обучает медицинская сестра стационара, где пациент проходит лечение.
В некоторых ситуациях пациентам показано формирование гастростомы: при обширном распространении опухоли на шее, при невозможности питаться, когда пища совсем не проходит. Гастростома чаще всего устанавливается эндоскопически, что позволяет избежать травматизации и своевременно начать питание.
Трудности с дыханием
В некоторых ситуациях у пациентов возникает необходимость формирования превентивной трахеостомы. Она нужна в случае, когда пациенту трудно дышать из-за опухоли в области шеи и в ситуации, когда врач понимает, что во время лучевой терапии возникнет отёк мягких тканей, который может привести к удушью.
Одна из частых проблем — это воспалительное или язвенное поражение ротовой полости и, связанная с этим осложнением, боль.
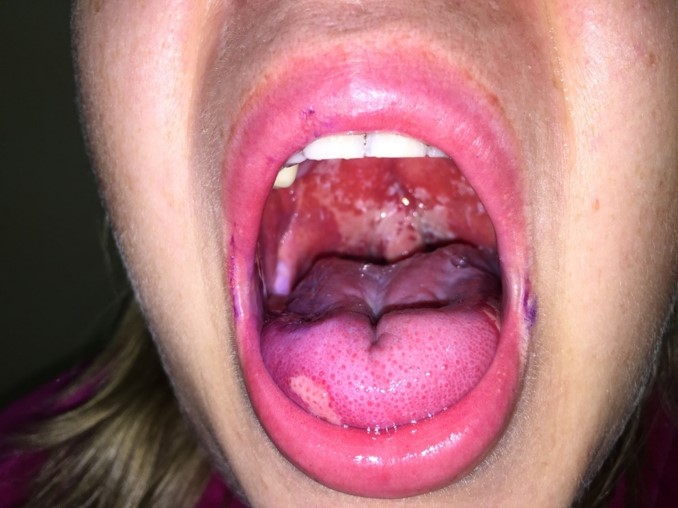
Пациент может заметить уменьшение слюноотделения, изменение вкуса, боль (она может быть острой), жжение, язвочки на слизистой полости рта, затруднение в приёме пищи и глотании.
С самого начала лечения рекомендуется соблюдать тщательную гигиену полости рта:
- использовать мягкую зубную щётку,
- чистить зубы после каждого приёма пищи,
- полоскать ротовую полость физиологическим раствором или другими растворами по назначению врача.
- Необходимо избегать приёма горячей, кислой, раздражающей, грубой пищи, а также горячих напитков.
При развитии вышеперечисленных симптомов лечащий врач назначает соответствующую терапию, в том числе противоболевую, облегчающую возникшее осложнение.
Осложнения со стороны ЖКТ
Запоры являются частой проблемой во время лечения. Причинами могут быть снижение двигательной активности, изменение рациона. Стул должен быть регулярным, ежедневным или через день. При задержке до трёх дней об этом необходимо сообщить врачу.
Диарея — это также осложнение от лечения, о ней обязательно нужно сообщить врачу. Последствия от потери жидкости в организме во время лечения могут быть невосполнимыми, а осложнения очень серьёзными.
Кожные осложнения
Кожные реакции в зоне облучения беспокоят многих пациентов. Лечащий врач назначит специальные средства для ухода за кожей.
Общие рекомендации:
- используйте мягкие, щадящие моющие средства для ежедневной гигиены;
- исключайте любое раздражение: воротнички, украшения, мочалки;
- после умывания высушивайте кожу промакивающими движениями;
- носите одежду с мягкой, свободной горловиной;
- закрывайте кожу от прямых солнечных лучей, используйте солнцезащитные средства SPF50;
- увлажняйте кожу и наносите кремы после сеанса радиотерапии.
Выпадение волос
Выпадение волос — неприятное осложнение, настигающее часть пациентов в процессе лечения.

Общие рекомендации: если выпадение сильное, то необходимо сбрить волосы полностью в парикмахерской. Волосы отрастут. Во время лечения необходимо избегать окрашивания и осветления волос. Для психологического комфорта можно использовать парики, шарфы, банданы или шапочки.
Это наиболее частые проблемы, с которыми может столкнуться пациент, а также способы их решения.
Вот ещё несколько советов, основанных на опыте сопровождения пациентов.
Сопутствующие хронические заболевания. Как их контролировать во время лучевого лечения?
Если у пациента есть хроническое заболевание: гипертония, сахарный диабет, гастрит и т.д., то следует знать, что возможно обострение или изменение его течения. Это может потребовать коррекции дозы принимаемых препаратов. Необходимо быть внимательным к своему самочувствию, аккуратно принимать назначенные лекарства.
Обо всех изменениях своего самочувствия необходимо сообщать лечащему врачу или медицинской сестре.
Что делать курильщикам?
Бесспорно — курение вредно. Необходимо постараться снизить количество выкуриваемых сигарет, а лучше совсем перестать курить.
Полезны ли физические нагрузки во время лечения?
Физические нагрузки должны быть лёгкими и неутомительными. Прогулки полезны и желательны.
Бег, поднятие тяжестей необходимо отложить на потом.
Если у пациента есть хобби: вязание, вышивка, рисование, то желательно взять всё необходимое этих занятий с собой в стационар. Если увлечения нет, то, может быть, стоит попробовать?
Общение, или где найти единомышленников?
Многие согласятся, что очень важно иметь единомышленников, с которыми можно поговорить и обсудить насущные проблемы. В ситуации заболевания единомышленник — это сосед по палате или отделению. Общение, поддержка друг друга, обмен информацией и даже взаимоконтроль помогают лучше и легче перенести лечение. Это доказано опытом.
С другой стороны, соседи по палате могут создавать и проблемы, например, храп! Не стоит пренебрегать берушами для сна. Качественный сон очень важен.

Врачи, медсёстры и другие медицинские работники — это тоже единомышленники пациента. Они рядом и готовы помочь.
Очень важно не замыкаться и не закрываться от окружающего мира.
А если нужна психологическая помощь?
Во многих стационарах есть возможность получить помощь медицинского психолога. Не стоит отказываться, если в этом есть необходимость.
Полезно задать психологу вопросы, которые беспокоят, получить на них ответы и профессиональную психологическую поддержку.
Перед выпиской важно обдумать и записать возникшие вопросы по питанию, обезболиванию, дальнейшему лечению и задать их лечащему врачу. Выписываясь из стационара, пациент должен знать, что ему делать, куда обращаться в той или иной ситуации.
И в завершение пожелание от одного из пациентов НМИЦ онкологии им. Н.Н. Петрова:
2013 год, 58 лет, диагноз рак горла IV стадия. В течение 7 месяцев 6 курсов химиотерапии, 33 сеанса лучевой терапии, не прекращая основной работы, переведя её в дистанционную форму.
2020 год, 65 лет. Работа, хобби.
Авторы:

Медсестринский состав отделения ОГШ
- Ольга Сергеевна Корнеева;
- Наталия Сергеевна Василькова;
- Елена Николаевна Степанова;
- Кабанова Лариса Валерьевна;
- Норочевская Инга Васильевна;
- Полякова Оксана Николаевна;
- Игнашова Надежда Борисовна;
- Верюжская Любовь Николаевна.
![]()

Под научной редакцией:
Раджабова З.А.
Заведующий отделением опухолей головы и шеи
НМИЦ онкологии им. Н.Н. Петрова,
врач-онколог, научный сотрудник, кандидат медицинских наук, доцент
Злокачественные опухоли головы и шеи в России составляют около 20% всех злокачественных новообразований.
В основном эти опухоли представляют собой плоскоклеточный рак (ПКР) (до 90%), возникающий в слизистой оболочке верхних отделов дыхательной и пищеварительной систем: полости носа и ее придаточных пазух, полости рта, носо-, рото- и гортаноглотки, гортани.
Некоторую долю составляют эпителиальные злокачественные опухоли, возникающие в больших и малых слюнных железах, а также в щитовидной железе.
Традиционно при изучении эффективности противоопухолевых препаратов лечение опухолей головы и шеи различных локализаций рассматривается как единая проблема. Главным образом, это ПКР разных отделов верхних дыхательных и пищеварительных путей, таких как полость рта, глотка, гортань и слизистая оболочка придаточных пазух. Факторами риска развития этих заболеваний являются табакокурение, употребление крепких спиртных напитков.
В последние годы появились работы о вирусе папилломы человека как факторе риска развития плоскоклеточного рака головы и шеи, особенно интересен факт лучшего прогноза заболевания и высокой чувствительности опухоли к химиолучевому лечению у пациентов с определяемым папилломавирусом.
У ПКР головы и шеи есть общие особенности: увеличение частоты рака с увеличением возраста, трудность определения первоначальной локализации опухоли в связи с близостью границ различных отделов и органов, включающих полость рта, ротоглотку, полость носа, гортань и гортаноглотку. Общность проявляется также и в направлении метастазирования, преимущественно в регионарные лимфоузлы шеи.
Отдаленные метастазы достаточно редки и обнаруживаются, как правило, в легких, лимфоузлах средостения, реже — в печени и костях скелета. Костные поражения вторичного характера при плоскоклеточном раке головы и шеи происходят преимущественно путем местного распространения на соседние структуры. От локализации опухоли зависит симптоматика, тактика обследования, клиническое течение заболевания, характер метастазирования, прогноз заболевания, что в конечном счете определяет план оптимального лечения.
Стадирование рака головы и шеи
Разработана классификация по системе TNM для основных локализаций опухоли в области головы и шеи: губы и полости рта, ротоглотки, носоглотки, гортаноглотки, гортани, полости носа и ее придаточных пазух, слюнных желез, щитовидной железы.
Помимо системы TNM для оценки степени распространенности опухолевого процесса и оценки прогноза заболевания обязательно использование классификации рака по стадиям. В табл. 9.3 отражена классификация ПКР по стадиям и группировка по системе TNM для основных локализаций в области головы и шеи.
Таблица 9.3. Группировка плоскоклеточного рака головы и шеи по стадиям

Цель химиотерапии
Химиотерапия (XT) применялась ранее у больных раком головы и шеи в основном с паллиативной целью при неоперабельных распространенных опухолевых процессах, чаще рецидивного характера, с наличием отдаленных метастазов. В последние годы она используется в качестве равноправного компонента сочетанного воздействия вместе с хирургическим и лучевым методами лечения.
Лечение плоскоклеточного рака головы и шеи проблематично в основном из-за того, что на всех этапах развития болезни требуется тщательный мультидисциплинарный подход для выбора существующих опций лечения больных.
На рис. 9.1 показан мультидисциплинарный подход к лечению ПКР головы и шеи. В верхней части рисунка — возможные стадии развития опухолевого процесса; в средней части — возможные варианты применяемого консервативного лечения; в нижней части — хирургический метод лечения, использование которого возможно на любом этапе развития болезни как с лечебной, так и паллиативной целью.

Рис. 9.1. Схема мультидисциплинарного подхода к лечению плоскоклеточного рака головы и шеи
Таким образом, на сегодняшний день XT при плоскоклеточном раке головы и шеи применяется в следующих клинических ситуациях. При лечении первичных местнораспространенных опухолевых процессов в виде нескольких курсов индукционной (неоадъювантной) полихимиотерапии (ПХТ) перед хирургическим лечением или облучением. Индукционная химиотерапия позволяет отобрать пациентов с опухолями, чувствительными к дальнейшему лучевому лечению, и выполнить хирургическое вмешательство на ранних этапах в случае неудовлетворительного ответа на XT.
Индукционная XT не увеличивает количество осложнений от последующего хирургического вмешательства, снижает риск развития отдаленных метастазов и дает возможность сохранения органов, но не улучшает выживаемость. Основная критика использования индукционной химиотерапии заключается в том, что она применяется только для отбора пациентов и в дозах, недостаточных, чтобы оказать реальное влияние на их выживаемость.
В последние годы вошло в широкую клиническую практику применение конкурентного (сочетанного или одномоментного) химиолуиевого лечения, когда на фоне лучевой терапии больному вводят химиопрепараты, что обеспечивает повышение выживаемости, улучшение локорегионарного контроля и увеличение доли сохранения органов, что особенно важно при лечении рака таких локализаций, как гортань и гортаноглотка.
Логичным продолжением применения XT при местнораспространенных первичных опухолях стало появление схем так называемого последовательного, или секвентального, химиолучевого лечения. При данном виде лечения на первом этапе проводится несколько курсов индукционной ПХТ с последующим конкурентным химиолучевым лечением. Основными комбинациями, используемыми при индукционной полихимиотерапии, на сегодняшний день признаны цисплатин с 5-ФУ, доцетаксел с цисплатином и 5-ФУ. Последняя схема представляется как наиболее эффективная, но и наиболее токсичная.
При развитии рецидива опухоли и невозможности выполнения радикального хирургического вмешательства пациентам обычно предлагается XT как лечение первой линии. С точки зрения ограниченных возможностей лечения эта категория пациентов с ПКР головы и шеи давно нуждалась в более современных химиотерапевтических средствах, но за последние десятилетия не появилось комбинаций химиопрепаратов, улучшавших показатели выживаемости этой группы больных.
Стандартом лечения этих больных была комбинация цисплатина и 5-ФУ, но при этом применение комбинации этих препаратов лишь увеличивало количество ответов опухоли на химиотерапию, не изменяя показатели выживаемости пациентов. По последним данным, единственной комбинацией химиопрепаратов, дающей не только увеличение количества полных и частичных ремиссий, но и увеличивающей продолжительность жизни больных с рецидивами и отдаленными метастазами плоскоклеточного рака головы и шеи, считается схема с использованием цетуксимаба, цисплатина и 5-ФУ.
Отбор пациентов для проведения химиолучевого лечения
Для принятия решения о проведении химиолучевого лечения удобно пользоваться следующим разделением пациентов с первичными опухолевыми процессами области головы и шеи, когда речь идет о ПКР.

В настоящее время принято считать, что пациенты с ранними стадиями болезни успешно лечатся с применением лучевой терапии в самостоятельном варианте, ау пациентов с умеренными и распространенными стадиями могут применяться химиолучевые методы лечения.
Химиотерапия
Химиотерапия рака некоторых локализаций в области головы и шеи
При I и II стадиях рака гортани, как правило, проводится лучевая терапия или хирургическое лечение, при этом предпочтение отдается облучению. Стандартом лечения рака гортани III стадии является комплексный подход, включающий химиолучевое лечение, либо в виде нескольких курсов индукционной ПХТ с последующей лучевой терапией, либо в виде конкурентного химиолучевого лечения с операцией в случае неэффективности лучевой терапии.
Клиническими исследованиями доказано повышение эффективности лучевой терапии при проведении одновременной с ней химиотерапией или индукционной XT. Такой подход позволяетувеличить количество больных раком гортани III стадии, которым удается сохранить гортань, и этим улучшить качество их жизни.
При раке гортани IV стадии стандартом лечения является ларингэктомия с последующим облучением. Однако в настоящее время проводятся исследования по изучению возможности проведения на первом этапе неоадъювантной или одновременной с облучением XT.
При распространении регионарных метастазов до стадии N2 и N3 и полной регрессии первичной опухоли рекомендуется обязательное выполнение шейной лимфодиссекции на завершающем этапе лечения.
В начальных стадиях плоскоклеточного рака ротоглотки (I и II стадий) проводится лучевое лечение. Также возможно использование хирургического метода лечения. В этих случаях выбор метода лечения обусловлен в основном локализацией опухоли и предполагаемой степенью возможных функциональных послеоперационных нарушений.
При III и IV стадиях рака ротоглотки стандартом лечения является химиолучевой метод. Использование противоопухолевых препаратов в виде 1-2 курсов индукционной XT целесообразно при распространенных опухолевых процессах в расчете на уменьшение объема опухоли к моменту облучения.
При неоперабельных опухолях целесообразно проводить химиотерапию одновременно с облучением. По данным клинических исследований, в таких ситуациях XT позволяет улучшить местный контроль опухоли, а также улучшить безрецидивную и общую выживаемость по сравнению с одной лучевой терапией.
Кроме ПКР носоглотки сюда относятся также переходноклеточный рак и лимфоэпителиома (опухоль Шминке). При раке носоглотки XT, как правило, является компонентом химиолучевого лечения. Противоопухолевые препараты вводятся в виде 1-2 курсов до начала облучения.
Такая индукционная химиотерапия позволяет в значительной степени уменьшить объем опухоли носоглотки и, если имеются, регионарных метастазов. В случае высоко- и умеренно дифференцированного рака чаще используется комбинация цисплатина и 5-ФУ, но возможны и другие сочетания противоопухолевых препаратов. При недифференцированном раке так называемого носоглоточного типа, связанного с вирусом Эпштейна-Барр, высокоэффективна схема АЦОП + цисплатин.
При раке полости рта I стадии проводится операция или облучение. Стандартом лечения рака II стадии кроме операции или облучения может быть комбинация этих методов. При этих стадиях XT, как правило, не проводится.
Поскольку результаты хирургического, лучевого или комбинированного методов лечения распространенного рака полости рта, соответствующего III и IV стадиям, до настоящего времени остаются неудовлетворительными, многими исследователями проводятся клинические испытания, направленные на изучение роли дополнительной индукционной XT.
Показано, что неоадъювантная химиотерапия приводит к уменьшению размера опухоли и, тем самым, способствует большей радикальности операции или облучения. Относительно улучшения показателей безрецидивной и общей выживаемости при методах лечения, включающих XT, выводы пока неоднозначны, требуется продолжение проспективных рандомизированных исследований. Тем не менее XT стала составной частью комплексного лечения рака полости рта.
Рак слюнных желез в большинстве случаев имеет железистую природу. Основные методы лечения — операция и облучение, чаще в виде комбинации этих методов. Роль химиотерапии при раке слюнных желез изучается в серии клинических исследований.
Есть данные о том, что некоторые гистологические варианты рака слюнных желез могут быть чувствительны к XT. При неоперабельных формах рака исследуется эффективность химиолучевого воздействия с использованием схем, включающих цисплатин, циклофосфамид, 5-ФУ и доксорубицин.
Принципы лечения рака щитовидной железы определяются морфологическим вариантом опухоли и ее стадией. Для дифференцированного рака (папиллярная, фолликулярная и папиллярно-фолликулярная аденокарцинома) основным методом при I, II и III стадиях служит хирургическое лечение.
Возможно использование радиоактивного йода (131I) в расчете на снижение риска рецидива и метастазов. При IV стадии выполняется тиреоидэктомия, в дальнейшем, при наличии отдаленных метастазов, в зависимости от их способности накапливать изотоп применяется либо 131I, либо наружное облучение и гормонотерапия Т4. Известны попытки химиотерапии с использованием доксорубицинсодержащих комбинаций.
При недифференцированном раке щитовидной железы применение гормонотерапии бесперспективно. При медуллярных формах рака лечение начинают с операции, при III стадии — в сочетании с облучением. При наличии отдаленных метастазов медуллярного рака применяют XT с использованием доксорубицинсодержащих комбинаций. В последние годы при этой форме рака успешно применяется ИФН-а (роферон) и октреотид.
При анапластическом раке щитовидной железы в случае возможности используется хирургическое лечение и наружное облучение. Применяется XT. Наибольшая эффективность (около 30%) при раке щитовидной железы отмечается у доксорубицина и эпирубицина. Противоопухолевой активностью при этой форме рака обладает также цисплатин, блеомицин. Показано, что комбинация доксорубицина с цисплатином имеет преимущество перед применением одного доксорубицина.
В стадии клинических исследований находится изучение сочетанного химиолучевого лечения при анапластическом раке. При полном клиническом эффекте становится возможным выполнить операцию, что может улучшить выживаемость больных анапластическим раком.
Режимы химиотерапии
Ниже приведены схемы наиболее часто используемых режимов ПХТ при ПКР любой локализации в области головы и шеи. Они могут применяться в качестве индукционной XT с последующим хирургическим вмешательством или лучевой терапией, а также при рецидивных или метастатических опухолях.
1. Цисплатин — 100 мг/м2 в/в в 1-й день. 5-ФУ — 1000 мг/м2/сут в/в 96-часовая непрерывная инфузия в 1-4-й день. Повторение цикла каждые 21 (28) день.
2. Цисплатин — 100 мг/м2 в/в в 1-й день. 5-ФУ — 750 мг/м2/сутки в/в 120-часовая непрерывная инфузия в 1-5-й день. Повторение цикла каждые 21 день.
3. Карбоплатин — AUC 6 в/в 1-й день. 5-ФУ — 1000 мг/м2/сутки в/в 96-часовая непрерывная инфузия в 1-4-й день. Повторение цикла каждые 21 день.
4. Цисплатин — 75 мг/м2/сутки в/в в 1-й день. Капецитабин — 1000 мг/м2 внутрь 2 раза в сутки в 1-14-й день. Повторение цикла каждые на 21 день.
5. Паклитаксел — 175 мг/м2 в/в в 1-й день. Цисплатин — 75 мг/м2 в/в во 2-й день. Повторение цикла каждые 21 день.
6. Паклитаксел — 175 мг/м2 в/в в 1-й день. Карбоплатин — AUC 6 в/в в 1-й день. Повторение цикла каждые на 21 день.
7. Доцетаксел — 75 мг/м2 в/в в 1-й день. Цисплатин — 75 мг/м2 в/в в 1-й день. Повторение курса 21 день.
8. Доцетаксел — 75 мг/м2 в/в в 1-й день. Цисплатин — 75-100 мг/м2 в/в в 1-й день. 5-ФУ — 1000 мг/м2/сутки в/в 96-часовая непрерывная инфузия в 1-4-й день. Повторение цикла каждые 21 день.
9. Паклитаксел — 175 мг/м2 в/в в 1-й день. Цисплатин — 100 мг/м2 в/в во 2-й день. 5-ФУ — 500 мг/м2/сут непрерывная инфузия 120-часовая в 1-5-й день. Повторение цикла каждые 21 день.
10. Цетуксимаб — 400 мг/м2 в/в 2-часовая инфузия в 1-й день 1-го курса, затем 250 мг/м2 в/в 1-часовая инфузия в 8-й и 15-й дни и в 1-й день последующих курсов. Цисплатин — 75-100 мг/м2 в/в в 1-й день. 5-ФУ — 1000 мг/м2/сут в/в 96-часовая непрерывная инфузия в 1-4-й день. Повторение цикла каждые 21 день.
При проведении конкурентного одновременного химиолучевого лечения рекомендованы следующие курсы химиотерапии:
1. Цисплатин — 100 мг/м2 в/в в 1, 22 и 43-й дни лучевой терапии. Лучевая терапия в суммарной очаговой дозе (СОД) 66-70 Гр, разовой очаговой дозе (РОД) 2 Гр.
2. Цисплатин — 20 мг/м2 в/в еженедельно при проведении лучевой терапии. Лучевая терапия в СОД 66-70 Гр, РОД 2 Гр.
3. Карбоплатин — AUC 1,5 в/в еженедельно при проведении лучевой терапии. Лучевая терапия в СОД 66-70 Гр, РОД 2 Гр.
4. Цетуксимаб — 400 мг/м2 в/в 2-часовая инфузия за неделю до начала лучевой терапии, затем 250 мг/м2 в/в 1-часовая инфузия еженедельно при проведении лучевой терапии.
Лучевая терапия в СОД 66-70 Гр, РОД 2 Гр.
При проведении монохимиотерапии рекомендовано применение следующих схем:
1. Доцетаксел — 75 мг/м2 в/в в 1-й день. Повторение цикла через 21 день.
2. Паклитаксел — 175 мг/м2 в/в в 1-й день. Повторение цикла через 21 день.
3. Метотрексат — 40 мг/м2 в/в или в/м. Повторение цикла каждую неделю.
4. Винорелбин — 30 мг/м2 в/в. Повторение цикла каждую неделю.
5. Цетуксимаб — 400 мг/м2 в/в 2-часовая инфузия в 1-й день, затем 250 мг/м2 в/в 1-часовая инфузия еженедельно.
При эстезионейробластоме полости носа и недифференцированном раке носоглотки используется схема АЦОП с цисплатином в сочетании с лучевой терапией:
Доксорубицин — 40 мг/м2 в/в в 1-й день.
Циклофосфамид — 600 мг/м2 в/в в 1-й день.
Винкристин — 2 мг/м2 в/в в 1-й день.
Цисплатин — 100 мг/м2 в/в в 4-й день.
Преднизолон — 1 мг/кг внутрь в 1-5-й день.
Повторение цикла каждые 21 день.
При раке головы и шеи железистого происхождения (рак больших и малых слюнных желез, неоперабельный рак щитовидной железы) возможно применение следующих режимов медикаментозного противоопухолевого лечения:
1. Доксорубицин — 60 мг/м2 в/в в 1-й день. Цисплатин — 40 мг/м2 в/в в 1-й день. Повторение цикла каждые 21 день.
2. Дакарбазин — 200 мг/м2 в/в в 1-3-й день. Эпирубицин — 25 мг/м2 в/в в 1-3-й день. 5-ФУ — 250 мг/м2 в/в в 1-3-й день. Повторение цикла каждые 21 день.
3. Доксорубицин — 60 мг/м2 в/в в 1-й день. Блеомицин — 15 мг в/в в 1-5-й день. Винкристин — 1,4 мг/м2 в/в в 1-й и 8-й дни. Повторение цикла каждые 21 день.
4. Винкристин — 1,4 мг/м2 в/в в 1-й день. Доксорубицин — 60 мг/м2 в/в в 1-й день. Циклофосфамид — 1000 мг/м2 в/в в 1-й день. Повторение цикла каждые 21 день.
Читайте также:

