Лучевая терапия на весь спинной мозг при опухоли
При проведении лучевой терапии, особенно при опухолях, расположенных вдоль средней линии, в поле облучения может попасть спинной мозг. Обычно при лучевой терапии рака легкого облучению подвергается часть спинного мозга. Радиочувствительность головного и спинного мозга имеет большое значение, поскольку она определяет дозу радиации, назначаемую на опухоль.
После облучения могут развиваться как острые, так и отдаленные последствия, причем последние оказываются для больных более важными. К числу ранних последствий облучения головного мозга относятся головные боли, тошнота и рвота, развитие чувства усталости. Их возникновение связано с повышением внутричерепного давления в результате роста опухоли и отека мозга, наступающего после облучения. У детей после облучения мозга наблюдается сонливость и раздражительность (синдром дремоты), однако эти признаки скоро проходят.
Крайне редко развивается синдром демиелинизации. К числу поздних последствий относятся геморрагии, глиоз, демиелинизация и развитие в мозге некротических процессов. Клинически эти последствия проявляются через месяцы и даже годы после облучения в виде фокальных или генерализованных неврологических нарушений. У больных, проходивших курс лучевой терапии по поводу опухоли гипофиза, часто поражается перекрест зрительных нервов. Вероятность поражения определяется дозовой нагрузкой, и для сведения этого риска к минимуму ежедневные фракции дозы должны находиться в пределах 1,8-2,0 Гр.

К числу поздних последствий относится миелопатия, которая служит причиной прогрессирующих двигательных и сенсорных нарушений, развивающихся в облученном участке. Эти нарушения приводят к парапарезу, анестезии, и, в редких случаях, к параплегии из-за наступления поперечной блокады спинного мозга. Если в поле облучения находился не весь спинной мозг, то может развиться синдром Броуна-Секара. Этот синдром вызывается поражением нервной ткани, которое сопровождается гибелью клеток переднего рога спинного мозга, других нейронов и глиальных олигодендроцитов, а также сосудов, что приводит к инфаркту спинного мозга.
Прогрессирующая и хроническая радиационная миелопатия обычно носит необратимый характер и приводит к спастической параплегии и к нарушению сфинктерных функций. Более чем в 50% случаев она является причиной смерти больных, особенно при поражениях шейного или верхнего отдела спинного мозга.
Устойчивость спинного мозга к облучению обратно пропорциональна длине облученного участка. Обычно считают, что доза 40 Гр, назначаемая на 10 см длины в режиме ежедневных фракций в течение 4 недель, является безопасной. Однако у больных с относительно радиоустойчивыми иноперабельными опухолями, например в случаях хондромы, доза может быть выше. Важную роль играет режим фракционирования дозы. Так, облучение в тотальной дозе 50 Гр в режиме ежедневного фракционирования в течение более 5 недель обычно считается безопасным. В то же время после облучения ежедневными фракциями дозы 40 Гр в течение более 3 недель отмечалось много случаев поражения спинного мозга.
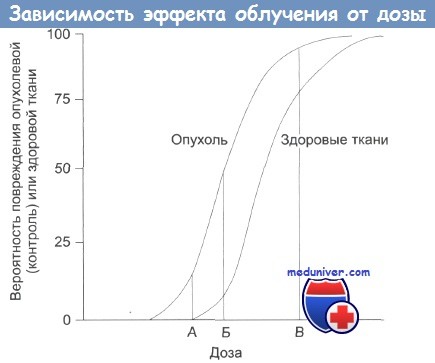
Зависимость терапевтического эффекта от дозы облучения.
А — нижняя безопасная доза; Б — увеличение дозы: растет поражение здоровых тканей;
В — наивысшая вероятность успешного лечения, но и высокая вероятность поражения здоровых тканей, многочисленные побочные эффекты, некоторые из которых могут проявиться в отдаленном будущем
Лучевая терапия опухолей спинного мозга показана только после оперативного их удаления или с симптоматической целью. В качестве самостоятельного вида лечения облучение проводят в случаях поражения спинного мозга при неходжкинских лимфомах, лимфогранулематозе, эндотелиомах, ангиомах и других процессах, отличающихся радиочувствительностью.
Выполняют дистанционное облучение на высокоэнергетических источниках - гамма-аппаратах и линейных ускорителях электронов. Лучевую те-
рапию осуществляют в статическом или подвижном режиме. При статической лучевой терапии облучение проводят с двух паравертебральных полей с наклоном к продольной оси на 15-20°. Разовая поглощенная доза - 2 Гр, суммарная поглощенная доза зависит от гистологического варианта опухоли, ее размеров и составляет от 40 до 60 Гр.
Ротационное облучение проводят в виде маятникового, с углом качания 120 о . Разовые поглощенные дозы также составляют 2 Гр, а суммарные - в зависимости от вида опухоли варьируют от 40 до 60 Гр.
При планировании облучения учитывают, что толерантные дозы применительно к гамма-облучению составляют 57 Гр при облучении участка спинного мозга длиной 20 см и 30 Гр при высоте поля облучения более 20 см.
Глава 8. ЛУЧЕВЫЕ ПОВРЕЖДЕНИЯ
Лучевые повреждения- патологические изменения в организме, органах и тканях, развивающиеся в результате воздействия ионизирующего излучения. При проведении лучевой терапии отмечаются общие и местные лучевые повреждения. Общие реакции являются ранними изменениями. Местные лучевые повреждения в области локального облучения делят на ранние и поздние. Условно к ранним лучевым повреждениям относят изменения, развившиеся в процессе проведения лучевой терапии и в течение 100 дней после ее окончания. Радиобиологическое обоснование этих сроков включает время, необходимое для восстановления сублетальных повреждений. Лучевые повреждения, которые появляются позже 3 мес, часто спустя многие годы после лучевой терапии, называют поздними, или отдаленными, последствиями облучения.
Рекомендации МКРЗ определяют допустимый уровень частоты лучевых повреждений при проведении лучевой терапии - не более 5 %.
В процессе проведения лучевого лечения могут появиться лучевые реакции - изменения, которые проходят в течение 2-4 нед часто без лечения.
У части больных отмечаются только ранние или только поздние местные лучевые повреждения. Клиническое проявление и течение лучевых повреждений обусловлены величиной и распределением во времени суммарной поглощенной дозы, а также толерантностью тканей в облучаемом объеме и, повидимому, индивидуальной чувствительностью.
В настоящее время типы нормальных тканей подразделяют на так называемые иерархические, или H-типа (от англ. hierarchy), и гибкие, или F-типа (от англ. flexible). Первый вид тканей различают по характеру клеток: стволовые, фракции роста, постмиотические зрелые клетки. Процессы при облучении в них протекают быстро, они являются ответственными за появление ранних лучевых повреждений. К ним относятся гемопоэтические клетки, слизистые оболочки, эпителий тонкой кишки. Ткани второго типа состоят из клеток, в которых процессы обновления идут медленно. К ним относятся ткани почки, печени, клетки центральной нервной системы. При облучении тканей гибкого типа возникают поздние лучевые повреждения.
Появление ранних лучевых повреждений связывают с функциональными нарушениями кровообращения, радиационной гибелью клеток и снижением процессов репарации в окружающих опухоль здоровых тканях. Ранние
повреждения в малой степени зависят от величины дозы за фракцию, имеют значение отношения α/β более 10 Гр, при этом укорочение общего времени курса облучения ведет к возрастанию их частоты и степени тяжести. Но ранние повреждения могут быстро регрессировать. Их появление не всегда свидетельствует о возникновении со временем поздних лучевых повреждений.
При развитии поздних лучевых повреждений выявляются морфологические изменения кровеносных и лимфатических сосудов. Постепенно эти изменения приводят к облитерации и тромбозу сосудов, склеротическим и другим изменениям. Появление поздних лучевых повреждений, возникающих спустя 3 мес после окончания лечения, зависит от дозы за фракцию, характеризуется значением отношения α/β от 1 до 5 Гр и не имеет связи с длительностью курса облучения. Поздние лучевые повреждения, как правило, требуют лечения, хотя изменения тканей носят практически необратимый характер.
Уровень необходимых туморицидных доз зачастую превышает уровень толерантности окружающих опухоль тканей и органов.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет

В своей работе мы используем систему КиберНож, эффективную в тех случаях, когда пациенту противопоказано хирургическое вмешательство.
Причины опухоли спинного мозга
Злокачественные опухоли спинного мозга, в том числе и грудного отдела, не считаются широко распространенным заболеванием, например, они в 4-9 раз менее распространены, чем внутричерепные опухоли. На сегодняшний день факторы, провоцирующие рак спинного мозга, не выявлены.
Типы опухолей спинного мозга различаются в зависимости от их локализации и происхождения. Среди них опухоли:
- интрамедуллярные (ИМО),
- экстрамедуллярные интрадуральные (ЭИО),
- экстрадуральные (эпидуральные).
Интрамедуллярные опухоли составляют порядка 10 % всех новообразований спинного мозга.
Экстрамедуллярные интрадуральные опухоли составляют 90 % всех новообразований спинного мозга. Они локализируются в твердой мозговой оболочке.
Экстрадуральные опухоли, включающие в себя экстрадуральные метастазы, а также первичные поражения костей позвоночника, являются самыми частыми новообразованиями позвоночника. Они составляют более 90 % позвоночных опухолей и располагаются за пределами твердой мозговой оболочки или рядом с ней.
Симптомы опухоли спинного мозга
Симптомы опухоли спинного мозга зависят от локализации опухоли. Также они обусловлены сжатием спинного мозга и могут проявлять в виде:
- локальной боли в спине и шее,
- прогрессирующего радикулита,
- прогрессирующего сенсомоторного расстройства,
- редкие спинные кровоизлияния,
- симптоматические нарушения.
Диагностика заболевания
Магнитно-резонансная томография (МРТ) – наиболее эффективный первичный метод диагностики рака спинного мозга. Помимо него, может понадобиться миелография, например, для диагностирования опухолей экстрадурального типа.
Лечение опухоли спинного мозга
На сегодняшний день самым доступным видом лечения ИМО является хирургическая операция. Выполнить ее необходимо как можно быстрее, только при этом условии можно сохранить здоровую часть спинного мозга. Подобная операция помогает поставить гистологический диагноз, а также устранить сдавливание опухолью мозга.
Любым вмешательству предшествует лечение рака спинного мозга кортикостероидами. Оно используется с целью уменьшения компрессии спинного мозга, а также сохранения его функций.
Иногда после операции на позвоночнике проявляется транзиторное неврологическое ухудшение, но редко остается на всю жизнь. В данном случае прогноз зависит от степени неврологического расстройства до вмешательства. Осуществление экспресс-диагностики в постоперационный период может быть очень важным, потому что не исключено прогрессирование расстройств даже после того как опухоль полностью устранена. Если ИМО удалена полностью, риск ухудшения составляет до 19,5%. Если же опухоль удалена не полностью, рецидив возможен в 27 – 40 % случаев.
При эпендимоме возможна полная резекция в 80-90 % случаев. Лучевая терапия может быть рекомендована после операции в случаях неполной резекции. После полной резекции рецидивы развиваются в редких случаях, но могут проявиться потом, по истечении нескольких лет после операции.
В случае сильной выраженности наиболее оптимальным лечением является биопсия, необходимая для подтверждения диагноза, также послеоперационная лучевая терапия.
В случае слабо выраженной астроцитомы обычно прибегают к хирургической операции, учитывая прогрессирование неврологического расстройства. Если оно стабильно, решение об операции не может быть однозначным. Бывает так, что глубокое проникновение опухоли препятствует полной резекции. Послеоперационная лучевая терапия также ставится под вопрос, потому что она применяется сразу после неполного удаления опухоли, либо откладывается до образования неоперабельных рецидивов. Итог лечения внутримозговой астроцитомы зависит от гистологической стадии заболевания и предоперационного неврологического состояния.
При гемангиобластоме наиболее оптимальным лечением является полная микрохирургическая резекция, проведение которой возможно в 90 % случаев. Сенсомоторные нарушения нередко проявляются до вмешательства, и в 80 % случаях отмечается стабилизация или регрессия симптомов. Необходимо добавить, что в 20 % случаев наблюдается ухудшение неврологического состояния пациента после операции.
При ЭИО лучшим методом лечения является полная хирургическая резекция. Она не может быть проведена без значительных манипуляций с различными неврологическими структурами.
Метастатические эпидуральные опухоли лечатся при помощи лучевой терапии, но в данном случае и хирургическая резекция также возможна при условии, что имеет место сдавление кости или радиотерапия не дает эффекта. Подобное альтернативное лечение значительно продлевает выживаемость.
Паллиативная лучевая терапия предназначена для неоперабельных больных, длительность неврологического расстройства которых превышает 48 часов и прогноз выживания составляет менее 3 месяцев. Также пациент должен иметь многочисленные сдавливания органов либо радиочувствительные опухолевые очаги.
КиберНож
Радиохирургия с применением системы КиберНож является альтернативным методом лечения метастазов первичных злокачественных или доброкачественных опухолей позвонков или спинного мозга. КиберНож эффективен при ЭИО, ИМО, олигометастазов или одиночных метастазов.
Хирургическая резекция по-прежнему остается основным лечением при раке спинного мозга, но она бывает невозможна при рецидивах сопутствующих заболеваниях. Стереотаксическая лучевая терапии для лечения рака спинного мозга применяется довольно давно благодаря устройствам иммобилизации. Но у некоторых пациентов даже незначительные движения взывают серьезные функциональные, учитывая их близость к спинному мозгу.
Система КиберНож позволяет проводить неинвазивное лечение с субмиллиметровой точностью. Она дает возможность пациентам с первичной или метастатической опухолью спинного мозга вести нормальный образ жизни, а также избавиться от боли.
Количество сеансов облучения варьируется в зависимости от каждого конкретного случая, в зависимости от расположения опухоли по отношению к спинному мозгу, ее типа, наличия облучения в анамнезе.
Показаниями для применения системы КиберНож служат:
- боли,
- прогрессирующие неврологические расстройства,
- лечение первичной опухоли,
- послеоперационное облучение для улучшения локального контроля,
- послеоперационное прогрессирование первичной или вторичной опухоли.
Что касается доброкачественных опухолей, то система КиберНож применяется в следующих случаях:
- четко определенные поражения,
- минимальная область контакта со спинным мозгом.
В остальных случаях пациентам с доброкачественными опухолями спинного мозга показано лечение на системе КиберНож.
В каждом отдельном случае стоимость определяется на основании показаний к лечению, необходимого количества фракций и плана лечения разработанного врачом радиационным онкологом и медицинским физиком.
| Стоимость лечения | |
| Опухоль спинного мозга (от 305 000) |
Точная стоимость лечения определяется только после консультации с врачом
- О центре
- Специалисты
- Новости
- Партнеры
- Отзывы
- Запись на приём
- Стоимость лечения
- Консультация
- Диагностика
- FAQ
- Статьи
- Аппарат Кибернож
- Уникальность системы
- Показания к лечению
- Противопоказания
- Как происходит лечение
- Сравнение методов
- Дистанционная
- Комбинированное лечение
- Лечение
- Опухоли головного мозга
- Рак легкого
- Рак печени
- Рак почки
- Рак предстательной железы
- Рак носоглотки
- Опухоль спинного мозга
- Опухоль ЦНС у детей
- Рак поджелудочной железы
- Опухолевое поражение костей
- Метастазы
- Невралгия тройничного нерва
- Пяточная шпора
Лучевая терапия
Лечение больных со злокачественными опухолями пинеальной области требует мультидисциплинарного подхода, что подразумевает применение трех основных методов лечения — прямого хирургического вмешательства, лучевой и химиотерапии (после шунтирования желудочков).
Эффективность лучевой терапии при лечении опухолей пинеальной области отмечается многими авторами.
Давно установлено, что при лучевой терапии 5-летняя выживаемость достигает от 60 до 88% случаев.
Облучение высокими дозами (от 50 до 55 Гр) приводит к существенному снижению частоты локального рецидива опухоли — от 47% при низкодозном облучении до 10% при облучении высокими дозами.
Существующий опыт показывает, что оптимальная суммарная очаговая доза (СОД) облучения большинства опухолей мозга, при которой эффективность высока и риск осложнений наименьший, должна составлять 50-55 Гр. Разовая доза фракции не должна превышать 1,8-2 Гр. Облучение более высокими дозами оправдано только при наиболее злокачественных опухолях. Доза при тотальном облучении центральной нервной системы (головного и спинного мозга) — 25-35 Гр.
Лучевая терапия, как отмечалось ранее, наиболее эффективна при герминомах. Исследования показали, что герминомы настолько чувствительны к лучевой терапии, что нет разницы в выживаемости среди больных, которые облучались после удаления опухоли (независимо от радикальности хирургического вмешательства) и теми больными, которые только облучались.
На ранних этапах развития хирургии опухолей пинеальной области риск серьезных осложнений и летальных исходов был очень высок. При этом, во многих случаях была установлена эффективность лучевой терапии. В связи с этим основным методом лечения являлось облучение опухоли без верификации ее гистологической природы: облучению подвергались как опухоли высокочувстивтельные к радиотерапии, так и опухоли, при которых лучевая терапия была практически неэффективной.
С целью выявления радиочувствительных опухолей J.Takeuchi в 1978 году предложил метод биологической пробы. Он установил, что герминомы высокорадиочувствительны и реагируют на облучение в дозе 15 Гр. Учитывая это, была принята следующая методика лечения термином. Лечение начиналось с облучения в дозе 20 Гр. Заметное уменьшение опухоли подтверждало предположение о наличии герминомы и облучение продолжалось до получения больным полной дозы (рис.97).

Рис.97. Динамика регресса герминомы пинеальной области, верифицированной с помощью стереотаксической биопсии в процессе дисганционной фракционированной гамматерапии с суммарной очаговой лозой 60 Гр, магнитно-резонансная томография (МРТ) в аксиальной и сагиттальной проекциях перед облучением (а,б): промежуточная МPT после облучения дозой 20 Гр (в) — размер опухоли заметно уменьшился, открыт водопровод. Полный регресс опухоли после завершения курса облучения (г,д). Стрелка указывает на увеличенное в размерах шишковидное тело.
Отсутствие реакции на начальное облучение свидетельствовало о другой гистоструктуре опухоли, облучение прекращали и производили хирургическое удаление опухоли. Однако в дальнейшем от такой схемы лечения отказались, поскольку было выявлено, что не только герминомы, но и другие опухоли — пинеобластомы, опухоли гистиоцитарного ряда могут иногда положительно реагировать на пробное облучение, что усложняет распознавание этих опухолей и соответственно создает определенные проблемы в их лечении (тактика лечения этих опухолей отличается).
В настоящее время применение этого метода ограничено из-за низкой его специфичности и возможности достаточно безопасного и точного определения гистологии опухоли с помощью стереотаксической операции или при прямом ее удалении.
Для лечения злокачественных опухолей пинеальной области в зависимости от распространенности опухоли и наличия метастазов предложено несколько схем дистанционной мелкофракционной гамматерапии:
а) локальное облучение места расположения опухоли дозой 50-55 Гр;
б) облучение головного мозга дозой 25-30 Гр с дополнительной дозой облучения в зоне расположения опухоли 25-30 Гр (суммарная очаговая доза — 50-55 Гр) (рис.98);
в) облучение всего головного и спинного мозга (головной мозг — 30 Гр, с дополнительной дозой на область расположения опухоли — 25Гр, спинной мозг — 30-35 Гр).

Рис.98. Дистанционная фракционированная гамматерапия больного с больших размеров герминомой пинеальной области, верифицированной с помощью стереотаксической биопсии. КТ (а) и МРТ (б,в) после введения контрастного вещества перед лучевой терапией; г,д) МРТ после завершения курса лучевой терапии с суммарной очаговой дозой 55 Гр — практически полное исчезновение опухоли
В нашей серии наблюдений лучевая терапия применена при лечении 145 больных (51%). Среди них 139 больных подверглись стандартному фракционированному облучению суммарной очаговой дозой от 40 Гр до 66 Гр. У шести больных облучение пришлось прервать в связи с прогрессией болезни и стремительным ухудшением состояния больного. В 29 случаях (20%) облучение произведено без удаления опухоли, после стереотаксической биопсии.
В зависимости от характера облучения выделены три группы больных:
а) больные с локальным облучением пинеальной области — 86 случаев (59%);
б) с облучением пинеальной области и всего головного мозга — 38 случаев (26%);
в) с облучением всей центральной нервной системы (головной и спинной мозг) — 21 случай (15%). Повторное облучение в связи с прогрессией и диссеминацией опухоли проведено в восьми наблюдениях.
В связи с неэффективностью лучевой терапии в 11 случаях осуществлено последовательное удаление опухоли (8%). Этими опухолями оказались: тератома — 1, злокачественная тератома — 2, астроцитома — 2, пинеоцитома — 1, анапластичекая пинеоцитома — 1, анапластичекая эпендимома — 1, кавернома — 1, метастаз рака — 1, эмбриональная карцинома — 1.
В данной работе мы не ставили задачу дать исчерпывающую оценку роли лучевой терапии в лечении больных с опухолями пинеальной области. Коротко остановимся лишь на некоторых наиболее важных проблемах. Одна из таких проблем — роль лучевой терапии в профилактике метастазирования опухолей пинеальной области по ликворным путям, так как большинство злокачественных опухолей пинеальной области (злокачественные герминативноклеточные опухоли, пинеобластомы, анапластические эпендимомы) склонны давать метастазы в пределах центральной нервной системы.
Нашего опыта недостаточно для суждения об эффективности профилактического облучения спинного мозга, но нам представляется наиболее обоснованной точка зрения о необходимости облучения спинного мозга только в случае обнаружения метастазов в спинно-мозговом канале при МРТ.
Как уже неоднократно подчеркивалось, при герминомах облучение является безусловно эффективным и наиболее обоснованным методом лечения. При других злокачественных новообразованиях эффективность лучевой терапии неизмеримо меньше, но, тем не менее, облучение таких больных является обоснованным, Положительные результаты могут быть получены при пинеобластомах, злокачественных пинеоцитомах и даже злокачественных герминативноклеточных опухолях — поскольку чаще строение этих опухолей смешанное и, наряду с малочувствительными к облучению фракциями, существуют участки опухоли, чувствительные к воздействию лучевой энергии.
Облучение не показано при доброкачественных опухолях — менингиомах, холестеатомах, пинеоцитомах, ограниченных доброкачественных глиомах, большая часть которых может быть эффективно удалена.
Полученные нами результаты, также как и данные К.Sano, J.N.Bruce и других свидетельствуют о том, что в лечении практически всех злокачественных опухолей пинеальной области оптимальные результаты могут быть получены при сочетании лучевой терапии с предварительным уменьшением объема опухоли. Исключением являются герминомы, при которых в силу высокой эффективности лучевой терапии нет необходимости их предварительного удаления.
Химиотерапия
С 1980 года, после того как была выявлена высокая эффективность химиотерапии в лечении герминативноклеточных опухолей яичка, она все чаще стала применяться в лечении идентичных по структуре интракраниальных герминативноклеточных опухолей. Большой вклад в обоснование целесообразности химиотерапии при интракраниальных герминативноклеточных опухолях внесла группа ученых во главе с L.H.Einhorn. Ими обосновано применение комбинированной химиотерапии, главными компонентами которой являются платиносодержащие препараты. Применение мультиагентной химиотерапии с обязательным использованием платиносодержащих препаратов улучшило результаты комбинированного лечения герминативноклеточных опухолей и злокачественных опухолей паренхимы шишковидного тела.
Положительные результаты были достигнуты и в лечении больных с другими злокачественными опухолями. Продолжаются поиски эффективных химиопрепаратов для лечения пинеобластом, при которых результаты комбинированного лечения до сих пор остаются неудовлетворительными.
В число препаратов, применяемых при комплексной химиотерапии злокачественных опухолей пинеальной области, входят: цисплатин, этопозид, винкристин, блеомицин и др. Их эффективность доказана практически при всех злокачественных опухолях пинеальной области.
Применение химиотерапии при опухолях пинеальной области показано:
• у части больных детского возраста, так как у детей младше 3-х лет применение лучевой терапии опасно — она может губительным образом сказаться на развитии нервной системы;
• при злокачественных герминативноклеточных опухолях, поскольку установлена эффективность химиотерапии в сочетании с лучевой терапией. При герминомах проведение химиотерапии перед облучением дает возможность примерно вдвое снизить лучевую нагрузку;
• при прогрессировании болезни. Разработаны и предложены различные протоколы лечения больных с рецидивами опухоли или с диссеминацией процесса (рис.99).

Рис.99. Эффективность химиотерапии влечении больного с герминомой пинеальной области и метастазами в хиазмально-селлярной области; боковые желудочки (верификация с помощью стереотаксической биопсии): КТ (а) и МРТ (б) перед химиотерапией; КТ (в) и МРТ (г) после проведения двух курсов химиотерапии по схеме этопозид+цисплатин. Отмечается значительный регресс опухоли.
Продолжаются поиски тех химиотерапевтических препаратов, которые могут воздействовать на всех стадиях деления клеток. Перспективным также представляется применение препаратов, активизирующих апоптоз опухолевых клеток.
Важно отметить, что применение химиотерапии в лечении термином перед лучевой терапией позволяет значительно снизить дозу облучения (до 24 Гр). Такое комбинированное лечение позволяет уменьшить побочный эффект от лучевой терапии (рис.100).

Рис.100. МРТ больного с больших размеров герминомой пинеальной области и метастазом в хиазмально-селлярной области, верифицированной при стереотаксической биопсии (а,б); контрольные КТ (в) и МРТ (г) через 2 года после завершения комбинированного лечения с применением химио — (этопозид+писплатин) и лучевой терапии в дозе 24 Гр — признаков рецидива не выявлено
Мы располагаем небольшим опытом применения химиотерапии — 16 наблюдений. Лечение производилось по следующей схеме: цисплатин 25 мг/м2 — 1-й день, этопозид 80 мг/м2 — 1-3 дни, блеомицин 15 мг — 1,3,5 дни. Пока можно сделать лишь предварительное заключение об эффективности химиотерапии при злокачественных герминативноклеточных опухолях.
Что касается последовательности лечебных мероприятий при комплексном подходе к лечению, можно отметить, что традиционно лучевая- и химиотерапия проводятся после удаления опухоли. Но в последнее время все шире стали применять такую тактику лечения, при которой верифицированные с помощью стереотаксической биопсии или опухолевых маркеров злокачественные герминативноклеточные опухоли вначале подвергаются лучевой и/или химиотерапии, а далее, при наличии остатков опухоли, — хирургическому удалению.
Осложнения лучевой и химиотерапии
По сравнению с прямым хирургическим вмешательством лучевая терапия считается более безопасным методом лечения, но, тем не менее, ее проведение сопряжено с определенным риском.
Побочные явления, связанные с облучением, в зависимости от времени их появления, делятся на 3 основные группы:
1) острая реакция, проявляющаяся отеком мозга в процессе облучения по общепринятой методике традиционного фракционарного облучения с суточными дозами 1,8-2,0 Гр. Такая реакция на облучение наблюдается редко и обычно проходит на фоне применения кортикостероидов;
2) ранняя отсроченная реакция; возникает в период от нескольких недель до 4 месяцев после завершения облучения. Предполагается, что эта реакция, проявляющаяся углублением локальных и общемозговых симптомов, обусловлена временной демиелинизацией нервных волокон. Такое осложнение, возникающее приблизительно у 25% больных, носит временный характер и обычно не требует специальной терапии;
3) отсроченные эффекты лучевой терапии, возникающие в период от 6 месяцев до 10 лет после лечения (рис.101).

Рис. 101. Осложнение лучевой терапии. КТ (а) больного с герминомой пинеальной области; КТ (б) сразу после лучевой терапии с суммарной очаговой лозой 59 Гр (лоза на желудочковую систему — 24 Гр, локально — 35 Гр, поле облучения 15x9 см) выявляет исчезновение опухоли: через 16 месяцев после завершения лучевой терапии выявляются обширные зоны понижения плотности мозговой ткани на КТ (в,г,стрелки) и изменения сигнала па МРТ (д,е, стрелки), указывающие на лучевое поражение в области зрительных бугров и в стволе мозга без явных признаков рецидива опухоли
В основе возникновения подобных осложнений лежит поражение сосудов и нарушение кровоснабжения мозга в зоне облучения с формированием очагов некроза. Осложнение проявляется постепенно прогрессирующими локальными и общемозговыми симптомами, встречается редко и, как правило, при дозах, превышающих 50 Гр.
Особенно неблагоприятны последствия лучевой терапии у детей раннего возраста. КТ и МРТ исследования в подобных случаях выявляют диффузную атрофию мозга, расширение желудочковой системы и арахноидальных щелей, отложения кальция в веществе мозга. При специальных исследованиях выявляется задержка умственного развития. Следствием облучения гипоталамической и гипофизарной областей может стать гормональная недостаточность, требующая соответствующей медикаментозной коррекции.
Учитывая высокий риск осложнений при повторных курсах лучевой терапии при рецидиве опухоли, повторное облучение возможно только при длительности периода между облучениями более 2-х лет.
К числу редких осложнений облучения мозга относится формирование сосудистых мальформаций в стволе мозга, типа капиллярных ангиом, которые могут явиться источником кровоизлияния с формированием гематом. Одно из таких редких осложнений встретилось в нашей практике.
Девочка 12 лет, заболела за 5 месяцев до- госпитализации в Институт. Заболевание проявилось головными болями, шаткостью походки и ухудшением зрения. Эти явления со временем стали нарастать. При компьютерной томографии (КТ) обнаружена кистозная опухоль пинеальной области с окклюзионной гидроцефалией и ребенок госпитализирован в Институт.
При поступлении общее состояние средней тяжести. На фоне выраженного застоя на глазном дне с кровоизлияниями выявлялась грубая среднемозговая симптоматика, координаторные нарушения и шаткость походки. Больной проведена шунтирующая операция по Торкильдсену, после чего ее состояние значительно улучшилось. С целью выяснения гистоструктуры опухоли осуществлена стереотаксическая биопсия, при которой установлено наличие герминомы.
Учитывая высокую радиочувствительность опухоли, решено отказаться от прямого хирургического вмешательства и больная была подвергнута дистанционной мелкофракционной гамматерапии с суммарной очаговой дозой 58 Гр (на желудочковую систему 30 Гр + локально 28 Гр с полем 15x29 см). После завершения курса лучевой терапии контрольные КТ и МРТ выявили значительное сокращение объема опухоли. На месте расположения опухоли обнаружена лишь кистозная полость (рис. 102).

Рис.102. Осложнение лучевой терапии — кровоизлияние в стволе головного мозга.
КТ (а) выявляет кистозную опухоль пинеальной области и левого зрительного бугра. Контрольные МРТ сразу после облучения (б,в) и через 2 года (г,д) после шунтирования желудочков и дистанционной гамматерапии не выявляют остатков опухоли или ее продолженного роста. На месте опухоли определяется кисгозная полость. Других патологических изменений не обнаружено. МРТ через 3 года после лучевой терапии выявляет гематому па уровне моста (е,ж). МРТ после удаления гематомы (з).
Девочка в удовлетворительном состоянии выписана. Контрольные МРТ через 1 и 2 года не выявили признаки продолженного роста опухоли. Через 3 года после лучевой терапии у больной остро развились грубые симптомы поражения ствола головного мозга. В связи с этим проведена МРТ, выявившая гематому на уровне моста. Больная прооперирована, произведено удаление гематомы ствола с доступом через четвертый желудочек. Больная операцию перенесла удовлетворительно, хотя в неврологическом статусе грубые стволовые нарушения остались.
Химиотерапия сопряжена с множеством побочных явлений. Химиопрепараты угнетают функцию костного мозга, снижают иммунитет, что может привести к инфекционным осложнениям, в том числе обусловленным возбудителями, которые в обычных условиях не являются патогенными.
Химиотерапия токсически воздействует на эндокринную систему, главным образом на яичники и яички, что может привести к бесплодию.
Среди пациентов детского возраста химиотерапия влечет за собой задержку роста и развития.
Токсическая реакция химиотерапии может иметь:
• острый характер вскоре после начала химиотерапии — тошнота и рвота;
• хронический, обусловленный поражением костного мозга;
• отсроченный — поздние осложнения могут возникнуть через месяцы или даже годы после химиотерапии и проявиться возникновением вторичных опухолей.
Психосоциальные последствия химиотерапии также являются немаловажной проблемой. Облысение и потеря сексуальной потенции после химиотерапии может привести к выраженным личностным нарушениям.
Читайте также:

