Лимфопролиферативный синдром классификация клиника диагностика лечение

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
- Код по МКБ-10
- Патогенез
- Симптомы
- Формы
- Диагностика
- Что нужно обследовать?
- Какие анализы необходимы?
- Дифференциальная диагностика
- Лечение
- Прогноз

Аутоиммунный лимфопролиферативный синдром (АЛПС) - заболевание, в основе развития которого лежат врожденные дефекты Fas-опосредоаанного апоптоза. Оно было описано в 1995 г., но еще с 60-х годов заболевание со схожим фенотипом было известно под названием синдром CanaLe-Smith.
Заболевание характеризуется хронической незлокачественной лимфопролиферацией и гипергаммаглобулинемией, которые могут сочетаться с различными аутоиммунными нарушениями.

[1], [2], [3], [4], [5]
Код по МКБ-10
Патогенез
Апоптоз, или физиологическая гибель клетки, является одним из неотъемлемых механизмов поддержания гомеостаза организма. Апоптоз развивается вследствие активации различных сигнальных механизмов. Особую роль в регуляции системы гемопоэза и иммунной системы играет апоптоз, опосредованный активацией Fas-рецепторов (CD95) при их взаимодействии с соответствующим лигандом (Fas-лиганд, FasL). Fas представлен на различных гемопоэтических клетках, высокая экспрессия Fas рецептора характерна для активированных лимфоцитов. Fasl-экспрессируется, главным образом, CD8+T-лимфоцитами.
Активация Fas рецептора влечет за собой ряд последовательных внутриклеточных процессов, итогом которых является дезорганизация ядра клетки, денатурация ДНК, изменения мембраны клетки, приводящие к ее распаду на ряд фрагментов без выброса во внеклеточную среду лизосомальных ферментов и без индукции воспаления. В передаче апоптотического сигнала к ядру участвует ряд ферментов, называемых каспазами, в том числе каспаза 8 и каспаза 10.
Fas-опосредованный апоптоз играет важную роль в элиминации клеток с соматическими мутациями, аутореамтивных лимфоцитов, а также лимфоцитов, выполнивших свою роль в процессе нормального иммунного ответа. Нарушение апоптоза Т-лимфоцитов приводит к экспансии активированных Т-клеток, а также так называемых двойных негативных Т-лимфоцитов, которые экспрессируют Т-клеточный рецептор с a/b цепями (TCRa/b), но не имеют ни CD4, ни CD8 молекул. Дефект программируемой гибели В-клеток в совокупности с повышением уровня интерлейкина 10 (IL-10) приводят к гипергаммаглобулинемии и повышению выживаемости аутореактивных В-лимфоцитов. Клиническими последствиями являются избыточное накопление лимфоцитов в крови и лимфоидных органах, увеличение риска аутоиммунных реакций и опухолевого роста.
К настоящему времени выявлено несколько молекулярных дефектов, приводящих к нарушению апоптоза и развитию АЛЛС. Это мутации в генах Fas, FasL, каспазы 8 и каспаэы 10.

[6], [7], [8], [9], [10], [11], [12], [13]
Симптомы аутоиммунного лимфопролиферативного синдрома
АЛПС отличается большой вариабельностью спектра клинических проявлений и тяжести течения, и возраст клинической манифестации также может колебаться в зависимости от выраженности симптоматики. Известны случаи дебюта аутоиммунных проявлений во взрослом возрасте, когда и был диагностирован АЛПС. Проявления лимфопролиферативного синдрома присутствуют с рождения в виде увеличения всех групп лимфоузлов (периферических, внутригрудных, внутрибрюшных), увеличения размеров селезенки, а часто и печени. Размеры лимфоидных органов могут изменяться в течение жизни, иногда отмечено их нарастание при интеркуррентных инфекциях. Лимфоузлы имеют обычную консистенцию, иногда плотноваты; безболезненны. Известны случаи резко выраженных проявлений гиперпластического синдрома, имитирующих лимфому, с увеличением периферических лимфоузлов, приводящим к деформации шеи, гиперплазией внутригрудных лимфоузлов вплоть до развития синдрома сдавления и дыхательной недостаточности. Описаны лимфоидные инфильтраты в легких. Однако во многих случаях проявления гиперпластического синдрома не столь драматичны, и они остаются незамеченными врачами и родителями. Степень выраженности спленомегалии также весьма вариабельна.
Тяжесть течения заболевания определяется главным образом аутоиммунными проявлениями, которые могут развиться в любом возрасте. Чаще всего встречаются различные иммунные гемопатии - нейтропения, тромбоцитопения, гемолитическая анемия, которые могут сочетаться в виде двух- и трехростковых цитопений. Может иметь место единичный эпизод иммунной цитопении, но зачастую они носят хронический или рецидивирующий характер.
Из других, более редких аутоиммунных проявлений, могут наблюдаться аутоиммунный гепатит, артрит, сиаладенит, воспалительные заболевания кишечника, узловатая эритема, панникулит, увеит, синдром Guiltain-Barre. Кроме того, могут наблюдаться различные кожные сыпи, преимущественно уртикарные, субфебрилитет или лихорадка без связи с инфекционным процессом.
У больных аутоиммунным лимфопролиферативным синдромом увеличена частота развития злокачественных опухолей по сравнению с популяцией. Описаны случаи гемобластозов, лимфом и солидных опухолей (карцинома печени, желудка).

[14]
Формы
В 1999 г. предложена рабочая классификация аутоиммунного лимфопролиферативного синдрома, основанная на типе дефекта апоптоза:
- ALP5 0 - полный дефицит CD95, являющийся следствием гомозиготной нуль-мутации (homozygous nuLl mutation) в гене Fas/CD95;
- ALPS I - дефект передачи сигнала через Fas-рецептор.
- При этом ALPS la является следствием дефекта Fas-рецептора (гетерозиготная мутация в гене Fas);
- ALPS lb является следствием дефекта Fas-лиганда (FasL), связанного с мутацией в соответствующем гене - FASLG/CD178;
- ALPS Ic является следствием только что выявленной гомозиготной мутации в гене FA5LG/CD178;
- ALPS II - дефект внутриклеточной передачи сигнала (мутация в гене каспазы 10 - ALPS IIа, в гене каспазы 8 - ALPS IIb);
- ALPS III - молекулярный дефект не установлен.
АЛПС 0 типа - полный дефицит CD95 - описан всего лишь у нескольких пациентов, Поскольку гетерозиготные члены семей не имеют фенотипа АЛПС, была предложена гипотеза о аутосомно-рецессивном типе наследования. Однако, неопубликованные данные о наблюдении за семьей, в которой был выявлен пациент с АЛПС 0, не полностью согласуются с данным утверждением. Ученые выяснили, что многие, если не все, мутации являются доминантными, и что если они оказываются гомозиготными, это приводит к более выраженному фенотипу заболевания.
При АЛПС I типа тип наследования - аутосомно-доминантный, с неполной пенетрантностью и вариабельной экспрессивностью. В частности, при АЛПС1а описаны случаи гомозиготности или сочетанной гетерозиготности, при которой определяются различные мутации гена Fas в обеих аллелях. Эти случаи характеризовались тяжелым течением с пренатальной или неонатальной манифестацией (водянка плода, гепатоспленомегалия, анемия, тромбоцитопения). Кроме того, выявлена корреляция выраженности клинической симптоматики с типом мутации в гене Fas; для мутации во внутриклеточном домене характерно более тяжелое течение. Всего в мире описано более 70 пациентов с ALPS la. Мутация FasL была впервые описана у пациента с клиническими проявлениями системной красной волчанки и хронической лимфопролиферацией. Она была категоризирована как ALPS lb, хотя фенотип не полностью отвечал критериям классического аутоиммунного лимфопролиферативного синдрома (двойные негативные Т-клетки и спленомегалия отсутствовали). Первая гомозиготная мутация А247Е в гене FasL (внеклеточный домен) была описана недавно, в 2006 году, Del-Rey M et al. у пациента с нелетальным АЛПС, что говорит о важной роли терминального домена FasL C0OH во взаимодействии Fas/FasL. Авторы предлагают в действующую классификацию аутоиммунного лимфопролиферативного синдрома внести подгруппу ALPS Ic.
АЛПС II типа наследуется по аутосомно-рецессивному типу, и у многих пациентов с этим типом заболевания отмечалась типичная клиническая и иммунологическая АЛПС, включая нарушенный Fas-опосредованный апоптоз, в реализации которого задействованы как каспаза 8 (вовлечена на ранних этапах межклеточной передачи сигнала на уровне взаимодействий TCR и BCR), так и каспаза 10 (вовлечена в апоптотический каскад на уровне всех известных рецепторов, которые индуцируют апоптоз лимфоцитов).
Более чем у 30 пациентов была выявлена клиническая картина АЛПС средней степени выраженности, включавшая в себя гипергаммаглобулинемию и повышенный уровень двойных негативных Т-клеток в крови, причем активированные лимфоциты пациентов с АЛПС III типа (именно так был назван этот синдром) показывали нормальную активацию Fas-опосредованного пути in vitro, и никаких молекулярных дефектов найдено не было. Возможно, причиной заболевания служат нарушений других апоптотических путей, опосредованных, например, Trail-R, DR3 или DR6. Интересным кажется наблюдение R. Qementi о выявлении мутации N252S в гене перфорина (PRF1) у больного с АЛПС III типа, у которого наблюдалось существенное снижение НК-активности. При этом автор отмечает, что значительная разница между частотой обнаружения N252S у пациентов с АЛПС (2 из 25) и частотой ее выявления в группе контроля (1 из 330) заставляет предполагать ее связь с развитием АЛПС в итальянской популяции. С другой стороны, F. Rieux-Laucat отмечает, что данный вариант мутации PRF1 выявлялся им у 18% здоровых и у 10% больных АЛПС (неопубликованные данные). И, кроме того, наряду с полиморфизмом N252S, им найдена мутация гена Fas у пациента с АЛПС и его здорового отца, что, по мнению F.Rieux-Laucat, говорит о непатогенности гетерозиготной мутации N252S в гене перфорина, описанной несколько ранее R. Qementi у пациента с АЛПС (мутация Fas) и крупноклеточной В-лимфомой. Таким образом, вопрос о причинах возникновения АЛПС III типа на сегодняшний день остается открытым.

[15], [16], [17], [18]
Аутоиммунный лимфопролиферативный синдром – передающееся по наследству патологическое состояние. Принадлежит к категории гетерогенных. Есть два механизма наследования: аутосомный доминантный и рецессивный. В редких случаях причина – соматические мутации. Лимфопролиферативный синдром может быть приобретенным.
История и факты
Впервые первоначальный х-сцепленный лимфопролиферативный синдром мальчиков был официально признан и оформлен в науке в 1967 году. С 1976 его причисляют к первичному иммунодефициту. Внимание ученых к патологическому состоянию приковано с последних десятилетий прошлого столетия. Уже тогда было выявлено, что базой развития заболевания становится неправильный лимфоцитный апоптоз.

Выявляя особенности аутоиммунного лимфопролиферативного синдрома, ученые установили, что всем больным свойственна неправильная экспрессия рецепторов мембран fasl, CD95. Именно этот нюанс определяет генетически объясняющуюся способность клеток умирать. Патологическое состояние развивается в случае генной мутации, влияющей на апоптоз.
Биология и анатомия: как все происходит?
В медицинской пропедевтике лимфопролиферативный синдром принято делить на несколько разновидностей. Для классификации учитывают особенности генетических отличий конкретного случая. Генные мутации могут затрагивать восьмую и десятую каспазы, CD95, CD178. В то же время стоит отметить, что не существует общепризнанной официальной классификации случаев на группы.
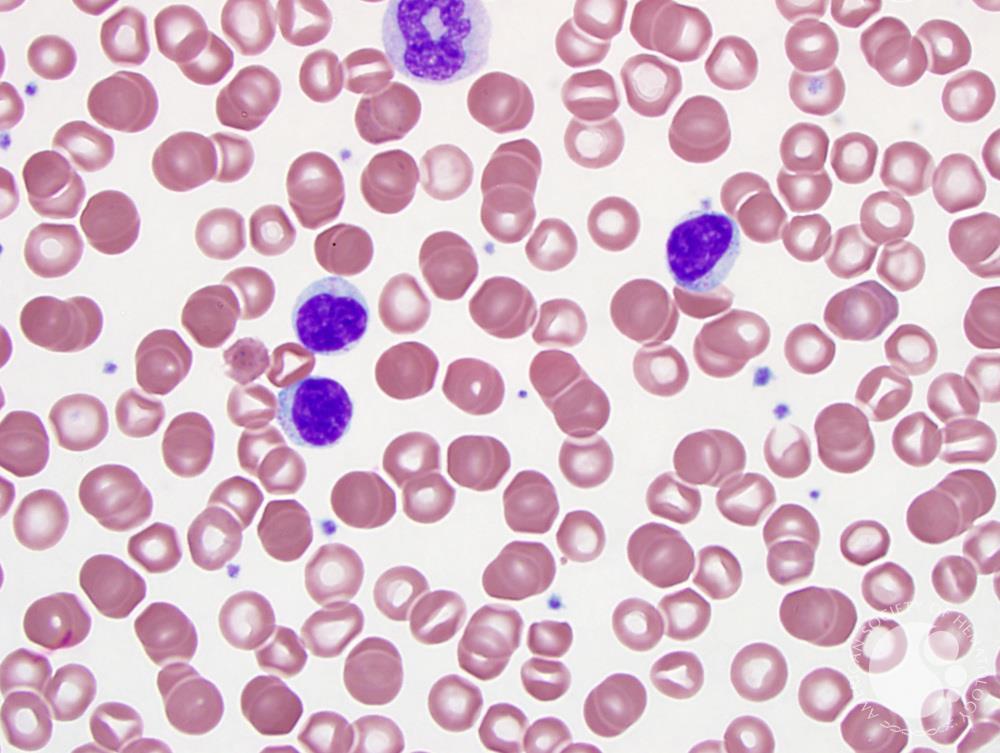
Особенности проявления
Симптомы заболевания исключительно разнообразны. Обычно х-сцепленный лимфопролиферативный синдром выявляют на первых годах жизни, несколько реже – в более старшем возрасте (до пятнадцатилетнего). Ключевой симптом – пролиферация лимфоидной ткани, провоцирующая спленомегалию, лимфаденопатию. Явлениям присущ хронический характер течения. Одновременно больной страдает от проявлений аутоиммунного дисбаланса. Анализы помогают выявить аутоиммунную цитопению. Она возможна в форме нейтро-, тромбоцитопении, анемии. Несколько реже цитопения появляется ранее пролиферации лимфоидных тканей.
Х-сцепленный лимфопролиферативный синдром провоцирует нарушения в работе кроветворной, кровеносной систем. Как правило, фиксируется гепатит аутоиммунной природы. Многие страдают от экземы, гломерулонефрита. Пациентам свойственны увеит, тиреоидит. Приблизительно у каждого десятого со временем формируется лимфома из клеток типа В.
Клинические проявления
Лимфопролиферативный синдром у детей имеет ряд типовых признаков. Наиболее яркий – лимфопролиферация. Процессу присущ доброкачественный характер, патологическое состояние хроническое. Обычно формируется уже в раннем детстве, иногда устанавливается у годовалых малышей. Состояние сохраняется от полугода и более. Вместе с тем наблюдается персистирующее разрастание лимфоузлов периферической лимфосистемы. Для постановки диагноза необходимо выявить такие процессы в трех группах узлов или большем количестве. Узлы плотные, с расположенными поблизости тканями не спаяны. У многих анализы помогают выявить гепатоспленомегалию.
Х-сцепленный лимфопролиферативный синдром у мальчиков проявляет себя аутоиммунными признаками. Классический вариант – анемия, нейтро-, тромбоцитопения. Возможен васкулит. Нередки случаи артрита, гепатита. Больные склонны к увеиту, гломерулонефриту, тиреоидиту. Возможны некоторые другие болезни аутоиммунной природы.
Обратить внимание!
Лимфопролиферативный синдром сопряжен с высокой вероятностью развития злокачественного формирования. Область локализации процесса непредсказуема. Неправильно протекающий апоптоз, работа которого сопряжена с активностью рецепторов Fas, приводит к понижению контроля за процессами разрастания тканей. Растет способность выживать у клеток, переживших патологическую трансформацию. В норме указанный ген – это угнетающий развитие компонентов опухолей фактор.
Чаще заболевание сопровождается формированием лимфом типа В, Т. Кроме того, высока вероятность раковых процессов в молочной железе, кишечном тракте, органах дыхания. Миело-лимфопролиферативный синдром с высокой степенью вероятности может спровоцировать лимфогранулематоз.
При аутоиммунном заболевании пациент склонен к крапивнице, васкулиту. У некоторых отмечается замедленное развитие организма.
Уточнение диагноза
Лимфопролиферативный синдром диагностируют, если установлена не носящая злокачественный характер лимфаденопатия. Возможна спленомегалия. Диагноз ставят при комбинации этих двух явлений или присутствии любого из них, если длительность развития состояния – полгода и больше. При подозрении на диагноз необходимо направить пациента на анализы. В лабораторных условиях устанавливают сбой опосредованного лимфоцитного апоптоза, уточняют концентрацию клеточных структур CD4, CD8 Т: при содержании более 1% можно говорить о патологическом состоянии.
Особенности случая
Далее рассматривается форма заболевания, не связанная с нарушением генетики в период развития эмбриона. Нижеописанное касается приобретенной формы заболевания.
Лимфопролиферативный синдром – симптомокомплекс, который может сопровождать не только лимфолейкоз, протекающий по типовому сценарию, но и более редкие формы патологического состояния. Иногда его устанавливают при волосатоклеточным лейкозе, лимфатическом, в качестве осложнения которого – цитолиз. Известно, что комплекс симптомов может развиться на фоне медикаментозной терапии, облучения, влияния химических компонентов. Большое внимание в современной медицине привлекает посттрансплантационный лимфопролиферативный синдром, существенно ухудшающий прогнозы перенесшего операцию человека. В развитии синдрома, полученного не наследственным путем, наиболее сильно влияние ретровирусов.
Нюансы и распространенность
Медицинская статистика показывает, что преимущественный процент пациентов с лимфопролиферативным синдромом – люди старше пятидесятилетнего возраста. Изредка заболевание выявляется у тех, кто младше 25, но такие случаи единичны. Среди мужского пола частота встречаемости в среднем вдвое выше, нежели у женщин. Исходя из течения, говорят о доброкачественной форме, спленомегалической, опухолевой, склонной к быстрому прогрессу, затрагивающей костный мозг, брюшную полость. Также есть пролимфоцитарный тип.
Когда только начинает развиваться лимфопролиферативный синдром, внутренние болезни не беспокоят, человек чувствует себя удовлетворительно, отсутствуют активные жалобы. Некоторые отмечают слабость, склонность к простудам. Несколько активнее нормы функционируют потовые железы. Заболевание на этом этапе можно выявить в рамках профилактического обследования или на случайном осмотре. Основные признаки – ненормально крупные лимфоузлы, лимфоцитоз, повышение концентрации лейкоцитов в кровеносной системе.
Специфика симптоматики
При заболевании склонны к увеличению лимфоузлы на шее, в подмышечной ямке. Несколько позже, когда болезнь приобретает развернутую форму, отмечается увеличение прочих групп. Размеры сильно варьируются, как и консистенция: некоторых похожи на неплотное тесто, при исследовании болью не отзываются, между собой или с кожными покровами не сливаются. Для таких участков нехарактерно формирование язв или нагноений.
Когда болезнь приобретает развернутую форму, проявления становятся ярко выраженными, пациент ощущает себя слабым, резко понижается способность работать. У больного активно работают потовые железы, он теряет вес, страдает от жара. Лимфатические узлы существенно увеличены, что и привлекает внимание при первичном осмотре.
Осмотр больного: комплекс проявлений
При обследовании пациента заподозрить лимфопролиферативный синдром можно, если четко диагностируется лифмоаденопатия. У многих больных видна трансформация отдельных участков кожи: появляется инфильтрат, выявляются неспецифические пораженные участки. Если человек ранее страдал от кожных заболеваний, они обостряются в силу описываемого синдрома. Многих беспокоит эксфолиативная эритродермия. На фоне синдрома возможно развитие герпеса, крапивницы, дермита.
Для уточнения состояния необходимо направить больного на КТ, УЗИ. На лимфопролиферативный синдром указывает рост лимфоузлов в грудине, брюшной полости, при этом состояние не всегда сопровождается проявлениями компрессии. У пациента больше нормы селезенка, печень. Изучение слизистых пищеварительного тракта позволяет заметить лейкемическую инфильтрацию. Дополнительные проявления – язвы в желудке, кишечном тракте, кровотечения в этой области. Есть вероятность мальабсорбционного синдрома.
Прогресс состояния
При лимфопролиферативном синдроме возможно вовлечение дыхательной системы в патологические процессы. Лейкемическая инфильтрация может затронуть как верхние отделы, так и нижние пути прохождения воздуха. Больной кашляет, беспокоит одышка, возможно отхаркивание мокроты с кровянистыми включениями. Иногда устанавливают плеврит.
В ряде случаев описанный синдром провоцирует инфильтрацию почечной паренхимы. Такое состояние крайне редко проявляет себя типичной симптоматикой. Возможно распространение инфильтрата на ЦНС, что приводит к менингиту, некоторым формам энцефалита и параличу нервных структур, может стать причиной комы. При распространении инфильтрата на кавернозные тела больной страдает от продолжительной и провоцирующей боль эрекции, в медицине называемой приапизмом.
Лабораторные анализы
При подозрении на лимфопролиферативный синдром пациента направляют на исследование крови. Указанное состояние сопровождается ростом концентрации лимфоцитов, лейкоцитов. Возможна анемия.
Лабораторные анализы помогают диагностировать у пациента гемат-, протеинурию. Анализ на биохимию уточняет гипогаммаглобулинемию. В небольшом проценте случаев у пациентов устанавливают гипоальбуминемию. Гепатоцитный цитолиз указывает на себя гиперферментемией.
Иммунологическое исследование указывает на повышение концентрации в селезенке, кровеносной системе лимфоцитов, сбой баланса хелперов и супрессоров из числа лимфоцитов. Вместе с тем снижается концентрация IgG, IgA, IgM (для двух последних изменения особенно ярко выражены). Иммунофенотипирование – основание заключить, что лейкозные клеточные структуры – CD 5, 19, 20, 23 из класса В-лимфоцитов. Результаты цитогенетического анализа в 65 % случаев указывают на аномалии хромосом.

Что делать?
При лимфопролиферативном синдроме больному показано соблюдение разработанного врачом лечебного режима – программа выбирается индивидуально. Пациенту назначают цитостатические препараты. Особенно актуально это, если состояние здоровья быстро ухудшается, печень и селезенка, лимфоузлы стремительно увеличиваются. Цитостатики незаменимы при лейкемической инфильтрации волокон ЦНС, а также в случае, если процессы затрагивают органы вне кроветворной системы. Состояние указывает на себя сильной болью и сбоем функциональности систем и органов.
Если количество лейкоцитов в кровеносной системе неуклонно и быстро растет, показаны хлорбутин, спиробромин. Неплохую реакцию организма позволяют получить проспидин, циклофосфан. Иногда врачи рекомендуют остановиться на пафенциле. Если к этому есть специфические показания, могут назначить полихимиотерапию. В рамках такого курса цитостатические средства, влияющие на организм разными образами, комбинируют между собой.
Мероприятия и способы: как помочь пациенту?
При повышении содержания лейкоцитов до уровня 200*10 на 9/л рекомендован лимфоцитафарез. Если отдельные лимфоузлы резко и сильно увеличиваются, такие процессы выявлены в селезенке, если лимфаденопатия переходит в системную генерализованную форму, назначают лучевое лечение. При разрастании селезенки, не корректирующемся медикаментозными средствами и облучением, пациенту рекомендована спленэктомия. Ее необходимо пройти, если часты инфаркты этого органа, а также при заболевании, сопровождающемся выраженной спленомегалией, определенными формами лейкоцитозома, лейкоза. Спленэктомия незаменима при гранулоцито-, эритро-, тромбоцитопении, анемии аутоиммунного типа, тромбоцитопении, которую не удается регулировать глюкокортикоидами.
Если гормональные соединения показывают выраженный эффект при тромбоцитопении, если установлена гемолитическая анемия, а предваряющим для этого патологического состояния был хронический лимфолейкоз, назначают глюкокортикоиды как основной курс терапии. Эти препараты помогают при хроническом сублейкемическом течении лимфолейкоза, сопровождающемся сильным разрастанием печени, селезенки, лимфатических узлов. Глюкокортикоиды используют, если пациент не переносит цитостатические медикаменты, нет возможно применить облучение либо патологическое состояние проявляет стойкость к таким терапевтическим подходам.
Важные нюансы
Гормональные средства незаменимы, если цитостатические стали причиной цитопении, геморрагического синдрома. Их применяют в рамках полихимиотерапии, комбинируя основной курс и преднизолон.
Для описываемого патологического состояния характерны осложнения инфекционной природы. При таком развитии ситуации больному показан курс антибиотиков. Чаще всего применяют препараты обширного спектра эффективности. Хорошо зарекомендовали себя макролиды, аминогликозиды. Можно использовать полусинтетические средства из пенициллинового ряда, цефалоспоринового, иммуноглобулин.
Миелопролиферативный синдром
Это патологическое состояние нередко рассматривают в рамках образовательной программы вместе с описанным выше. Термином принято обозначать патологию, при которой активно вырабатываются миелоидные клетки. Причина явления – неправильная работа стволовых клеток системы, ответственной за производство крови. Синдром объединяет в себя несколько болезней – лейкоз, миелофиброз, тромбоцитоз, полицитемию. Сюда же принято относить миелодиспластический синдром.
Синдром лимфопролиферативный ( синонимы: синдром увеличения лимфатических узлов, лимфаденопатия) имеет в соей основе увеличение размеров лимфатических узлов различной природы. Лимфоузлы при этом синдроме пальпируются в одной или нескольких группах.
Выделяется четыре группы причин увеличения лимфоузлов:
1. Увеличение числа доброкачественных лимфоцитов и макрофагов в процессе иммунного ответа на антиген;
2. Инфильтрация воспалительными клетками при инфекциях, когда в процесс вовлекаются лимфоузлы;
3. Пролиферация в лимфоузлах злокачественных лимфоцитов и макрофагов;
4. Инфильтрация лимфоузлов метастатическими злокачественным клетками.
Практически можно по этиологии и патогенезу выделить даже две группы лимфаденопатий - воспалительные и опухолевые.
Синдром лимфопролиферативный - клиника
Основной симптом - увеличение лимфатических узлов. Необходимо при осмотре и пальпации больных выявить ряд параметров этого симптома, что позволяет в дальнейшем проводить дифференциальный диагноз. Устанавливается точная локализация увеличения лимфоузлов - в одной, двух или нескольких группах, т.е. имеется ли регионарная или генерализованная лимфаденопатия. Оценивается величина лимфоузлов, их консистенция, болезненность, подвижность, спаянность между собой и с кожей, изменения кожи над лимфоузлами, наличие свищей.
Можно выделить особенности клиники лимфопролиферативного синдрома воспалительного и опухолевого генеза.
При воспалительных лимфаденопатиях чаще встречаются регионарное увеличение лимфоузлов, нередко можно найти входные ворота инфекции. Лимфоузлы увеличены умеренно, всегда болезненны при пальпации, кожа над ними может быть гиперемированной. Лимфоузлы обычно подвижны, не спаяны между собой. Иногда выявляется лимфангоит.
При опухолевых лимфаденопатиях поражение узлов или генерализованное или изолированное в одной-двух группах; узлы нередко спаяны между собой, образуют пакеты. Узлы умеренной плотности или плотные и, как правило, безболезненные. Метастазы в лимфоузлы обычно одиночные, в регионарные области, очень плотные, безболезненные.
Регионарные воспалительные лимфаденопатии - острый лимфаденит.
При остром лимфадените увеличиваются один, реже 2-3 лимфоузла, они мягкой консистенции, чаще всего довольно болезненны, подвижны, не спаяны с кожей, при выраженном воспалении кожа над увеличенным лимфоузлом может быть гиперемированной. Надо искать входные ворота инфекции. Это могут быть инфицированные раны, фурункулы, абсцессы, мастит, панариций, больные зубы. Нередко бывают случаи уже полностью затихшего воспаления в первичном очаге. Иногда вместе с лимфаденитом определяется лимфангоит - красный тяже от входных ворот инфекции к увеличенному лимфоузлу.
Бубоны - это лимфоузы значительных размеров (до 3-5 см в диаметре), с нередким нагноением и распадом. Регионарное их выявление позволяет заподозрить ряд серьезных, опасных в эпидемиологическом отношении заболеваний:бубонную форму чумы, туляремию, содоку (болезнь укуса крыс), болезнь кошачьих царапин, болезнь Никола-Фавра (венерический лимфогранулематоз). Укажем опорные симптомы этих заболеваний.
Думать о чуме следует, если больной приехал из природного очага этой болезни - Забайкалья, Закавказья, районов Каспийского и Аральского морей. Обычно бывает выраженная лихорадка, интоксикация, бубоны выявляются в паховой и бедренной областях. Контуры бубонов нечеткие, они спаяны между собой и с кожей. Уже в течение недели наступает нагноение и образование свища. Диагноз чумы подтверждается выделением возбудителя из пунктата бубона.
Предположение о туляремии должно возникнуть при указаниях на контакт с грызунами, при укусах кровососущих насекомых. Поражаются подмышечные и шейные лимфоузлы. Они не спаяны с кожей и между собой. Развитие бубона медленное, распад происходит к концу третьей недели. Диагноз ставится на основании пробы с тулярином и серологических исследований.
Для содоку характерно указание на укус крысы, развитие на месте укуса первичного аффекта, повторные периоды лихорадки, появление уртикарной сыпи. Бубон чаще всего развивается в подмышечной области. Диагноз устанавливается микроскопически - в крови и материале из первичного аффекта обнаруживаются спирохеты или стрептобациллы.
Для диагностики болезни кошачьих царапин важны указания на контакт с животным, наличие первичного аффекта в виде небольшой пустулы или язвочки, длительный период формирования бубона - 15-30 дней; бубон чаще в подмышечной области, течение его доброкачественное. При размягчении бубона в гное выявляются хламидии.
Для болезни Никола-Фавра характерны указания на случайные и беспорядочные половые связи, наличие бубона в паховой области при отсутствии первичного аффекта.
Регионарные воспалительные лимфаденопатии с первичным аффектом.
При ряде инфекционных заболеваний развивается регионарный умеренно выраженный лимфаденит, и всегда можно обнаружить первичный аффект в виде участка гиперемии с инфильтрацией вокруг. В последующем на месте гиперемии образуется корочка, затем эрозия или язвочка. Регионарные лимфоузлы небольших размеров - менее 2 см в диаметре, болезненные, не нагнаиваются. Такие симптомы характерны для группы заболеваний с природной очаговостью - марсельской лихорадки, клещевого сыпного тифа Северной Азии, лихорадки цуцугамуши, везикулярного риккетсиоза, клещевого энцефалита. Заболевания эти возникают в эндемичных зонах. Окончательный диагноз ставится на основании серологических исследований.
Из хронических инфекционных заболеваний регионарное увеличение лимфоузлов с определением первичного аффекта (шанкра) характерно для первичного сифилиса.
Инфекционный мононуклеоз.
Инфекционный мононуклеоз - острое вирусное заболевание, ведущим синдромом которого является генерализованное увеличение лимфатических узлов практически во всех группах, но больше всех увеличиваются шейные и подмышечные узлы. Они небольших размеров, эластичной консистенции, болезненные, подвижные, не спаяны между собой и кожей, не нагнаиваются. Лимфаденопатия сочетается с лихорадкой, гепатомегалией и спленомегалией, часто бывает ангина. Диагноз устанавливается на основании типичных изменений гемограммы. Увеличивается число лейкоцитов ( в пределах 12 -15 х 109/л), определяется нейтропения и увеличение числа мононуклеаров. Подтверждают диагноз мононуклеоза положительные результаты реакции гетерогемагглютинации. Специфичной является также реакция связывания комплемента с антигеном вируса Эпштейна - Бара.
Краснуха
Краснуха - острое вирусное заболевание, названное так по основному симптому - появлении с первого дня болезни по всему телу красноватой бледной сыпи. Лимфаденопатия также весьма характерна для этого заболевания. Лимфатические узлы увеличиваются позади ушных раковин, сосцевидного отростка, в затылочной и шейной областях; они величиной с горошину, плотные и болезненные.
Аденовирусные заболевания
Из всех форм ОРЗ аденовирусные заболевания часто проявляются генерализованной лимфаденопатией. Увеличиваются преимущественно подчелюстные, заднешейные и затылочные узлы, они величиной с вишню, подвижные и болезненные. Наблюдаются также умеренная лихорадка, ринит, конъюнктивит, реже фарингит.
Бруцелез
Увеличение лимфоузлов при бруцеллезе отмечается нечасто. Они увеличиваются во многих группах, но незначительно. Некоторые из них могут быть болезненными, другие нет. Подозрение на бруцеллез должно возникнуть, если в анамнезе имеются указания на пребывание больного в эндемичных очагах, контакт с сельскохозяйственными животными. Характерны для бруцеллеза разнообразные формы поражения опорно-двигательного аппарата - артриты, синовиты, бурситы, миозиты. Часто выявляются признаки поражения нервной системы в виде невритов, радикулитов. Диагноз подтверждается с помощью внутрикожной пробы Бюрне, реакции Райта-Хедльсона, реакции связывания комплемента со специфическим диагностикумом.
Токсоплазмоз
Хронические формы этого заболевания в подавляющем большинстве случаев протекают с увеличением лимфоузлов. Узлы увеличиваются во многих группах, но весьма подозрительным на токсоплазмоз является увеличение мезентериальных лимфоузлов и развитие мезоаденита. У ряда больных поражается также миокард. Диагностика основывается на клинических данных. Положительные реакции с токсоплазмином, выявление токсоплазменных антител подтверждают диагноз косвенно, больше указывая на инфицированность.
Туберкулез
Поражаются обычно шейные лимфоузлы. Вначале они небольших размеров (1-2 см), довольно плотные и всегда болезненные. По мере прогрессирования заболевания узлы увеличиваются, становятся спаянными с кожей и размягчаются. Кожа над ними становится синюшной. Как правило, узел расплавляется, возникает холодный абсцесс, который, прорвавшись наружу, оставляет после себя свищ. В гное обнаруживаются бациллы Коха. Может быть положительной реакция Манту.
СПИД
Генерализованное увеличение лимфатических узлов является одним из ранних и постоянных признаков СПИДа. Увеличение наблюдается во всех или в большинстве групп, размеры узлов до 2-3 см в диаметре, они плотные, болезненные при пальпации, не спаяны с кожей. СПИД необходимо заподозрить, если лимфаденопатия сочетается с 2-3 серьезными (по терминологии ВОЗ) симптомами: снижением массы тела на 10% и выше, хронической диареей продолжительностью более 1 месяца, перемежающейся или постоянной лихорадкой более 1 месяца. Выявление у больного саркомы Капоши или криптококкового менингита делает диагноз СПИДа почти несомненным. Для верификации диагноза используются реакции обнаружения противовирусных антител.
Читайте также:

