Лечение т клеточной крупноклеточной анапластической лимфомы
Крупноклеточная лимфома - это онкологическое заболевание клеток лимфатической системы. При лимфоме клетки делятся и растут бесконтрольно, старые клетки не отмирают, как это должно быть в здоровом организме. Эта патология может возникнуть в любой части организма, может развиваться в одном лимфоузле, в группе лимфоузлов или во внутренних органах.
Постепенно вытесняя нормальные здоровые клетки в костном мозгу, клетки лимфомы нарушают продуцирование эритроцитов, главных поставщиков кислорода, выполняющих защиту организма от инфекций и тромбоцитов, уменьшение количества которых в крови может приводить к кровотечениям.
Существуют диффузные В-крупноклеточные лимфомы, с характерной экспрессией общих антигенов В-лимфоцитов и антигенов активированных В-лимфоцитов. Из этой группы опухолей можно выделить первичную В-крупноклеточную лимфому средостения и лимфому из клеток центра фолликула, обладающих высоким уровнем вредоносности.
Болезнь поражает людей среднего и старшего возраста, опухоли задевают лимфатические узлы на шее и в брюшине, в желудочно-кишечном тракте, яички, кости, щитовидную и слюнные железы, головной мозг.
Прогрессируя заболевание, вовлекает в опухолевый процесс печень, почки и легкие. Также есть диффузные В-крупноклеточные лимфосаркомы, прорастающие в сосуды, органы дыхания и нервы, разрушают кости. Тимическая – первичная В-крупноклеточная лимфома средостения обнаруживается у молодых женщин, она прорастает ткани и органы, метастазы – редкое явление.
Анапластическая крупноклеточная лимфома – агрессивная форма Т-клеточных лимфом. В норме Т-клетки защищают организм, уничтожая вредоносные бактерии и свои больные клетки. Когда молодая клетка на этапе развития переходит в зрелый Т-лимфоцит, может произойти формирование больной группы клеток, влияющих на увеличение лимфатических узлов.
Изменение при анапластической лимфоме опухолевых клеток такое, что полностью все признаки созревания теряются, и они становятся похожими на молодые клетки. Это явление анаплазии. В такой ситуации на шее, в подмышечных и паховых зонах лимфатические узлы увеличиваются группами. Сопровождается болезнь повышением температуры, потерей аппетита и соответственно снижением веса.
Происходят сбои в работе иммунной системы, которая уже не может защитить здоровые клетки. При лечении анапластической крупноклеточной лимфомы выявляют наличие фермента ALK, если он присутствует, то лечение небольшими дозами лекарственных средств всегда успешное. Часто приходится применять химиотерапию. При отсутствии фермента ALK лечение протекает сложнее, но благодаря постоянному появлению новых лекарственных препаратов болезнь может быть преодолена.
Энтеропатической Т-клеточной лимфомой люди болеют редко. Энтеропатическая лимфома образуется в тонком кишечнике, распространяется затем в другие органы желудочно-кишечного тракта. Практически всегда этот вид лимфомы вызывается болезнью целиакии – генетической непереносимостью белка глютена, содержащегося в зерновых продуктах.
Ее симптомы диарея, боли в животе, повышение температуры, потеря веса, повышенная потливость. Выявляют болезнь при помощи методов фиброколоноскопии или энтероскопии. Также используют компьютерную томографию грудной клетки и брюшной полости и малого таза, чтобы узнать увеличены лимфатические узлы или нет. Эту болезнь лечат по различным схемам лечения других лимфом, используя новые препараты.
Первичнокожная анапластическая крупноклеточная лимфома относится к классу клеточных индолентных, с вялотекущим процессом развития. Только несколько лет назад её стали считать отдельной болезнью, а не анапластической крупноклеточной лимфомой. В данном случае опухоль не распространяется глубже кожи. Наблюдается появление одного или множественных болезненных уплотнений красно-багрового цвета, возникающих в любом месте или сразу в нескольких местах на теле.
Они возвышаются над кожей, со временем образуются язвы. Сопровождается болезнь повышением температуры, снижением веса, сильным потоотделением. Пока ещё нет общепринятого метода лечения редкой болезни. Опухоль небольшого размера удаляют или облучают. При распространении опухоли большого размера применяют лечение препаратами нового поколения.
Печеночно-селезеночная Т-клеточная лимфома относится к классу агрессивных клеточных лимфом. Поражает печеночно-селезеночную лимфу, приводит к увеличению печени и селезенки, лимфатические узлы не изменяются. Болезнь понижает гемоглобин, снижается количество лейкоцитов и тромбоцитов.
Симптомы такие же, как и при других крупноклеточных лимфомах. Диагноз ставится на основании исследования костного мозга или печени, но обычно достаточно проведение проточной цитометрии крови. Лечение выполняется по схемам, применяемым при крупноклеточных лимфомах.
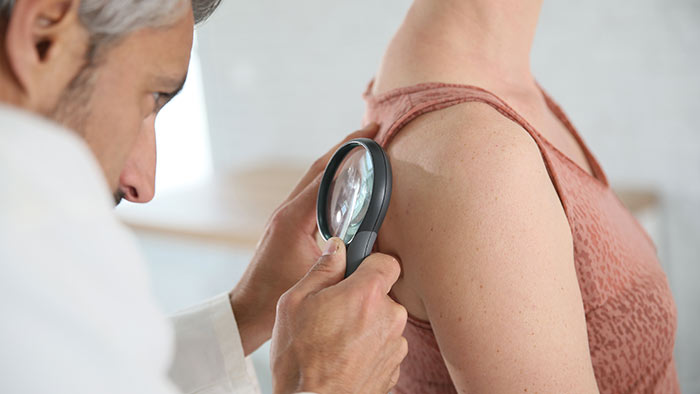
Т-клеточная лимфома кожи (ТКЛК) — это разнородная группа заболеваний, относящихся к неходжкинским лимфомам, основной чертой которых является инфильтрация кожи злокачественными моноклональными Т-лимфоцитами.
- Почему развивается Т-клеточная лимфома кожи
- Виды Т-клеточных лимфом кожи и их стадии
- Как проявляется лимфома кожи, симптомы
- Диагностика Т-клеточной лимфомы кожи
- Как проводится лечение лимфомы кожи
- Трансплантация костного мозга и стволовых клеток
- Процесс восстановления после лечения
- Прогноз
Почему развивается Т-клеточная лимфома кожи
Возникновение Т-клеточной лимфомы связано с мутацией зрелых Т-лимфоцитов, что приводит к их бесконтрольному размножению, миграции в кожу и ее инфильтрации. Что именно вызывает мутацию, неизвестно. Предполагается, что она может быть спровоцирована стимуляцией антигенами в результате сбоя работы иммунной системы.
Спровоцировать сбой иммунной системы могут следующие факторы:
- Вирусные инфекции: вирус Эпштейн-Барра, цитомегаловирус, вирус простого герпеса, ретровирусы, лимфотропный вирус человека и др.
- Некоторые химические вещества, которые используются в промышленности, сельском хозяйстве, строительстве и др.
- Ионизирующее излучение, в том числе лучевая терапия в анамнезе.
- Избыточное воздействие УФ-лучей на кожу.
Т-клеточная лимфома кожи может быть первичной и вторичной. Первичные формы начинаются с поражения кожи. При вторичных сначала поражается лимфоидный орган (например, лимфоузлы), в результате чего в нем происходит размножение и накопление лимфоцитов, потом они мигрируют в кожу и инфильтрируют ее.
Виды Т-клеточных лимфом кожи и их стадии
Выделяют следующие виды Т-клеточной лимфомы кожи:
- Грибовидный микоз.
- Синдром Сезари.
- CD30+ Т-клеточные лимфомы — лимфатоидный папулез (ЛП) и кожная анапластическая крупноклеточная лимфома (КАКЛ).
- Панникулитоподобная Т-клеточная лимфома подкожной клетчатки.
- Первичная кожная агрессивная эпидермотропная CD8+ Т-клеточная лимфома.
- Первичная кожная мелко/среднеклеточная CD4+ Т-клеточная лимфома.
Наиболее часто встречаемые первые 2 типа опухоли. При их стадировании заболевания учитываются следующие факторы:
- Степень поражения кожных покровов.
- Вовлеченность в процесс лимфатических узлов.
- Лимфоидное поражение внутренних органов.
- Поражение системы кроветворения.
Их стадирование происходит согласно следующей схеме:
- 1А стадия. Имеются кожные поражения в виде пятен, которые занимают менее 10% кожного покрова, лимфоузлы не увеличены, в крови обнаруживается незначительное количество атипичных клеток Сезари.
- 1В стадия. Помимо пятен на коже, образуются бляшки, но объем высыпаний не превышает 10% от кожного покрова. Остальные признаки такие же, как на 1А стадии.
- 2А стадия. К вышеперечисленным симптомам добавляется поражение лимфатических узлов.
- 2В стадия. На коже появляются узлы.
- 3 стадия. Кожные проявления генерализуются, образуют сливающуюся эритему и покрывают более 90% поверхности тела.
- При 4 стадии, в крови обнаруживается большое количество атипичных клеток Сезари (более 1000 на микролитр), плюс присоединяется лимфоидное поражение внутренних органов.
Пациентов с синдромом Сезари изначально относят к 4 стадии заболевания, поскольку у них имеется обширная эритродермия и большое количество атипичных лимфоцитов в крови.
Остальные нозологии Т-клеточных лимфом, не являющиеся грибовидным микозом и синдромом Сезари, стадируются на основании следующих признаков:
- Т1А — имеется единичный очаг поражения не превышающий 5 см.
- Т1В — единичный очаг поражения, превышающий 5 см.
- Т2 — имеются множественные высыпания кожи, не выходящие за пределы 1-2 зон
- Т2А — зона поражения не превышает 15 см.
- Т2В — зона поражения не превышает 30 см.
- Т2С — высыпания распространяются более чем на 30 см.
- Т3 — имеется поражение кожи, затрагивающее не рядом расположенные зоны, либо высыпания занимают более 3 зон.
Поражение лимфатических узлов:
- N0 — нет увеличения лимфоузлов, ни центральных, ни периферических.
- N1 — поражена 1 группа периферических ЛУ, которые осуществляют лимфодренаж от пораженного участка кожи.
- N2 — поражено более 1 группы ЛУ, липо есть признаки поражения ЛУ, не осуществляющих дренаж вовлеченной области кожи.
- N3 имеются данные за поражение центральных ЛУ.
Поражение внутренних органов:
- М0 — поражения внутренних органов не обнаружено.
- М1 — есть данные за поражение внутренних органов (требуется морфологическое подтверждение).
Как проявляется лимфома кожи, симптомы
Симптоматические проявления будут зависеть от типа Т-клеточной лимфомы.
Симптомы грибовидного микоза:
- Высыпания в виде пятен и бляшек различной формы и цвета. Они носят множественный характер и располагаются на участках кожи, не подвергающихся инсоляции (зона купальника).
- Феномен одновременного прогрессирования и регресса разных элементов сыпи.
- Пойкилодермия — в зоне клеточных высыпаний имеется пятнистая пигментация, расширение кровеносных сосудов и атрофические изменения кожи.
- Наличие зуда.
В зависимости от стадии заболевания, грибовидный микоз будет иметь следующие особенности. На начальном этапе (1 стадия) отмечается наличие множественных или единичных пятен, которые могут достигать размеров в 20 см. Пятна зудят и могут шелушиться. Внешне они напоминают псориаз или экзему. На этой стадии заболевание может существовать годами и даже десятилетиями. Пятна могут спонтанно регрессировать и образовываться снова. Учитывая то, что клиническая картина сходна с другими дерматологическими нозологиями, правильный диагноз сразу поставить сложно, как правило, на это занимает достаточно длительное время.
Для второй стадии пятна начинают трансформироваться в бляшки — пораженная кожа утолщается и как бы приподнимается над здоровой, ее цвет становится красно-синюшным. Бляшки могут спонтанно регрессировать, или, наоборот, увеличиваться в размерах и сливаться друг с другом. На их поверхности может быть шелушение.
На 3 стадии образуются кожные опухоли в виде куполообразных красно-синюшных узлов, с гладкой поверхностью. Узлы увеличиваются в размерах и распадаются, при этом образуются язвы с кровянисто-гнойным отделяемым.
Панникулитоподобная Т-клеточная лимфома подкожной клетчатки проявляется множественными плотными бляшками, либо узлами различного цвета, которые преимущественно располагаются на нижних конечностях. Клинически напоминают панникулит (воспаление подкожной клетчатки).
Первичная CD4+кожная лимфома из мелких/крупных клеток проявляется единичными или множественными узлами синюшно-багрового цвета. В отличие от грибовидного микоза, узлы появляются сразу, без этапа пятна и бляшки.
Клиническим проявлением синдрома Сезари является наличие обширной эритемы (покраснения кожи), которая распространяется не менее чем на 80% покровов тела. Эритема может шелушится, но не обязательно. Характерно увеличение лимфоузлов до размеров ореха. Чаще всего, поражаются паховые и подмышечные ЛУ.
CD30+ Т-клеточная лимфома проявляется рецидивирующими сгруппированными или диссеминированными папулезными высыпаниями. Отдельные элементы могут спонтанно регрессировать в течение нескольких недель, причем на данном фоне могут образовываться новые папулы. В ряде случаев элементы сыпи могут некротизироваться с образованием некротических язв размером от 1 до 4 см, которые самопроизвольно разрешаются с формированием рубца.
Диагностика Т-клеточной лимфомы кожи
Для постановки диагноза необходимо комплексное обследование:
- Осмотр кожных высыпаний.
- Морфологическое и иммунотипическое исследование биоптатов кожи из очагов поражения. Чтобы результаты биопсии были более информативным, необходима отмена всех наружных препаратов, а также системных глюкокортикостероидов за две недели до забора материала. В сомнительных случаях проводят повторную биопсию через 2-4 недели после предыдущей и материал берут из разных очагов.
- Молекулярно-генетические исследования для определения характерных генетических мутаций.
При подозрении на синдром Сезари проводят такое же обследование, как и при грибовидном микозе (ГМ), плюс добавляют следующие данные:
- Определение площади поражения кожи. Если есть узлы, определяют их количество и размер наибольшего из них.
- Производят определение количества клеток Сезари с помощью проточной цитометрии.
Как проводится лечение лимфомы кожи
Для лечения лимфомы кожи используется химиотерапия. Схемы будут определяться типом заболевания и его стадией.
- Топические кортикостероиды. Их необходимо наносить на поверхность пятен и бляшек.
- УФО спектра В — узковолоконное ультрафиолетовое облучение лучами спектра В. Может применяться для пятен и тонких бляшек.
- ПУВА-терапия — псорален + УФО лучами спектра А. Данный вид лечения эффективен при толстых бляшках и фолликулярной форме ГМ.
- Локальная лучевая терапия в СОД 10-20 Гр. Применяется при единичных высыпаниях.
- Тотальная лучевая терапия (ТЛК). Проводится при наличии распространенных высыпаний, которые не реагируют на топические стероиды. Облучение проводится в суммарной очаговой дозе 30-40 Гр с фракционированием разовой очаговой дозы 1,2-1,5Гр. В качестве поддерживающего лечения после ТЛК применяется ПУВА-терапия. Т-клеточная лимфома кожи является чувствительной к облучению опухолью, поэтому лучевая терапия может применяться, как терапия первой линии при лечении ранних и поздних лимфом, так и для лечения рецидивов.
Если наружная терапия лимфомы кожи не оказала эффекта, добавляют вторую линию терапии, в рамках которой могут использоваться следующие системно действующие препараты:
- Ретиноиды.
- Интерфероны.
- Вериностат — ингибитор гистондеацетилазы.
- Цитостатики метотрексат или проспидин.
На поздних стадиях лимфомы кожи используется химиотерапия и электронно-лучевая терапия. Химиотерапия проводится с помощью вориностата. Его необходимо принимать перорально до достижения контроля заболевания (критериями контроля является отсутствие признаков прогрессирования). В случае развития неприемлемых токсических реакций препарат отменяют.
Лечение СС базируется на следующих принципах:
- Комбинированное лечение (наружное и системное) является более эффективным, чем монотерапия.
- По возможности, следует избегать назначения цитостатиков, поскольку они подавляют иммунитет.
- Необходима своевременная диагностика и лечение инфекционных осложнений.
- Поскольку одним из основных симптомов, снижающих качество жизни пациентов, является зуд. Необходимо его эффективное устранение.
Терапия первой линии
Наилучшую эффективность в рамках терапии первой линии у больных с СС показал экстракорпоральный фотоферез (ЭКФ). Из цельной крови выделяют лейкоциты, которые обрабатывают фотосенсибилизирующим веществом и затем обрабатывают светом с заданной длиной волны. Это приводит к их гибели. За одну процедуру можно удалить только часть клеток, поэтому сеансы повторяют с определенной периодичностью — 1 раз в день в течение 2-х дней с последующим 4-х недельным перерывом.
Также может использоваться альфа-интерферон, только в более высоких дозах, чем при лечении ГМ, или метотрексат в низких дозах, при недоступности других видов терапии.
Для достижения лучшего эффекта, эти методы лечения комбинируют с методами наружной терапии, которые используются при ГМ, например:
- Альфа-интерферон + ПУВА.
- Метотрексат + наружные глюкокортикостероиды.
- ЭКФ + ТОК и др.
Терапия второй линии
При отсутствии эффекта от лечения первой линии, переходят ко второй. Здесь уже используются цитостатические препараты:
- Хлорамбуцил.
- Доксорубицин.
- Вориностат.
- Гемцитабин.
- Пентостатин.
- Флударабин+циклофосфамид.
Устранение зуда
Часто больных кожной лимфомой беспокоит зуд. Он может иметь ярко выраженный характер и существенно снижать качество жизни таких людей. Для борьбы с этим симптомом используются следующие препараты и методы терапии:
- Увлажняющие кремы.
- Антигистамины.
- Антибиотики. Доказано, что кожа больных СС обширно колонизирована золотистым стафилококком, поэтому назначение антибактериальных препаратов благоприятно сказывается не только на выраженности зуда, но и на общем течении заболевания.
Если зуд носит нестерпимый характер, назначается габапентин, который используется для лечения боли при нейропатиях. Начинают с дозировки 900 мг/сут, постепенно увеличивая ее до 3600 мг/сут. Для улучшения сна могут назначаться снотворные препараты.
Если имеются многочисленные генерализованные высыпания, используется ПУВА-терапия и низкие дозы метотрексата. Во время терапии наблюдается частичное исчезновение высыпаний, но после отмены лечения, они образуются снова. Полной ремиссии удается достичь редко.
В связи с этим, для контроля лечения необходима поддерживающая терапия с помощью данных методов, но необходимо помнить о возможных осложнениях. Например, ПУВА может спровоцировать развитие рака кожи, а метотрексат — фиброз печени.
Если имеются крупноузелковые элементы (более 2 см), которые не разрешаются самопроизвольно или под действием терапии, их можно удалить хирургически. Тем более при их наличии необходима биопсия для исключения вторичной анапластичной крупноклеточной лимфомы. Альтернативой может стать локальная лучевая терапия. В целом пациенты с ЛП должны пожизненно наблюдаться у врача, поскольку есть вероятность трансформации их заболевания в другие формы лимфом.
При одиночных или сгруппированных высыпаниях показано их хирургическое удаление или локальное облучение. Такая тактика позволяет добиться полной ремиссии у 95% пациентов. Но независимо от применяемого метода лечения, у 40% больных возникают рецидивы. Если они ограничены только кожными проявлениями, без затрагивания лимфатических узлов и внутренних органов, других методов лечения не требуется, можно использовать предыдущую тактику.
Для больных с множественными высыпаниями рекомендованы низкие дозы метотрексата (5-25 мг/нед). Если желаемый эффект не наступает, добавляют терапию альфа-интерфероном. При наличии очагов внекожного проявления необходима системная химиотерапия по протоколу CHOP.
Трансплантация костного мозга и стволовых клеток
При неэффективности других методов лечения, молодым пациентам с поздними стадиями заболевания может быть рекомендована химиотерапия с последующей аллогенной трансплантацией гемопоэтических стволовых клеток (ГСК). Процедура проводится следующим образом.
Первый этап — это химиотерапия, которая призвана уничтожить клон злокачественных Т-лимфоцитов. Этот этап называется кондиционирование. В рамках химиотерапии используются следующие препараты и режимы:
- CHOP — циклофосфамид, доксорубицин, винкристин, преднизолон
- EPOCH — этопозид, циклофосфамид, доксорубицин, винкристин, преднизолон.
- Пентостатин.
- Флурадабин+ интерферон альфа или циклофосфамид.
- Гемцитабин.
Вторым этапом является пересадка гемопоэтических клеток донора. Для реципиента эта процедура не представляет проблем и выглядит как обычное переливание крови. В течение последующих 3-4 недель трансплантат начинает приживаться в костном мозге, о чем свидетельствует повышение уровня лейкоцитов в крови. Генетически, это лейкоциты донора, и они должны полностью заменить иммунную системы больного. Весь этот процесс занимает от нескольких месяцев до года.
Процесс восстановления после лечения
После того как иммунная система восстановится, необходимо будет заново пройти полный курс вакцинации, который выполняется в детском возрасте.
Прогноз
Прогноз заболевания зависит от клинической формы Т-клеточной лимфомы и ее стадии. Для пациентов с ранней стадией ГМ прогноз благоприятный, поскольку эта лимфома кожи очень редко прогрессирует до более серьезных стадий, и средняя продолжительность жизни таких больных составляет 12 лет.
Для пациентов с изначально более поздними стадиями Т-клеточной лимфомы (2В и больше) без признаков поражения внутренних органов, средняя продолжительность жизни составляет 5 лет, при этом для больных с поражением лимфоузлов прогноз несколько хуже, чем при системном обширном поражении кожи. Для больных, у которых лимфома кожи поразила внутренние органы, средняя продолжительность жизни составляет 2,5 года.
CD 30+ Т-клеточные лимфомы характеризуются относительно доброкачественным течением. В частности, лимфоматоидный папулез не влияет на продолжительность жизни больных, за исключением случаев трансформации в другие виды лимфом, в том числе грибовидный микоз, лимфому Ходжкина и др. Трансформация возникает у 4-25% больных и может возникнуть в период дебюта ЛП, после его излечения и даже предшествовать ему. Кожная анапластическая крупноклеточная лимфома также характеризуется благоприятным прогнозом, пятилетней выживаемости достигают 96% больных.
СD30-лимфопролиферативные заболевания с поражением кожи
Учитывая тот факт, что первичная злокачественная кожная анапластическая крупноклеточная лимфома (PCALCL) — медленно прогрессирующее заболевание, лечение обычно ограничивается минимально агрессивным местным воздействием. Системную терапию применяют у пациентов с распространенной формой или болезнью, резистентной к местной терапии. Больших исследований по изучению эффективности местного воздействия при PCALCL пока нет, но имеются положительные результаты ряда работ, показывающие достижения при применении хирургического метода или локального облучения.
При кожной T-клеточной лимфоме используются различные методики лучевой терапии (ЛТ) и они экстраполируются на АККЛ. Принято считать адекватной суммарную дозу лучевой терапии — 30 Гр. Эффективность составляет более 90%. Облучение пучком электронов характеризуется меньшим повреждением тканей, поэтому является методом выбора для минимализации побочных эффектов (ангидроз и эритема). Следует ли ЛТ применять в монорежиме или комбинировать с хирургическим этапом лечения — вопрос, остающийся пока открытым.
У пациентов с распространенной кожной формой болезни или при неудачах лучевого и хирургического этапов используется монохимиотерапия, при которой препаратом выбора является метотрексат в низких дозах. В исследовании, включающем PCALCL и генерализованный лимфоматоидный папулез (LP) — 45 пациентов, у 87% больных констатированы длительные ремиссии при терапии метотрексатом в дозе 15-20 мг в неделю с переходом на поддерживающую дозу с интервалом от 1 до 4 нед. У 10 пациентов длительность ремиссий составила 24-227 мес после прекращения приема метотрексата. Продолжительность терапии метотрексатом у всех пациентов превысила 39 мес.
Побочные эффекты были умеренными, но у 5 из 10 пациентов (получавших лечение более 3 лет) развился ранний токсический фиброз печени. Оптимальная продолжительность терапии остается неясной, но пациенты с положительным ответом без побочных эффектов не имеют противопоказаний для проведения поддерживающей терапии в дозе 15-20 мг в неделю с интервалом от 1 до 4 нед длительно.
Известны случаи развития резистентности к метотрексату в этих клинических ситуациях. Пеметриксид (TMTX-Alimta) — липофильный антифалат, проникает в клетку путем пассивной диффузии и, таким образом, преодолевает механизм резистентности. Имеется небольшой клинический опыт использования пеметриксида у 3 пациентов с рецидивами PCALCL, у одного из которых зафиксирован эффект. Использование пеметриксида требует дальнейшего изучения прежде, чем его роль в лечении PCALCL будет определена.
Другие агенты с известным механизмом действия — винбластин, в частности, не являются препаратами выбора при лечении данной формы заболевания. Пациентам с генерализованными стадиями болезни, которые являются невосприимчивыми к местной терапии метотрексатом, показана химиотерапия в виде комбинации различных химиопрепаратов, используемая при генерализованных стадиях периферических Т-клеточных лимфом.
Терапия системной анапластической крупноклеточной лимфомы
Несмотря на значительный прогресс в очерчивании молекулярных механизмов заболевания, терапевтические подходы не претерпели значительных изменений. Стандарта терапевтических режимов для лечения АККЛ не существует. Большинство протоколов лечения у взрослых основано на использовании их в педиатрической практике.
Исследования эффективности терапии во взрослой практике в основном носят ретроспективный характер и обобщают разнообразие многих режимов, интерпретация эффективности которых осложняется включением в анализируемый материал лиц, отнесенных к больным АККЛ ошибочно. Новые данные о морфологии и патогенезе заболевания дают возможность выделить больных с подтвержденной ЛХ и диффузной В-крупноклеточной лимфоме (ДККЛ).
Основой большинства протоколов лечения являются алкилирующие агенты, антрациклины, винкаалколоиды и кортикостероиды (т.е. циклофосфан, доксорубицин, винбластин, преднизолон и СНОР-подобные режимы). Педиатрические протоколы часто включают высокие дозы метотрексата и/или ци-тарабина, реже используемые во взрослой практике.
Французские исследователи провели анализ результативности терапии анапластической крупноклеточной лимфомы (без учета данных о возможных различиях в отдельных группах в соответствии с экспрессией анапластической лимфомы киназы (ALK)-белка), включающей три цикла ACVBP (доксорубицин, циклофосфан, виндезин, блеомицин, преднизолон) с последующей консолидацией высокими дозами метотрексата, ифосфамида, этопозида, аспарагиназы, цитозин-арабинозида) или восемь циклов м-BACOD (метотрексат, блеомицин, циклофосфан, винкристин, дексаметазон): полные ремиссии были достигнуты у 69% пациентов с АККЛ T-клеточной природы и у 64% — О-фенотипа.
В итальянском исследовании эффективность лечения оценивали в зависимости от ALK-экспрессии: общий ответ при ALK-позитивных опухолях составил 92,3% (77,3% полных ремиссий); в отличие от этого общий ответ при отсутствии экспрессии ALK-белка был равен 84%, и только у 56% больных достигнуты полные ремиссии. К сожалению, используемые режимы химиотерапии были гетерогенны и не анализировались авторами. Процент пациентов, получивших консолидацию радиотерапией, также неизвестен.
При ДККЛ не удалось продемонстрировать преимущества так называемых режимов III поколения в 1-й линии терапии, например, м-BACOD, MACOP-B, ProMACE-CytaBOM (циклофосфан, доксорубицин, этопозид, преднизолон, винкристин, блеомицин, цитозин-арабинозин, метотрексат с лейковорином) по сравнению с режимом СНОР-21, и, следовательно, большинство онкологов не решаются использовать эти режимы при АККЛ.
Хочется надеяться, что в ближайшее время будут решены проблемы выбора наиболее эффективного режима 1-й линии химиотерапии АККЛ. Уже сейчас обсуждаются вопросы о необходимости интенсификации лечения с использованием комбинаций EPOCH, Hyper CVAD/MA и др.
Трансплантация стволовых клеток
Применение аутологичной трансплантации стволовых клеток (ASCT) вызывает много споров, и пока данных для окончательной оценки этого вида лечения анапластической крупноклеточной лимфомы недостаточно. ASCT изучали проспективно и ретроспективно. В ретроспективных исследованиях трансплантацию выполняли преимущественно при рецидивах АККЛ.
Отдаленные результаты существенно различались в зависимости от экспрессии ALK-белка: при ALK-позитивных опухолях 3-летняя общая выживаемость составила 86%, 3-летняя бессобытийная выживаемость — 100% по сравнению с 0% в ALK-негативных случаях. В этой серии число пациентов с кожными формами АККЛ было невелико, но у всех этих больных отмечено развитие рецидивов заболевания, хотя дальнейший характер болезни был индолентным.
Идентичный результат отмечен в финском исследовании у 14 пациентов, получивших ASCT при АККЛ, в котором в качестве режима кондиционирования применена схема BEAC (кармустин, этопозид, цитарабин и циклофосфан) или АЕМ (цитарабин, этопозид и мелфалан): 5-летняя общая выживаемость при данном режиме составила 86%, при PCALCL у нескольких пациентов констатированы рецидивы. ALK-принадлежность опухоли не определяли, и оценка эффективности используемой комбинации в зависимости от экспрессии ALK-белка неизвестна.
Неудовлетворительный результат ASCT при ALK-негативной форме АККЛ был подтвержден в отдельном исследовании у 15 ALK-негативных пациентов, из которых у 13 пациентов отмечено прогрессирование заболевания в ранние сроки после проведения трансплантации: медиана выживаемости свободной от прогрессирования составила 12 нед, медиана общей выживаемости — всего 72 нед.
Европейская группа трансплантации костного мозга (EBMT) сообщила самый большой к настоящему моменту опыт ASCT: анализ включает 64 случая системной анапластической крупноклеточной лимфомы. Средний возраст пациентов составил 25 лет. После проведения режимов кондиционирования, трансплантацию получили 49 из 64 пациентов. У 15 пациентов трансплантацию проводили в первой полной ремиссии, развитие рецидива в дальнейшем отмечено только у 1 больного. Из 18 пациентов, которым трансплантацию осуществили в частичной ремиссии, констатирован возврат заболевания в 6 случаях.
Самый плохой результат — 14 рецидивов — был в группе из 16 больных, в которой трансплантацию провели у пациентов с первично-резистентной формой болезни. Ранняя стадия болезни, молодой возраст, отсутствие симптомов интоксикации и экстранодальных зон поражения указывали на лучший прогноз при проведении многофакторного анализа в данном исследовании.
В нескольких работах оценивали эффективность использования ASCT в качестве 1-й линии терапии при АККЛ. Французские исследователи описали 1 5 наблюдений АККЛ B-клеточной природы (включая 7 случаев ALK-позитивных) после проведенной химиотерапии, состоящей из двух чередующихся антрациклинсодержащих режимов.
При достижении положительного ответа, пациентам проводили кондиционирование режимом BEAM с последующей ASCT: у всех пациентов достигнуты полные ремиссии; бессобытийная и общая 5-летняя выживаемость составили 87%. Несмотря на обнадеживающие результаты, необходимо акцентировать внимание на том, что анализу подвергнуты АККЛ В-клеточной природы, что не позволяет с уверенностью надеяться на их воспроизведение при АККЛ.
Безусловно, что применение ASCT при анапластической крупноклеточной лимфоме обосновано. Остается вопрос, проводить ли трансплантацию у пациентов в качестве 1-й линии или только при рецидиве болезни. Учитывая благоприятный прогноз у ALK-позитивных пациентов, особенно с низким/низко-промежуточным уровнем МПИ, трудно считать целесообразной трансплантацию в качестве терапии 1-й линии у этой категории больных.
Ограниченные данные позволили предположить, что ASCT неэффективно при лечении рецидивов ALK-негативных опухолей. Эта группа больных может участвовать в клинических испытаниях, исследующих новые подходы к лечению. Улучшает ли результат ASCT в качестве 1-й линии терапии у ALK-негативных пациентов, остается пока неясным.
В литературе описано несколько сообщений успешной аллогенной трансплантации стволовых клеток при АККЛ. Однако нет никаких данных о сравнении этих двух подходов. Учитывая токсичность аллогенной транс — плантации и благоприятные результаты, полученные при стандартной химиотерапии и ASCT, аллогенную трансплантацию следует изучать как терапию наиболее рефрактерных пациентов при неблагоприятном прогнозе.
Новые подходы к терапии
Представляют интерес начатые исследования новых методов терапии АККЛ. Предварительные разработки полностью гуманизированного antiCDSO-антитела показали многообещающие результаты при экспериментальных опухолях мышей. In vitro эти антитела обладают синергизмом со стандартной химиотерапией.
Аnti-CD30 моноклональные антитела SGN-30 показали эффект при АККЛ в I фазе исследования и в настоящее время оцениваются в исследованиях II фазы. MDX-60 — полностью человеческое моноклональное антитело anti-CD30 IqG1K, направленное против CD30, исследовано в I фазе: MDX-60 был применен при АККЛ у 6 предлеченных пациентов: отмечены 1 частичный ответ и 1 полная ремиссия.
Полная ремиссия длилась 4 мес и наблюдалась в случае применения еженедельного режима в течение 4 нед; следует подчеркнуть, что в этом случае полная ремиссия достигнута повторно при лечении рецидива заболевания. В проводимом протоколе, включающем 48 пациентов анапластической крупноклеточной лимфомы и ЛХ, отмечено только два связанных с применением препарата серьезных нежелательных явления — повышение уровня печеночных трансаминаз 3-й степени и пневмония/острый респираторный дистресс-синдром — 4-я степень.
Недавно при АХ был протестирован новый радиоиммуноконъюгат, состоящий из anti-CD30 моноклонального антитела, меченного радиоактивным йодом 131. У 6 из 22 пациентов отмечен положительный эффект. У 7 пациентов зафиксирована гематологическая токсичность 4-й степени. Начато исследование препарата при АККЛ, однако предварительные результаты еще не опубликованы.
Denileukin diftitox — recombinant — рекомбинантный протеин, состоящий из IL-2 и дифтерийного токсина, который блокирует клетки, экспрессирующие средние и высокоаффинные IL-2-рецепторы. Единичные сообщения указывают на эффект denileukin diftitox при рецидивах АККЛ. Комбинация СНОР-21 и denileukin diftitox сейчас исследуется в качестве 1-й линии терапии АККЛ в рамках продолжающихся испытаний II фазы.
Histone deacetylases (HDACs) — гистоновые диацетилазы — регулируют генную экспрессию в ряде клеток. Диацетилирование ведет к уменьшению генной экспрессии. Нарушения регуляции процессов диацетилирования генов, замедляющих рост клетки, считаются важными в патогенезе многих опухолевых заболеваний, включая лимфомы.
Ингибиторы гистоновых диацетилаз — HDAC-ингибиторы (HDIs) — могут увеличить генную активность, клеточную дифференцировку, остановку клеточного роста и апоптоз опухолевых клеток, восстанавливая баланс между ацетилированием и диацетилированием генов, отвечающих за клеточный цикл. Несколько HDACs находятся в клинической разработке, включая depsipeptide SAHA (vorinostat), и PXD101. Эти агенты открывают многообещающие перспективы в терапии B- и в основном T-клеточных лимфом и в настоящее время проходят II фазу испытаний при разнообразных неоплазмах, включая АККЛ.
Эффективность действия ядерного фактора NFкВ(р50) homodimer (p50) 2 была описана при анапластической крупноклеточной лимфоме: она заключается во взаимодействии с Bcl-3, что вызывает трансформацию T-клеток (пока еще необъясненным до конца механизмом). Данные свидетельствуют о том, что Bcl-3 ингибирует апоптоз Т-лимфоцитов. Фармакологическое ингибирование путей NFkB(p50) протеосомными ингибиторами, такими как bortezomib, может открыть новые подходы к терапии АККЛ.
Наиболее привлекательным направлением лечения АККЛ является непосредственно сам ALK-белок. In vitro малые молекулы, производные pyrrolo-carbazole (FP) с ALK-ингибирующей активностью, замедляли пролиферацию и усиливали апоптоз опухолевых клеток. ALK-ингибитор имел минимальное воздействие на ALK-клеточные линии и не подвергся испытанию на человеке.
Результаты опубликованных исследований дают представление о морфологических особенностях и подтверждают прогностическую значимость некоторых факторов системной АККЛ, однако ряд вопросов остается спорным и не изученным до конца. Это позволяет считать важным детальное изучение различных прогностических признаков, определяющих вероятный исход болезни, так как может иметь значение для выбора оптимальной тактики лечения больных системной анапластической крупноклеточной лимфомой.
И.В. Поддубная, А.А. Семенова, Н.А. Пробатова
Читайте также:

