Лечение саркомы юинга после лучевой терапии химиотерапия

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Лечение саркомы – это комплекс методов, направленных на оказание комплексного терапевтического эффекта.
До недавнего времени, единственным действенным методом лечения саркомы считалось хирургическое лечение. Но, на сегодняшний день существует множество других методов, позволяющих вылечить саркому любой локализации и на любой стадии развития. Давайте рассмотрим основные методы, используемые при лечении саркомы.
Хирургическое лечение саркомы
Методика предполагает удаление новообразования оперативным методом. В зависимости от размеров опухоли и ее локализации, может проводиться полостная операция, резекция или лапароскопия. Так, если саркома находится в головном мозге, врачи проводят трепанацию черепа для удаления саркомы. Если саркома поразила кишечник, то онкологи проводят полостную операцию, удаляя пораженный орган и соседние с ним ткани, которые также могут быть поражены.
Удаление саркомы
Удаление саркомы – это хирургический метод лечения злокачественного новообразования. Различают несколько видов удаления саркомы, которые зависят от локализации новообразования.
Применяется в том случае, если хирург 100% уверен в отсутствии метастазов. После такого лечения, используют химиотерапию и лучевое облучение. Частота рецидивов саркомы после локального удаления, составляет 90%
Хирург иссекает не только саркому, но и соседние ткани, расположенные на расстоянии 3-5 см от опухоли. Рецидивы после такого удаления злокачественного новообразования встречаются в 30-50% случаев.

[1], [2], [3], [4], [5], [6], [7]
Представляет собой удаление саркомы в пределах анатомической области. Подобное лечение сравнивают с ампутацией. После такого лечения, используют протезирование, имплантацию, пластику и резекцию. Послеоперационные дефекты устраняют с помощью аутодермопластики. Рецидивы заболевания возникают в 20% случаев.
Представляет собой тотальное удаление пораженной конечности или органа и окружающих его тканей. Рецидивы возникают в 5-10% случаев.

[8], [9], [10], [11], [12], [13], [14], [15], [16]
Химиотерапия при саркоме
Химиотерапия при саркоме – это один из самых важных этапов в лечении онкологических заболевания. Как правило, химиотерапию используют после хирургического лечения. Лечение с использование препаратов позволяет предупредить метастазирование и полностью уничтожить раковые клетки. В некоторых случаях, химиотерапию могут проводить перед операцией, это позволяет уменьшить объемы саркомы.
Данный метод представляет собой лечение с помощью препаратов. Химиотерапия очень эффективна при остеосаркоме, рабдомиосаркоме и саркоме Юинга. Очень часто онкологи сочетают лучевую терапию и химиотерапию для достижения лучшего лечебного эффекта. Единственные недостаток данного метода в том, что препараты действуют на весь организм, вызывая множество осложнений и ужасных побочных эффектов.
Многих пациентов, которым назначают химиотерапию, пугают возможные побочные эффекты (выпадение волос, рвота, тошнота, развитие лейкопении). Но необходимо понимать, что цена побочных действий – это жизнь и здоровье. В некоторых случаях, побочные эффекты удается уменьшить, а то и вовсе избежать. Для этого, схему лечения применения препаратов для химиотерапии должен составлять опытный онколог. Эффективность химиотерапии саркомы зависит от достоверных сведений о природе злокачественных клеток.

[17], [18], [19], [20], [21], [22], [23], [24]
Данный вид лечения представляет собой направленную химиотерапию. Вводимые препараты влияют только на пораженные раковые клетки. Это довольно эффективный метод, так как позволяет не затрагивать здоровые клетки.
Лучевая терапия
Данные метод лечения саркомы используется через 4-6 недель после хирургического лечения и предполагает лечебный курс в 2-3 месяца. Лучевая терапия представляет собой пучок протонной энергии, которая действует на место локализации опухоли, уничтожая раковые клетки и предупреждая метастазирование.
Лечение саркомы в Израиле
Лечение саркомы в Израиле это популярная практика избавления от онкологических заболеваний и злокачественных новообразований. Израиль – это страна с высокими технологиями и многолетней успешной практикой лечения раковых заболеваний. Давайте рассмотрим основные преимущества лечения саркомы в Израиле.
- Хирургическое лечение саркомы проходит с использованием щадящих методик. Благодаря этому, есть возможность сохранить пораженный орган и восстановить его функции. Особой популярностью пользуется микрохирургия, с помощью которой можно пересадить мышечные ткани, восстановить работу пораженных органов и обеспечить эстетичный вид прооперированной части тела.
- Использование современных методик радиотерапии. Данный метод существенно повышает эффективность лечения любого вида саркомы. Курс радиотерапии может занимать от 2 до 3 месяцев. Лечение проводится как до хирургического вмешательства, так и после него.
- Таргентные методы лечения. Терапия позволяет воздействовать препаратами прямиком на источник поражения и эффективно устранять его. Таргетная терапия намного эффективнее химиотерапии и не оставляет после себя губительных побочных симптомов, что также очень важно.
Успехи лечения злокачественных опухолей в Израиле – это гарантия жизни и здоровья, а также надежда современной онкологии. Израильские клиники принимают на лечение не только своих граждан, но и пациентов с других стран, оказывая лечение на самом высоком уровне.
Лечение саркомы в Германии
Лечение саркомы в Германии отличается высокой эффективность и успешностью. Немецкие онкологические клиники располагают всеми возможными методами точной диагностики, что гарантирует высокую эффективность лечения. В лечении сарком, онкологи используют комбинированные методики, которые позволяют добиться эффективного результата. Преимущества лечения саркомы в Германии:
- Применение высокотехнологичного оборудования и самых эффективных лекарственных препаратов.
- Работа профессионального, квалифицированного персонала.
- Немецкие клиники сотрудничают с ведущими онкологическими центрами по всему миру.
Лечение саркомы в Германии характеризуется комплексным подходом к проблеме. Программу лечения разрабатывает группа профессиональных врачей – хирурги, химиотерапевты, морфологи, специалисты по лучевой терапии. Главное правило, которого придерживаются немецкие онкологические клиники – стремление к надежному результату и применение органосберегающих методов.
Народное лечение саркомы
Народное лечение саркомы – это методы народной медицины, которые складывались на протяжении многих столетий. Народное лечение злокачественных новообразований не имеет ничего общего с общепризнанной медицинской практикой и зарекомендовавшими себя методами лечения. Рецепты народной медицины основаны на лекарственных свойствах трав. Давайте рассмотрим несколько рецептов народного лечения саркомы.
- Из алоэ можно сделать лекарственную настойку, которая будет оказывать лечебное действие на весь организм. Итак, возьмите 5-6 больших листов алоэ и положите на сутки в холодильник. После этого, растение необходимо порезать на небольшие кусочки и залить 500 мл спирта или водки. Настойка должка постоять 14-20 дней, в темном прохладном месте, при этом, каждый день банку с настойкой нужно встряхивать. Принимать настойку по одной ложке перед каждым приемом пищи, но не чаще трех раз в сутки.
- Настойка из прополиса также обладает целебными свойствами, и согласно народной медицине, может помочь вылечить саркому. Для настойки вам понадобится 100 г измельченного прополиса и 300 мл водки. Залейте растение водкой, закройте крышкой и взбалтывайте в течение часа. После этого настойку отправляют на неделю в темное место, ежедневно встряхивая банку. Через неделю настойку необходимо процедить и принимать по 10-15 капель, разбавляя в стакане воды, три раза в сутки.
- Возьмите 20-50 г березовых почек и залейте их 100-150 мл водки. Настойка настаивается 15-20 дней, каждый день ее необходимо встряхивать. Как только лечебная настойка настоялась, ее необходимо процедить. Настойку наносят на марлю и накладывают на пораженный саркомой участок тела 2-3 раза в сутки.
- Приготовьте 15-20 г коры дуба и 1000 мл водки. Залейте кору водкой и поставьте на огонь. Варите 30-40 минут, постепенно добавляя 4 ложки меда. После этого отвар нужно процедить и использовать как средство для смачивания повязок. Повязки нужно наносить на пораженный участок тела, то есть на приблизительное место локализации саркомы.
- Соберите пучок свежих листьев подорожника, хорошенько промойте их и выдавите из них сок. Сок можно пить, а можно смачивать и наносить на повязки, прикладывая к пораженному злокачественной опухолью месту.

[25], [26], [27], [28], [29], [30]
Питание при саркоме
Питание при саркоме играет важную роль. Так как правильное сбалансированное питание позволяет ослабить болезненную симптоматику злокачественной опухоли и укрепить иммунную систему. Больные, которым диагностировали саркому, должны питься дробно, 5-6 раз в день, чтобы поддерживать нормальное функционирование организма.
Читайте более подробно о диете при раке здесь.
При саркоме рекомендуется употреблять:
- Свиную, говяжью и куриную печень, сливочное масло и молочные продукты, овощи и фрукты – данные продукты содержат много витамина А, который является антиоксидантом и ускоряет процесс регенерации клеток.
- Орехи и каши, макароны, свиное мясо – эти продукты обогащают организм витаминами группы В, которые повышают сопротивляемость к инфекциям и нормализуют работу всех органов и систем.
- Плоды шиповника, черной смородины, калины, а также сладкий перец, киви, капуста брокколи, цитрусовые и шпинат – богаты витаминов С. Витамин принимает участие в формировании соединительной ткани, выводит токсины и яды из организма.
Вредные и противопоказанные продукты:
- Мучное, сладкое и высококалорийные блюда должны быть под запретом. Это объясняется тем, что пища, богатая углеводами увеличивает риск онкологических заболеваний.
- Люди, употребляющие жаренную и жирную в пищу, рискуют стать обладателями саркомы.
- Злоупотребление соленой, острой и горячей пищей – это одна из причин саркомы желудка.
Лечение саркомы зависит от размеров опухоли, степени поражения, наличия метастазов, стадии саркомы и общего состояния организма. Все это, в комплексе с лечебными методами, позволяют сделать прогноз, относительно выживаемости больного после саркомы.
Лечение должно быть как местным, так и системным. При местном лечении курабильность достигается только в 10-20% случаев, и химиотерапия дает более благоприятный прогноз.
Местное лечение саркомы Юинга. В отличие от большинства сарком костей саркома Юинга представляет собой радиочувствительную опухоль. Поэтому основным методом местного лечения является радикальная высоковольтная лучевая терапия. Первичную опухоль облучают в дозах 55-60 Гр, которые даются фракциями по 2 Гр в течение 6-7 недель. Необходимо принять меры к тому, чтобы не облучить в этой дозе все мягкие ткани конечности.
В последние годы у некоторых больных после сеансов лучевой и химиотерапии стали развиваться поздние рецидивы. Поэтому в качестве адъювантного средства при лучевой и химиотерапии все чаще используется хирургическая операция с последующим эндопротезированием кости. В отдельных случаях опухолевый рост удается контролировать с помощью только хирургической операции, однако, учитывая высокую инвазивность опухоли, иногда следует сочетать хирургический метод с лучевой терапией. Еще одна причина отказа от лучевой терапии — риск развития радиационных сарком.
Так, риск развития радиационной саркомы в течение последующих 20 лет после лечения опухоли Юинга у детей, составляет 7%. Проблема состоит в том, что при больших опухолях хирургическим методом невозможно удалить весь пораженный участок, содержащий опухолевые клетки, и поэтому не удается избежать последующего облучения. Таким образом, выбор между хирургией и лучевой терапией сделать сложно, особенно в случаях опухолей костей таза. Злокачественные круглоклеточные опухоли костей лучше лечить в специализированных клиниках, а не в обычных больницах.
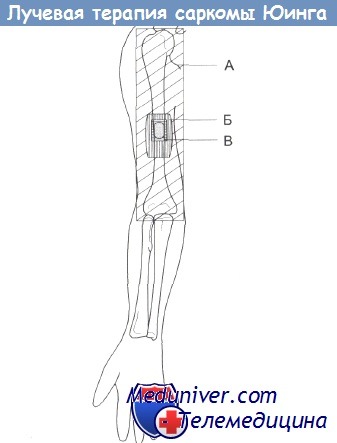
Формирование полей при лучевой терапии саркомы Юинга.
(А) Вся плечевая кость облучается в умеренной дозе (30 Гр)
(Б) Поле сужено до размеров опухоли и примыкающего участка кости (45 Гр)
(В) Облучение опухоли (60-70 Гр). Если опухоль не затрагивает эпифизов, их можно не облучать.
Химиотерапия саркомы Юинга
В последнее время эффективным методом лечения саркомы Юинга, который дает неплохие прогностические результаты, стала адъювантная химиотерапия. Наиболее часто применяются следующие препараты: доксорубицин, циклофосфамид, винкристин, актиномицин D и ифосфамид. Некоторой эффективностью также обладают этопозид, метотрексат и нитрозомочевина.
В настоящее время используется несколько рецептур, но ни одной из них нельзя отдать предпочтение. По-видимому, следует использовать все обычно применяющиеся цитостатики, причем назначать их в максимальных дозах. В последние годы утвердилась тенденция назначать интенсивную химиотерапию на срок 9-12 месяцев вместо приема цитостатиков в небольших дозах на протяжении 1-2 лет. Типичный курс начинается с назначения ифосфамида, доксорубицина и винкристина.
Больные принимают препараты в течение 12 недель, а затем проводится локальное лечение (операция и лучевая терапия). После операции продолжают назначать цитостатики, и когда достигнута максимальная доза доксорубицина, его заменяют актиномицином. В течение всего времени лечения больных необходимо регулярно обследовать: проводить анализы крови и рентгенографию грудной клетки, а при необходимости также сканирование костей. Разработка метода назначения химиопрепаратов в больших дозах с поддержкой аутологичных стволовых клеток периферической крови пока еще находится в стадии эксперимента.
Проводятся клинические испытания на больных, входящих в группу повышенного риска, например, у которых при обследовании в легких было обнаружено несколько метастазов. Предварительные результаты показывают, что для небольшого числа больных метод оказался эффективным. Эта эффективность связана со степенью ремиссии заболевания в период назначения препаратов в высоких дозах.
Прогноз саркомы Юинга
В настоящее время радикальное местное лечение и интенсивная химиотерапия обеспечивают 5-летнюю выживаемость 50-60% больных детей с локализованной опухолью. Большинство их, вероятно, вылечиваются. Хотя на успех лечения влияют многие факторы, несомненно, что наиболее важным из них является химиотерапия.
Для больных с опухолями костей таза прогноз оказывается менее благоприятным, чем для больных с опухолями костей конечностей. В случаях небольших опухолей, например, челюсти, мелких костей кисти и ступни прогноз оказывается благоприятным, и неясно, насколько интенсивной должна быть при этом химиотерапия. Основными прогностическими факторами являются величина опухоли и наличие метастазов. Большие опухоли в большей степени склонны к локальному росту и к метастазированию.
Рецидив метастазирующей опухоли часто приводит к дальнейшему увеличению количества метастазов. При этом методы стандартной химиотерапии почти неэффективны, хотя для больных с несколькими метастазами в легких существует шанс излечения. В настоящее время исследуются возможности применения в этом случае интенсивной химиотерапии.
Саркома мягких тканей слабо чувствительна к химио- и лучевой терапии и дает рецидивы при операциях, когда не удается убрать все пораженные ткани. Чтобы лечение было успешно, нужно усиливать действие химиотерапии и избежать резкого всплеска метастазирования и роста саркомы после операции.

Метод общей электромагнитной гипертермии своим высокотемпературным воздействием (от 42,5 °С и выше):
- усиливает действие лучевой терапии и химиопрепаратов;
- стимулирует противоопухолевый иммунитет;
- повреждает жизнеспособность клеток саркомы до операции, что снижает риск метастазирования и рецидива после.
При лечении саркомы мягких тканей гипертермией становится возможным:
- выполнение органосохранных операций, а не ампутаций и травмирующих;
- предупреждение рецидивов болезни;
- уменьшение дозы облучения или отпадает необходимость проведения лучевой терапии.
В клинику “К-тест” больных с саркомами мягких тканей принимают на лечение из любых регионов России и СНГ, Европы. Ознакомиться с условиями размещения пациентов и их сопровождающих можно в соответствующем разделе.
Саркома мягких тканей: результаты лечения гипертермией
Предыстория: Большинство пациентов поступали к нам с устойчивостью к нескольким схемам химиотерапии. Они имели высокозлокачественные опухоли размером более 5 см с метастазами. У 42 % больных первичная опухоль была неудалимой. Другой части больных уже были проведены травмирующие операции, множественные курсы химио- и лучевой терапии. На фоне проводимого лечения наблюдалось только прогрессирование. После радикальных операций метастазирование и неоперабельные рецидивы выявлялись в среднем через 20 месяцев.
Таким образом, мы приступали к лечению крайне тяжелой и малоперспективной категории больных. Общая гипертермия проводилась как последняя попытка добиться ремиссии.
Но и при таких исходных данных гипертермия давала эффект: под действием температуры опухоль некротизировалась, уменьшалась, что позволяло отказаться от ампутации конечностей.
Клинический пример:
Больная О., 53 года. Диагноз: Саркома мягких тканей правой подколенной области.
В феврале 2017 года была обнаружена опухоль в подколенной области. Обратилась за помощью в ЦРБ по месту жительства через 6 месяцев. Выполнена операция – удаление опухоли. Гистология: миксофибросаркома. Через 2,5 мес. появился рецидив опухоли. В январе 18 выполнена химиоэмболизация артерий опухоли. В феврале иссечена рецидивная опухоль. Иммуногистохимия: эмбриональная рабдомиосаркома.
Поступила в клинику К-тест в феврале 2018 года. С незажившей раной, некрозами кости в подколенной области. Больной проведено 5 курсов гипертермии с химиотерапией в период с февраля по август 18 года. После заживления раны в послеоперационном рубце в январе 2019 года выявлен узел 13х10 мм. В феврале 2019 года произведено удаление рецидивной опухоли. Гистология: рабдомиосаркома 3 стадии лечебного патомарфоза. Послеоперационная рана зажила. При контрольных обследованиях признаков рецидива и отдаленных метастазов не выявлено через 3,6 и 9 месяцев.
3 стадия патаморфоза говорит о глубоком повреждении опухоли и о практическом отсутствии потенциала для рецидивирования и метастазирования.
НЕПОСРЕДСТВЕННЫЕ РЕЗУЛЬТАТЫ. 155 больных в выборке:
| Диагноз | Полная регрессия | Частичная регрессия | Стабили зация | Улучшение качества жизни |
| Саркомы мягких тканей T2bN0M1 | 3,6 % | 36,4 % | 47,3 % | 83,6 % |
Подсчет показателей выживаемости проводился по методу Каплана — Майера. Результаты достоверны (P ОТДАЛЕННЫЕ РЕЗУЛЬТАТЫ
Достигнутый в результате гипертермии пятилетний рубеж пережили 49,8 % больных саркомами мягких тканей с 4-й стадией.
Выживаемость с саркомами 4-й стадии, прошедших лечение гипертермией
| Диагноз | 1 год | 3 года | 5 лет |
| Саркомы мягких тканей, 4-я стадия | 94,2 % | 68,2 % | 49,8 % |
Подсчет показателей выживаемости проводился по методу Каплана — Майера. Результаты достоверны (P Наилучшие результаты получены при лечении следующих видов сарком мягких тканей:
- лимфосаркомы;
- липосаркомы;
- ангиолейомиосаркомы;
- синовиальные саркомы;
- злокачественные невриномы;
- мезенхимомы;
- злокачественные шванномы;
- миксомы;
- саркомы GIST;
- хондросаркомы.
По локализации наиболее успешно лечатся саркомы желудочно-кишечного тракта, саркомы матки и забрюшинного пространства.
Если после 2-3 курсов проводимой химиотерапии в рамках стандартного лечения по ОМС нет заметной положительной динамики, улучшения самочувствия, уменьшения размеров опухоли и метастазов, то следует задуматься о необходимости усиления химиотерапии нагревом. Дальнейшее продолжение стандартной химиотерапии при отсутствии динамики, даже со сменой химиопрепаратов, приведет только к устойчивости саркомы к лекарствам.
Мы остановились на схемах, наиболее изученных при саркомах мягких тканей. Применяя известные режимы полихимиотерапии (комбинирование нескольких препаратов), мы получили возможность сравнить их эффективность и токсичность в обычных условиях и в условиях гипертермии. Химиопрепараты вводились на высоте максимального нагрева в дозе 50–70 % от курсовой дозы и давали в разы больший эффект, чем без нагрева.
Перспективно также применение на фоне общей гипертермии новых противоопухолевых средств. Нескольким пациентам в ходе гипертермии вводился препарат Йонделис®, мы видим быстрый и мощный эффект, но окончательные выводы пока делать рано.
Что касается осложнений химиотерапии в сочетании с общей гипертермией, то они встречались реже, чем при классической химиотерапии, и были легкими по степени тяжести.
Таблица 16.1. Дифференциальная рентгенодиагностика опухоли Юинга и острого гематогенного остеомиелита
саркома Юинга в фазе прогрессирования опухолевого процесса
Диафиз с распространением на метафизы; метафиз с последующим распространением на диафиз. Ростковая зона временно препятствует распространению опухоли на эпифиз
Метафиз с распространением процесса на диафиз и через ростковую зону на эпифиз
Изменения структуры пораженного участка кости
Потеря четкости внутреннего контура коркового слоя с возникновением очагов деструкции без образования некроза и секвестрации
Очаги деструкции быстро сливаются с образованием обширных участков остеолиза с некрозами и формирующимися секвестрами
Как правило, возникают линейные, многослойные, разорванные и козырьковые периостозы
Всегда возникают линейные, многослойные и разорванные периоститы
Наблюдаются в 20—30 % случаев
Изменения в мягких тканях пораженного сегмента конечности
Локальная припухлость с максимальным увеличением размеров на уровне наиболее выраженной деструкции
Распространенное увеличение размеров мягких тканей, которое предшествует деструктивному процессу
Таблица 16.2. Дифференциальная рентгенодиагностика опухоли Юинга с диафизарным туберкулезом и остеомиелитом Гарре
саркома Юинга в фазе относительной ремиссии
диафизарный туберкулез
остеомиелит Гарре
Метафиз, метадиафиз, диафиз
Разнообразная деструкция губчатой кости, а также коркового слоя
Деструкция, разрушающая кость и ассимилированные периостальные наслоения
Деструктивный процесс слабо выражен либо отсутствует
Ассимилированные и ассимилирующиеся периоститы
Наблюдаются в 20-30 %
Временно существующее увеличение размеров
Размеры увеличены по типу "вздутия"
Постоянно выраженное утолщение кости
Изменения в мягких тканях
Локально увеличены в размерах с повышением их интенсивности
Некоторое повышение интенсивности
Оперативное лечение
Локальный контроль может быть достигнут с помощью хирургического вмешательства или лучевой терапии.
Радикальное удаление первичной опухоли с минимальными косметическими и функциональными нарушениями, выполненное после неоадъювантной химиотерапии, в большинстве случаев обеспечивает стойкое излечение саркомы Юинга. Особые сложности имеются при опухолях тазовых костей. Только в редких случаях в этой зоне встречаются первичные операбельные опухоли. Большинство из них имеет большие размеры с инвазией мягких тканей и проникновением в полость таза и является неоперабельными.
Предоперационная лучевая терапия не увеличивает число осложнений в послеоперационном периоде и в некоторых случаях необходима с целью снижения размеров, васкуляризации опухоли и предотвращения интраоперационного разрыва опухоли. По данным ряда авторов, наиболее эффективно проведение операции в первые 10 нед от начала лечения с целью снижения риска отдаленного метастазирования.
В последние годы принципиально изменились подходы к оперативному вмешательству по сравнению с ранее принятыми традиционными установками, когда операции выполнялись только по индивидуальным показаниям (рецидивы, патологические переломы, наличие кровотечения) у 10—20 % больных.
В настоящее время все больные должны подвергаться хирургическому лечению, за исключением неоперабельных локализаций (кости таза, позвоночник). Во время операции должен осуществляться так называемый принцип абластики — широкая резекция пораженной кости вместе с окружающими нормальными мышцами во всех направлениях, т. е. единым мышечно-фасциально-футлярным блоком с обязательным удалением всех мест предыдущих биопсий.
При наличии патологического перелома конечности, кровотечения в месте первичного очага поражения вследствие распада новообразования показано удаление опухоли в объеме ампутации или экзартикуляции конечности на первом этапе лечения (до проведения индуктивной химиотерапии). При возможности радикального удаления первичного опухолевого очага с сохранением функции пораженного органа операция должна быть выполнена на первом этапе лечения. При невозможности проведения органосохранной операции на первом этапе лечения ее нужно осуществить после 3-го курса индуктивной химиотерапии при локализованном процессе и после 4-го или 5-го курса — при прогностических неблагоприятных вариантах саркомы Юинга (СЮ)/примитивной нейроэктодермальной опухоли (ПНЭО). Необходимо подчеркнуть, что во всех случаях химиотерапия начинается через 24 ч после проведения операции.
После удаления опухоли определяют степень лечебного патоморфоза по Huvos с выявлением жизнеспособных опухолевых клеток в гистотопографических срезах:
- I степень — незначительное или полное отсутствие эффекта;
- II степень — от 50 до 95 % ткани опухоли некротизировано;
- III степень — более 95 % опухоли некротизировано, встречаются лишь небольшие фокусы жизнеспособной опухолевой ткани;
- IV степень — отсутствие жизнеспособной опухолевой ткани.
Лучевая терапия
Лучевое лечение широко использовалось из-за высокой радиочувствительности саркомы Юинга с целью излечения первичной опухоли. Высокий процент локальных рецидивов после облучения стало толчком к успешному использованию полихимиотерапии и расширению показаний к оперативному вмешательству.
Эффективность радиологического контроля зависит от адекватности дозы лучевой терапии (ЛТ) и выбранного объема облучения.
В настоящее время в большинстве международных протоколов (EICESS92, EICESS99, CCG и др.) и в клинике НИИ ДО РОНЦ РАМН принят дифференциальный подход к лучевой терапии в зависимости от эффективности неоадъювантной химиотерапии (XT) и хирургического этапа лечения. При полном радикальном удалении опухоли ЛТ не проводится; при микроскопически обнаруживаемой остаточной опухоли после ее удаления облучение осуществляется в суммарной очаговой дозе (СОД) 35—45 Гр; при макроскопически остаточной опухоли и неоперабельных локализациях — 50—55 Гр. Не используются более высокие дозы ЛТ (60 Гр и выше) в связи с высоким риском инвалидизации пациентов из-за развития поздних лучевых осложнений и увеличением риска появления вторичных опухолей (остеогенная саркома) в облученной кости.
Объем облучения жизненно важных органов не должен превышать следующих уровней:
- спинной мозг — не более 30 Гр;
- сердце — не более 18 Гр на менее чем 50 % объема органа;
- печень — не более 18 Гр на менее чем 50 % поверхности органа;
- почки — одна из двух почек не должна подвергаться облучению;
- тонкий кишечник — не более 30 Гр.
При локализованных формах СЮ/ПНЭО в случае выполнения оперативного вмешательства на первом этапе лечения лучевую терапию проводят после 1-го курса химиотерапии; при выполнении операции после проведения 3 курсов химиотерапии 4-й курс проводят в послеоперационном периоде с последующим облучением. В случае микроскопически определяемой остаточной опухоли лучевую терапию назначают в СОД 30 Гр в режиме стандартного фракционирования (разовая очаговая доза — РОД 2 Гр).
При макроскопически остаточной опухоли и неоперабельных локализациях ЛТ проводят после 3-го, 4-го или 5-го курсов химиотерапии в соответствии со стандартными принципами: объем облучаемой зоны должен включать всю область распространения опухоли на момент постановки диагноза + 2 см вокруг пораженного участка. Облучение проводят в режиме гиперфракционирования в дозе 1,5 Гр 2 раза в день с интервалом 6 ч, 5 дней в неделю; СОД 50 Гр.
Крупнопольное облучение легких также доказало свою эффективность в профилактике рецидивов, повысив 4-летнюю выживаемость у больных с изолированным метастатическим поражением легких с 13 до 53 % случаев. Облучению подвергаются также и все выявленные метастатические очаги (СОД 30—36 Гр).
Крупнопольное облучение легких проводят после 2-го курса полихимиотерапии в режиме стандартного фракционирования — РОД 1,2 Гр, СОД 12 Гр. При сохранении очагов в легких после 6-го курса полихимиотерапии дополнительно производится локальное облучение очагов — СОД 12 Гр. Суммарная площадь облучения легочных метастазов не должна превышать 25 % от общей поверхности легких.
Все костные метастаэы должны облучаться в объеме, установленном при первичной диагностике до начала специального лечения. Облучение костных метастазов производится после 5-го курса полихимиотерапии параллельно облучению основного очага. Не подвергаются облучению костные поражения, определявшиеся только по данным сцинтиграфии и исчезнувшие после 2-го курса химиотерапии. Облучение при поражении более 50 % миелопролиферативных зон требует дополнительной консультации радиолога. Облучение проводят в режиме стандартного фракционирования — РОД 1,5 Гр в день, СОД 30 Гр.
При наличии изолированного метастаза в кости черепа облучают все кости черепа (СОД 24 Гр) с последующим локальным облучением метастатического очага — СОД 6,6 Гр. Метастазы в ЦНС облучают после 2-го курса химиотерапии в СОД 30 Гр. Регионарные и другие метастазы должны подвергаться облучению в объеме начального поражения с захватом 2 см от зоны нормальных тканей в режиме стандартного фракционирования (РОД 1,5 Гр, СОД 30 Гр).
Необходимо отметить, что суммарная площадь облучения не должна превышать 30 % поверхности тела (не более 50 % миелопролиферативных зон). Если необходимо облучать большую площадь, то преимущество имеют опухолевые очаги, плохо регрессировавшие на индуктивной терапии. Очаги же, не выявляемые доступными диагностическими методами к моменту начала ЛТ, не облучают. Вопрос об их облучении решается индивидуально после консультации с радиологом. Программа облучения пациентов, имеющих другие метастатические поражения, составляется индивидуально.
Химиотерапия
Сочетание адъювантной химиотерапии, лучевой терапии и расширение хирургического подхода улучшили прогноз для пациентов с саркомой Юинга и примитивной нейроэктодермальной опухолью.
В настоящее время в большинстве протоколов для лечения неблагоприятных в прогностическом отношении СЮ/примитивной нейроэктодермальной опухоли используют альтернирующие курсы VAC, VAdrC, IE (ифосфамид + вепезид). Существующие программы лечения больных с саркомой Юинга/ПНЭО из групп высокого риска включают высокоэффективные лекарственные препараты с обязательным увеличением дозовой интенсивности и уменьшением интервалов между курсами полихимиотерапии (ПХТ). Эффективность замены циклофосфана на ифосфамид в курсовой дозе 9 г/м2 (курс VAIA) у больных с первично-диагностированной СЮ/ПНЭО в протоколе ЕТ-2 (UK) позволила добиться достоверного увеличения бессобытийной 6-летней выживаемости по сравнению с предыдущим ЕТ-1 исследованием с 34 до 51%.
В исследовании CESS-86 показано увеличение 5-летней бессобытийной выживаемости у больных с локализованными нерезектабельными СЮ/примитивной нейроэктодермальной опухоли с 44 до 58 % по сравнению с предыдущим исследованием CESS-81 при применении к ним дифференцированного подхода и интенсивного облучения. В этой группе больных высокого риска (тазовая и другая центральная локализация) циклофосфан был заменен на ифосфамид в комбинации с адриамицином, винкристином, актиномицином. Общая длительность лечения — 12 курсов с облучением после 6 курсов ПХТ в СОД 60 Гр.
Более чем 65 % детей с первично-локализованным процессом имеют долговременную безрецидивную выживаемость при проведении современных программ лечения. Однако пациенты с наличием метастазов на момент постановки диагноза и больные с локализованной формой заболевания с неблагоприятной локализацией опухоли (кости таза, кости осевого скелета) или имеющие объем новообразования более 100 см2 образуют группу с очень плохим прогнозом, безрецидивная выживаемость в которой составляет 21—42 %.
В предварительных исследованиях была выявлена эффективность химиотерапевтических протоколов, включающих высокодозную химиотерапию (ВХТ) в самостоятельном варианте или в комбинации с тотальным облучением тела для пациентов с прогностически неблагоприятными формами саркомы Юинга. С начала 80-х годов была доказана эффективность высоких доз мелфалана в сочетании с аутотрансплантацией стволовых клеток у больных с СЮ/ПНЭО с крайне неблагоприятным прогнозом на стандартную ПХТ. За период с 1978 по 1999 г. в 89 европейских центрах проведено 192 ВХТ с трансплантацией гемопоэтических клеток пациентам с СЮ. Многофакторный анализ лечения больных группы высокого риска саркомы Юинга/примитивной нейроэктодермальной опухоли с применением ВХТ в Европе показал высокую эффективность данного метода.
В 1997 г. в НИИ ДО РОНЦ РАМН был создан протокол ESIPO-97 для пациентов группы высокого риска, состоящий из индуктивной химиотерапии в соответствии с протоколом CCG—7951; локальной терапии в виде хирургического удаления опухоли и/или облучения; фазы консолидации в виде высокодозной химиотерапии с последующей трансплантацией гемопоэтических стволовых клеток или стандартной химиотерапии для пациентов, подвергшихся радикальному хирургическому вмешательству локализованной опухоли.
Индуктивная фаза протокола включает 5 курсов полихимиотерапии в альтернирующем режиме — 1-й, 3-й и 5-й курсы по схеме: винкристин, 1,5 мг/м5 в 1-й, 8-й, 15-й дни, адриамицин, 37,5 мг/м2 в 1-й, 2-й дни в виде 24-часовой инфузии, циклофосфан, 2,1 г/м2 в 1-й, 2-й дни (блок А); 2-й и 4-й курсы ПХТ по схеме: ифосфамид, 2,4 г/м2 в 1—5-й день, этопозид, 100 мг/м2 в 1—5-й день (блок В). Интервал между курсами составляет 21 день; критерием начала очередного курса ПХТ является восстановление уровня лейкоцитов >1,5 • 109/л и тромбоцитов >75 • 109/л. Забор периферических стволовых клеток и эксфузию костного мозга для обеспечения проведения ВХТ производят минимум после 2 курсов индуктивной полихимиотерапии при условии санации костного мозга.
Пациенты с метастатическим поражением легких подвергаются крупнопольному облучению легких в СОД 12 Гр после 2-го курса индуктивной ПХТ. Лучевая терапия на область первичного поражения проводится в СОД 50—55 Гр, на область метастатических очагов — в СОД 30—36 Гр. В некоторых случаях при наличии множественных костных поражений часть метастатических очагов облучают после проведения ВХТ. Схема высокодозной химиотерапии: бисульфан — 16 мг/кг на курс, мелфалан — 140 мг/м2 на курс, тиофосфамид — 600 мг/м2 на курс с последующей трансплантацией аутологичных гемопоэтических стволовых клеток.
Для пациентов с саркомой Юинга/примитивная нейроэктодермальная опухоль группы стандартного риска (отсутствие регионарных и отдаленных метастазов, объем опухоли менее 150 мм3, отсутствие патологического перелома или прорастания опухоли в магистральные сосуды) рекомендовано проведение 10 курсов ПХТ в альтернирующем режиме. Каждый курс нужно начинать на 21-й день от начала предыдущего или при восстановлении абсолютного числа лейкоцитов >2 • 109/л, тромбоцитов >7,5 • 1012/л (но не позднее 25-го дня). Уровень креатинина сыворотки крови не должен превышать 2-кратного нормального уровня и 1,5-кратного перед назначением ифосфамида.
- винкристин — 1,5 мг/м2 (максимальная доза) в 1-, 8-, 15-й день, в/в струйно;
- циклофосфан — 1400 мг/м в 1-й и 2-й день внутривенно капельно за 1 ч в 200 мл 0,9 % раствора NaCl (курсовая доза 2,8 г/м2);
- Месна — 1600 мг/м2 в 1-й и 2-й дни внутривенно. Первые 400 мг/м2 за 4 ч капельно в 0,9 % растворе NaCl (начать вместе с циклофосфаном), затем внутривенно капельно в течение суток или по 300 мг/м2 через каждые 3 ч внутривенно струйно или внутрь;
- доксорубицин — 25 мг/м2 в 1-й и 2-й дни внутривенно капельно в виде 4-часовой инфузии (курсовая доза 50 мг/м2).
Блок IE
- ифосфамид — 3 г/м2 в 1—3-й день внутривенно капельно в 200 мл 0,9 % раствора NaCl за 1 ч (курсовая доза 9,0 г/м2). Месна — 3000 мг/м2 в 1—3-й день внутривенно. Первые 800 мг/м2 за 4 ч капельно в 0,9 % растворе NaCl (начать параллельно с ифосфамидом), затем внутривенно капельно в течение суток или по 600 мг/м2 через каждые 3 ч внутривенно струйно или внутрь;
- этопозид — 150 мг/м2 в 1—3-й день внутривенно капельно 1-часовая инфузия (концентрация вепезида: 0,2—0,4 мг/мл разводят в 0,9 % растворе NaCl или 5 % растворе глюкозы; курсовая доза 450 мг/м2).
При отсутствии ифосфамида он может быть заменен на циклофосфан (БЛОК СЕ) в эквитоксической дозе (циклофосфан — 750 мг/м2 в 1—3-й день внутривенно капельно в 200 мл 0,9 % раствора NaCl за 1 ч (курсовая доза 2,25 г/м2) с аналогичным применением месны.
Биотерапия
В ходе проведения основных исследовательских протоколов были выявлены следующие прогностические факторы: наличие метастазов на момент постановки диагноза, локализация первичного очага поражения в костях таза и осевого скелета по сравнению с поражением костей конечностей, возраст старше 15 лет, объем опухоли более 100 см2 или поражение >8 см по длиннику трубчатой кости, повышение уровня сывороточной ЛДГ, наличие патологического перелома.
Значимыми прогностическими факторами являются метастазы, дозовая интенсивность химиотерапии, выраженность лечебного патоморфоза.
Читайте также:





