Лечение от рака т клетки

Новости о Т-клетках
Вот что читаем в отчете доктора медицинских наук Стефана Группа (Stephan A. Grupp), который был размещен в журнале The new England Journal of Medicine в номере от 18 апреля 2013 года.
“Химерный модифицированный рецептор антигена Т-клеток со специфичностью для CD19, показал обнадеживающие результаты в лечении хронического лимфолейкоза (ХЛЛ). Остается установить, действительно ли химерный рецептор антигена Т-клетки имеет клиническую эффективность при остром лимфобластном лейкозе (ОЛЛ). Двое детей с детской острой лимфобластной лейкемией получали вливание Т-клеток, трансдуцированных анти-CD19 антителами и молекулами сигнализации Т-клеток (CTL019 химерный рецептор антигена Т-клетки иммунной системы), в дозе 1,4 × 10 6 до 1,2 × 10 7 CTL019 клеток на килограмм массы тела. У обоих пациентов, CTL019 Т-клетки расширен до уровня, который был более чем в 1000 раз выше, чем исходный уровень в момент приживления, и клетки были идентифицированы в костном мозге”.
Понятно, что этот отчет был написан специалистами (доктор Стефан Групп возглавляет коллектив исследователей) и для специалистов. Но нам, как “простым смертным” важно понимать, что исследователи ищут… Ищут новые варианты, чтобы помочь человечеству в борьбе с коварной болезнью.
В отчете отмечаются еще положительные случаи применения Т-клеток иммунной системы в борьбе с раком уже у взрослых пациентов и с другими типами рака. Естественно, есть смерти. Но положительных исходов со значительным увеличением срока выживаемости больше. И это вселяет надежду. Так что же такое Т-клеточная терапия?
Т-клетки в борьбе с раком
В другой, более новой разработанной форме этой терапии, которая является также своего рода генной терапией, исследователи выделили Т-клетки из небольшого образца крови пациента. Они генетически модифицировали выделенные клетки путем вставки гена для рецептора, который распознает собой антиген, специфичный для раковых клеток пациента и вырастили большое количество этих модифицированных клеток в культуре.
Генетически модифицированные клетки затем вводятся пациентам, чьи иммунные клетки были истощены. Выраженный рецептор модифицированных Т-клеток позволяет этим клеткам присоединиться к антигенам на поверхности опухолевых клеток, которые активируют Т-клетки, чтобы атаковать и убивать опухолевые клетки.

Клеточный перенос Т-клеток впервые был изучен для лечения метастатической меланомы, поскольку меланома часто вызывает значительную иммунную реакцию, со многими нацеленными на опухоль цитотоксическими Т-клетками. Клеточный перенос генетически модифицированных Т-клеток также исследуется как инструмент для лечения других твердых опухолей, а также для гематологических злокачественных опухолей.
Таким образом, наука не стоит на месте и дает обществу дополнительный заряд оптимизма. Более подробно о новых результатах терапии с участием Т-клеток будем сообщать в новостях онкологии.

Самое дорогое лечение рака.
Министерство здравоохранения США впервые разрешили к применению CAR-T-клеточную терапию рака. Препарат Kymriah (Tisagenlecleucel) может применяться у пациентов моложе 25 лет, которые заболели лимфобластной лейкемией, если проведенное ранее лечение было не результативно или привело к рецидиву заболевания. С расходами на лечение в размере 450.000$ за однократное введение препарата это может стать самым дорогим лечением рака.
Для CAR-T-клеточной терапии Т-клетки из крови пациента изолируются сначала посредством лейкофереза. В лаборатории Т-клетки снабжают химерным антигенным рецептором, который облегчает распознавание Т-киллерами антигена CD19 на поверхности В-лимфоцитов. Сначала Т-клетки модифицируют в лабораторных условиях и затем отдельно вводятся пациенту.
В принципе, данная терапия может применяться при всех раковых заболеваниях, в которых задействованы В-лимфоциты. К ним относятся острый лимфобластный лейкоз, множественная миелома, неходжкинская лимфома. Во всех этих группах заболеваний лечение проводилось в течение последних лет с частично хорошими долговременными результатами.
Достоверно известен случай с шестилетней девочкой, которая заболела острым лимфобластным лейкозом: после того, как были применены все известные способы лечения, ребенок получил в 2012 году CAR-T-клеточную терапию в детской больнице Филадельфии. Девочка с тех пор без рецидива заболевания.
Много пациентов в полной ремиссии, но риски не исключены.
Полученные результаты были предметом исследования программы ELIANA, которое производитель препарата провел в течение последних 25 лет в Северной Америке, Европе, Австралии и Японии. При этом 52 из 63 пациентов достигали полной ремиссии. У всех пациентов костный мозг после лечения был свободен от опухолевых клеток.
Тем не менее, эта терапия не без риска, поскольку описывались смертельные случаи. Вероятно, самое опасное осложнение — это синдром освобождения цитокинов. При этом освобожденные Т-клетками нейромедиаторы вызывают опасное для жизни системное заболевание с высокой температурой и похожими на грипп симптомами. Также возможны тяжелые неврологические осложнения, присоединение тяжелых инфекций, снижение артериального давления, развитие острой почечной недостаточности и гипоксии. Эти симптомы развивались в течение 22 дней после введения Kymriah.
Риск инфекции повышен в течение более длинного периода, так как CAR Т-клетки также уничтожают и здоровые В-лимфоциты. Пациент может снова бороться с инфекцией только тогда, когда костный мозг образовал новые В-лимфоциты.
С синдромом освобождения цитокинов может бороться Tocilizumab. В клинических исследованиях синдром освобождения цитокинов у 69 % пациентов полностью стихал после одного или двукратного введения Tocilizumab в течение 2 недель.
Исследователи пытаются найти возможность лечить также другие виды рака, например, опухоли молочных желез, яичников, легких или поджелудочной железы, с помощью CAR Т-клеток, но, разумеется, до сих пор с небольшим успехом.
Новейшая CAR Т-клеточная иммунотерапия рака (лечение рака с помощью Т-клеток иммунной системы, изменённых химерным антигенным рецептором CAR) уже спасает жизни американцев.
4 ноября 2014 года. Жизнь двадцатилетнего парня Милтона Райта, кажется, наконец-то вошла в нормальное русло. После серии неудач в части образования, футбольной карьеры и планов по вступлению в морскую пехоту, он нашел свой путь, начиная карьеру рекламной модели в компаниях Zumiez и Adidas. Он почти уже забыл, что у него был рак.
Врач Райта, Ребекка Гарднер, доктор медицинских наук, подтвердила возврат лейкемии у Райта, но вместо обещания 6 месяцев оставшейся жизни она предложила ему стать вторым пациентом – участником проводимых ею клинических испытаний. Первый пациент не имел никаких признаков лейкемии всего через 9 дней после начала лечения.
CAR T-клеточная терапия является одним из видов иммунотерапии, новой волны экспериментальных и впервые утверждённых процедур, подстёгивающих иммунную систему на борьбу с раком так, как это она делает с другими болезнями. Эта тема преобладала в текущем году на заседании Американского общества клинической онкологии.
Некоторые врачи и учёные называют иммунотерапию основным направлением на пути к избавлению от рака. В 2014 году FDA одобрило еще два препарата иммунотерапии ─ для лечения меланомы и хронического лимфолейкоза, в том числе пембролизумаб (продаётся как Keytruda), который был официально одобрен для иммунотерапии меланомы в прошлом месяце.
Поскольку раковые клетки имеют черты здоровых клеток, иммунная система не распознаёт их, принимая за нормальные. В процессе клинических испытаний Ребекки Гарднер учёные генетически изменяют Т-клетки собственной иммунной системы человека ─ белые кровяные тельца (лейкоциты), которые путешествуют по всему телу в поисках инфекций и других нарушений нормального состояния. Цель этих изменений ─ научить их распознавать и атаковать раковые клетки лейкемии.
Признаком того, что Т-клетки работают, является лихорадка, но если врачи не смогут взять её под контроль, им, скорее всего, придется убить Т-клетки специальными препаратами и прекратить лечение рака.
После того, как учёные модифицировали Т-клетки Милтона Райта в лаборатории, он получил их обратно через капельницу, после чего стали ждать наступление лихорадки. Две недели спустя лихорадка, которую не удалось обуздать, привела его в реанимацию, и врачи стали обсуждать вариант уничтожения Т-клеток.
Два дня спустя лихорадка Райта прекратилась. Когда через несколько дней он стал достаточно крепким для процедуры спинномозговой пункции (с целью проверки на лейкемию), стало ясно, что рак исчез.
После выздоровления Райта ему сделали пересадку костного мозга ─ дополнительную гарантию против рецидива рака. Сейчас ему 21 год и своё восстановление он считает чудом, хотя уже довольно много людей с этим типом лейкемии успешно прошли подобные процедуры.
Другие техногенные антитела, разгоняющие иммунную систему, нацелены на различные этапы роста и распространения рака.
Сасура закончил лечение ─ четыре вливания за 12 недель, и с тех пор находится в состоянии ремиссии (значительное ослабление симптомов). Сканирование тела ещё показывает кое-где рак в его теле, но он не растет, а иногда сокращается.
Исследователи надеются, что эти результаты будут повторены с другими видами рака. Клинические испытания с препаратом Ipilimumab, которые сейчас проводятся, включают пациентов с раком молочной железы, лёгких, шейки матки, предстательной железы, головы и шеи, поджелудочной железы, почек, крови.
Год или более после иммунотерапии, такие люди, как Райт и Сасура, уже не думают о том, как они проведут свои последние дни. Жизнь у них продолжается. Сасура вернулся на работу по ремонту сантехники в кухнях и ванных комнатах. Райту разрешили вернуться в спортзал на несколько месяцев раньше тех, кого лечили только пересадками костного мозга. Вернув физическую форму, он теперь возвращается в модельный бизнес.
Добавить комментарий Отменить ответ
Этот сайт использует Akismet для борьбы со спамом. Узнайте как обрабатываются ваши данные комментариев.

Группа израильских ученых обнаружила, что трюк для борьбы с раком - это изменение собственной иммунной системы человека, обучение ее борьбе с раковыми клетками. Совершенно новый способ борьбы с раком почти готов к широкому применению. Американское управление по контролю за продуктами и лекарствами единодушно рекомендовало революционное лечение рака по технологии ТАР Т-клеток для окончательного утверждения.
Раку легко противостоять иммунной системе человека - болезнь возникает, когда собственные клетки организма становятся раковыми, поэтому иммунная система не всегда распознает их и не воспринимает как внешняя угроза. Даже когда это происходит, не всегда достаточно остановить распространение рака, нужно научить имунную систему человека бороться с ним.
Группа Израильских ученых обнаружила, что успех излечения заключается в изменении иммунной системы. Для этой цели ими были использованы Т-клетки - лейкоциты, которые борются с зараженными вирусом клетками и другими атаками на организм.
Используя Т-клеточный рецептор химерного антигена (CAR-T) для генетической модификации лейкоцитов Т-клеток, учеными могут быть созданы более сильная версия исходной имунной системы с добавленной способностью обнаружения и охоты на конкретные виды раковых клеток.
Эти новые клетки привязаны к уникальной химической подписи - молекуле, называемой CD19, обнаруженной на B-клетках, клетках иммунной системы, которые продуцируют антитела - на поверхности лимфомы и опухолей лейкемии. Модифицированные Т-клетки затем атакуют раковые клетки так же, как и инфекции.
Один препарат на всех?
Химерный антиген CAR-T не является универсальным лекарством от рака, проводящееся в настоящее время клиническое испытание в больнице Шиба в Израиле специально предназначено для лечения лейкемии и лимфомы, но та же идея терапии сохраняется со всеми раковыми опухолями. Как только исследователи могут идентифицировать уникальную молекулярную сигнатуру (подпись) опухоли, они могут начать разработку CAR-T-клеток, которые будут охотиться за ней.
Задача ученых состоит в том, чтобы убедиться, что генетически модифицированные лейкоциты не повреждают здоровые клетки с подобными химическими сигнатурами, хотя исследователи уверены, что эти данные будут собраны всего за несколько лет.
Основой лечения CAR-T является результат более чем 20 летних исследований, впервые проведенных в Израиле иммунологом доктором Зелигом Эшхар. Клиническому испытанию, проводимому в Медицинском центре Шиба, помогали данные, полученные из Национального института рака в Бетесде Мэриленд.
Технология CAR-T все еще находится в клинических испытаниях, но в детском и взрослом отделении гемато-онкологии в Израиле лечение имеет удивительно высокие показатели успеха. Новое лечение также имеет меньше побочных эффектов, чем традиционные методы лечения. Химиотерапия убивает иммунную систему организма, оставляя пациента слабым и неспособным бороться с инфекциями. CAR-T терапия оставляет иммунную систему пациента неповрежденной. Побочные эффекты нового лечения включают лихорадку и низкий уровень нейротоксичности.
Лечение было первоначально опробовано в Университете Пенсильвании в 2010 году среди взрослых с хронической лимфоцитарной лейкемией (ХЛЛ). В 2012 году Детская больница Филадельфии стала первым учреждением, которое провело лечение детей по технологии CAR-T. Широкие клинические исследования прошли в 13 американских медицинских центрах, а также в других странах.
Ожидается, что еще одна терапия по технологии ТАР Т-клеток, разрабатываемая концерном Kite Pharma, будет одобрена в конце 2018 года для лечения некоторых пациентов с лимфомами. С успехом, наблюдаемым при раке крови, исследователи из NCI и других организаций заняты разработкой путей расширения использования молекулярной терапии.
Технология использования Т-клеток с СAR это метод, показавший беспрецедентную эффективность в терапии В-клеточного ОЛЛ и обнадеживающие результаты при других В-клеточных опухолях.
Основной проблемой на пути CAR Т-клеточной терапии в онкологии является трудность идентификации опухоль- или ткань-специфичных антигенов, обеспечивающих необходимую селективность (выборочность) терапевтического воздействия.
Читать далее: С некоторыми видами онкологических заболеваний на поздних стадиях рака сегодня можно успешно бороться с помощью синтетических иммунных клеток, статья Карл Джун, Брюс Левин и Эвери Пози.

Работа, опубликованная в Nature Medicine учёными из National Cancer Institute (NCI), описывает новый тип иммунотерапии, который привёл к полному исчезновению опухолей у женщины с метастатическим раком молочной железы, которой осталось всего несколько месяцев жизни.
Результаты показывают, как естественные опухолевые инфильтрирующие лимфоциты (TIL) были извлечены из опухоли пациента, выращены вне её тела, чтобы увеличить их количество, и введены обратно пациенту для борьбы с раком. Пациент ранее получил несколько форм лечения, включая гормональную терапию и химиотерапию, но никакая из них не остановила прогрессирование рака. После лечения все опухоли пациентки исчезли, и через 22 месяца она все ещё находится в ремиссии.
Первым шагом этого нового подхода к лечению является секвенирование генома опухоли. В случае этого пациента учёные нашли 62 мутации в клетках опухоли молочной железы. Второе – выделить TIL, которые присутствуют в 80% опухолей эпителиальных клеток, но в крошечных количествах, недостаточных, чтобы уничтожить опухоль. Затем они анализируются на их способность распознавать мутированные белки в опухоли. В случае с пациентом с метастатическим раком молочной железы учёные обнаружили TIL, которые распознали четыре мутантных белка.
Во время выращивания TIL пациента также лечили иммунотерапевтическим веществом Keytruda, блокирующим PD-1, в целях изменения иммунной системы, чтобы иные иммунные клетки не мешали TIL, когда их вводили обратно пациенту.
Пациент с метастатическим раком молочной железы – не единственный человек, успешно прошедший лечение с использованием этого метода. Розенберг и его коллеги также достигли впечатляющих результатов при использовании TIL в лечении ещё трёх различных типов метастатического рака: колоректального, желчных протоков и шейки матки.
Хотя результаты, несомненно, являются многообещающими, особенно из-за низкого уровня токсичности, испытываемого пациентами по сравнению с химиотерапией, рак часто вырабатывает устойчивость к лечению, и часто метастазы могут иметь мутации, отличные от начальной опухоли.
Так легко ли у пациентов разовьётся устойчивость к TIL?
Как ни странно, это одно из преимуществ многих старых химиотерапевтических препаратов по сравнению с новыми персонализированными методами лечения. Из-за того, что химиотерапия без разбора пронизывает геном повреждениями в стиле ковровой бомбардировки, раковой клетке становится сложнее выработать устойчивость к ним. Выбор TIL, которые нацелены на небольшое количество мутированных белков в опухоли, может увеличить вероятность, что рак сможет развить резистентность. Нужны ещё работы в этой сфере, а также приёмы по изучению, какие мутации у раковых клеток являются возможными мишенями TIL.
Если крупные работы подтверждают эти великолепные предварительные результаты, разработка персонализированной терапии пациенту, несомненно, является финансовой и технической проблемой, требующей специализированных лабораторий и опыта. Насколько практично производить полностью персонализированную терапию?
И несколько компаний уже проводят испытания лечения TIL, в том числе Bristol-Myers Squibb и Iovance Biotherapeutics, последняя из которых специально фокусируется на TIL. В настоящее время проводятся клинические испытания TIL для меланомы, рака шейки матки, лёгких и даже, как известно, мало поддающихся лечению глиобластомы и рака поджелудочной железы.
Нечасто в борьбу вступают совершенно новые методы лечения рака с такими впечатляющими результатами, как показанные TIL в этих примерах. Что сейчас крайне нужно, так это результаты более масштабных клинических испытаний и постоянного контроля за пациентами, которые были успешно вылечены, чтобы убедиться, что у них не возникло проблем.
- 1036 просмотров
Материалы по теме
А вот ещё:

Почему некоторые люди умнее других? С незапамятных времен ученые пытаются выяснить, что нужно делать, чтобы голова хорошо соображала. Но теперь хотя бы ясно: список составляющих интеллекта длиннее, чем предполагалось.
Венцель, которому сегодня 17 лет, обладает уникальным математическим даром: он умножает, делит, извлекает корни из двенадцатизначных чисел без ручки, бумаги и прочих вспомогательных средств. На последнем чемпионате мира по устному счету он занял третье место. Как он сам говорит, на решение особо сложных математических задач у него уходит от 50 до 60 минут: например, когда ему требуется разложить двадцатизначное число на простые множители. Как же ему это удается? Вероятно, главную роль здесь играет его кратковременная память.
Коктейль из нескольких ингредиентов
1. Мозг у одних людей работает эффективнее, чем у других. Их владельцы обладают большими интеллектуальными способностями. Но какова общая нейробиологическая основа, пока еще не ясно.
2. Ученые находят все новые и новые гены, способствующие развитию высокого интеллекта. Многие из них располагаются в пирамидных клетках коры головного мозга.
3. Чем длиннее и более разветвлены клеточные волокна в височных долях мозга, тем человек в принципе умнее. В других участках мозга благоприятное влияние на интеллект оказывает малая плотность нейронов.
Как выяснилось позже, этот его тезис был верен — как минимум отчасти. Американские психологи Томас Бушар (Thomas Bouchard) и Мюттью Макги (Matthew McGue) проанализировали более 100 опубликованных исследований схожести интеллектов среди членов одной семьи. В некоторых работах были описаны однояйцовые близнецы, разделенные сразу после рождения. Несмотря на это, при тестах интеллекта они показывали практически аналогичные результаты. Близнецы же, выросшие вместе, в отношении умственных способностей были схожи в еще большей степени. Вероятно, окружающая среда также оказывала на них немаловажное влияние.
Сегодня ученые считают, что интеллект на 50-60% передается по наследству. Иными словами, разница в IQ между двумя людьми на добрую половину объясняется строением их ДНК, полученной от родителей.
В поисках генов интеллекта
Однако поиски конкретно отвечающих за это наследственных материалов до сих пор мало к чему приводили. Правда, иногда находили некоторые элементы, которые на первый взгляд имели отношение к интеллекту. Но при ближайшем рассмотрении эта взаимосвязь оказывалась ложной. Возникла парадоксальная ситуация: с одной стороны, бесчисленные исследования доказывали высокую наследственную составляющую интеллекта. С другой стороны, никто не мог сказать, какие гены конкретно отвечают за это.
В последнее время картина несколько изменилась, в первую очередь благодаря технологическому прогрессу. План строительства каждого отдельного человека заключен в его ДНК — своеобразной гигантской энциклопедии, состоящей из приблизительно 3 миллиардов букв. К сожалению, она написана на языке, который мы почти не знаем. Хотя мы и можем читать буквы, но смысл текстов этой энциклопедии остается от нас скрыт. Даже если ученым удается секвенировать всю ДНК какого-либо человека, они не знают, какие ее участки отвечают за его умственные способности.
Интеллект и IQ
Интеллект, как правило, не ограничивается одним предметом, например, математикой. Тот, кто хорош в одной области, часто выделяется и в других. Четко ограниченные одним предметом дарования встречаются редко. Поэтому многие ученые исходят из того, что существует общий фактор интеллекта, так называемый фактор G.
В 1912 году немецкий психолог Вильям Штерн (William Stern) предложил новый метод, при котором возраст интеллектуального развития делился на хронологический возраст, а получаемая при этом величина называлась коэффициентом интеллекта (IQ). И хотя название сохранилось до сих пор, сегодня IQ больше не описывает возрастные коэффициенты. Вместо этого IQ дает представление о том, как соотносится уровень интеллекта того или иного индивида с уровнем интеллекта среднестатистического человека.
Люди различаются между собой, и соответственно различаются их наборы ДНК. Однако у индивидов с высоким IQ должны совпадать как минимум те части ДНК, которые связаны с интеллектом. Сегодня ученые исходят из этого основополагающего тезиса. Сравнивая ДНК сотен тысяч испытуемых в миллионах ее частей, ученые могут определить наследственные регионы, способствующие формированию более высоких интеллектуальных способностей.
Тайна за семью печатями
Но остается еще одна большая проблема: сегодня известны 2 тысячи мест (локусов) в структуре ДНК, которые ассоциируются с интеллектом. Но во многих случаях еще не понятно, за что конкретно отвечают эти локусы. Чтобы решить эту загадку, исследователи интеллекта наблюдают, какие клетки чаще, чем другие, реагируют на поступающую новую информацию. Это может означать, что именно эти клетки каким-то образом связаны с мыслительными способностями.
Возможно, пирамидные клетки играют ключевую роль в формировании интеллекта. На это указывают во всяком случае результаты исследований, проведенных нейробиологом Натальей Горюновой, профессором Свободного университета Амстердама.
Недавно Горюнова опубликовала результаты исследования, привлекшего всеобщее внимание: она сравнила пирамидные клетки у испытуемых с различными интеллектуальными способностями. Образцы тканей были взяты в основном из материала, полученного при операциях у больных эпилепсией. В тяжелых случаях нейрохирурги пытаются удалить очаг возникновения опасных судорожных приступов. При этом они всегда удаляют и части здорового мозгового материала. Именно этот материал и исследовала Горюнова.
Только часть правды
Сделать какие-то общие выводы из результатов исследований амстердамских ученых пока еще нельзя. Тем более что есть данные, говорящие о прямо противоположном. Они получены биопсихологом из Бохума Эрханом Генчем (Erhan Genç). В 2018 году он вместе с коллегами также исследовал, насколько различается строение серого вещества у очень умных и менее умных людей. При этом он пришел к выводу, что сильная разветвленность дендритов скорее вредит, чем способствует мыслительной способности.
Правда, Генч не исследовал отдельные пирамидные клетки, а помещал своих испытуемых в сканер мозга. В принципе, магнитно-резонансные томографы не годятся для исследования тончайших структур волокон — разрешение снимков, как правило, оказывается недостаточным. Но бохумские ученые использовали особый метод, позволяющий увидеть направление диффузии тканевой жидкости.
Предположительно, именно благодаря этому мы можем перерабатывать информацию более эффективно.
Действительно, люди с богатым интеллектом проявляют более сфокусированную мозговую активность, чем менее одаренные, когда им приходится решать сложную задачу. Кроме того, их мыслительному органу нужно меньше энергии. Эти два наблюдения привели к так называемой нейронной гипотезе эффективности интеллекта, согласно которой решающее значение имеет не напряженность работы мозга, а эффективность.
У семи нянек дитя без глазу
Однако и тут есть много загадочного. Это в равной степени относится и к мужчинам, и к женщинам, потому что у обоих полов маленькому мозгу соответствуют и меньшие умственные способности. С другой стороны, мозг у женщин в среднем на 150 г меньше, чем у мужчин, однако в тестах IQ они показывают те же результаты, что и мужчины.
Если пирамидные клетки можно считать процессорами мозга, то белое вещество представляет собой как бы компьютерную шину: благодаря ему находящиеся на больших расстояниях друг от друга мозговые центры могут общаться между собой и сотрудничать при решении проблем. Несмотря на это, белое вещество долгое время недооценивалось исследователями интеллекта.
Но если все работает как надо, то человеческий мозг способен творить удивительные вещи. Это видно на примере южнокорейского ядерного физика Кима Ун Ёна, который обладая IQ в 210 единиц, считается самым умным человеком на Земле. В семь лет он решал на японском телешоу сложные интегральные уравнения. В восемь лет его пригласили в НАСА в США, где он проработал десять лет.
11 декабря 2015
- 4114
- 3,4
- 0
- 8
![]()
Татьяна Ожаровская
Обратите внимание!
Спонсоры конкурса: Лаборатория биотехнологических исследований 3D Bioprinting Solutions и Студия научной графики, анимации и моделирования Visual Science.
Медицина перешла на новый уровень: клетки стали живым лекарством
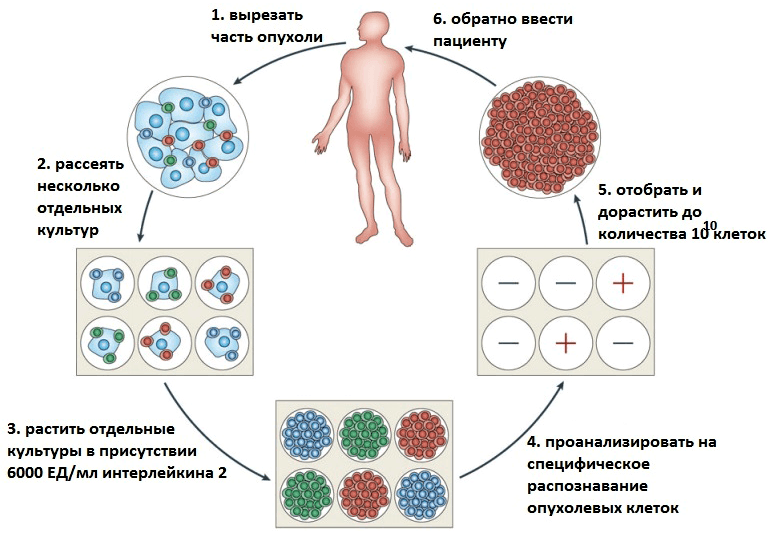
Рисунок 1. Схема получения антиопухолевых Т-клеток для адоптивной иммуноцитотерапии. Рисунок из [3].
Впервые метод адоптивной иммуноцитотерапии был описан еще в 1988 году — у пациентов с метастатической меланомой (то есть раком кожи на четвертой стадии) наблюдалась регрессия заболевания при терапии с помощью их TIL-клеток (лимфоцитов, инфильтрующих опухоль) [2]. В настоящее время терапия метастатической меланомы на основе TIL-клеток является наиболее эффективным способом лечения данного заболевания, поскольку регрессия опухоли наблюдается у половины пациентов [3].
Необходима система наведения
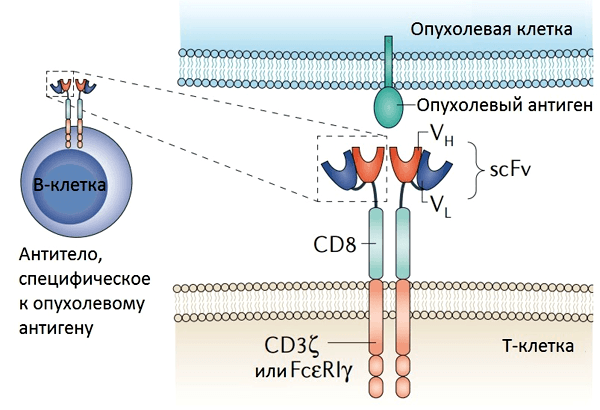
Рисунок 2. Структура химерного антигенного рецептора (CAR). CAR состоит из внеклеточного домена (одноцепочечного вариабельного фрагмента антитела (scFv)), соединенного с помощью цепей и трансмембранных доменов с цитоплазматической сигнальной областью. Гены, кодирующие scFv, получены из В-клеток, продуцирующих антитела, специфичные к опухолевому антигену. CAR существует в виде димера, и распознавание опухоли происходит напрямую (без участия MHC). Рисунок из [5].
Все новое — это хорошо забытое старое. Первые Т-клетки с химерным антигенным рецептором были получены командой ученых под руководством профессора Эсхара (Zelig Eshhar); результаты работы были опубликованы еще в 1989 году [6]. Эсхар понял, что, обладая данной техникой, Т-клетки можно запрограммировать на нацеленную атаку.
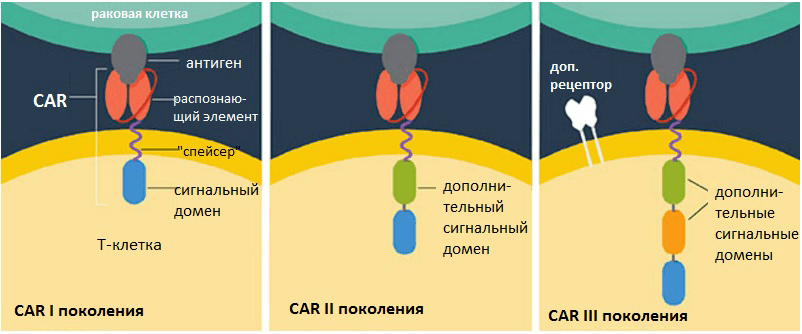

Рисунок 4. Бутылка с питательной средой для Т-клеток, которые после введения в них нового рецептора выращивают около 10 дней до достижения ими количества в несколько миллиардов. Тогда они могут быть введены в вены пациента. Рисунок из [9].
Первые клинические испытания генетически модифицированных Т-лимфоцитов, несущих химерные антигенные рецепторы, прошли в 2012 году. Они выпали на долю девочки по имени Эмили, больной острой лимфобластной лейкемией. После того, как генетически модифицированные Т-клетки были обратно введены девочке, ее состояние резко ухудшилось, и она провела несколько недель в отделении интенсивной терапии на искусственной вентиляции легких. В какой-то момент жизнь Эмили висела на волоске, но в итоге девочка поправилась, и уже три года в ее организме врачи не находят даже единичных раковых клеток [8].
Побочные эффекты новой терапии
Т-клетки взяли под контроль
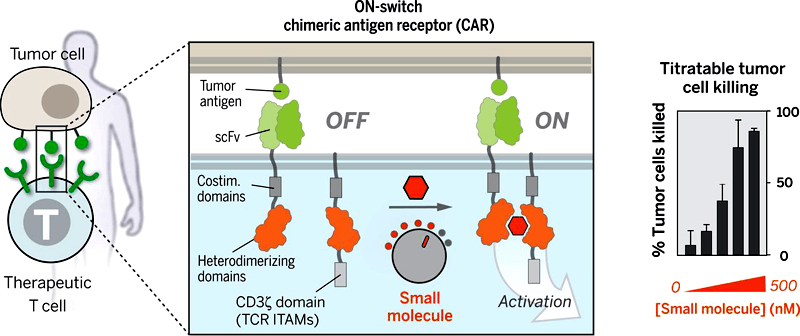
Иммунотерапия с помощью Т-клеток с CAR успешна против рака крови, но, когда дело доходит до твердых опухолей, которые образуются в толстой кишке, молочных железах, мозге и других тканях, модифицированные Т-клетки до сих пор не показывают высокой эффективности. Возможно, метод дистанционного управления Т-клетками позволит разработать более мощные версии химерных антигенных рецепторов, которые позволят Т-клеткам поражать твердые опухоли, при этом не обладая серьезными побочными эффектами.
Читайте также:


