Лечение хронического лейкоза мабтерой
Основным методом лечения хронического лимфолейкоза является химиотерапия. Верификация диагноза хронического лимфолейкоза не всегда является показанием для проведения противоопухолевой терапии. В ряде случаев (обычно в дебюте заболевания) оправдана выжидательная тактика, так как доказано, что раннее начало лечения не увеличивает выживаемость больных хроническим лимфолейкозом.
Показания к началу химиотерапии:
1) синдром опухолевой интоксикации (проливные ночные поты, лихорадка выше 38 °С, снижение массы тела);
2) анемия или тромбоцитопения, обусловленные опухолевой инфильтрацией костного мозга;
3) аутоиммунная гемолитическая анемия или тромбоцитопения (при отсутствии ответа на глюкокортикостероиды);
4) выраженная лимфоаденопатия и/или спленомегалия с компрессией органов и тканей с нарушением их функций;
5) время удвоения абсолютного лимфоцитоза в периферической крови меньше 12 месяцев;
6) гипогаммаглобулинемия, сопровождающаяся рецидивирующими инфекционными осложнениями;
7) массивная лимфоцитарная инфильтрация костного мозга;
8) лейкоцитоз больше 150 • 10 9 /л;
9) стадия III—IV по классификации К. Rai.
Основным препаратом для лечения хронического лимфолейкоза является хлорбутин (хлорамбуцил, лейкеран). Существует 2 основных режима назначения препарата:
1) малые дозы (0,07 мг/кг массы тела через день в течение 14 дней; курс повторяется каждые 28 дней);
2) большие дозы (0,7 мг/кг один раз в неделю).
Эффект достигается у 2/3 больных, побочное действие практически отсутствует. После получения ответа на лечение проводится поддерживающая терапия в дозе 10-15 мг 1-3 раза в неделю.
Применение хлорбутина позволяет быстро снизить количество лейкоцитов, однако уменьшение лимфатических узлов и селезенки достигается не всегда. Поэтому при преобладании в клинической картине лимфоаденопатии и спленомегалии с умеренным лейкоцитозом может использоваться комбинированная терапия хлорбутином и преднизолоном (преднизолон 30-70 мг в сутки + хлорбутин 10-20 мг в сутки) курсами по 5-14 дней с перерывами 2-4 недели.
При непереносимости хлорбутина, резистентности к препарату, а также у лиц моложе 60 лет можно применять циклофосфан в дозе 2-3 мг/кг в сутки ежедневно внутрь или 1000 мг внутривенно каждые 2 недели. Эффективность препарата сравнима с хлорбутином, однако возможны побочные эффекты (диспепсия, геморрагический цистит).
Преднизолон в дозе 30-60 мг/м2 внутрь ежедневно назначается при аутоиммунной гемолитической анемии или тромбоцитопении. После достижения эффекта доза глюкокортикостероидов постепенно уменьшается до полной отмены препарата.
При неэффективности монотерапии и прогрессировании заболевания (а в ряде случаев — и в качестве индукционного курса) возможно проведение полихимиотерапии по программам СОР (циклофосфан, винкристин, преднизолон) или CHOP (СОР+адриабластин). У пожилых пациентов с сопутствующими заболеваниями сердечно-сосудистой системы доза адриабластина редуцируется (программа мини-СНОР).
Непосредственный эффект комбинированного лечения хороший, однако достоверного увеличения медианы выживаемости по сравнению с пациентами, получавшими монохимиотерапию, не отмечено. Следует иметь в виду также более выраженную токсичность программ полихимиотерапии по сравнению с монотерапией.
Стандартные режимы монохимиотерапии и полихимиотерапия увеличивают продолжительность жизни больных в среднем на 2-3 года.
В последние годы в клиническую практику внедрено новое поколение цитостатических препаратов для лечения хронического лимфолейкоза — аналоги пуриновых нук-леозидов (флударабин, пентостатин, кладрибин).
Наибольшее распространение получил флударабин, который может использоваться как при резистентности к другим цитостатикам (эффективность 50-60%, частота полных ремиссий 25%), так и для первичной терапии (эффективность 80%, частота полных ремиссий 40-50%). Флударабин назначается внутривенно (болюсом или капельно) ежедневно в дозе 25 мг/м2 в течение 5 дней. В среднем необходимо проведение 6 курсов лечения с 28-дневными интервалами между ними.
Основным побочным эффектом является выраженная миелосупрессия с возможным развитием инфекционных осложнений, реже отмечаются аутоиммунная гемолитическая анемия и нейротоксичность. В целом флударабин переносится хорошо и в настоящее время рассматривается как наиболее эффективный препарат для лечения больных хроническим лимфолейкозом как в виде монотерапии, так и в сочетании с другими препаратами (чаще всего с циклофосфаном, митоксантроном и ритуксимабом).
Последние несколько лет характеризуются активным внедрением для лечения хронического лимфолейкоза моноклональных антител: анти-CD20 (Mabthera, Rituximab) и анти-CD52 (Campath-1, Alemtuzumab). Мабтера в настоящее время используется в комбинации с флударабином и алкилирующими агентами при проведении химиотерапии первой линии. При проведении химиотерапии второй линии применяются комбинация мабтеры, пентостатина и циклофосфана и другие режимы.
Анти-CD52 (Campath-1, Alemtuzumab) рекомендуется для проведения химиотерапии второй линии в виде монотерапии или в сочетании с другими цитостатиками.

Современные химиотерапевтические подходы к лечению хронического лимфолейкоза:
I. Химиотерапия 1-й линии:
— Флударабин ± ритуксимаб
— Хлорбутин ± преднизолон
— Циклофосфан ± преднизолон
— СОР (циклофосфан. винкристин, преднизолон)
— FC (флударабин, циклофосфан) ± ритуксимаб
II. Химиотерапия 2-й линии:
— Алемтузумаб
— PC (пентостатин, циклофосфан) ± ритуксимаб
— Полихимиотерапия ± ритуксимаб или алемтузумаб
В последние годы при хроническом лимфолейкозе изучается эффективность трансплантации аллогенных гемопоэтических стволовых клеток и биологических методов лечения.
Трансплантация аллогенных гемопоэтических стволовых клеток используется у больных моложе 55 лет при наличии неблагоприятных прогностических факторов (в частности, высокого уровня ZAP-70). Этот метод лечения используется редко, так как большинство пациентов старше 60 лет и имеют большое количество сопутствующих заболеваний.
После трансплантации достоверно увеличивается общая выживаемость, однако это нивелируется высокой смертностью, обусловленной лечением. При внедрении немиелоаблативных режимов кондиционирования количество больных хроническим лимфолейкозом, которым показана трансплантация, может существенно увеличиться, а совершенствование метода позволит уменьшить количество осложнений.
В ряде случаев у больных хроническим лимфолейкозом могут применяться паллиативные методы лечения (лучевая терапия, спленэктомия, лейкоцитаферез).
Лучевая терапия используется при наличии выраженной спленомегалии или конгломерата лимфатических узлов с признаками компрессии окружающих органов.
Необходимость в спленэктомии у больных хроническим лимфолейкозом возникает редко. Показания к спленэктомии:
а) аутоиммунная гемолитическая анемия, резистентная к терапии глюкокортикостероидами и цитостатическими препаратами;
б) выраженная спленомегалия, не поддающаяся консервативным методам лечения, в том числе лучевой терапии.
Лейкоцитаферез может использоваться для профилактики и лечения лейкостаза у больных с гиперлейкоцитозом, при резистентном к терапии хронического лимфолейкоза или при наличии противопоказаний к химиотерапии.
Лечение осложнений хронического лимфолейкоза (инфекционных, аутоиммунных) проводится по общим принципам онкогематологии.
К новым методам лечения, эффективность которых изучается у больных хроническим лимфолейкозом, относятся:
1) антисмысловые олигонуклеотиды (в частности, направленные против BCL-2);
2) генная терапия, направленная на изменение иммунофенотипа хронического лимфолейкоза;
3) комбинированная терапия мабтерой и ингибиторами ZAP-70;
4) моноклональные антитела к детерминантам опухолевых клеток (HLA-DR, CD40 и др.).
Хронический лимфолейкоз (ХЛЛ) — опухолевое заболевание, возникающее вследствие мутаций в геноме В-лимфоцита. Основная функция В-лимфоцитов — обеспечение гуморального иммунитета. Конечная стадия развития В-лимфоцита в организме — иммуноглобулинсекретирующ
Хронический лимфолейкоз (ХЛЛ) — опухолевое заболевание, возникающее вследствие мутаций в геноме В-лимфоцита. Основная функция В-лимфоцитов — обеспечение гуморального иммунитета. Конечная стадия развития В-лимфоцита в организме — иммуноглобулинсекретирующая плазматическая клетка. В-лимфоциты при ХЛЛ вследствие изменений в клеточном геноме не развиваются до плазматических клеток. Это ведет к резкому уменьшению в организме больного выработки иммуноглобулинов, к которым относятся все антитела.
ХЛЛ — наиболее распространенный вид лейкоза в странах Европы и Северной Америки, в которых на его долю приходится около 30% всех лейкозов. Ежегодная заболеваемость им составляет 3–3,5 случая на 100 000 человек, увеличиваясь для лиц старше 65 лет до 20, а старше 70 — до 50 случаев на 100 000 человек.
Как самостоятельное заболевание ХЛЛ выделен в 1856 г. знаменитым немецким патологом Р. Вирховым.
Мужчины заболевают ХЛЛ в 2 раза чаще женщин. ХЛЛ в основном болезнь людей пожилого возраста, средний возраст заболевших составляет 65—69 лет. Более 70% заболевают в возрасте старше 60 лет, менее 10% — до 40 лет.
Не наблюдается увеличения частоты ХЛЛ среди лиц, подвергавшихся воздействию ионизирующей радиации или часто контактировавших с бенолом и автомобильным бензином, т. е. факторами, играющими ведущую роль в возникновении миелоидных лейкозов.
Диагностика ХЛЛ в подавляющем большинстве случаев не вызывает трудностей. Это заболевание должно быть заподозрено при увеличении в крови количества лейкоцитов и лимфоцитов. Если абсолютное количество лимфоцитов достигает 5х109/л, диагноз ХЛЛ становится очень вероятным. Нужно иметь в виду, что абсолютное количество лимфоцитов 5х109/л — это 55% при общем количестве лейкоцитов 9х109/л, и такая картина крови часто не привлекает внимания врача. Иногда на протяжении 2–3 лет при нормальном количестве лейкоцитов наблюдается постепенно нарастающий лимфоцитоз — 55–60–70% лимфоцитов в формуле крови. Пациенту с такой картиной крови обязательно нужно повторять анализ крови не реже 1 раза в полгода, так как после длительного периода спокойного течения может начаться быстрое прогрессирование заболевания. В настоящее время в терапии ХЛЛ имеются широкие возможности, поэтому каждый больной с подозрением на это заболевание должен быть проконсультирован гематологом, независимо от наличия у него другой патологии.
В большинстве случаев при установлении диагноза ХЛЛ количество лейкоцитов составляет 20–50х109/л, но иногда при первом обращении к врачу имеется высокий лейкоцитоз, достигающий 100–500х109/л и свидетельствующий о длительном недиагностированном периоде заболевания. При подсчете лейкоцитарной формулы содержание лимфоцитов обычно составляет 60–70%, при высоком лейкоцитозе достигает 95–99%. Уровень гемоглобина и число тромбоцитов обычно бывают нормальными, но при высоком лейкоцитозе и лимфоцитозе, превышающем 85–90%, может быть некоторое снижение показателей гемоглобина и числа эритроцитов и тромбоцитов. При биохимическом анализе крови вначале никаких изменений не отмечается, с течением времени в большинстве случаев выявляются гипопротеинемия и гипогаммаглобулинемия.
В костно-мозговом пунктате на ранних этапах болезни обнаруживается небольшое содержание лимфоцитов (40–50%), при высоком лейкоцитозе лимфоциты могут составлять 95–98% костно-мозговых элементов.
Только морфологического исследования недостаточно для установления диагноза ХЛЛ, поскольку аналогичная картина крови и костного мозга может наблюдаться при некоторых видах лимфом. Согласно современным критериям, диагноз ХЛЛ может считаться установленным только после иммунологического исследования. Лимфоциты при ХЛЛ имеют абсолютно характерный иммунофенотип. Они экспрессируют на своей поверхности антигены CD19, CD5, CD23, также отмечается слабая экспрессия на поверхности клеток иммуноглобулинов (экспрессируются IgM, нередко одновременно с IgD) и антигенов CD20 и CD22.
При значительном увеличении периферических лимфоузлов, как правило, оказываются увеличенными лимфоузлы брюшной полости, что выявляется при УЗИ. Лимфоузлы могут сливаться между собой, образуя конгломераты. Медиастинальные лимфоузлы увеличиваются редко и обычно незначительно. Размеры лимфоузлов у разных больных могут изменяться в очень широких пределах — от 1,5–2 до 10–15 см в диаметре. У одного больного эти размеры в разных областях варьируются, однако резкое увеличение лимфоузлов какой-либо одной области нехарактерно. В подобных случаях обязательна пункция или биопсия данного узла для исключения трансформации ХЛЛ в агрессивную лимфому.
Спленомегалия у большинства больных появляется позже, чем увеличение лимфоузлов. Увеличение селезенки без увеличения лимфоузлов совершенно не характерно для ХЛЛ и чаще всего в таких случаях речь идет о других заболеваниях. Гепатомегалия наблюдается нечасто и обычно появляется позже, чем спленомегалия.
В начале заболевания жалобы обычно отсутствуют. С течением времени появляются жалобы на повышенную утомляемость, слабость и главным образом на резкую потливость, особенно в жаркое время года.
У большинства пациентов процесс отличается медленным развитием и в течение ряда лет довольно успешно контролируется терапией. При современной терапии продолжительность жизни большинства больных составляет 7–10 лет и более.
Существуют две современные классификации ХЛЛ, делящие его на стадии в зависимости от клинических проявлений. Одна из них предложена в 1975 г. американскими учеными K. Rai и его коллегами, она используется преимущественно в США (табл. 1). Другая классификация опубликована в 1981 г. французскими учеными J. L. Binet и соавторами, она получила распространение в Европе и в нашей стране (табл. 2). В основу обеих классификаций положен единый принцип: учет массы опухоли и ее распространения, отражением чего являются: количество лейкоцитов, лимфоцитоз, размеры лимфоузлов, печени и селезенки, наличие или отсутствие угнетенных здоровых ростков кроветворения. Этот последний фактор оказывает даже большее влияние на продолжительность жизни больных, чем объем опухолевой массы.
В связи с гипогаммаглобулинемией, которая постепенно углубляется по мере прогрессирования заболевания и к 7–8 годам болезни отмечается у 70% больных, при ХЛЛ имеется повышенная склонность к развитию оппортунистических инфекций, чаще всего легочных.
Инфекционные осложнения при ХЛЛ могут возникнуть в любой стадии заболевания, в том числе и в начальной, но гораздо чаще они развиваются у больных с выраженными клинико-гематологическими проявлениями болезни. Этот факт показывает, что не следует откладывать лечение больного даже в пожилом возрасте и при наличии других заболеваний, если есть признаки прогрессирования ХЛЛ.
Терминальная стадия ХЛЛ чаще всего характеризуется рефрактерностью к терапии и учащением инфекционных эпизодов без каких-либо изменений прежней картины крови. Инфекции становятся причиной смерти большинства больных. Лечение инфекций у больных ХЛЛ должно начинаться немедленно при их возникновении и до получения данных бактериологического анализа проводиться антибиотиками широкого спектра, лучше всего в стационаре.
Помимо инфекционных, для ХЛЛ характерны аутоиммунные осложнения — аутоиммунная гемолитическая анемия (АИГА) и аутоиммунная тромбоцитопения. АИГА развивается в течение заболевания у 10–25% больных ХЛЛ. Аутоиммунный гемолиз эритроцитов может носить характер остро и бурно развившегося гемолитического криза, сопровождаясь повышением температуры, появлением желтушного окрашивания кожи и темной окраски мочи, увеличением содержания непрямого билирубина в сыворотке. Быстрое развитие и прогрессирование анемии становится причиной резкого ухудшения состояния больного и может быть опасным для жизни, особенно при наличии сопутствующих заболеваний сердца или легких. Чаще аутоиммунный гемолиз развивается постепенно. Иммунная тромбоцитопения встречается реже, чем АИГА, всего в 2–3% случаев, но может быть опасней, чем АИГА, из-за часто возникающих жизненно опасных кровотечений или кровоизлияний в головной мозг, становящихся причиной смерти больных.
Аутоиммунные осложнения всегда требуют лечения. Чаще всего для этого применяются кортикостероидные гормоны в высоких дозах — 1–2 мг/кг веса в расчете на преднизолон.
В лечении ХЛЛ в настоящее время имеются широкие возможности. До начала ХХ в. терапия всех лейкозов была одинаковой: мышьяк, уретан, симптоматическое лечение. С 1902 г. основным средством лечения хронических лейкозов стала рентгенотерапия, которая при ХЛЛ оставалась ведущим лечебным методом на протяжении 50 лет. Она давала хороший местный эффект, но не меняла темпов развития болезни: средняя продолжительность жизни при симптоматическом лечении составляла 40 мес, при рентгенотерапии — 42 мес.
Современная эра в терапии ХЛЛ началась с середины ХХ столетия, когда были получены данные об уменьшении лимфоидной пролиферации под влиянием стероидных гормонов. Широкий диапазон действия быстро сделал стероидные гормоны универсально используемым средством при этом заболевании. Однако кратковременность достигнутого эффекта, неизбежно наступающая при длительном приеме, снижение эффективности, наличие серьезных побочных явлений и нередкие осложнения сузили область применения гормональной терапии при ХЛЛ, оставив на первом месте среди показаний к ее назначению аутоиммунные осложнения.
Важнейшим событием в развитии терапии ХЛЛ было появление алкилирующих препаратов. Первый из них — хлорамбуцил — используется в настоящее время. Терапия хлорамбуцилом или его комбинация с преднизолоном в случаях медленного нарастания лейкоцитоза позволяет на определенное время контролировать проявления болезни. Продолжительность жизни больных ХЛЛ при такой терапии составляет 55–60 мес. Вместо хлорамбуцила нередко используется циклофосфамид. Терапия хлорамбуцилом или циклофосфамидом и их комбинация с преднизолоном у подавляющего числа больных позволяют получать лишь частичные ремиссии. Стремление улучшить имеющиеся результаты привело к созданию в 70–80-е годы ХХ в. комбинированных лечебных схем, включающих циклофосфамид, преднизолон, винкристин и какой-либо из антрациклинов (Рубомицин, Адрибластин или Идарубицин). Наибольшее распространение получили схемы COP, CHOP и CAP. Эти схемы позволяют у большинства больных добиться сокращения размеров лимфоузлов и селезенки и уменьшить количество лейкоцитов, а в результате проведения нескольких курсов у 30–50% больных получить даже полные ремиссии, которые, однако, всегда оказываются кратковременными. Международные рандомизированные исследования показали, что продолжительность жизни при использовании этих лечебных схем не превосходит полученную при лечении ХЛЛ хлорамбуцилом и преднизолоном.
При лечении флударабином ремиссии, нередко полные, удается получить у большинства больных, в том числе и рефрактерных ко всем другим средствам. Однако со временем выяснилось, что даже полные ремиссии после лечения флударабином, хоть и являются, как правило, довольно длительными, все же временны. Это стало причиной разработки комбинированных схем терапии, содержащих флударабин и какой-либо другой препарат — циклофосфамид, митоксантрон, доксорубицин.
Наиболее эффективным и вызывающим менее всего серьезные побочные явления оказалось сочетание флударабина с циклофосфамидом. Многочисленные исследования, проведенные в разных странах, показали, что эта комбинация препаратов позволяет получить ремиссии у 70–80% ранее леченных и у 90–95% ранее нелеченных больных ХЛЛ, при этом у многих ремиссии, особенно полные, имеют продолжительность 20–28 мес. Эта комбинация оказалась эффективной даже у ряда больных, рефрактерных к предыдущей комбинированной терапии и, что не менее важно, при повторном использовании в случае возникновения рецидива.
В конце 1990-х годов появился флударабин для перорального приема. Его эффективность в соответствующей дозе аналогична эффективности внутривенного препарата. Появление флударабина для приема внутрь позволяет комбинировать его с пероральной формой циклофосфамида. Эта комбинация очень удобна для больных, особенно пожилого возраста, так как избавляет их от необходимости посещения поликлиники для внутривенных инъекций препаратов.
Новым и важнейшим этапом в лечении ХЛЛ стало появление и внедрение в клиническую практику моноклональных антител. Первым в терапии ХЛЛ стал применяться препарат ритуксимаб (Мабтера) — моноклональные антитела к антигену CD20. Антиген CD20 — это фосфопротеин, часть молекулы которого располагается на поверхности клетки, другая — в цитоплазме. Он участвует в доставке кальция к ядру клетки. Антитела к антигену CD20 — это химерные антитела, имеющие вариабельный мышиный и константный человеческий регион IgG. Соединение антител с антигеном CD20 индуцирует в клетке сигналы апоптоза.
При ХЛЛ имеется малая плотность молекул антигена CD20 на лимфоцитах, поэтому антитела к этому антигену при ХЛЛ в монорежиме оказались эффективными лишь в больших дозах. Ко времени появления ритуксимаба (Мабтеры) флударабин показал себя как наиболее эффективный препарат в терапии ХЛЛ, поэтому были предприняты исследования эффективности сочетания ритуксимаба и флударабина. Они показали, что это сочетание высокоэффективно как у ранее леченных, так и у нелеченых больных: частота ремиссий у ранее леченных составляет 60–70%, у нелеченых — 90–95%, у половины больных достигаются полные ремиссии. После такого лечения у большинства ранее нелеченных больных ремиссии сохраняются 2 года и дольше. Сочетание флударабина, циклофосфамида и ритуксимаба позволяет получить эффект у 95–100% ранее нелеченных больных и у ранее получавших терапию хлорамбуцилом (Лейкераном) или сочетанием преднизолона, винкристина, циклофосфамида (СОР), а у 70–75% больных достигаются полные ремиссии.
Терапия ритуксимабом оказалась эффективной и у ряда больных с аутоиммунной анемией и тромбоцитопенией. В этих случаях ее применяют либо в монорежиме, либо в сочетании с преднизолоном или с СОР.
Еще более высокие результаты могут быть достигнуты при использовании антител к антигену CD52 (Alemtuzumab, Campath-1H).
Антиген CD52 — это гликопротеин, который экспрессирован на мембране большинства зрелых нормальных и опухолевых Т- и В- лимфоцитов, эозинофилов, моноцитов и макрофагов, но не обнаружен на мембране стволовых клеток, эритроцитов и тромбоцитов. Его функция в клетке до сих пор не выяснена. В то время как антиген CD20 экспрессирован на патологических лимфоцитах при ХЛЛ с плотностью примерно 8000 молекул на клетку, плотность молекул антигена CD52 очень высока — примерно 500 000 молекул на клетку.
Campath-1H — это гуманизированные антитела, в которых только маленький участок, непосредственно связывающийся с антигеном, является крысиным IgG2a, вся остальная часть молекулы антитела — человеческий IgG1.
Применение Campath-1H часто оказывается эффективным даже у больных, получивших несколько курсов лечения флударабином и ставших к нему резистентными. В большом многоцентровом международном исследовании Campath-1H получили 152 пациентов, рефрактерных к флударабину, у 42% получены ремиссии, в том числе у 5% — полные. Этот результат свидетельствует о высокой эффективности Campath-1H, поскольку резистентность к флударабину — крайне неблагоприятный прогностический признак.
Дальнейшие исследования показали, что применение препарата у ранее нелеченных больных позволяет получить эффект в 80% случаев, у 2/3 больных можно получить полную костно-мозговую ремиссию.
Еще лучшие результаты были получены при комбинации Campath-1H с флударабином (FluCam) у 36 больных ХЛЛ, которые ранее получали флударабин с ритуксимабом или ритуксимаб в сочетании с комбинацией препаратов, включающей алкилирующие агенты. Эффект был достигнут у 83% этих тяжелых и плохо отвечающих на терапию больных, при этом у 30% были получены полные ремиссии. Медиана продолжительности жизни в этой группе составила 35,6 мес и не была достигнута за время наблюдения у больных с полной ремиссией. У двух больных с аутоиммунной анемией, имевшейся до начала лечения, к концу терапии уровень гемоглобина полностью нормализовался без гемотрансфузий и все признаки гемолиза исчезли.
В нескольких исследованиях Campath-1H был использован в качестве консолидирующей терапии у больных, эффективно леченных флударабином. В самом большом исследовании, включившем 56 больных, после флударабина полные ремиссии отмечены у 4%, частичные у 52% больных, после добавочного лечения Campath-1H число полных ремиссий возросло до 42%, число частичных ремиссий составило 50%, таким образом общий эффект увеличился с 56% после лечения флударабином до 92% после добавочного лечения Campath-1H.
Лечение Campath-1H должно проводиться только в стационаре под наблюдением гематологов, так как в связи с резким уменьшением в результате лечения количества не только В-, но и Т-лимфоцитов без профилактических мер у больного часто развиваются осложнения. Наиболее грозное осложнение лечения Campath-1H — частое присоединение инфекций. Самым опасным является развитие септицемии, пневмоцистной пневмонии, системного аспергиллеза или кандидоза, появление распространенного herpes zoster, реактивация цитомегаловирусной инфекции. Учитывая эту опасность, при проведении лечения и не менее 2 мес после его окончания больной профилактически должен получать Бисептол (для профилактики пневмоцистной пневмонии), противогрибковые и антивирусные средства. При обнаружении реактивации цитомегаловируса проводится лечение ганцикловиром, при появлении грибковой инфекции — лечение противогрибковыми препаратами высокой эффективности.
Несмотря на возможные осложнения, применение Campath-1H становится все более распространенным. Те положительные результаты, которые достигаются при его применении, поставили его в ряд наиболее эффективных препаратов в терапии ХЛЛ.
Анализ возможностей терапии ХЛЛ на протяжении столетия показывает, что в течение последних двух десятилетий ХЛЛ из неизлечимого заболевания превратился в заболевание, которое в большинстве случаев при своевременном начале можно успешно лечить, продлевая жизнь и соматическое благополучие больных, и которое в настоящее время стало принципиально излечимым.
- Руководство по гематологии/ под ред. А. И. Воробьева. М.: Ньюдиамед, 2005.
- Клиническая онкогематология / под ред. М. А. Волковой. М.: Медицина, 2001.
- Chronic lymphoid leukemias edited by B. D. Cheson, Marcell Dekker A.G. New York, 2001.
- Волкова М. А., Бялик Т. Е. Ритуксимаб в терапии аутоиммунных осложнений при хроническом лимфолейкозе// Гематология и трансфузиология. 2006. № 3. С. 11–17.
- Волкова М. А. Моноклональные антитела к антигену CD52: оптимизация терапии хронического лимфолейкоза// Гематология и трансфузиология. 2006. № 2. С. 27–33.
М. А. Волкова, доктор медицинских наук, профессор
Онкологический научный центр им. Н. Н. Блохина РАМН, Москва
| Радиоперехваты круглых столов [8] |
| Радиомагазин-73 [505] |
Войти через uID
Классификация.
ХЛЛ подразделяют на В-ХЛЛ и Т-ХЛЛ.
В-ХЛЛ - 90-95%, Т-ОЛЛ - 5-10%.
Эпидемиология.
Самый частый тип опухоли среди взрослого населения, 40% всех лейкозов у людей старше 65 лет.
Средний возраст — 65—70 лет, очень редко встречаются пациенты до 30 лет, 20—30% больных — моложе 55 лет.
Заболеваемость: 3 случая на 100 000 населения в год.
Этология ХЛЛ не отличается от таковой при других неопластических заболеваниях.
Патогенез. На уровне предшественника В-клетки происходит хромосомная аберрация, приводящая или ктрисомии хромосомы 12, или к структурным нарушениям хромосом 6, 11, 13 или 14.
Патологические клетки дифференцируются до уровня рециркулирующих В-клеток или В-клеток памяти.
Их нормальные клеточные аналоги — длительно живущие иммунологически ареактивные митотически пассивные В-клетки Т-независимого пути дифференцировки и В-клетки памяти соответственно.
Последующие деления генетически нестабильных лимфоцитов могут привести к появлению новых мутаций и новых биологических свойств (субклонов).
Клинически это проявляется интоксикацией, трансформацией ХЛЛ в агрессивную лимфоидную опухоль (в 3% случаев).
Болезнь иногда сопровождается появлением моноклонального IgM или IgG. ХЛЛ относится к медленно прогрессирующим опухолям.
Постепенно колонизируя костный мозг, опухоль вытесняет нормальные гемопоэтические клетки, что со временем приводит к развитию недостаточности костномозгового кроветворения.
Кроме того, при ХЛЛ нередко наблюдаются аутоиммунные цитопении, связанные с образованием AT к кроветворным клеткам.
Лимфатические узлы при ХЛЛ увеличиваются обычно медленно, но со временем они могут сдавливать близлежащие органы и нарушать их функции.
Диагностика.
Диагностические критерии В-ХЛЛ:
1) абсолютный лимфоцитоз более 5х10*9/л — по версии NCI (1988 г.), более 10х10*9/л — по критериям международной рабочей группы (1989 г.);
2) количество лимфоцитов в костном мозге равно или более 30%.
Для пациентов с абсолютным лимфоцитозом от 3 до 5х10*9/л, а по критериям NCI — при любом лимфоцитозе, — для подтверждения ХЛЛ необходимо иммунофенотипирование лимфоцитов.
Экспрессия CD5, CDI9, CD 20, CD 23 характерна для В-ХЛЛ.
В периферической крови — тени Боткина—Гумпрехта (полуразрушенные ядра лимфоцитов).
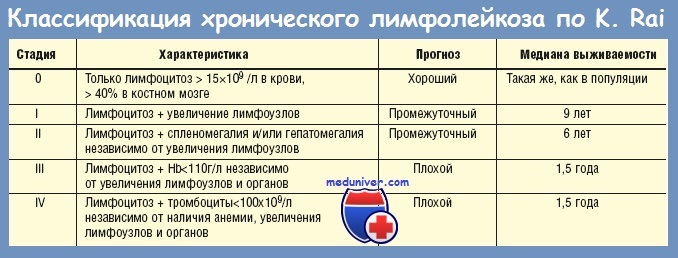
Стадии ХЛЛ по Ret:
Стадия 0 — абсолютный лимфоцитоз, продолжительность жизни — 10—12 лет.
Стадия 1 — лимфоцитоз + лимфаденопатия — продолжительность жизни 6—8 лет.
Стадия 2 — лимфоцитоз + лимфаденопатия + гепатоспленомегалия — продолжительность жизни до 4 лет.
Стадия 3 — присоединение анемии менее 110 г/л — продолжительность жизни до 2 лет.
Стадия 4 — присоединение тромбоцитопении менее 100х10*9/л— продолжительность жизни до 2 лет.
Стадии ХЛЛ по Binet:
А стадия — лимфоцитоз + лимфаденопатия менее 3 зон;
В стадия — более 3 зон поражения лимфоузлов;
С стадия — анемия менее 100х10*9/л или тромбоцитопении менее 100x10*9/л.
Характерные для ХЛЛ аутоиммунные анемии и аутоиммунные тромбоцитопении не влияют на стадию ХЛЛ.
Обследование больного ХЛЛ включает: КТ грудной клетки, брюшной полости, малого таза с измерением опухолевых очагов; биопсию костного мозга; исследование спинномозговой жидкости при агрессивных лимфомах; определение ЛДГ; определение b2-микроглобулина.
Прогностические факторы:
А стадия по Binet и 0 по Rei — низкий риск прогрессии;
В и С стадии no Binet и 1, 2, 3, 4 стадии по Rei — высокий риск прогрессии.
Наличие повышенной ЛДГ, b2-микроглобулина, немутированного гена Ig VH, повышенной экспрессии CD 38, ZAP-70 являются плохими прогностическими факторами.
Пациенты с нормальным кариотипом или делецией 13 хромосомы имеют лучший прогноз по сравнению с пациентами с транслокациями — трисомия 12 хромосомы, транслокация 11q- и аномалии 17 хромосомы — они отличаются короткой выживаемостью.
Лечение. Радикальных методов терапии нет, хотя современная медицина к этому предпринимает попытки.
На ранней стадии болезни при стабильном лейкоцитозе без признаков прогрессии (увеличение лимфоцитоза в 2 раза или увеличение размеров лимфоузлов на 50% за 2 месяца) лечение не проводят, показано только наблюдение, периодически (раз в 3—6 мес) — контроль анализа крови.
Показания к началу лечения:профессия ХЛЛ, т. е. появление В-симптомов (лихорадка, похудание, потливость), увеличение количества лимфоцитов в 2 раза за 2 мес или увеличение массы лимфоузлов на 50%, присоединение аутоиммунной анемии или тромбоцитопении, 3 или 4 стадия no Rei, трансформация в злокачественную лимфоидную опухоль.
Специфическая химиотерапия.
Глюкортикостероиды.
Монотерапия ГКС при ХЛЛ показана только в случаях аутоиммунных осложнений, поскольку они усугубляют имеющийся иммунодефицит и могут стать причиной фатальных септических осложнений.
Применяют преднизолон в дозе 60—90 мг/сут.
Алкилирующие химиотерапевтические средства (хлорамбуцил, циклофосфамид) с или без преднизолона.
Терапия алкилируюшими препаратами не вызывает полных ремиссий и рекомендована в качестве первой линии терапии только для пациентов с наличием противопоказаний к флюдарабину.
Кладрибин (2CdA) с преднизолоном — большая частота полных ремиссий и время безрецедивной выживаемости по сравнению с хлорбутином + преднизолон.
Схема: флюдарабин 25 мг/м2 (дни 1-3) в/в и циклофосфан 250 мг/м2 (дни 1—3) — 35% полных клинико-гематологических ремиссий и 88% общих ответов.
Флюдарабин с циклофосфаном в настоящее время рекомендованы в качестве первой линии терапии.
Схема: флюдарабин 25 мг/м2 в/в (дни 1-3), циклофосфан 250 мг/м2 (дни 1-3 + мабтера 375 мг/м2 (день 1)) — 77% полных клинико-гематологических ремиссий и 90% общих ответов.
Монотерапия флюдарабином менее эффективна по сравнению с комбинированной терапией.
Флюдарабин для перорального применения требует увеличения доз.
Монотерапия мабтерой (ритуксимаб) — 375 мг/м2 еженедельно в течение 8 нед рекомендована в качестве первой линии у пациентов с ранними стадиями В-ХЛЛ.
Для резистентных к терапии флюдарабином пациентов — Campath 30 мг, два раза в нед х 12 нед в/в.
Частота полных ремиссий — 19%, частичных ремиссий — 68%.
При устойчивости к алкилируюшим средствам также назначают комбинацию препаратов по программе СОР, включающую циклофосфамид (750 мг/м2 в/в в 1 день), винкристин (1,4 мг/м2 в/в в 1 день), преднизолон в дозе 40 мг/м2 внутрь в течение 5 дней.
Другие полихимиотерапевтические схемы — CVP (винбластин 10 мг/м2 вместо винкристина), CHOP (COP + доксорубицин 50 мг/м2).
Высокодозная терапия с последующей аутологичной или аллогенной трансплантацией стволовых клеток крови или костного мозга показана пациентам моложе 50-60 лет с рецидивирующим течением ХЛЛ и факторами плохого прогноза.
XT пациентов ХЛЛ требует адекватной поддерживающей терапии (антибактериальной, противовирусной, противогрибковой).
Вариантом ХЛЛ, требующим особого терапевтического подхода, является волосатоклеточный (ворсинчатоклеточный) ХЛЛ (ВКЛ).
Диагностика ВКЛ — на основании морфологических особенностей лимфоцитов, на фоне терапии интерфероном — высокая частота полных ремиссий и увеличение безрецидивной выживаемости.
Прогноз.
ХЛЛ является достаточно медленно текущим заболеванием.
Длительность жизни больных может варьировать от 1—2 до нескольких десятков лет в зависимости от стадии заболевания, прогностических факторов и адекватного лечения.
Читайте также:

