Кселода при лечении рака молочной железы












Кселода при раке молочной железы: опыт длительного применения
Проведен ретроспективный анализ результатов лечения с применением препарата Кселода (капецитабин) как в монорежиме, так и в комбинации с другими препаратам, 63 больных метастатическим раком молочной железы (мРМЖ). Полученные в исследовании данные по частоте объективного ответа, общей и безрецидивной выживаемости подтверждают мнение многих авторов об эффективности применения препарата Кселода в группе больных мРМЖ, ранее получавших лечение антрациклинами и/или таксанами. Проведенный анализ показал, что применение Кселоды характеризуется хорошей переносимостью препарата и минимальными токсическими проявлениями.
В развитых странах в структуре онкологической заболеваемости женщин рак молочной железы (РМЖ) занимает 1-е или 2-е место и составляет 20–25 % всех случаев рака [2]. Усовершенствование ранней диагностики и использование адъювантной терапии существенно улучшили результаты лечения больных ранним РМЖ. Однако более чем у половины пациенток с РМЖ на том или ином этапе заболевания развиваются отдаленные метастазы.
Метастатический РМЖ (мРМЖ) является неизлечимым заболеванием, однако современные лечебные подходы позволяют достигать у больных клинически значимого регресса опухолевого процесса [1]. Современные схемы комбинированной химиотерапии (ХТ) позволяют добиваться выраженного клинического эффекта у 50–60 % больных диссеминированным РМЖ при средней продолжительности ремиссии 6–14 месяцев и медиане продолжительности жизни с момента начала лечения около 2 лет [1, 2].
У больных РМЖ с распространенным опухолевым процессом и висцеральными поражениями предпочтительнее использовать в первой линии лечения комбинации, включающие антрациклины и таксаны. Во второй линии терапии применяются препараты, не обладающие перекрестной резистентностью, к числу которых относится капецитабин.
Противоопухолевый препарат, антиметаболит капецитабин – производное фторпиримидина карбамата, представляет собой цитостатик для приема внутрь, активирующийся в ткани опухоли и оказывающий на нее селективное цитотоксическое действие. Перорально назначаемый капецитабин предоставляет врачам возможность лечить пациентов с РМЖ с таким же эффектом, как это обеспечивают длительные инфузии фторурацила, но без осложнений и расходов, связанных с парентеральным введением последнего и применением инфузионных насосов [1, 5, 6, 8]. Капецитабин был одобрен в 1998 г. Управлением по надзору за качеством пищевых продуктов и лекарственных средств США (FDA) в монотерапии мРМЖ, резистентных к паклитакселу и антрациклинам, а также для лечения больных РМЖ, резистентных к паклитакселу, которым противопоказано назначение антрациклинов. В настоящее время препарат применяют как в монотерапии, так и в комбинации с другими цитостатиками, такими как доцетаксел, цисплатин, винорелбин и др. [3, 4, 5, 7].
Целью нашего исследования являлась оценка эффективности препарата Кселода производства компании Ф. Хоффманн Ля-Рош Лтд., Швейцария при лечении мРМЖ и связанной с его применением токсичности [3].
В исследование было включено 63 пациентки с генерализацией РМЖ, находившихся на лечении в РНИОИ с 2000 по 2010 г., в возрасте от 30 до 80 лет (табл. 1).
Таблица 1. Распределение больных РМЖ по возрасту.
Самой многочисленной была группа больных в возрасте 50–59 лет (38 %). Женщины в возрасте 50 лет и старше составили более половины больных – 37 (58 %).
Менструальная функция была сохранена у 17,5 % пациенток. У остальных отмечена менопауза различной продолжительности: менее года – 17,5 %, 1–5 лет – 23,8 %, 5–10 лет – 19 %, более 10 лет – 20,6 %. Овариэктомия была проведена 14 (22,2 %) пациенткам, в т. ч. двум по поводу метастазов в яичники и 12 – для устранения действия эстрогенов.
По морфологическому строению опухоли преобладал инфильтрирующий протоковый рак – 92 %, остальные гистологические типы были представлены слизистым и медуллярным раком.
Исходно больные мРМЖ имели различные стадии заболевания: I – 7 (11,1 %), II – 23 (36,5 %), III – 28 (44,4 %), IV – 5 (7,9 %). Однако к началу проводимой нами терапии у всех пациенток имел место распространенный опухолевый процесс. Минимальное время от окончания ранее проведенного лечения до прогрессирования в исследуемой группе составило 2,5 месяца, максимальное – 16 лет. У 78 % больных в метастатический процесс было вовлечено более 2 органов и систем. Среди 14 пациенток с поражением одного органа в пяти случаях определены метастазы в печень, в пяти – в легкие, в трех – в кости, в одном – в надключичные лимфоузлы. При наличии нескольких метастатических очагов наблюдалась практически одинаковая частота поражения: печени – 33 (52,3 %), легких – 32 (50,8 %) и костей – 30 (47,6 %). Отмечено также частое поражение мягких тканей, имевшее место у 21 пациентки (33,3 %).
Препарат Кселода применялся в составе 3-й и последующих линий терапии мРМЖ – в основном при прогрессировании заболевания на фоне применения антрациклинов и/или таксанов [6]. Препарат назначался в дозе 1250 мг мг/м2 2 раза в сутки в течение 14 дней с перерывами в 7 дней. За исследуемый период пациенткам было проведено 266 курсов ХТ с использованием различных схем лечения (табл. 2).
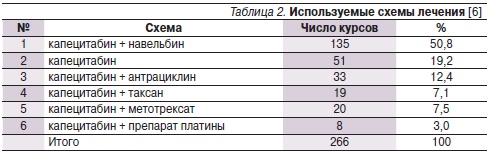
Чаще всего использовали схему Кселода + навельбин (50,8 %), в монорежиме Кселоду применяли в 19,2 % курсов. Больным проводили от 2 до 6 курсов ХТ, терапию продолжали до достижения максимального эффекта или прогрессирования. В результате 28 пациенткам было проведено 6 курсов, 12 (в связи с прогрессированием) – только 2 курса, остальные больные пациентки получали по 3–4 курса ХТ.
Во время контрольного осмотра каждой больной проведено физикальное и общепринятое лабораторное обследования.
Анализ общей (ОВ) и безрецидивной выживаемости (БРВ) по Каплану–Майеру проведен с использованием программы STATISTICA 6.0 в двух группах больных. Статистическую значимость различий в выживаемости оценивали с помощью Log-Rank тест.
Объективный ответ на проводимое лечение получен среди 40 (63,5 %) пациенток, в т. ч. у 4 (6,3 %) больных была достигнута полная ремиссия, 6 (9,5 %) – частичная и у 30 (47,6 %) – стабилизация процесса. У 23 (36,5 %) больных наблюдалось прогрессирование опухолевого процесса. Необходимо отметить, что прогрессирование отмечено среди пациенток с множественными метастазами в печень, легкие и головной мозг.
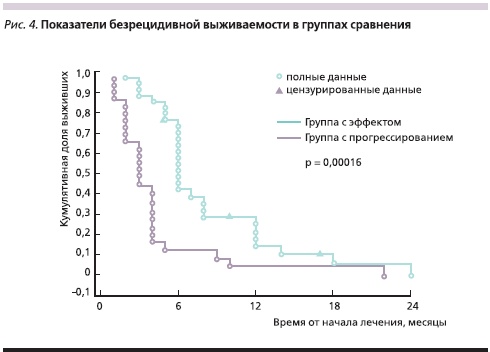
Медиана ОВ наблюдавшихся больных составила 9 месяцев (рис. 1), а медиана БРВ – 5 месяцев (рис. 2).
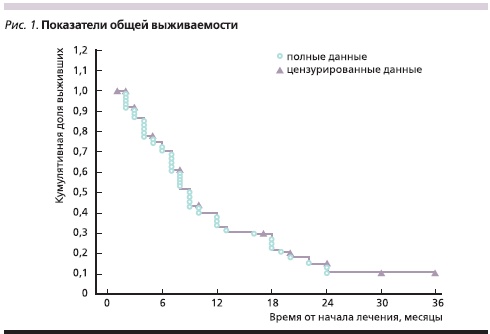
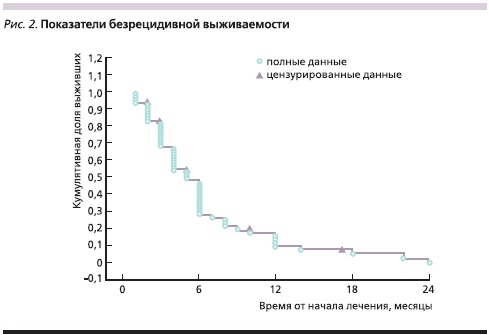
Для более детальной оценки ОВ и БРВ участницы исследования были разделены на две группы – с объективным ответом (эффектом) на лечение и с прогрессированием процесса.
В группе с эффектом от проводимой терапии медиана ОВ составила 13 месяцев, а в группе с прогрессированием заболевания – 4 месяца (р = 0,00004; рис. 3). Медиана БРВ в группе с эффектом была равна 6, а в группе с прогрессированием – 3 месяцам (р = 0,00016; рис. 4). Живы на момент подготовки статьи 8 (12,7 %) пациенток.
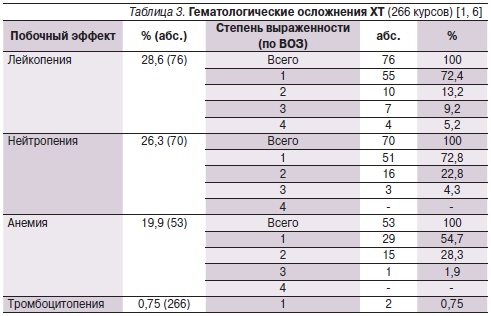
При изучении токсичности проводимой ХТ было проанализировано 266 курсов.
Гематологическая токсичность была представлена в основном лейкопенией (28,6 %) и нейтропенией (26,3 %), преимущественно 1 и 2 степеней (табл. 3). Случаев фебрильной нейтропении не было отмечено ни у одной пациентки. Анемия также главным образом 1 и 2 степени развивалась на фоне 19,9 % курсов ХТ. Тромбоцитопения I степени тяжести за время проведения исследования зарегистрирована у двух пациенток. Лечение гематологической токсичности проводилось общепринятыми методами.
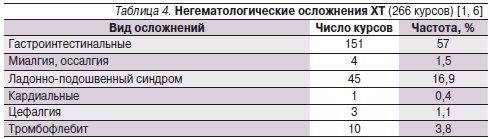
Негематологические осложнения представлены в табл. 4. Из их числа преобладали гастроинтестинальные осложнения – 57 %. Чаще всего наблюдались тошнота – 28,5 %, рвота – 12,5 % и диарея – 16,0 %. Проявление ладонно-подошвенного синдрома имели 1–2 степени выраженности и не требовали коррекции проводимой терапии [1, 6].
У одной пациентки лечение Кселодой было прекращено на 4-е сутки из-за выраженных диспепсических явлений (тошноты и рвоты), а также головной боли и головокружения, которые купировались после отмены препарата.
Полученные в исследовании данные по частоте объективного ответа, ОВ и БРВ подтверждают мнение многих авторов об эффективности применения препарата Кселода (капецитабин) в группе больных мРМЖ, ранее получавших лечение антрациклинами и/ или таксанами, а так же увеличение продолжительности выживаемости [1, 3, 9].
Проведенный анализ применения препарата Кселода в монотерапии и в сочетании с другими препаратами показал, что он характеризуется хорошей переносимостью, минимальными токсическими проявлениями, которые купируются применением адекватной симптоматической терапии. Исходя из этого, Кселоду можно использовать в лечении пожилых больных, в амбулаторном режиме и у ослабленных пациентов.
Информация об авторах:
Владимирова Любовь Юрьевна – доктор медицинских наук, профессор, руководитель отделения химиогормонотерапии ФГУ “Ростовский научно-
исследовательский онкологический институт” Министерства здравоохранения и социального развития РФ.
Тел. 8 (8863) 2-955-374, e-mail: vlu@aaanet.ru;
Попова Ирина Леонидовна – кандидат медицинских наук, научный сотрудник отделения химиогормонотерапии ФГУ “Ростовский научно-
исследовательский онкологический институт” Министерства здравоохранения и социального развития РФ.
Тел. 8 (8863) 2-538-546
1. Гарин А.М., Насырова Р.Ю. Капецитабин (Кселода) – удобная лекарственная форма пиримидиновых антиметаболитов, завоевавшая важные позиции на всех этапах лечения рака молочной железы // Эффективная фармакотерапия. Онкология, гематология и радиология 2011. Т. 2. С. 3–8.
2. Переводчикова Н.И. Руководство по химиотерапии опухолевых заболеваний // Практическая медицина, 2011. С. 182–96.
3. Ershler WB. Монотерапия капецитабином: эффективное и безопасное лечение метастатического рака молочной железы // Современная онкология, 2008. Т. 10. № 1. С. 11–17.
4. Hirata M, Tacao S, at al. A phase II trial of oral combination chemotherapy with capecitabine and cyclophosphamide in metastatic breast cancer. Eur J Cancer 2010;8(3):65.
5. Martin M. Randomized, phase II trial comparing continuos versus intermittent capecitabine monotherapy for metastatic breast cancer: Results from the GEICAM 2009–05 study. JClinOncol 2011;29:82.
6. Saif MW, Katirtzoglou NA, Syrigos KN. Капецитабин: клинические проявления и тактика лечения побочных эффектов // Современная онкология, 2008. Т. 10. № 2. С. 22–36.
7. Pippen JE, Paul D, at al. Randomized, phase III study of adjuvant doxorubicin plus cyclophosphamide, docetaxel with or without capecitabine in high-risk early breast cancer: Exploratory Ki-67 analyses. J Clin Oncol 2011;29:46.
8. Svensson H, Einbeigi Z, at al. Quality of life in women with metastatic breast cancer during nine months after randomization in the TEX trial (epirubicin and paclitaxel w/o capecitabine). Eur J Cancer 2010;8(3):197.
9. Ziellinski C, Gralov J, Martin M. Optimising the dose of capecitabine in metastatic breast cancer: confused, clarified or confirmed? Ann Oncol 2010;doi:10.1093\annonc\mdq069:1–8.

Кселода (капецитабин, Xeloda, capecitabine) — препарат для пероральной химиотерапии, одобренный FDA при метастатическом раке (лечение рака молочной железы 4 стадии) в случае, если опухоль не ответила на применение таких химиопрепаратов, как таксол (паклитаксел), таксотер (доцетаксел), адриамицин (доксорубицин) или на другие схемы химиотерапии, содержащие антрациклины.
Кселода при метастазирование рака молочной железы назначается как в монорежиме, так и в комбинации с другими цитостатиками (группа противоопухолевых препаратов, которые нарушают процессы роста, развития и механизмы деления раковых клеток).
Показания к применению
Если показана химиотерапия, а не гормональная терапия, то рак молочной железы 4 стадии с метастазами в легкие, печень или другие отдаленные органы начинают лечить, как правило, с помощью паклитаксела и адриамицина (доксорубицина). Если опухоль не отвечает на эти препараты, то ваш врач может порекомендовать Кселоду, таблетированный препарат, который вы можите принимать самостоятельно на дому без посещения больницы для проведения инъекций.
Кроме того, если вы принимали только антрациклины и не было ответа, ваш врач может рекомендовать комбинацию Кселода / Таксотер.
Кселода используется не только для лечения злокачественной опухоли грудной железы с метастазами, но и при метастазирование рака ободочной и прямой кишки, а также если метастазирует предстательной железы.
Как препарат работает
Молекула капецитабина встраивается в геном раковой клетки, что приводит к ее гибели, прежде чем она начнёт делиться. Это, в свою очередь, замедляет и останавливает рост злокачественной опухоли.
Эффективность
Клинические исследования показали, что этот препарат, по-видимому:
- Комбинация капецитабина с лапатинибом улучшает общую выживаемость и выживаемости без прогрессирования при HER2-положительном раке молочной железы с метастазами, который прогрессирует на фоне применения трастузумаба.
- В комбинации с лапатинибом капецитабин улучшает результаты лечения HER2-позитивного рака грудной железы с метастазами в головной мозг, когда местное воздействие на очаг поражения неэффективно и повторное обучение невозможно.
- В сочетании со стандартной химиотерапией увеличивается общая выживаемость и выживаемость свободна от заболевания при трижды негативном раке молочной железы.
Несмотря на то, что во многих исследованиях была продемонстрирована эффективность Кселоды, для некоторых людей может не подойти, как и в случае других цитостатиков опухоль может быть резистентна к препарату. Помимо этого, комбинация с другими химиотерапевтическими средствами увеличивается риск возникновения побочных эффектов.
Статья по теме: HER2-позитивная опухоль в сравнении с HER2-негативной
Дозировка и способ введения
Кселода представляет собой продолговатую таблетку персикового цвета. Препарат выпускается в двух дозировках: по 150 мг и 500 мг. Обычно его принимают два раза в день, в идеале примерно через 30 минут после еды, с большим количеством воды.
Он принимается циклами — ежедневный в течении двух недель приём, затем недельный перерыв, после чего цикл повторяется. Ваш доктор решит, как долго вы будете оставаться в этом режиме.
Побочные эффекты
Наиболее частые побочные эффекты Кселодаы:
- Диарея
- Тошнота и рвота
- Мукозит ротовой полости (язвочки на слизистой)
- Боль в животе
- Плохой аппетит
- Обезвоживание организма
- Кожная сыпь или сухость, зуд кожи
- Головокружение
- Постоянная усталость
- Головная боль
- Отёчность нижних конечностей
- Периферическая невропатия
Когда вы принимаете кселоду, постарайтесь пить больше жидкости. Рекомендуется выпивать дополнительных два-три литра воды каждые 24 часа. Не рекомендуется употреблять алкоголь и кофеин. Это может усугубить обезвоживание организма. Если появились эрозии во рту или на языке, используйте щетку с мягкой щетиной.
Если появится головокружение, постарайтесь побольше отдыхать. В случае выраженной тошноты доктор может порекомендовать вам антиэметики (лекарства, которые используются для лечения тошноты и рвоты).
Обязательно сообщите обо всех побочных эффектах своему врачу. Запишите даты и время их появления и оцените выраженность каждого симптома.
Позвоните своему врачу и немедленно прекратите принимать Кселода, если у вас появились следующие симптомы:
- Тяжелая диарея
- Частая рвота
- Болезненные язвы во рту и на языке
- Лихорадка
Риски
Если вы используете кумадин или варфарин (препараты, разжижающие кровь), применение с этими препаратами Кселоды увеличивает опасность возникновения выраженного кровотечения. Сообщите врачу, если вы принимаете какой-либо из препаратов, направленных на разжижения крови. Возможно, вам придется снизить дозу принимаемые Кселоды.
У пожилых кселода чаще вызывают понос, тошноту и рвоту, чем у молодых.
Обычные порезы хуже заживают, когда принимается Кселода. Поэтому следует минимизировать риски их получения. По этой причине врачи рекомендуют пользоваться электрической плитой.
Кроме того, время приема данного препарата повышается восприимчивость к солнечному свету. Избегайте длительного пребывания на солнце; и используйте надёжный солнцезащитный крем, когда вы планируйте дневную прогулку.
Противопоказания
Вы не должны принимать капецитабин, если:
- У вас непереносимость 5-фторурацил (5-FU)
- У вас проблемы с почками или печенью
- Вы кормите грудью
- Вы беременны
Кроме того, примерно у 5% людей из-за недостатка определенного фермента распад препараты замедлен. Это может привести к появлению выраженных побочных эффектов, таких как тяжелой диареи и обширному ладонно-подошвенному синдрому (ладонно-подошвенная эритродизестезия). Люди с недостатком фермента не должны принимать Кселоду.
Узнайте больше: Мониторинг вашего ответа на лечение
Список использованных источников:
- КЛЮЧЕВЫЕ СЛОВА: антиметаболиты, рак молочной железы, лечение рака молочной железы, онкология
Антиметаболиты в онкологии – это вещества, химическая структура которых напоминает субстраты, вовлеченные в синтез ДНК опухолевых клеток. Будучи имитаторами этих субстратов, антиметаболиты разрушают ДНК, изменяют ее функции, что ведет к гибели опухолевых клеток. Принцип антиметаболитов взят в онкологию из химиотерапии инфекции. Белый стрептоцид – парааминосалициловая кислота (ПАСК) – имел большое химическое сходство с парааминобензойной кислотой (ПАБК), необходимой для размножения микробов, что позволяло ему конкурировать с ПАБК за связывание ферментов в бактериальной клетке и прекращать их рост.
Один из первых антиметаболитов – фторурацил – был синтезирован в Мэдисоне в 1950-х гг. Это фтористый аналог урацила. В основу его синтеза были положены наблюдения, свидетельствующие о большей утилизации урацила опухолевыми клетками, нежели нормальными. В механизме действия фторурацила главным является непрямое торможение фермента тимидилат-синтетазы (ТС), который необходим для синтеза предшественников пиримидина (одного из 4 нуклеотидов, образующих ДНК). Метаболит фторурацила – фтордезоксиуридин монофосфат – расходует ТС на синтез фторпиримидинов вместо физиологических тимидилатов, что приводит к нарушению функции ДНК опухолевых клеток. Фторурацил широко используется для лечения новообразований желудочно-кишечного тракта, опухолей головы и шеи, рака яичников, рака молочной железы и других опухолей [1].
Общепризнанным фактом является неизлечимость больных с метастатическим РМЖ, их медиана выживаемости в развитых странах – 3 года [6]. РМЖ гетерогенен по молекулярно-генетическому статусу, различен по скорости роста и клиническому течению, по характеру метастазирования, по ответу на эндокринную терапию, химиотерапию, таргетную терапию, по срокам выживаемости и другим параметрам [7]. РМЖ – давний объект лекарственной терапии опухолей. Увеличивается набор опций, препаратов, схем комбинированной терапии, изменяются методы введения, дозовые режимы, лекарственные формы (например, созданы липосомальные антрациклины, альбумин-связанный паклитаксел, пероральные формы фторпиримидинов и т.д.). Важной целью лекарственной терапии остается улучшение баланса противоопухолевого действия лекарств и их токсичности.
Капецитабин (Кселода) – фторпиримидиновый карбамат – является инактивной продраг-формой фторурацила, всасывается в ЖКТ (100%-ная биоэквивалентность). В печени Кселода, благодаря ферменту карбоксил-эстеразы, превращается вначале в 5-дезоксифторпиримидин, а затем в печени и опухолях – в 5-дезоксифторуридин. Важнейший этап метаболизма происходит в опухолях при посредстве тимидин-фосфарилазы (ТФ) – превращение дезоксифторуридина в 5-фторурацил. Поскольку экспрессия ТФ в опухолях значительно выше, чем в нормальных тканях, концентрация 5-фторурацила в них в 100 раз больше, чем в слизистых желудка, кишечника и других тканях. Противоопухолевое действие оказывает фторурацил, который приводит к торможению тимидилат-синтетазы и выключению ди- и трифосфатных метаболитов в ДНК и РНК с нарушением их синтеза и функции [9].
В метаанализе [10] приведены результаты 5 крупных исследований Кселоды в монотерапии 1476 больных, леченных ранее антрациклинами и таксанами. Противоопухолевый эффект регистрировался в диапазоне 14–29%, медиана времени до прогрессирования варьировала от 3,8 до 5 месяцев, медиана общей выживаемости – от 11,1 до 15,6 месяца. В ряде исследований эффективность Кселоды сравнивалась с противоопухолевым действием винорелбина (этот препарат резервирован для второй линии терапии метастатического рака молочной железы). Во время III фазы исследования было показано, что эффект в группе получавших Кселоду (n = 54) был 24%, время до прогрессирования – 5 месяцев, общая выживаемость – 14,6 месяца, 1-летняя выживаемость – 29%. В группе, леченной винорелбином, эффект составил 28%, время до прогрессирования – 3,7 месяца, общая выживаемость – 12,5 месяца, 1-летняя выживаемость – 17%.
При сравнении Кселоды и гемцитабина и винорелбина во второй линии терапии РМЖ выживаемость до прогрессирования после применения одного препарата составила 21 месяц, после комбинации – 13,5 месяца [11]. Комбинация капецитабина (1 г/м2, 1–14-й дни, каждые 3 недели) и винорелбина (25 мг/м2, 1-й и 8-й дни, каждые 3 недели) оценена в 4 исследованиях, эффект регистрировался во второй линии терапии у больных с Her2-негативным метастатическим РМЖ в 33–50%, время до прогрессирования составило 5–8 месяцев, общая выживаемость при разных исследованиях – от 11 до 27 месяцев [10].
Кселода вместе с трастузумабом или лапатинибом изучалась во второй линии терапии больных Her2-позитивным РМЖ. В немецком рандомизированном исследовании Her2-позитивные больные, прогрессирующие на комбинациях таксанов с трастузумабом, получали Кселоду в комбинации с трастузумабом или только Кселоду. Время до прогрессирования составило 8,5 и 5,6 месяца соответственно, HR = 0,69 в пользу комбинации препаратов (p = 0,034). Общая выживаемость после комбинации – 25,5 месяца, после монотерапии Кселодой – 20,3 месяца (тоже высокий показатель). Комбинация Кселоды и лапатиниба эффективна у Her2-позитивных больных после терапии таксанами, антрациклинами и трастузумабом. Время до прогрессирования при применении комбинации – 6,2 месяца, при монотерапии Кселодой – 4,3 месяца, HR = 0,57, p 1000 мг/м2 и
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
Российский онкологический научный центр им. Н.Н. Блохина РАМН
В последнее время в лечении больных злокачественными опухолями достигнут значительный прогресс за счет введения в онкологическую практику новых препаратов. Разрешены к применению или находятся в стадии исследования огромное количество препаратов, как цитостатиков, так и препаратов, основанных на последних открытиях фундаментальной науки (ингибиторы ангиогенеза, блокаторы рецепторов факторов роста, и т.д,).
В настоящем обзоре представлены наиболее эффективные препараты, вошедшие в повседневную практику в последние 2–3 года.
Алимта (МТА, Eli Lilly) – многоцелевой антифолат. Механизм действия – нарушение метаболизма фолиевой кислоты за счет блокирования нескольких ферментов, участвующих в нем – тимидилатсинтазы, дигидрофолатредуктазы, и глицинамид-рибонуклеотид-формилтрансферазы. При этом нарушается синтез пурина и тимидина, необходимых для синтеза ДНК. Алимта проникает через мембрану клетки и, в виде полиглютаматов, надолго задерживается в клетке, что, наряду с ингибированием ферментов, определяет селективность и противоопухолевую активность.
В исследованиях I фазы оптимальным режимом лечения было признано введение препарата в дозе 600 мг/м 2 1 раз в 21 день в виде 10–минутной внутривенной инфузии. Основные токсические проявления – нейтро– и тромбоцитопения (дозолимитирующая токсичность) и изменения функциональных проб печени (преходящие и не требовавшие коррекции дозы). Другие токсические проявления – слабость, кожная сыпь, мукозиты, диарея, тошнота, как правило, умеренно выражены (I–II степень).
Объективная противоопухолевая активность Алимты в монотерапии была выявлена при немелкоклеточном раке легкого (16–23%), колоректальном раке (15–17%), опухолях головы и шеи (26%), раке молочной железы (18–31%), толстой кишки (15–17%), поджелудочной железы (6%), шейки матки (25%), мочевого пузыря (27%). В настоящее время изучаются комбинации Алимты с препаратами платины, Гемцитабином, таксанами, антиметаболитами, ингибиторами топоизомеразы I, алкалоидами, а также с лучевой терапией.
В исследованиях II фазы в монотерапии при немелкоклеточном раке легкого Алимта (500 мг/м 2 каждые 28 дней) в I линии индуцировала частичную регрессию у 23% из 30 больных (Канадская группа) и у 18% из 51 больного (исследовательские центры Австралии и Южной Африки). Во II линии у 45 больных, получавших ранее препараты платины, эффект Алимты был достигнут у 9% больных, у не получавших препаратов платины (33 больных) эффект достигнут в 15% случаев.
В исследованиях II фазы комбинация Алимта (500 мг/м 2 день 1) + Цисплатин (75 мг/м 2 день 1, каждые 3 недели) была эффективна (частичная регрессия + стабилизация заболевания) от 39% (36 больных) до 45% (29 больных). Дозолимитирующей токсичностью была III – IV степень гранулоцитопении. Назначение фолиевой кислоты до начала химиотерапии Алимтой позволяет существенно минимизировать ее токсичность
Гемцитабин (Гемзар, Eli Lilly) – аналог дезоксицитидина, обладает активностью при ряде солидных опухолей.
В настоящее время Гемзар рекомендован к применению в дозах 1000–1250 мг/м 2 в/в, 30 минутная инфузия, дни 1, 8 и 15 каждого 28–дневного цикла.
Наиболее часто встречающиеся побочные эффекты – гранулоцитопения (II–III) – 46%, гриппоподобный синдром (II) – 20%, повышение температуры тела (I–II) – 53%, периферические отеки (II) – 30%, анемия (I–II) – 61%, повышение уровня печеночных ферментов (I–II) – 40–60%, одышка (I–II) – 10%. Дозолимитирующая токсичность – нейтропения.
Рак поджелудочной железы – первая нозология, при которой Гемцитабин был разрешен к применению, учитывая его выраженный симптоматический эффект (в 30% случаев) и достоверное увеличение общей выживаемости. Комбинация Гемцитабин + Цисплатин, по данным различных авторов, индуцирует объективный ответ от 22% до 36% с медианой выживаемости от 8 до10 мес. В комбинации с 5–фторурацилом эффект наблюдался в 17–19% при средней выживаемости от 6 до 8 мес. Режим Гемцитабин + 5–фторурацил + Эпирубицин по предварительным данным (26 больных) был эффективен в 69% при медиане выживаемости 8 мес.
Рак легкого. В монотерапии в исследованиях II фазы общая эффективность составила 22% при средней выживаемости 12 мес, что ставит Гемцитабин в ряд наиболее активных препаратов при немелкоклеточном раке легкого. По данным ряда исследований, комбинация Гемцитабина (1000–1250 мг/м 2 , дни 1, 8 ± 15) с Цисплатином (80–100 мг/м 2 , день 1) показала общий ответ в 50% с приемлемым профилем токсичности. При сравнении режима Гемцитабин + Цисплатин со стандартным лечением Этопозид + Цисплатин у 135 ранее не получавших химиотерапию больных, эффективность в первом случае была достоверно выше – 41% против 22%, без существенных различий во времени выживаемости. Полученные результаты служат основанием для использования комбинации Гемцитабин + Цисплатин в первой линии химиотерапии распространенного рака легкого. Изучаются комбинации Гемцитабин + Цисплатин в качестве адъювантного лечения при немелкоклеточном раке легкого, а также 3-хкомпонентные режимы с включением Гемцитабина, Цисплатина, Навельбина и таксанов. Несмотря на обнадеживающие результаты, двухкомпонентная комбинация пока считается стандартным лечебным подходом (до тех пор, пока не будут опубликованы результаты III фазы клинических испытаний сравнения 2- и 3-хкомпонентных режимов).
Рак мочевого пузыря. Гемцитабин в режиме монотерапии эффективен в 23–28%. В комбинации с Цисплатином объективный ответ составляет от 24% до 66%. В настоящее время рекомендован режим: Гемцитабин 1000 мг/м 2 в 1, 8 и 15 дни и Цисплатин 70 мг/м 2 во 2 день каждого 28 дневного курса.
Изучаются 3-хкомпонентные режимы, в частности, опубликованы данные о 82% общем эффекте (29 больных) при лечении по схеме Гемцитабин + Цисплатин + Паклитаксел.
Проводятся исследования эффективности комбинированной терапии с включением Гемцитабина при раке молочной железы, яичников, опухолях головы и шеи.
Герцептин (Трастузумаб, F. Hoffmann–La Roche) – препарат с принципиально новым механизмом действия. Он представляет собой рекомбинантные гуманизированные моноклональные антитела, связывающиеся с рецептором НЕR–2/neu. В настоящее время проведены исследования по применению Герцептина при раке молочной железы с гиперэкспрессией НЕR–2/neu, которая выявляется в 25–30% опухолей и обусловливает плохой прогноз.
Герцептин вводится внутривенно, первая доза – 4 мг/кг, далее еженедельно по 2 мг/кг. У 40% больных после первого введения отмечен озноб и повышение температуры, при последующих введениях эти явления были у 5% больных. Основным побочным эффектом при применении препарата была кардиотоксичность у 2,6% больных, не получавших ранее антрациклинов, и у 8,5% после применения антрациклинов. При применении Герцептина одновременно с антрациклинами – в 28% случаев, у 19% из них – III–IV степени.
При самостоятельном применении Герцептина у ранее не получавших лечение больных, положительных по НЕR–2/neu, получен объективный ответ в 23% случаев, у 15% больных отмечена длительная стабилизация заболевания. Во II–III линии лечения объективный ответ получен в 16%.
Завершено рандомизированное исследование, включившее 469 больных метастатическим раком молочной железы. Больные, не получавшие антрациклинов в адъювантном лечении, рандомизированы на 2 группы: химиотерапия в режиме АЦ (Доксорубицин + Циклофосфан) + Герцептин; химиотерапия АЦ без Герцептина. Получавшие антрациклины в адъювантном лечении больные получали Таксол в монотерапии или Таксол + Герцептин (табл. 1).
Отмечено, что при НЕR–2/neu 2+ по данным иммуногистохимического исследования (ИГХ) полная и частичная регрессия отмечены у 26% больных, у НЕR–2/neu 3+ в 35%, а при положительных по НЕR–2/neu по методу флюоресцентной in situ гибридизации (FISH) – в 41% случаев. Все больные НЕR–2/neu 2+, имевшие эффект, были положительными по данным FISH.
С учетом результатов исследований разработаны рекомендации к назначению Герцептина: препарат показан всем больным с НЕR–2/neu 3+ по данным ИГХ, при НЕR–2/neu 2+ следует дополнительно провести FISH.
Предклинические исследования показали усиление эффективности при комбинации Герцептина с Таксолом, Доксорубицином, Карбоплатином, Цисплатином, Циклофосфаном, Этопозидом, Метотрексатом, 5–фторурацилом. Разработаны эффективные режимы, включающие Герцептин и Таксол, Герцептин и Навельбин. Изучаются комбинации Герцептина с различными химиопрепаратами и эндокринотерапией при диссеминированном раке молочной железы, а также в пред– и послеоперационном лечении.
Гиперэкспрессия НЕR–2/neu и эффективность Герцептина по экспериментальным данным, выявлены при аденокарциноме легкого, раке поджелудочной железы, желудка, яичников.
Кампто (Иринотекан, Авентис) – полусинтетический растворимый дериват камптотецина, гидролизующийся in vivo в активный метаболит SN–38. Кампто стабилизирует комплекс топоизомеразы–I с ДНК, препятствуя его диссоциации и соединению нитей ДНК. Кампто относится к фазоспецифичным препаратам, максимально повреждая клетки, находящиеся в S–фазе.
Побочные действия: гастроинтестинальная и миелотоксичность, острый холинергический синдром, алопеция. Дозолимитирующими осложнениями являются диарея и миелотоксичность. Диарея отмечается у 87% пациентов (выраженная – у 38,5%), обычно развивается на 4–8 день и хорошо контролируется приемом лоперамида. Холинергический синдром наблюдается в 85% и требует премедикации атропином в последующих курсах. Нейтропения встречается в 55%, из них в 47% – III–IV степени. Анемия бывает у 20–25% больных, обычно III степени, тромбоцитопения – в 5% случаев. Алопеция – у 50%.
Наибольшее применение препарат нашел при распространенном колоректальном раке. У больных, ранее не получавших химиотерапию, объективный ответ составил от 18,8 до 36%, с длительностью эффекта от 6,5 до 9,1 мес. Эффективность Кампто в монотерапии во II–III линии терапии составляет от 14 до 40%. Длительность эффекта от 3 до 9,1 мес.
В настоящее время Кампто рекомендован в США в качестве препарата I линии терапии колоректального рака в дозе 350 мг/м 2 каждые 3 недели. Значительные исследования проведены по изучению комбинации Кампто с 5–фторурацилом/Лейковорином. В исследование сравнительной эффективности комбинации Кампто + 5–фторурацил + Лейковорин; стандартного режима 5–фторурацил + Лейковорин и Кампто в монотерапии было включено 666 больных метастатическим колоректальным раком, не получавших ранее химиотерапии. Лучшие результаты получены в группе Кампто/5–фторурацил/Лейковорин: объективный ответ был достоверно выше – 33% против 18% и 17%, медиана времени до прогрессирования и продолжительности жизни была на 2 мес больше, чем в двух других группах.
В настоящее время изучаются режимы Кампто + Томудекс; Кампто + Оксалиплатин и др. Также проводятся исследования эффективности Кампто в послеоперационном периоде у больных колоректальным раком стадии Dukes’ B и C.
Монотерапия Кампто при немелкоклеточном раке легкого эффективна в 21% при 44% средней годичной выживаемости. Эффективность комбинации Кампто и Цисплатина составляет 43–50%. Комбинация Кампто и Карбоплатина эффективна в 40%, и в 40% случаев отмечается длительная стабилизация болезни.
Комбинация Кампто и Цисплатина (Цисплатин 80 мг/м 2 1 день и Кампто 60 мг/м 2 1, 8, 15 дни каждые 3 нед) эффективна у 43% больных, среднее время до прогрессирования 21 нед, выживаемость в течение 1 года 49%, средняя продолжительность жизни – 52 нед. Данный режим является одним из самых эффективных в первой линии лечения при немелкоклеточном раке легкого.
При мелкоклеточном раке легкого эффективность Кампто у получавших ранее химиотерапию больных составила от 26,6% до 50%. Комбинация Кампто с другими препаратами более эффективна, особенно в первой линии химиотерапии. Режим Кампто 60 мг/м 2 1, 8 и 15 дни + Цисплатин 60 мг/м 2 в 1 день был эффективен в 78% случаев, а в комбинации с Этопозидом (Кампто 60 мг/м 2 в 1, 8 и 15 дни, Этопозид 80 мг/м 2 во 2, 3 и 4 дни) – в 66% случаев, из них у 10% больных получена полная ремиссия.
Эффективность Кампто при раке яичников колеблется в пределах 21–23%. Изучаются комбинации Кампто с другими препаратами в I и II линии химиотерапии рака яичников.
При раке желудка эффективность Кампто в монотерапии составила 17,6%, причем у 40% – симптоматический эффект.
У 25 ранее леченных больных распространенным раком желудка комбинация Кампто 65 мг/м 2 и Цисплатина 30 мг/м 2 еженедельно была эффективна в 51%. Изучается комбинация Кампто и Митомицина.
Кселода (Капецитабин, F. Hoffmann–La Roche) – противоопухолевый препарат нового класса, который превращается в активную форму непосредственно в опухоли, что обеспечивает высокую эффективность и низкую токсичность. Кселода при приеме внутрь хорошо всасывается в кишечнике, проходит ряд преобразований в печени, и конечный продукт (5–фторурацил) образуется в опухолевой ткани под действием фермента тимидинфосфорилазы, которая, в отличие от нормальной ткани, в значительно большем количестве содержится в опухолях молочной железы, толстой кишки, желудка, яичников, шейки матки, почки, мочевого пузыря.
Рекомендовано 2 режима приема препарата: ежедневно непрерывно по 1330 мг/м 2 /день (в 2 приема), или в течение 2 нед по 2500 мг/м 2 /день с перерывом 1 нед. Большинство авторов предпочитают второй режим, некоторые считают, что снижение дозы до 2000 мг/м 2 /день улучшает переносимость препарата при неизменном эффекте.
Основные побочные явления: диарея, мукозиты, тошнота/рвота, ладонно–подошвенный синдром. Тяжелые реакции (III–IV степени) редки. Коррекция доз Кселоды позволяет продолжить лечение эффективно и безопасно при сохранении хорошего качества жизни.
Экспериментально показан синергизм Кселоды с различными цитостатиками – Циклофосфаном, Адриамицином, таксанами, Метотрексатом, Митомицином Ц. Один из механизмов потенцирования эффекта – стимуляция синтеза тимидинфосфорилазы в опухоли.
Проведено сравнительное изучение монотерапии Кселодой и комбинации ЦМФ (Циклофосфан, Метотрексат, 5–фторурацил) у ранее не получавших терапии больных с метастазами рака молочной железы. Эффект отмечен у 30% больных, получавших Кселоду (режим ЦМФ был эффективен у 16% больных).
У больных с антрациклин–резистентным раком молочной железы Кселода была эффективнее, чем Таксол, и объективный эффект составил 36% и 21%, соответственно. При этом нейтропения отмечалась значительно реже при лечении Кселодой, чем при химиотерапии Таксолом или в режиме ЦМФ.
Высокая эффективность Кселоды показана во II–III линиях лечения метастатического рака молочной железы, причем 100% больных ранее получали таксаны, 91% – антрациклины. Объективный эффект достигнут у 20% больных, у 41% – стабилизация. Медиана выживаемости составила 12,8 мес.
В настоящее время разработаны и исследуются комбинации Кселоды с антрациклинами, таксанами, препаратами платины, Герцептином.
Высокая эффективность Кселоды показана при метастатическом колоректальном раке. В рандомизированном исследовании, включавшем 1207 больных, Кселода была эффективнее, чем стандартный режим Мэйо (5–фторурацил + Лейковорин). Объективный эффект составил соответственно 22,4% и 13,2%. Открыто крупное исследование по сравнительному изучению Кселоды и режима Мэйо в адъювантном применении. Разрабатываются комбинации Кселоды с Кампто, Оксалиплатином, лучевой терапией.
Одним из новых и перспективных препаратов – производных платины является Оксалиплатин (Eloxatin, Sanofi–Synthelabo) – платино–содержащий препарат III поколения.
По результатам I фазы исследований Оксалиплатин был рекомендован для последующего изучения в дозе 130 мг/м 2 , 1 раз в 3 нед или 85 мг/м 2 каждые 2 нед, в виде инфузий продолжительностью от 2 до 6 часов.
Токсичность препарата – развитие специфической нейропатии, умеренной миелотоксичности, редко – гастроинтестинальной. В отличие от Цисплатина Оксалиплатин не вызывает почечной и ототоксичности.
Специфическая нейропатия является кумулятивной и становится выраженной при достижении дозы в 1200 мг/м 2 . После отмены препарата эти нарушения обычно проходят. Также одним из проявлений нейротоксичности является ларингоспазм. Гастроинтестинальная и миелотоксичность обычно умеренно выражены (I–II степень).
Объективный эффект Оксалиплатина в I линии распространенного колоректального рака составил от 20 до 24%. Комбинация Оксалиплатин + 5–фторурацил/Лейковорин (5ФУ/ЛВ), основанная на данных о синергизме препаратов, позволила достичь значительного увеличения эффективности. В большом сравнительном исследовании, включившим 207 пациентов, объективный эффект составил 50,7% против 16% у получавших стандартную терапию 5–ФУ/ЛВ.
При применении Оксалиплатина во II линии объективный эффект был отмечен в 10–11%, длительные стабилизации – в 31–42%.
Также показана 13–40% эффективность лечения Оксалиплатином + 5ФУ/ЛВ у больных с прогрессированием после 5–фторурацила.
В настоящее время изучаются сочетания Оксалиплатина и Кампто, Томудекса, Кселоды и других препаратов.
Другой опухолью, при которой Оксалиплатин показал высокую эффективность, является рак яичников. Эффективность Оксалиплатина/Циклофосфана в I линии терапии была сравнима в Цисплатином/Циклофосфаном (33% и 42% соответственно) при одинаковом времени до прогрессирования (13 мес) и близкой средней выживаемости (36 и 25 мес).
Во II линии терапии у пациентов, отвечавших на Цисплатин–содержащие режимы, объективный ответ составил 42%, в то время как у резистентных к Цисплатину – 14%.
Изучаются комбинации Оксалиплатина и Таксола, Оксалиплатина и Цисплатина во II линии лечения резистентных к Цисплатину больных. Эффективность лечения достигает 40–73%.
Проводятся широкие исследования по изучению эффективности Оксалиплатина в монотерапии и в комбинации при других опухолях, таких как рак молочной железы, рак простаты, злокачественная мезотелиома, мелкоклеточный и немелкоклеточный рак легкого и др.
Достижения в области изучения фундаментальных механизмов канцерогенеза позволили создать высокоэффективные противоопухолевые препараты направленного действия. Использование в повседневной клинической практике новых противоопухолевых препаратов значительно повысило эффективность терапии, улучшило качество жизни онкологических больных. В настоящее время изучается множество противоопухолевых препаратов, избирательно действующих на процессы роста и прогрессии опухоли, которые в недалеком будущем смогут принципиально изменить результаты лечения.
1. Новые противоопухолевые препараты в лечении рака. Сборник трудов Европейской школы по онкологии. Москва, 1999.
2. Oxaliplatin. // Drugs, 2000; 60(4): 895–924.
3. Treatment of Solid Tumors: A Clinical Update of Gemzar and MTA. Ely Lilly ONCOLOGY. 2000.
4. Seminars in Oncology Vol 26, N 4, Suppl 12, 1999.
5. Campto. Official abstracts from the 23rd European Society for Medical Oncology Congress. Athens, November 6–10, 1998.
Читайте также:

