Комбинированное лечение рака гортани
Опыт лечения больных раком гортани показал, что при поражении преддверия гортани, особенно при распространении процесса за пределы гортани, чисто хирургический метод лечения не обеспечивает благоприятных результатов. После обширных хирургических операций при локализации опухоли в тех отделах гортани, в которых значительно развита лимфатическая сеть, часто в послеоперационном периоде возникают метастазы и рецидивы опухоли. Одно же лучевое лечение больных раком преддверия и подсвязочного отдела гортани также дает менее стойкие результаты, чем при опухолях истинных голосовых связок. Поэтому в настоящее время общепризнано, что наиболее эффективным является комбинированный метод лечения больных раком гортани, т. е. сочетание хирургического метода лечения с лучевой терапией.
Методика комбинированного лечения, разработанная в Онкологическом институте имени П. А. Герцена, состоит прежде всего в том, что на опухоль воздействуют икс-или гамма-излучением, с целью подавления ее роста и уменьшения ее объема, а затем (через 4—6 недель по окончании облучения) прибегают к оперативному вмешательству, полностью удаляя гортань после стихания острых послелучевых реакций на коже и слизистой оболочке. Следует отметить, что после рентгено- илителегамматерапии возможность частичной резекции гортани ограничена ввиду опасности возникновения тяжелой формы хондронекроза.
При опухолях, суживающих просвет гортани и затрудняющих дыхание, что чаще наблюдается при подсвязочной локализации, а также при хорошо подвижных метастатических лимфатических узлах или перихондрите хрящей гортани, во избежание перехода процесса в IV стадию, облучение производят после расширенного удаления гортани. Предварительно намеченный план комбинированного лечения с соблюдением указанных сроков, к сожалению, иногда приходится нарушать либо вследствие запоздалой явки больного для проведения второго этапа лечения, либо в связи со стойкими реакциями и осложнениями после облучения, заставляющими откладывать операцию. Иногда лучевое лечение лучше проводить в два приема: половину дозы давать до операции и половину после нее. К этому прибегают, когда в процессе лучевого лечения появляется опасность возникновения лучевых осложнений или выявляется его безрезультатность.
При раке преддверия гортани основным методом лечения является комбинированный, который чаще других приводит к непосредственному излечению и дает хорошие отдаленные результаты. В настоящее время его применяют не только при ограниченных, рано диагностированных опухолях, но и при запущенных, перешедших за пределы гортани. При I и II стадиях ракового поражения этой области не исключена возможность стойкого излечения путем только лучевой терапии. При III стадии распространения процесса сразу же планируется комбинированное лечение. Если после лучевого лечения выясняется, что опухоль мало чувствительна к лучам, что чаще всего бывает при эндофитном росте и локализации ее в гортанном желудочке, то через месяц после облучения необходимо полностью удалить гортань вместе с подъязычной костью и прилежащими тканями, захваченными процессом.
При изолированном поражении свободного отдела надгортанника, если после предоперационного лучевого лечения остается опухоль, можно применять резекцию пораженных опухолью частей гортани, сохраняя ее функции (горизонтальная резекция преддверия гортани).
Для лечения рака истинных голосовых связок в I и II стадиях распространения опухоли одинаково эффективны как лучевой, так и хирургический способ лечения. Преимуществом лучевой терапии является сохранение функций гортани, однако при безуспешности этого метода чаще всего и в этих стадиях заболевания приходится позднее полностью удалять гортань. При I стадии с локализацией опухоли на истинной голосовой связке можно производить тиреофиссуру с последующей электрокоагуляцией опухоли; при II стадии — частичные резекции пораженных раком отделов гортани, сохраняя заднюю ее стенку, т. е. фронтально-латеральную резекцию по Отану; при III стадии рака среднего отдела гортани, неподвижности голосовой связки и распространении опухоли на перстне-черпаловидный сустав, щитовидный хрящ, преддверие или подсвязочный отдел гортани чаще применяют комбинированное лечение, начинающееся с лучевой терапии. При строго одностороннем поражении опухолью производится в виде исключения половинная резекция по Глюку, но без предварительного облучения.
При I и II стадиях рака подсвязочного отдела производят частичную резекцию гортани, но допустима и лучевая терапия как самостоятельный метод. При I стадии, если опухоль локализуется под одной из истинных голосовых связок и не доходит до передней комиссуры и голосового отростка черпаловидного хряща, операцию производят через ларингофиссуру. Пораженную часть гортани резецируют в пределах здоровых тканей, захватывая соответствующие отделы перстневидного и щитовидного хрящей. При II стадии с распространением опухоли под обеими голосовыми связками и передней комиссурой, но не достигающей голосовых отростков черпа-ловидных хрящей, пораженную часть гортани резецируют по типу операции Отана, захватывая передние отделы перстневидного и щитовидного хрящей. При III стадии, часто сопровождающейся стенозом и перихондри-том хрящей гортани, применяют ларингэктомию, а через 10—15 дней после операции рентгенотерапию. Однако, согласно опыту ЛОРотделений Онкологического института имени П. А. Герцена и МОНИКИ, лучшие результаты дает комбинированный метод с предоперационной лучевой терапией и при условии точного соблюдения сроков лечения, т. е. проведении второго этапа (хирургического вмешательства) через 1—2 месяца после окончания облучения.
При IV стадии рака гортани радикальное лечение, как хирургическое, так и лучевое, нецелесообразно; рекомендуется только симптоматическое лечение в виде трахеостомии, гастростомии, перевязки сосудов при кровотечениях, широкого применения антибиотиков, наркотических средств.
При рецидивах опухоли после лучевой терапии применяют хирургическое лечение, обычно полностью удаляя гортань; частичная резекция гортани в таких случаях проводится лишь иногда в I и II стадии процесса, причем она наиболее эффективна при локализации опухоли на истинных голосовых связках. Иногда проводят и повторное облучение, но оно часто способствует возникновению осложнений, препятствующих проведению хирургических вмешательств; к тому же рецидив обычно менее чувствителен к лучам.
При рецидивах после одного хирургического лечения часто оказывает положительное действие лучевая терапия. Если после частичной резекции гортани опухоль рецидивирует, то следует применить комбинированный метод лечения, т. е. рентгенотерапию с последующим полным удалением гортани по схеме, применяемой в III стадии заболевания.
При рецидивах после комбинированного лечения повторная лучевая терапия в большинстве случаев неэффективна и даже может вызвать ухудшение. У большинства больных такие рецидивы следует расценивать как IV стадию заболевания, при которой возможно лишь симптоматическое лечение. Только у некоторых больных, лечившихся комбинированным методом, рецидивировавшая опухоль иногда уменьшается или совсем исчезает после применения телегамматерапии или внутритканевого введения коллоидного радиоактивного золота Au198 (M. И. Светлаков). Однако стойкое излечение этих больных наступает редко, в том числе и тех, у которых ограниченный рецидив опухоли, возникший в области срединного кожного рубца, был немедленно и достаточно широко удален, но все же иногда можно сделать попытку оперативного удаления рецидива как паллиативного лечения.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Представлены 2-летние результаты комбинированного лечения 24 больных раком гортани и гортаноглотки III–IV (T3N0–1M0) стадий. На первом этапе всем пациентам проводилась дистанционная лучевая терапия на фоне локальной гипертермии (ЛГ) в качестве радиомодификатора. При выраженной регрессии опухолевого процесса, которая оценивалась на дозе 40,0 Гр, лучевая терапия продолжалась по радикальной программе до СОД 66,0 Гр в сочетании с локальной гипертермией (всего 12 сеансов). Наличие трахеостомы у больных не препятствовало проведению ЛГ. Больным с частичной регрессией или стабилизацией опухолевого процесса (n=19) выполнялся хирургический этап комбинированного лечения, в 36,8 % осуществлены органосохраняющие операции. Морфологическое исследование операционного материала показало, что у 10 (53 %) больных отмечался лечебный патоморфоз IV степени, у 4 (21 %) – III степени. Все больные, включенные в исследование, живы и находятся под динамическим наблюдением от 6 до 29 мес, медиана выживаемости – 13,5 мес. Таким образом, применение локальной гипертермии в качестве радиомодификации лучевой терапии у больных раком гортани и гортаноглотки позволяет улучшить непосредственные результаты лечения, не увеличивая лучевую нагрузку на организм больного.
Чойнзонов Евгений Лхамацыренович, академик РАН, доктор медицинских наук, директор Томского НИИ онкологии.
E-mail: nii@oncology.tomsk.ru. SPIN-код: 2240-8730.
Мухамедов Марат Рафкатович, доктор медицинских наук, ведущий научный сотрудник отделения опухолей головы и шеи Томского НИИ онкологии.
E-mail: muhamedov@oncology.tomsk.ru. SPIN-код: 6780-1498.
Старцева Жанна Александровна, доктор медицинских наук, руководитель отделения радиологии.
E-mail: zhanna.alex@rambler.ru. SPIN-код: 8121-0310.
Спивакова Ирина Олеговна, очный аспирант, отделение опухолей головы и шеи.
E-mail: irensp2005@ mail.ru. SPIN-код: 5877-5820.
Черемисина Ольга Владимировна, доктор медицинских наук, заведующая эндоскопическим отделением.
E-mail: СheremisinaOV@oncology.tomsk.ru. SPIN-код: 9579-2691.
Васильев Николай Вольтович, кандидат медицинских наук, старший научный сотрудник лаборатории патологической анатомии и цитологии.
E-mail: vasilievasn@yandex.ru. SPIN-код: 1627-5226.
Грибова Ольга Вячеславовна, кандидат медицинских наук, научный сотрудник отделения радиологии.
E-mail: gribova79@mail.ru. SPIN-код: 1405-1669.
1. Каприн А.Д., Старинский В.В., Петрова Г.В. Злокачественные новообразования в России в 2012 году (заболеваемость и смертность). М., 2014. 250 с.
2. Кицманюк З.Д., Чойнзонов Е.Л., Мусабаева Л.И., Новиков В.А. Тактика лечения рака гортани на современном этапе // Сибирский онкологический журнал. 2003. № 2. С. 3–11.
3. Мухамедов М.Р., Чойнзонов Е.Л., Гюнтер В.Э., Черемисина О.В., Лукьянов В.Д., Мядзель А.А., Шинкарев С.А., Коренев А.А., Васильев Н.В., Цветаев В.А., Кульбакин Д.Е. Использование биоадаптированных имплантатов на основе никелида титана в хирургической реабилитации больных раком гортани (результаты десятилетнего кооперированного исследования // Вестник РОНЦ им. Н. Н. Блохина РАМН. 2010. Т. 21, № 1. С. 65–70.
4. Подвязников С.О., Чойнзонов Е.Л., Кропотов М.А., Кожанов Л.Г., Пустынский И.Н., Письменный В.И., Алиева С.Б., Акетова Т.А., Таболиновская Т.Д. Диагностика и лечение рака гортаноглотки. Клинические рекомендации // Сибирский онкологический журнал. 2014. № 6. С. 71–75.
5. Чижевская С.Ю., Чойнзонов Е.Л., Балацкая Л.Н. Качество жизни больных раком гортани и гортаноглотки на этапах комбинированного лечения и в отдаленные сроки // Сибирский онкологический журнал. 2015. № 2. С. 15–22.
6. Чижевская С.Ю., Чойнзонов Е.Л. Современные возможности и перспективы комбинированного лечения рака гортани и гортаноглотки // Сибирский онкологический журнал. 2007. № 4. С. 127–132.
7. Чойнзонов Е.Л., Старцева Ж.А., Мухамедов М.Р., Спивакова И.О., Черемисина О.В., Грибова О.В., Кульбакин Д.Е., Суркова П.В. Локальная гипертермия в комбинированном лечении рака гортани и гортаноглотки // Сибирский онкологический журнал. 2014. № 5. С. 5–12.
8. Чойнзонов Е.Л., Балацкая Л.Н., Мухамедов М.Р. Рак гортани. Современные аспекты лечения и реабилитации. Томск, 2008. 276 с.
9. Чойнзонов Е.Л., Балацкая Л.Н. Качество жизни онкологических больных. Томск, 2011. 152 с.
10. Genden E.M., Ferlito A., Rinaldo A., Silver C.E., Fagan J.J., Suárez C., Langendijk J.A., Lefebvre J.L., Bradley P.J., Leemans C.R., Chen A.Y., Jose J., Wolf G.T. Recent changes in the treatment of patients with advanced laryngeal cancer // Head Neck. 2008. Vol. 30 (1). P. 103–110.
11. Nakahara R., Kodaira T., Furutani K., Tachibana H., Tomita N., Inokuchi H., Mizoguchi N., Goto Y., Ito Y., Naganawa S. Treatment outcomes of definitive chemoradiotherapy for patients with hypopharyngeal cancer // J. Radiat. Res. 2012. Vol. 53 (6). P. 906–915. doi: 10.1093/jrr/rrs052.
Чойнзонов Е.Л., Мухамедов М.Р., Старцева Ж.А., Спивакова И.О., Черемисина О.В., Васильев Н.В., Грибова О.В. КОМБИНИРОВАННОЕ ЛЕЧЕНИЕ МЕСТНОРАСПРОСТРАНЕННОГО РАКА ГОРТАНИ И ГОРТАНОГЛОТКИ С ПРИМЕНЕНИЕМ ЛОКАЛЬНОЙ ГИПЕРТЕРМИИ. Сибирский онкологический журнал. 2015;(6):13-18.
Choynzonov E.L., Mukhamedov M.R., Startseva Z.A., Spivakova I.O., Cheremisina O.V., Vasilyev N.V., Gribova O.V. COMBINED MODALITY TREATMENT INCLUDING LOCAL HYPERTHERMIA IN PATIENTS WITH LOCALLY-ADVANCED LARYNGEAL AND LARYNGOPHARYNGEAL CANCER. Siberian journal of oncology. 2015;(6):13-18. (In Russ.)

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
Междисциплинарное обследование пациентов с раком гортани включает консультацию онколога-радиолога. Рак голосовой щели ранних стадий очень редко мета-стазирует в регионарные лимфоузлы, поэтому у таких пациентов можно использовать лишь один метод воздействия, которым с полным правом может быть лучевая терапия. Лучевая терапия имеет свои преимущества, к которым относятся неинвазивность, приемлемое сохранение голосовой функции, превосходный контроль местного опухолевого роста.
У пациентов с заболеванием на ранней стадии обычно удается достичь превосходных функциональных результатов, а побочные эффекты носят временный характер (ксеростомия, мукозит, дисфагия, местные воспалительные реакции). Благодаря совершенствованию методов лучевой терапии, а именно изобретению лучевой терапии модулированной интенсивности (ЛТМИ), при низком риске регионарных метастазов возможно подвергать облучению лишь саму гортань, избегая поражения других органов головы и шеи.
И хотя качество голоса после лучевой терапии почти всегда ухудшается, у большинства пациентов с раком ранних стадий голос возвращается до почти нормального уровня в течение года после завершения лучевой терапии. Использование лучевой терапии при опухолях Т1 стадии позволяет добиться подавления опухолевого роста в 90% случаев. Показатели при опухолях стадии > Т2 не столь впечатляющие, но тоже приемлемые (80%). Следует отметить, что, согласно опубликованным данным, в случаях поражения передней комиссуры первичное лечение при помощи лучевой терапии обычно менее эффективно.
Использование лучевой терапии на ранних стадиях рака надскладочного отдела также позволяет добиться подавления опухолевого роста в 90% случаев. Поскольку надскладочный отдел имеет более богатую сеть лимфатических сосудов, доза облучения, получаемая пациентами, выше, чем при опухолях складочного отдела, т.к. воздействовать необходимо и на лимфоузлы шеи.
Конкретные алгоритмы лечения в каждом учреждении разные, может использоваться как однократное каждодневное облучение, так и курсы гиперфракционирования или ускоренные схемы.
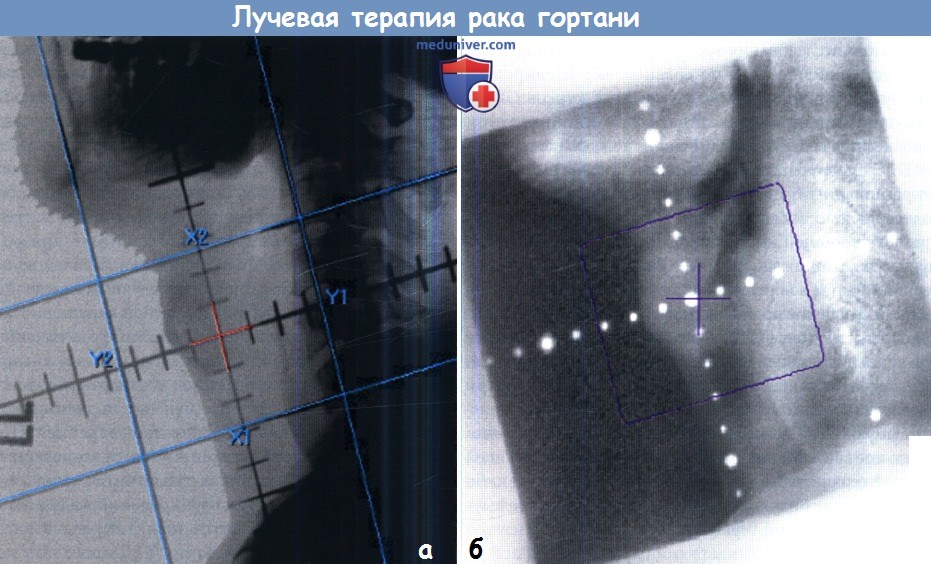
Рак гортани ранней стадии, локализующийся в области голосовой щели.
Двухмерная техника с использованием противоположных латеральных полей. Верхняя и нижняя границы устанавливаются с учетом подвижности гортани, которая будет отмечаться во время лечения.
Обратите внимание на то, что лимфоузлы не облучаются.
Запущенные формы рака гортани (III и IV) традиционно лечились хирургически с возможной послеоперационной лучевой терапией, однако положение дел изменила публикация фундаментального исследования рака гортани, выполненное в 1991 году исследовательской группой Американского министерства по делам ветеранов, согласно которому индукционная химиотерапия с последующей лучевой терапией позволяет добиться лучшего сохранения функций гортани, не снижая при этом показатели выживаемости. За последние 20 лет химиолучевая терапия в лечении распространенных форм рака гортани стала использоваться гораздо чаще.
Изменение протокола внесло и свои недостатки, поскольку интенсивная химиолучевая терапия сопровождается развитием серьезных побочных эффектов, к которым относятся длительная дисфагия и ксеростомия. Использование больших доз облучения увеличивает риск развития тяжелых осложнений, например, остераднекроза гортани, который может потребовать трахеотомии и даже ларингэктомии даже при отсутствии рецидива опухолевого роста. Одновременно с описанным выше поворотом в подходах к лечению, Hoffman и соавт., проанализировав данные Национальной базы данных по онкологическим заболеваниям (National Cancer Data Base), отметили снижение выживаемости пациентов с раком гортани на протяжении 1985-2001 годов.
Причины данного спада в выживаемости до конца не ясны. Согласно современным рекомендациям Американского сообщества клинических онкологов, у всех пациентов с раком гортани Т1-Т2 рекомендуется использовать органосохраняющие методы лечения (как хирургические, так и нехирургические). У пациентов с опухолями Т3 и Т4, не прорастающими через хрящи гортани в мягкие ткани, допустима органосохраняющая химиолучевая терапия. Могут использоваться либо неоадъювантная химиотерапия с последующей химиолучевой терапией, либо модифицированные схемы химиолучевой терапии. Выбор химиопрепаратов достаточно широк, от традиционных препаратов платины (цисплатин), до моноклональных антител и антагонистов рецепторов эпителиального фактора роста (цетуксимаб).
При выборе между послеоперационной лучевой или химиолучевой терапией необходимо учитывать несколько факторов. Во-первых, определяется распространение процесса (положительные или неясные края резекции опухоли, инвазия в кровеносную или лимфатическую систему, внеларингеальный рост). Также необходимо оценить наличие метастазов в лимфоузлы шеи. Назначение адъювантного лечения проводится совместно с онкологами.
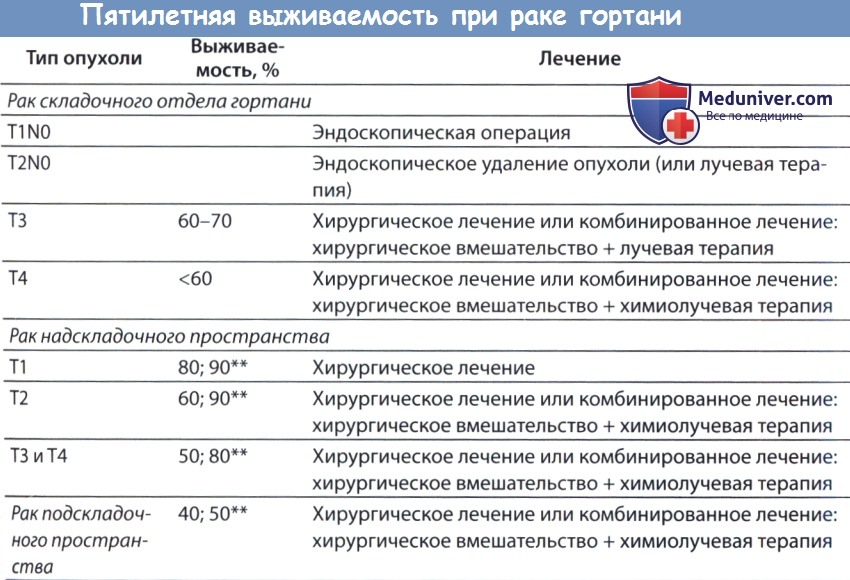
* Выживаемость существенно снижается, если регионарные лимфатические узлы поражены метастазами;
если пораженные лимфатические узлы неподвижны, то снижение выживаемости еще более значительное.
** Первое значение указывает на безрецидивную выживаемость, второе значение - на общую выживаемость.
Ключевые моменты:
• Тщательное предоперационное обследование пациента имеет решающее значение. Постановка меньшей, чем есть на самом деле, стадии заболевания может привести к неблагоприятному исходу лечения, срыву планируемой операции. Особенно важно оценивать распространение опухоли в область передней комиссуры и подсвязочного отдела.
• Необходимо учитывать особенности лимфоттока от надсвязочного отдела гортани. Селективное воздействие на лимфоузлы шеи должно проводиться даже у пациентов с ранними формами рака надсвязочного отдела.
• Существует множество различных методов лечения рака гортани. Лечение планируется индивидуально, с учетом особенностей течения опухолевого процесса, возможностей пациента по активному участию в процессах реабилитации. Не существует метода лечения, который подошел бы всем без исключения.
• Плоскоклеточный рак является самым часто встречающимся злокачественным новообразованием гортани. Тем не менее, обследуя некурящего пациента с малым числом факторов риска, необходимо помнить о доброкачественных и системных заболеваниях, способных имитировать рак гортани. К результатам экспресс-методов биопсии с использованием свежезамороженного материала следует относиться критично. Окончательный диагноз ставится после полноценного хирургического вмешательства.
- Вернуться в оглавление раздела "отоларингология"

Весь контент iLive проверяется медицинскими экспертами, чтобы обеспечить максимально возможную точность и соответствие фактам.
У нас есть строгие правила по выбору источников информации и мы ссылаемся только на авторитетные сайты, академические исследовательские институты и, по возможности, доказанные медицинские исследования. Обратите внимание, что цифры в скобках ([1], [2] и т. д.) являются интерактивными ссылками на такие исследования.
Если вы считаете, что какой-либо из наших материалов является неточным, устаревшим или иным образом сомнительным, выберите его и нажмите Ctrl + Enter.
Показания к госпитализации
Рак гортани или подозрение на него являются показаниями к госпитализации.
Цели лечения рака гортани
Особенность планирования лечения рака гортани состоит в том, что необходимо не только излечить больного, но и восстановить голосовую, дыхательную и защитную функции гортани. На ранних стадиях заболевания полного выздоровления можно добиться с помощью лучевой терапии, органосохраняющих операций или сочетания этих методов.
Не следует догматически подходить к выполнению первоначального плана лечения. В процессе лучевой терапии выявляют одну из наиболее существенных характеристик опухоли - радиочувствительность. В зависимости от её выраженности производят коррекцию первоначального плана лечения.
Планирование лечения необходимо проводить на консилиумах хирургов, лучевых терапевтов, химиотерапевтов. При необходимости для участия в консилиуме приглашают эндоскопистов, рентгенологов и патоморфологов. Для обсуждения плана лечения необходимо располагать информацией о локализации опухоли в гортани, её границах, распространении на соседние отделы, преднадгортанниковое и околоскладочное пространство, форме роста, особенностях гистологического строения и морфологической дифференцировке. В процессе лечения к этим критериям добавляют информацию о радиочувствительности опухоли, оценивая степень уменьшения новообразования в процессе лучевой терапии. При биопсии после предоперационной лучевой терапии или микроскопического исследования после хирургического вмешательства правильность оценки этого критерия может быть проконтролирована при определении степени лучевого патоморфоза опухоли.
Немедикаментозное лечение рака гортани
Рак среднего отдела гортани Т1-Т2 обладает высокой радиочувствительностью, поэтому лечение начинают с лучевой терапии. Лучевое лечение в предоперационном периоде (доза облучения 35-40 Гр) не ухудшает заживление тканей, если после него выполняют операцию. В тех случаях, когда степень уменьшения опухоли больше 50% её первоначального объема, а остаток небольшой, через 2 нед продолжают лучевую терапию до достижения терапевтической дозы (60-65 Гр). С помощью морфологических исследований было показано, что через 3-4 нед после предоперационной дозы лучевой терапии опухоль начинает восстанавливаться за счёт радиорезистентных клеток: тем самым нивелируется предоперационный эффект лучевой терапии. В связи с этим интервал между этапами лечения не должен превышать 2 нед.
Следует отметить, что хирургическое вмешательство, выполняемое после полной дозы лучевой терапии, чревато опасностью развития послеоперационных осложнений, приводящих к образованию свищей, аррозий магистральных сосудов, существенно пролонгирующих послеоперационный период и затрудняющих его ведение.
При лечении рака голосовых складок Т1-Т2 лучевую терапию проводят с двух встречных полей под углом 90°: высота поля составляет 8 см, ширина - 6 см. При наличии регионарных метастазов можно рекомендовать поля, направленные сзади наперёд под углом 110°.
Вместо методик классического фракционирования дозы (по 2 Гр 5 раз в неделю)
В настоящее время применяют более эффективную методику дробления дозы на 3,3 Гр (по 1,65 Гр с каждого поля) 3 раза а неделю. Используя эту методику, можно за 10 лечебных сеансов в течение 22 дней поднести к опухоли дозу 33 Гр, эквивалентную по эффективности 40 Гp. При продолжении лучевой терапии по радикальной программе на 2-м этапе подводят к опухоли еще 25Гр. При этом используют классическое фракционирование дозы по 2 Гр 5 раз в неделю как более щадящее. Это позволяет избежать повреждении хрящей и развития хондроперихондрита.
Помимо лучевой терапии, проводимой в обычных условиях (в воздухе), разработан метод лучевой терапии в условиях гипербарической оксигенации. Преимуществами этого метода при предоперационном облучении считают усиление лучевого повреждения опухоли, уменьшение лучевого повреждения нормальных тканей, включенных в объём облучения, снижение частоты лучевых эпителиитов.
Использование гипербарической оксигенации позволило снизить при предоперационном облучении суммарную очаговую дозу до 23,1 Гр (7 сеансов по 3,3 Гр>, что эквивалентно 30 Гр при классическом фракционировании в тех случаях, когда изначально планируют комбинированное лечение с выполнением резекции гортани. Морфологическое изучение лучевого патоморфоза показало, что III степень патоморфоза у этих больных была в 2 раза выше, чем после подведения 33 Гр в воздухе. Подобные наблюдения послужили основанием для расширения показаний к самостоятельной лучевой терапии в условиях гипербарической оксигенации по радикальной программе.
При раке вестибулярного отдела гортани Т1-Т2 лечение следует начинать с лучевой терапии. Верхнюю границу поля облучения поднимают выше горизонтальной ветви нижней челюсти на 1,5-2 см. Методика фракционирования дозы и уровень суммарных очаговых доз при предоперационной лучевой терапии и облучении по радикальной программе для всех отделов гортани идентичны. Если после лучевой терапии в предоперационной дозе (40 Гр) опухоль уменьшается незначително (менее чем на 50%), то выполняют горизонтальную резекцию гортани.
Лечение рака вестибулярного отдела гортани ТЗ-Т4 начинают с химиотерапии. После 2 курсов химиотерапии проводят лучевую терапию в предоперационной дозе.
Окончательную тактику лечения определяют после подведения к опухоли дозы облучения 40 Гр. Больному выполняют резекцию гортани, если остаточная опухоль имеет небольшие размеры, и ларингэктомию при больших размерах опухоли, локализующиеся в области передней комиссуры, подкомиссуральной области, гортанного желудочка, черпаловидного хряща обычно радиорезистентны. Обнаружение поражения этих отделов гортани считают веским аргументом и пользу операции.
При раке подголосового отдела гортани ТТ-Т2 лечение также начинают с лучевой терапии. Её результаты оценивают после предоперационной дозы облучения 40 Гр. При уменьшении опухоли менее чем на 50% выполняют хирургическое вмешательство.
Зоны регионарного метастазирования включают в поле облучения при пред- или послеоперационной лучевой терапии по поводу рака гортани.
Наличие трахеостомы не является препятствием к проведению лучевой терапии: её включают в поле облучения.
Медикаментозное лечение рака гортани
Химиотерапию проводят больным распространённым раком надголосового отдела гортани (поражение корня языка, гортаноглотки, мягких тканей шеи). При раке подголосового и голосового отделов гортани химиотерапия малоэффективна.
Неоадъювантная химиотерапии состоит из 2 идентичных курсов с перерывами в 1 день между ними. Каждый блок включает:
- 1-й день. Циспластин в дозе 75 мг/м 2 на фоне гипергидратации и форсированного диуреза.
- на 2-5-е сутки фторурацил в дозе 750 мг/м 2 .
Хирургическое лечение рака гортани
При выявлении радиорезистентности рака среднего отдела Т1-Т2 на 2-м этапе лечения после предоперационной лучевой терапии в дозе 40 Гр (в воздухе) выполняют органосохраняющую операцию. При раке голосового отдела гортани, если опухоль не распространяется на переднюю комиссуру и черпаловидный хрящ, выполняют боковую резекцию гортани. Если опухоль распространяется на переднюю комиссуру, производят переднебоковую резекцию . Следует отметить, что хирургический метод (резекция гортани) в качестве самостоятельного даёт сопоставимые результаты. Однако в этом случае исключена возможность излечения больного без операции с помощью лучевой терапии, при которой можно сохранить хорошее качество голоса.
При раке среднего отдела гортани ТЗ-Т4 на 1-м этапе проводят химиолучевое или лучевое лечение, на заключительном-ларингэктомию. В последние годы разработаны методики органосохраняющих операций операций при раке ТЗ, однако их выполняют по строгим показаниям. Излечение рака ТЗ с помощью лучевой терапии возможно только у 5-20% больных.
Разработана методика резекции гортани при ТЗ с эндопротезированием.
Показания к операции:
- поражение с одной стороны с переходом на переднюю комиссуру и другую сторону более чем на 1/3 при сохранении черпаловидных хрящей;
- поражение трёх отделов гортани с одной стороны с инфильтрацией подголосового отдела, требующее резекции перстневидного хряща.
Во избежание рубцового сужения гортани её просвет формируют на трубчатом протезе, изготовленном на основе винилпирролидона и акрилатон, пропитанных антисептиком, или из медицинского силикона. Через 3-4 нед после фор мирования каркаса просвета резецированной гортани протез удаляют через рот.
При раковой опухоли подголосового отдела гортани ТЗ-Т4 предоперационную лучевую терапию не проводят, т.к. у больных выражен стеноз просвета гортани до начала лечения или велика опасность его развития в процессе лучевой терапии Лечение начинают с ларингэктомии с 5-6 кольцами трахеи. Лучевую терапию проводят в послеоперационном периоде.
Основным методом лечения рецидивов рака гортани считают хирургического вмешательство. В зависимости от степени распространения опухоли, формы роста, морфологической дифференцировки планируют объём операции (от резекции до ларингэктомии).
Превентивные операции (при отсутствии пальпируемых и определяемых при УЗИ метастазов) выполняют при глубоком эндофитном росте опухоли с разрушением хрящей гортани, при распространении опухолей на гортаноглотку, щитовидную железу и трахею.
При наличии регионарных метастазов выполняют фасциально-футлярное иссечение лимфатических узлов и клетчатки шеи. При прорастании опухоли во внутреннюю ярёмную вену или грудино-ключично-сосцевидную мышцу резецируют эти анатомические структуры (операция Крайля). При обнаружении у больного раком гортани единичных метастазов в лёгких и печени решают вопрос о возможности их удаления.
Дальнейшее ведение
После проведённого консервативного и хирургического лечения больным необходимо тщательное регулярное и длительное наблюдение. Режим наблюдении и первые полгода - ежемесячно, во вторые полгода - через 1,5-2 мес; на 2-Й год - через 3-4 мес, на 3-5-й годы - через 4-6 мес.
Потеря голосовой функции после ларингэктомии - одна из частых причин отказа больных от этой операции. В настоящее время широкое распространение получил логопедический метод восстановления голосовой функции.
Однако метод имеет ряд недостатков: трудности с освоением методики заглатывания воздуха в пищевод и его выталкивания при фонации, небольшой пищевода (180-200 мл) в качестве резервуара для воздуха, гипертонии или спазм сжимателей глотки. При использовании этого метода хорошего качества голоса можно добиться у 44-60% пациентов.
Этих недостатков лишен существенно усовершенствованный хирургический метод реабилитации голоса после ларингэктомии. Он основан на принципах спадании шунта между трахеей и пищеводом, через который мощный поток воздуха из лёгких проникает в пищевод и глотку. Поток водуха вытыкает вибрационную активность глоточно-пищеводного сегмента, являющегося генератором голоса. Голосовой протез, помещённый в просвет шунта, пропускает воздух из лёгких в пищевод и препятствует попаданию жидкости и нищи в обратном направлении.
Проведённый акустический анализ выявил большие преимущества трахео-пищеводного голоса (с использованием голосовых протезов) перед пищеводным. С помощью этого метода хорошее качество голоса было достигнуто у 93,3% пациентов.
Таким образом, после операций по поводу рака гортани необходимо восстановление голосовой функции.
Читайте также:

