Клеточная терапия при лечении рака

Работа требует предельной внимательности
Меланома, злокачественное образование кожи, давно и достаточно хорошо изученное врачами-онкологами заболевание. Опухоль обычно лечат хирургическим путем. Как правило, операции проходят успешно, пациенты возвращаются к нормальной жизни. Более того, это направление хирургии не стоит на месте: сейчас в ряде случаев после удаления опухоли даже не остается шрама на теле.
Но рак – заболевание коварное. Бывает, опухоль до удаления успевает дать метастазы, раковые клетки проникают вглубь организма, начинают делиться, захватывая все новые пространства. И это порой приводит к очень печальным последствиям: через какое-то время лет человек вновь серьезно заболевает.
К беде привела обычная родинка
Родинку удалить не удалось, Татьяна чувствовала несильную боль в плече. За компанию с подругой она отправилась к онкологу. Его вердикт был неутешительным: необходимо делать операцию.
Несмотря на хирургическое вмешательство, летом 2011года женщине был поставлен тяжелый диагноз: меланома кожи спины, метастазы в мягкие ткани шеи. Сделали еще две операции, удалив надключичные лимфоузлы. Но болезнь продолжала прогрессировать, достигнув третьей, уже опасной для жизни стадии.
- И тогда врачи нашего института применили разработанную ими новую методику, направленную на усиление иммунной системы самого пациента: ввели в организм клеточную вакцину, - рассказывает пресс-аташе НИИ онкологии имени Н.Н. Петрова Ирина Столярова . – За год провели двенадцать вакцинаций, достигнув очень хорошего результата: опухоль перестала расти. Хотя Татьяна по-прежнему находится под наблюдением наших специалистов, она сейчас может вести привычный для нее образ жизни.
Злокачественные клетки хитры и коварны
…Механизм образования раковых опухолей давно и хорошо известен. Все клетки, за исключением нервных, постоянно делятся. Каждый день появляется определенное количество потенциально раковых, но они быстро вычисляются и уничтожаются иммунной системой. Но защитный механизм нашего организма может дать сбой и упустить момент возникновения раковой клетки. Причины бывают самые разные: связанное с возрастом ослабление иммунитета, радиационное облучение, работа с канцерогенными веществами, вирусы. Так возникает клон быстро размножающихся опасных клеток, не подвластных контролю со стороны организма.
И потому ученые пришли к выводу: для того, чтобы эффективно бороться с онкологическими заболеваниями, нужно научиться восстанавливать иммунную систему пациента. Любопытно, что об этом догадывались врачи еще в позапрошлом веке. В медицинской литературе описывается такой случай. Человек, у которого была обнаружена раковая опухоль, заболел оспой. И опухоль стала исчезать. Вероятно, иммунная система, мобилизовавшись на борьбу с оспой, вновь начала уничтожать злокачественные клетки.
Однако в двадцатом веке появились распространенные сейчас во всем мире методы лечения - хирургический, химиотерапевтический и радиационный. Но, как показывает многолетняя практика, все они, наряду с достоинствами, имеют и серьезные недостатки. И сегодня иммунотерапия, которая начала развиваться на стыке столетий, считается наиболее перспективным направлением в онкологии.
Вакцину делают вручную

Врачи института - за изготовлением вакцины
Заведующая научным отделом онкоиммунологии НИИ имени Петрова доктор медицинских наук Ирина Балдуева прошла путь от медсестры до известного ученого. Она занимается клеточными технологиями уже более двадцати лет.
- Суть разработанной нами методики, которая использовалась для лечения Татьяны Протасевич, других пациентов, такова, - объясняет заведующая отделом. – После предварительной подготовки, детали которой я опускаю, у больного берут кровь, затем ее помещают в специальные флаконы. Через несколько часов клетки, которые используются при изготовлении вакцины, так называемые дендритные клетки, оседают на стенках флакона. После чего их помещают в специальную среду, по составу близкую к той, что существует в организме человека. Это нужно для того, чтобы клетки обрели силу, необходимую для борьбы с метастазами. Процесс продолжается семь дней.
Следующий этап – научить клетки бороться с опухолями. В лаборатории института уже накоплен банк данных так называемых опухолевых антигенов, по сути, злокачественных клеток.
Отметим, что вакцину фактически делают вручную. Это сложная, требующая высокой квалификации работа.
Методика проверена временем
Клеточные технологии применяются не только при лечении меланомы. У пожелавшего остаться неизвестным инженера Г в 2009 году диагностировали хондросаркому правой голени. Говоря простым языком, нашли опухоль в кости. Несмотря на ампутацию ноги – другого выхода не было, метастазы проникли в легкие и ребра.
Пациент пережил еще две сложнейшие операции, но заболевание прогрессировало, достигнув четвертой стадии. Остановить его рост и тем самым спасти больному жизнь помогла начатая в 2011 году вакцинотерапия. Она продолжается и поныне.
Кстати, на первых этапах вакцинация проводится раз в две-три недели. Затем интервал увеличивается до трех месяцев, затем до полугода. При хороших результатах врачи ограничиваются ежегодными профилактическими осмотрами.
В НИИ онкологии иммунотерапию применяют уже на протяжении восьми лет. Чаще всего в сочетании с другими методами лечения. Например, в перерывах между курсами химиотерапии. Однако лишь совсем недавно специалисты пришли к выводу, что клеточные технологии способны существенно помочь онкологическим больным в третьей и четвертой стадии.
- На протяжении пяти и более лет врачи наблюдали за пациентами, которые прошли курс иммунотерапии, - говорит Ирина Столярова. – Подчеркну, что ее применяли к тяжело больным людям. Примерно у 46 процентов из них опухоль перестала расти, либо даже уменьшилась в размерах. В онкологии это считается хорошим результатом.
И что важно: почти все пациенты проходили курс вакцинации бесплатно, поскольку методика входила в финансируемую государством программу высокотехнологичной медицинской помощи. Реальная же стоимость только первого курса колеблется от 140 до 220 тысяч рублей.
Начиная с 2010 года, в НИИ онкологии провели 1585 циклов вакцинотерапии на основе дендритных клеток, лечение получили 203 пациента.
Долгожданный закон
Фармацевтические препараты
Сегодня также существуют фармацевтические препараты, направленные на восстановление иммунной системы. Но они чрезвычайно дороги – стоимость курса может доходить до четырех миллионов рублей, а помогают далеко не всем. Кроме того, эти препараты токсичны, использовать их нужно очень осторожно.
Иммунотерапия рака – прогрессивный метод борьбы с онкологическими опухолями, который стремительно развивается и уже сегодня дает обнадеживающие результаты в борьбе с этим смертельно опасным недугом. Наиболее действенным методом борьбы со злокачественными опухолями является клеточная терапия рака, в которой особое место занимает лечение стволовыми клетками.
О стволовых клетках сегодня говорят много. Введутся научные исследования, призванные подтвердить эффективность применения стволовых клеток практически во всех отраслях медицины, в том числе и в онкологии. И пусть терапия рака при помощи этих клеток еще мало изучена и практически не применяется на людях, ученые возлагают на нее большие надежды. Недаром же сегодня в Израиле, Германии, США и многих других странах создаются центры по имплантации стволовых клеток, где квалифицированные врачи оказывают действенную помощь тем больным онкологией, которым не помогли другие методы лечения. Давайте подробно разберемся в новом методе лечения рака, который в недалеком будущем обещает стать основным средством борьбы с онкологией.

Стволовые клетки – что нужно знать о них
Природа наделила наш организм удивительными способностями, в том числе способностью восстанавливаться. Только задумайтесь, у нас срастаются переломы, восстанавливаются повреждения кожи, отрастают ногти и волосы, проходят болезни. Ключевую роль в процессе регенерации играют так называемые стволовые клетки – недифференцированные (незрелые) клетки организма, которые являются родоначальниками всех клеток и способны превращаться в клетки любых тканей, будь то клетки печени, легких или крови. Стволовыми называют их потому, что они являются как бы стволом, основой, дающей начало побегам дерева жизни. Из этих незрелых клеток образуются зрелые клетки конкретного органа, приходя на смену отмирающим.
Данный процесс обновления наиболее активен у детей, а потому в детском организме количество стволовых клеток наивысшее. А вот с годами этих клеток в организме становится все меньше, чем и объясняется процесс старения организма.
Нужно сказать, что процесс обновления клеток в каждом из органов протекает с разной скоростью. К примеру, клетки роговицы глаза обновляются 2–4 дня, кишечника – 3–5 дней, кожи – 14 дней, а клетки печени и крови – целых 150 дней. Сложнее дело обстоит с клетками сердца, которые обновляются всего дважды за жизнь.
По мнению ученых, открытие стволовых клеток позволит ученым в самом ближайшем будущем выращивать любые органы, начиная от сперматозоидов и клеток сердца, и заканчивая костной и хрящевой тканью. Желудок, печень, легкие – любые из этих органов можно будет вырастить и заменить нуждающемуся больному, решив тем самым проблему трансплантации органов.

Лечение рака стволовыми клетками
Точной причины развития онкологических опухолей науке до настоящего времени выявить не удалось. Тем не менее, доказано, что рак возникает на фоне иммунодефицита, когда иммунных тел недостаточно для того, чтобы обезвредить зарождающиеся клетки опухоли. Подтверждает это и статистика. Согласно данным ВОЗ рак желудка чаще настигает лиц преклонного возраста, у которых активность иммунитета заметно снижена, а лейкемия чаще развивается у детей и подростков, чьи защитные силы организма еще не сформировались.
Именно это легло в основу иммунотерапии онкологических заболеваний, в результате чего научными лабораториями были созданы иммунные препараты, призванные существенно повысить эффективность лечения рака. Введение таких клеточных препаратов в кровоток позволяет существенно увеличить образование здоровых частиц крови (тромбоцитов, эритроцитов и др.), благодаря чему устраняется гипоксия, восстанавливается снабжение тканей кислородом и нормализуется свертываемость крови. Во многих случаях именно такой подход помогает победить лейкемию.
Но есть у стволовых клеток и другое предназначение, а именно, способность восстанавливать организм после химиотерапии. И этот подход уже сегодня активно используется медиками всего мира. Введение незрелых клеток в кровь позволяет применять мощнейшие дозы химиопрепаратов для борьбы с раковыми опухолями, рассчитывая на то, что эти клетки смогут восстановить нанесенный здоровью урон. Такая практика уже более 10 лет применяется в клиниках Германии. Более того, в клинике города Потсдама из стволовых клеток вырастили молочную железу и пересадили ее пациентке, которой в результате раковой опухоли пришлось удалить грудь.
![]()
Виды онкологии, которые можно лечить стволовыми клетками
Нужно заметить, что еще до начала экспериментов со стволовыми клетками ученые активно применяли переливание крови для борьбы с лейкемией. Впоследствии выяснилось, что в этом процессе, как и в случае с пересадкой костного мозга, ключевыми являются незрелые стволовые клетки, которые способствуют синтезу иммунных клеток лимфоцитов. Благодаря этому открытию сегодня при помощи стволовых клеток можно успешно бороться с такими заболеваниями, как:
- лейкемия;
- рак молочной железы;
- нейробластома;
- лимфома;
- рак легких;
- рак яичка;
- миеломная болезнь.
Причем на этом научная медицина не останавливается. Активно ведутся исследования других онкологических заболеваний, которые можно лечить при помощи стволовых клеток. Вполне возможно в будущем медицина сможет лечить при помощи этих клеток рак щитовидной железы, рак яичника, онкологию кишечника и многие другие злокачественные опухоли.
По сути, универсальность недифференцированных клеток позволяет применять их для терапии любых онкологических заболеваний. Просто технология такого лечения еще несовершенна и необходимо время для накопления клинического опыта, после чего препараты на основе стволовых клеток можно будет использовать для массового лечения рака.
Изучением воздействия этих клеток на онкологические опухоли активно занимаются в США и Израиле. Принимают участие в этом процессе и российские ученые. По прогнозам в ближайшие 5–10 лет из экспериментального метода, лечение рака стволовыми клетками превратится в официальный международный стандарт, который станет основой программы по борьбе с онкологическими заболеваниями.

Источники стволовых клеток для лечения рака
Многих интересует вопрос – где берутся незрелые клетки, способные справиться со злокачественными опухолями? По словам ученых, для этой цели подходят гемопоэтические клетки, являющиеся основой для образования кровяных телец. Таким образом, сырьем для получения стволовых клеток выступает:
- кровь;
- костный мозг (красный);
- пуповинная кровь (или плацентарная).
Причем наибольшее предпочтение врачи отдают пуповинной крови. Дело в том, что для получения незрелых клеток из крови необходимы доноры. Донору назначают медикаменты, стимулирующие синтез недифференцированных клеток. После этого производят забор крови и пропускают ее через особый сепаратор, который отсеивает стволовые клетки. Ценные клетки забирают, а оставшуюся кровь возвращают в организм. Процесс этот дорогостоящий, да к тому же сопряжен с рисками для здоровья донора, поэтому применяют его редко. Еще сложнее обстоит дело с изъятием стволовых клеток из костного мозга.
В то же время пуповинная или плацентарная кровь – это тот материал, который обычно выбрасывается. Получение его не требует финансовых затрат, а количество стволовых клеток в нем чрезвычайно велико. Причем такие клетки более функциональны, нежели те, которые берут у взрослых доноров из крови и костного мозга. За одни лишь роды ученым удается получить 100 мл пуповинной крови и до 150 мл плацентарной.
Как получают стволовые клетки из пуповинной крови
Перед родами у родителей интересуются, хотят ли они сохранить пуповинную кровь, которая будет храниться в замороженном виде в течение десятков лет, и которую можно будет использовать для лечения самого донора и его родственников. Разумеется, такое хранение стоит немалых денег. Если же родители отказываются от плацентарной крови, ее сохраняют в банках-регистраторах и используют для безвозмездного донорства.
Плацентарную кровь проверяют на наличие инфекций и генных патологий, после чего отфильтровывают незрелые клетки и на 3 недели помещают в карантин. Получив подтверждение о пригодности этих клеток по результатам анализов, стволовые клетки замораживают в жидком азоте и хранят в специальном банке на протяжении 15–20 лет.

Технология лечения рака стволовыми клетками
Перед внедрением стволовых клеток больному с онкологическим заболеванием необходимо пройти обследование, сдав общий анализ крови, а также исследовав легкие, почки, печень, сосуды, сердце и ЛОР-органы. Представительницы прекрасного пола дополнительно сдают тест на беременность. Если анализы не выявляют противопоказаний к проведению процедуры, больного отправляют в стационар.
Сама процедура трансплантации стволовых клеток включает несколько периодов:

Инновационная методика лечения рака
Более того, сегодня в генетических лабораториях ученые проводят так называемое генетическое модифицирование незрелых клеток. Говоря понятным языком, недифференцированные клетки нацеливают на лечение конкретного вида рака. И пусть сегодня такое лечение проходит стадию экспериментов, ученые уже говорят о результатах, которые превосходят все ожидания.
Иммунотерапия рака – за и против
На сегодняшний день у ученых нет единого мнения по вопросу лечения онкологических опухолей иммунотерапией. Просто методика эта еще слишком молода, находится в процессе становления и совершенствования, а потому сопряжена с определенными осложнениями и не всегда дает ожидаемый результат. К тому же массовому применению стволовых клеток в лечении рака препятствует высокая стоимость такой терапии.
Тем не менее, большинство ученых онкологов видят в таком подходе к лечению огромную перспективу. Подтверждением тому являются сотни пациентов, которых уже сегодня удалось спасти от этого смертельно опасного заболевания.
Крепкого вам здоровья!

Работа, опубликованная в Nature Medicine учёными из National Cancer Institute (NCI), описывает новый тип иммунотерапии, который привёл к полному исчезновению опухолей у женщины с метастатическим раком молочной железы, которой осталось всего несколько месяцев жизни.
Результаты показывают, как естественные опухолевые инфильтрирующие лимфоциты (TIL) были извлечены из опухоли пациента, выращены вне её тела, чтобы увеличить их количество, и введены обратно пациенту для борьбы с раком. Пациент ранее получил несколько форм лечения, включая гормональную терапию и химиотерапию, но никакая из них не остановила прогрессирование рака. После лечения все опухоли пациентки исчезли, и через 22 месяца она все ещё находится в ремиссии.
Первым шагом этого нового подхода к лечению является секвенирование генома опухоли. В случае этого пациента учёные нашли 62 мутации в клетках опухоли молочной железы. Второе – выделить TIL, которые присутствуют в 80% опухолей эпителиальных клеток, но в крошечных количествах, недостаточных, чтобы уничтожить опухоль. Затем они анализируются на их способность распознавать мутированные белки в опухоли. В случае с пациентом с метастатическим раком молочной железы учёные обнаружили TIL, которые распознали четыре мутантных белка.
Во время выращивания TIL пациента также лечили иммунотерапевтическим веществом Keytruda, блокирующим PD-1, в целях изменения иммунной системы, чтобы иные иммунные клетки не мешали TIL, когда их вводили обратно пациенту.
Пациент с метастатическим раком молочной железы – не единственный человек, успешно прошедший лечение с использованием этого метода. Розенберг и его коллеги также достигли впечатляющих результатов при использовании TIL в лечении ещё трёх различных типов метастатического рака: колоректального, желчных протоков и шейки матки.
Хотя результаты, несомненно, являются многообещающими, особенно из-за низкого уровня токсичности, испытываемого пациентами по сравнению с химиотерапией, рак часто вырабатывает устойчивость к лечению, и часто метастазы могут иметь мутации, отличные от начальной опухоли.
Так легко ли у пациентов разовьётся устойчивость к TIL?
Как ни странно, это одно из преимуществ многих старых химиотерапевтических препаратов по сравнению с новыми персонализированными методами лечения. Из-за того, что химиотерапия без разбора пронизывает геном повреждениями в стиле ковровой бомбардировки, раковой клетке становится сложнее выработать устойчивость к ним. Выбор TIL, которые нацелены на небольшое количество мутированных белков в опухоли, может увеличить вероятность, что рак сможет развить резистентность. Нужны ещё работы в этой сфере, а также приёмы по изучению, какие мутации у раковых клеток являются возможными мишенями TIL.
Если крупные работы подтверждают эти великолепные предварительные результаты, разработка персонализированной терапии пациенту, несомненно, является финансовой и технической проблемой, требующей специализированных лабораторий и опыта. Насколько практично производить полностью персонализированную терапию?
И несколько компаний уже проводят испытания лечения TIL, в том числе Bristol-Myers Squibb и Iovance Biotherapeutics, последняя из которых специально фокусируется на TIL. В настоящее время проводятся клинические испытания TIL для меланомы, рака шейки матки, лёгких и даже, как известно, мало поддающихся лечению глиобластомы и рака поджелудочной железы.
Нечасто в борьбу вступают совершенно новые методы лечения рака с такими впечатляющими результатами, как показанные TIL в этих примерах. Что сейчас крайне нужно, так это результаты более масштабных клинических испытаний и постоянного контроля за пациентами, которые были успешно вылечены, чтобы убедиться, что у них не возникло проблем.
- 1036 просмотров
Материалы по теме
А вот ещё:

Почему некоторые люди умнее других? С незапамятных времен ученые пытаются выяснить, что нужно делать, чтобы голова хорошо соображала. Но теперь хотя бы ясно: список составляющих интеллекта длиннее, чем предполагалось.
Венцель, которому сегодня 17 лет, обладает уникальным математическим даром: он умножает, делит, извлекает корни из двенадцатизначных чисел без ручки, бумаги и прочих вспомогательных средств. На последнем чемпионате мира по устному счету он занял третье место. Как он сам говорит, на решение особо сложных математических задач у него уходит от 50 до 60 минут: например, когда ему требуется разложить двадцатизначное число на простые множители. Как же ему это удается? Вероятно, главную роль здесь играет его кратковременная память.
Коктейль из нескольких ингредиентов
1. Мозг у одних людей работает эффективнее, чем у других. Их владельцы обладают большими интеллектуальными способностями. Но какова общая нейробиологическая основа, пока еще не ясно.
2. Ученые находят все новые и новые гены, способствующие развитию высокого интеллекта. Многие из них располагаются в пирамидных клетках коры головного мозга.
3. Чем длиннее и более разветвлены клеточные волокна в височных долях мозга, тем человек в принципе умнее. В других участках мозга благоприятное влияние на интеллект оказывает малая плотность нейронов.
Как выяснилось позже, этот его тезис был верен — как минимум отчасти. Американские психологи Томас Бушар (Thomas Bouchard) и Мюттью Макги (Matthew McGue) проанализировали более 100 опубликованных исследований схожести интеллектов среди членов одной семьи. В некоторых работах были описаны однояйцовые близнецы, разделенные сразу после рождения. Несмотря на это, при тестах интеллекта они показывали практически аналогичные результаты. Близнецы же, выросшие вместе, в отношении умственных способностей были схожи в еще большей степени. Вероятно, окружающая среда также оказывала на них немаловажное влияние.
Сегодня ученые считают, что интеллект на 50-60% передается по наследству. Иными словами, разница в IQ между двумя людьми на добрую половину объясняется строением их ДНК, полученной от родителей.
В поисках генов интеллекта
Однако поиски конкретно отвечающих за это наследственных материалов до сих пор мало к чему приводили. Правда, иногда находили некоторые элементы, которые на первый взгляд имели отношение к интеллекту. Но при ближайшем рассмотрении эта взаимосвязь оказывалась ложной. Возникла парадоксальная ситуация: с одной стороны, бесчисленные исследования доказывали высокую наследственную составляющую интеллекта. С другой стороны, никто не мог сказать, какие гены конкретно отвечают за это.
В последнее время картина несколько изменилась, в первую очередь благодаря технологическому прогрессу. План строительства каждого отдельного человека заключен в его ДНК — своеобразной гигантской энциклопедии, состоящей из приблизительно 3 миллиардов букв. К сожалению, она написана на языке, который мы почти не знаем. Хотя мы и можем читать буквы, но смысл текстов этой энциклопедии остается от нас скрыт. Даже если ученым удается секвенировать всю ДНК какого-либо человека, они не знают, какие ее участки отвечают за его умственные способности.
Интеллект и IQ
Интеллект, как правило, не ограничивается одним предметом, например, математикой. Тот, кто хорош в одной области, часто выделяется и в других. Четко ограниченные одним предметом дарования встречаются редко. Поэтому многие ученые исходят из того, что существует общий фактор интеллекта, так называемый фактор G.
В 1912 году немецкий психолог Вильям Штерн (William Stern) предложил новый метод, при котором возраст интеллектуального развития делился на хронологический возраст, а получаемая при этом величина называлась коэффициентом интеллекта (IQ). И хотя название сохранилось до сих пор, сегодня IQ больше не описывает возрастные коэффициенты. Вместо этого IQ дает представление о том, как соотносится уровень интеллекта того или иного индивида с уровнем интеллекта среднестатистического человека.
Люди различаются между собой, и соответственно различаются их наборы ДНК. Однако у индивидов с высоким IQ должны совпадать как минимум те части ДНК, которые связаны с интеллектом. Сегодня ученые исходят из этого основополагающего тезиса. Сравнивая ДНК сотен тысяч испытуемых в миллионах ее частей, ученые могут определить наследственные регионы, способствующие формированию более высоких интеллектуальных способностей.
Тайна за семью печатями
Но остается еще одна большая проблема: сегодня известны 2 тысячи мест (локусов) в структуре ДНК, которые ассоциируются с интеллектом. Но во многих случаях еще не понятно, за что конкретно отвечают эти локусы. Чтобы решить эту загадку, исследователи интеллекта наблюдают, какие клетки чаще, чем другие, реагируют на поступающую новую информацию. Это может означать, что именно эти клетки каким-то образом связаны с мыслительными способностями.
Возможно, пирамидные клетки играют ключевую роль в формировании интеллекта. На это указывают во всяком случае результаты исследований, проведенных нейробиологом Натальей Горюновой, профессором Свободного университета Амстердама.
Недавно Горюнова опубликовала результаты исследования, привлекшего всеобщее внимание: она сравнила пирамидные клетки у испытуемых с различными интеллектуальными способностями. Образцы тканей были взяты в основном из материала, полученного при операциях у больных эпилепсией. В тяжелых случаях нейрохирурги пытаются удалить очаг возникновения опасных судорожных приступов. При этом они всегда удаляют и части здорового мозгового материала. Именно этот материал и исследовала Горюнова.
Только часть правды
Сделать какие-то общие выводы из результатов исследований амстердамских ученых пока еще нельзя. Тем более что есть данные, говорящие о прямо противоположном. Они получены биопсихологом из Бохума Эрханом Генчем (Erhan Genç). В 2018 году он вместе с коллегами также исследовал, насколько различается строение серого вещества у очень умных и менее умных людей. При этом он пришел к выводу, что сильная разветвленность дендритов скорее вредит, чем способствует мыслительной способности.
Правда, Генч не исследовал отдельные пирамидные клетки, а помещал своих испытуемых в сканер мозга. В принципе, магнитно-резонансные томографы не годятся для исследования тончайших структур волокон — разрешение снимков, как правило, оказывается недостаточным. Но бохумские ученые использовали особый метод, позволяющий увидеть направление диффузии тканевой жидкости.
Предположительно, именно благодаря этому мы можем перерабатывать информацию более эффективно.
Действительно, люди с богатым интеллектом проявляют более сфокусированную мозговую активность, чем менее одаренные, когда им приходится решать сложную задачу. Кроме того, их мыслительному органу нужно меньше энергии. Эти два наблюдения привели к так называемой нейронной гипотезе эффективности интеллекта, согласно которой решающее значение имеет не напряженность работы мозга, а эффективность.
У семи нянек дитя без глазу
Однако и тут есть много загадочного. Это в равной степени относится и к мужчинам, и к женщинам, потому что у обоих полов маленькому мозгу соответствуют и меньшие умственные способности. С другой стороны, мозг у женщин в среднем на 150 г меньше, чем у мужчин, однако в тестах IQ они показывают те же результаты, что и мужчины.
Если пирамидные клетки можно считать процессорами мозга, то белое вещество представляет собой как бы компьютерную шину: благодаря ему находящиеся на больших расстояниях друг от друга мозговые центры могут общаться между собой и сотрудничать при решении проблем. Несмотря на это, белое вещество долгое время недооценивалось исследователями интеллекта.
Но если все работает как надо, то человеческий мозг способен творить удивительные вещи. Это видно на примере южнокорейского ядерного физика Кима Ун Ёна, который обладая IQ в 210 единиц, считается самым умным человеком на Земле. В семь лет он решал на японском телешоу сложные интегральные уравнения. В восемь лет его пригласили в НАСА в США, где он проработал десять лет.

Во время деления клеток в нашем организме периодически возникают ошибки. Это неизбежно. Если что-то пошло не так, после деления дочерние клетки имеют неправильное строение, могут становиться раковыми. Иммунная система всегда настороже и готова их уничтожить.
Однако, иммунитет справляется со своей функцией не всегда — в противном случае ни у кого бы не возникали злокачественные опухоли.
Раковые клетки коварны, они могут обзавестись разными видами защиты:
- Если раковая клетка вырабатывает недостаточно много чужеродных веществ, иммунитет её не замечает.
- Некоторые опухоли умеют вырабатывать вещества, которые подавляют работу иммунных клеток.
- Иногда ведущая роль принадлежит микроокружению опухоли — клеткам и молекулам, которые окружают раковые клетки. Микроокружение тоже может подавлять иммунитет.
Для того чтобы иммунная система начала расправляться с опухолью, её нужно активировать, либо предоставить ей необходимые компоненты. Современные врачи и ученые знают, как это сделать. Такое направление лечения рака называется иммунотерапией. Существует несколько её разновидностей.
Какие бывают разновидности иммунотерапии?
На данный момент онкологам доступны разные виды иммунотерапии:
Многие ученые считают, что за иммунотерапией будущее в лечении рака. Исследования в этом направлении продолжаются, в лабораториях разрабатывают и тестируют новые препараты.
Моноклональные антитела
Чужеродные вещества в организме человека называют антигенами. В ответ на их внедрение иммунная система вырабатывает специфические белковые молекулы — антитела. Каждое антитело связывается с соответствующим ему антигеном, после чего происходит ряд событий, приводящий к уничтожению чужеродного агента.
Моноклональные антитела — по сути искусственные заменители собственных антител человека. Каждое из них находит в организме свою молекулу-мишень и связывается с ней. В случае с онкологическими заболеваниями такой мишенью является определенное вещество, которое раковые клетки вырабатывают в достаточно большом количестве, а здоровые — в очень малом, или не вырабатывают вообще.
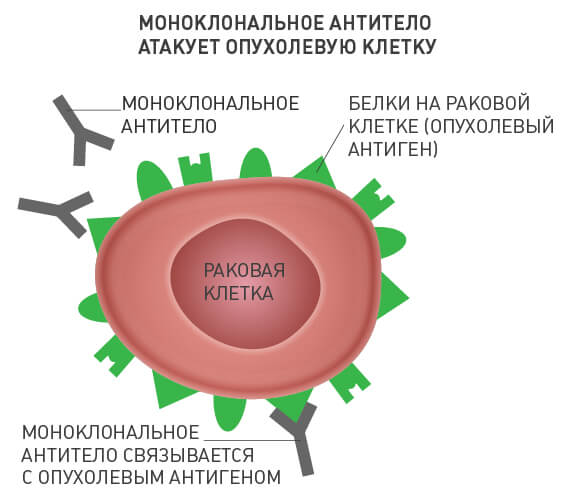
Различные моноклональные антитела действуют по-разному:
Моноклональные антитела можно использовать для доставки к раковым клеткам других лекарств. Например, можно прикрепить к молекуле антитела радиоактивную частицу или химиопрепарат.
За последние годы в мире было одобрено и внедрено в клиническую практику более десятка разных моноклональных антител. Они применяются для лечения ряда злокачественных опухолей, обладающих определенными молекулярно-генетическими характеристиками. В настоящее время ученые работают над созданием новых препаратов, некоторые лекарства проходят испытания и, возможно, вскоре будут введены в клиническую практику.
Кейтруда (Пембролизумаб)
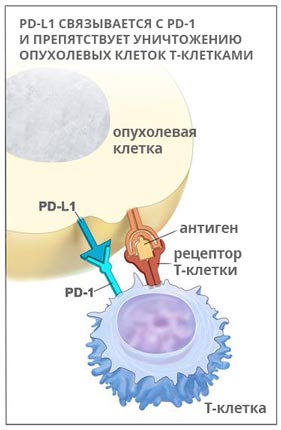
PD-1 – это рецептор, который находится на поверхности T-клеток. Когда он взаимодействует с белком PD-L1, замедляется размножение иммунных клеток, они перестают выделять цитокины и атаковать опухолевую ткань. Кейтруда разрывает эту связь и снимает блок с лимфоцитов:
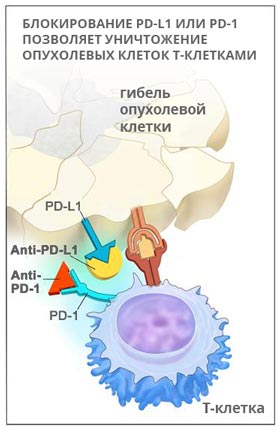
Пембролизумаб был одобрен к применению в Америке в сентябре 2014 года. В настоящее время его используют для лечения меланомы, немелкоклеточного рака легких, опухолей головы и шеи. Кейтруду обычно назначают при некурабельных опухолях, которые невозможно удалить хирургически, если другие методы лечения не помогают.
Ниволумаб (Опдиво)
Ниволумаб, как и Кейтруда, является ингибитором белка-рецептора PD-1. В декабре 2014 года этот препарат был одобрен в Америке для лечения меланомы. В настоящее время основными показаниями к применению Ниволумаба являются: метастатическая и неоперабельная меланома, местнораспространенный или метастатический мелкоклеточный и немелкоклеточный рак легких, почечно-клеточный рак на поздних стадиях. В ряде случаев ниволумаб сочетают с другим ингибитором контрольных точек – ипилимумабом (Ервой).

Ритуксимаб (Мабтера, Ритуксан)
Мишень для ритуксимаба — рецептор CD20, который находится на поверхности B-лимфоцитов. Соединяясь с рецептором, препарат заставляет NK-клетки (натуральные киллеры — разновидность иммунных клеток) атаковать B-лимфоциты, как злокачественные, так и нормальные. После курса лечения организм производит новые нормальные B-лимфоциты, их количество восстанавливается.
Ритуксимаб был одобрен к применению достаточно давно — еще в 1997 году. В настоящее время его используют для лечения аутоиммунных и онкологических заболеваний: хронического лимфолейкоза, вульгарной пузырчатки, неходжкинской лимфомы, идиопатической тромбоцитопенической пурпуры.
Ипилимумаб (Ервой)
Ервой связывается с молекулой CTLA-4 и активирует иммунную систему, для того чтобы она могла бороться с раком. Исследования показывают, что препарат помогает надолго остановить рост опухоли, а в 58% случаев способствует уменьшению её размеров, как минимум, на треть.
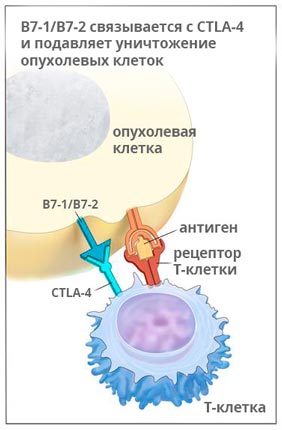
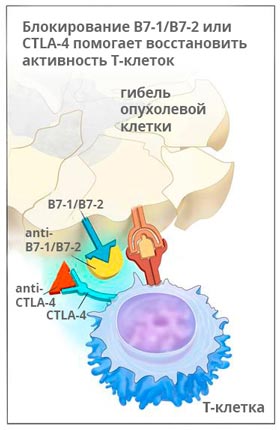
Ипилимумаб применяют у пациентов, страдающих меланомой на поздних стадиях, раком легкого, простаты.
Цитокины
Цитокины – это неспецифические стимуляторы иммунитета. Они активируют иммунную систему не против какого-то определенного антигена, а в целом. В настоящее время в онкологии главным образом применяют два препарата – интерлейкин-2 (ИЛ-2) и интерферон-альфа.
Интерлейкин-2 представляет собой молекулу, которая переносит биохимические сигналы между лейкоцитами. Он ускоряет рост и размножение иммунных клеток. Этот препарат находит применение при распространенном раке почек, метастатической меланоме. Иногда ИЛ-2 сочетают с химиотерапией и другими цитокинами. При этом его действие усиливается, но повышается риск серьезных побочных эффектов.
В настоящее время ведутся исследования по возможности применения в онкологии других типов интерлейкинов, таких как ИЛ-7, ИЛ-12, ИЛ-21.
Интерфероны – вещества, которые принимают участие в борьбе с вирусами и раковыми клетками. Существует три типа интерферона, названных по буквам греческого алфавита – альфа, бета и гамма. Для лечения рака применяют препараты интерферона-альфа. Они помогают усилить противоопухолевый иммунный ответ, непосредственно замедлить рост раковых клеток и кровеносных сосудов, которые обеспечивают опухоль кислородом и питательными веществами.
Интерферон-альфа применяют при раке почек, меланоме, волосатоклеточном лейкозе, некоторых типах лимфомы, саркоме Капоши.
Иммунотерапия при раке легкого
Рак легких — одно из самых распространенных онкологических заболеваний. По заболеваемости и уровню смертности он занимает первое место у мужчин и третье место у женщин. Почти 20% пациентов, умерших от злокачественных опухолей, погибли от рака легкого. В группе повышенного риска находятся курильщики в возрасте старше 50 лет. На каждые 3–4 миллиона выкуренных сигарет приходится одна смерть от рака легких.
Заболевание часто диагностируют на поздних стадиях, когда многие виды лечения оказываются неэффективны. В таких случаях пользу может принести иммунотерапия.
При раке легкого применяют такие препараты, как ниволумаб (Опдиво), ипилимумаб (Ервой), пембролизумаб (Кейтруда), атезолизумаб (Тецентрик).
В Европейской клинике применяются наиболее современные методы лечения рака легкого, меланомы и других онкологических заболеваний. Благодаря сотрудничеству с зарубежными коллегами, мы может предоставить пациентам возможность пройти курс иммунотерапии, персонализированного лечения в нашем центре иммунотерапии. Мы знаем, как продлить жизнь и избавить от мучительных симптомов при запущенном раке. Мы знаем, как помочь.
Иммунотерапия при меланоме
Меланома — далеко не самая распространенная (всего 2%) форма рака кожи, но она очень агрессивна и чаще других опухолей приводит к смерти. Так, в 2012 году в мире было диагностировано 232 000 новых случаев меланомы, 55 000 больных погибли. Меланома рано метастазирует, после чего многие методы лечения становятся неэффективны.
На поздних стадиях для лечения меланомы применяют пембролизумаб (Кейтруда), ипилимумаб (Ервой), ниволумаб (Опдиво).
Отзыв пациента о лечении меланомы иммунотерапией:
Мне 41, я бывший спортсмен-байдарочник, волосы черные, глаза карие — то есть, я нормально переношу загар, кожа смуглеет быстро, а ожогов у меня не бывает. Я, конечно, слышал, что длительное пребывание на солнце чревато всякими проблемами, а так как основную часть времени я проводил как раз на солнце, регулярно проверялся у дерматолога. От него и узнал, что есть такая беда, как меланома — рак кожи. Но, по его словам, мне она не грозит, как раз ввиду особенностей моей кожи.
Ну, и, конечно, у меня нашли меланому. Причем, что обидно, не на спине или плечах, что было бы логично — эти места постоянно под лучами, а на бедре.
В первую очередь, по совету дерматолога, отправился в одну небезызвестную клинику. Приняли охотно, сказали, что вероятность хорошего исхода большая, так как обнаружена она достаточно рано.
Но, этот выигрыш они благополучно спустили на недельные обследования. По результатам мне назначили операцию ещё через неделю, а потом Интерферон. Я обратился к тому же дерматологу, который послушал меня, и несколько удивился. Ничего толком не сказал, но намекнул на то, что можно бы получить и второе мнение, да побыстрее.
Иммунотерапия при раке желудка
При раке желудка I–III стадии основным методом лечения является хирургическое удаление опухоли, нередко его дополняют курсом химиотерапии и лучевой терапии. На IV стадии, когда опухоль распространяется за пределы органа и дает метастазы, шансы на полную ремиссию стремятся к нулю. В таких случаях проводят лечение, направленное на замедление роста опухоли, сокращение её размеров, продление жизни пациента.
Именно на IV стадии, когда рак желудка не реагирует на другие виды лечения, может принести пользу иммунотерапия. Эффективны такие препараты, как трастузумаб и рамуцирумаб. В настоящее время исследования в отношении иммунотерапии при раке желудка ведутся в четырех основных направлениях: ингибиторы контрольных точек, таргетная иммунотерапия моноклональными антителами, противораковые вакцины и клеточная иммунотерапия.
Иммунотерапия при раке почки
При лечении рака почек иммунотерапией применяет две группы иммунопрепаратов:
- Цитокины — белки, которые активируют иммунную систему и заставляют её бороться с раком. Для лечения применяют искусственно синтезированные аналоги этих белков: интерлейкин-2 (IL-2) и интерферон-альфа.
- Ингибиторы контрольных точек. Контрольные точки — это особые молекулы иммунной системы, которые она использует, чтобы сдерживать себя от атаки здоровых клеток. Иногда они мешают бороться против опухолевых клеток. При раке почек применяют Ниволумаб (Опдиво) — он блокирует PD-1, белок, который находится на поверхности T-лимфоцитов.
Иммунотерапия при раке яичников
В последние годы хирургическое лечение и химиотерапия при раке яичников значительно продвинулись вперед, и все же ситуация пока еще далека от идеальной. У многих женщин опухоль рецидивирует, перестает реагировать на препараты, которые помогали ранее. Из иммунопрепаратов при раке яичников в настоящее время применяется Бевацизумаб (Авастин) — представитель группы моноклональных антител, который блокирует фактор роста эндотелия сосудов. Раковые клетки синтезируют это вещество в большом количестве, чтобы стимулировать рост новых сосудов, обеспечить себя кислородом и питательными веществами. Некоторые методы иммунотерапии при раке яичников в настоящее время находятся на стадии разработки и тестирования: моноклональные антитела, ингибиторы контрольных точек, иммуномодуляторы, противораковые вакцины, иммуноклеточная терапия, онколитические вирусы.
Побочные эффекты иммунотерапии
Лечение иммунотерапевтическими препаратами имеет некоторые общие моменты с химиотерапией. Такое сходство заключается в том, что клетки опухоли погибают в пределах органов и тканей тела, и организму приходится избавляться от них, как от чужеродного вредоносного материала. Это очень ресурсоёмкая задача, поэтому пациент может испытывать симптомы, вызванные перенапряжением различных систем организма.
Иногда иммунотерапия активирует иммунные клетки чрезмерно, и они начинают атаковать нормальные ткани организма. Из-за этого могут возникать некоторые побочные эффекты:
- При поражении слизистой оболочки полости рта и глотки на ней возникают болезненные язвы, которые могут инфицироваться. Обычно они проходят в течение 5–14 дней после окончания лечения.
- Кожные реакции: покраснение, отечность, сухость, повышение чувствительности к свету, трещины на кончиках пальцев.
- Симптомы, напоминающие грипп: слабость, разбитость, повышенная температура, озноб, кашель.
- Тошнота и рвота.
- Головные боли, головокружения.
- Повышение или снижение артериального давления.
- Мышечные боли.
- Одышка.
- Отеки на ногах.
- Увеличение веса из-за задержки жидкости в организме.
- Диарея.
У разных иммунопрепаратов побочные эффекты выражены по-разному. Лучше заранее поговорить с врачом и спросить, каких проблем можно ожидать во время курса лечения, как с ними бороться.
Иммунотерапия: за и против
Однако, не всё так гладко. У иммунопрепаратов есть и минусы. Они работают далеко не у всех пациентов. Иногда опухоль удается уничтожить полностью, а иногда — лишь замедлить её рост. Ученые пока не могут объяснить, почему результаты лечения бывают такими разными. Несмотря на то, что побочные эффекты встречаются не так часто, как при химиотерапии, иногда они могут быть весьма серьезными.
Иммунотерапия — это всегда длительное лечение. Со временем иммунопрепарат, который помогал пациенту ранее, может перестать работать. К минусам можно отнести и достаточно высокую стоимость иммунотерапии при раке. Таким образом, в каждом случае решение нужно принимать индивидуально. Прежде чем назначить иммунотерапию, врач обязательно взвесит все возможные преимущества и риски.
Ещё один минус иммунотерапии — она подходит не для всех типов рака. Существует не так много онкологических диагнозов, для которых разработан препарат, способный точно и эффективно воздействовать на клетки данного рака. Однако это путь, по которому онкология продолжает идти, открывая всё новые и новые препараты и их комбинации, способные воздействовать на новые виды опухоли. Всё остальное — это исключительно преимущества, которые могут отменить остальные виды лечения уже в обозримом будущем.
Сколько стоит иммунотерапия?
Иммунотерапия — это самый современный медикаментозный метод лечения рака. Стоимость иммунотерапии рака немаленькая. Особенно в сравнении с другими известными методами. Стоимость лечения зависит от вида применяемого иммунопрепарата, типа и стадии опухоли, ее степени агрессивности. Высокая цена иммунотерапии связана с тем, что производство иммунопрепаратов — сложный и дорогой процесс.
В России очень немного клиник, которые проводят лечение иммунотерапией. В большинстве случаев, чтобы пройти курс иммунотерапии, россиянину приходится обращаться к посредникам для лечения за границей. В основном это Израиль, Германия и США. В таком случае стоимость перелёта и лечения составит огромную сумму. Но теперь в России есть возможность пройти иммунотерапевтическое лечение рака в Европейской клинике, что делает его доступным для многих пациентов.
Читайте также:


