Какое может быть лечение назначено при раке
Процесс лечения онкологических заболеваний очень долгий и сложный. Единого лекарства против рака пока не существует, но комбинация различных препаратов при онкологии позволяет добиться торможения роста опухоли, снятия болевого синдрома и общего улучшения состояния пациента.
Роль лекарственных препаратов в терапии онкозаболеваний
Современные препараты при лечении рака решают несколько задач, потому и назначаются они чаще всего комплексно. Одни лекарства от рака разрушают пораженные клетки, другие останавливают их рост и предотвращают возникновение новых раковых клеток. На поздних стадиях активно применяются обезболивающие препараты, а также средства, которые сами по себе никак не влияют на рост опухоли, но улучшают общее состояние человека, снимая неприятную симптоматику.
Химиотерапия — высокотехнологичный и эффективный способ лечения онкологических заболеваний, пусть и не лишенный недостатков. Препараты для химиотерапии подавляют рост раковых клеток или уничтожают их, однако многие их них воздействуют также и на здоровые клетки. Из-за этого химиотерапия переносится тяжело, а пациенты после каждого курса нуждаются в реабилитации. Побочными эффектами препаратов для химиотерапии являются рвота и тошнота, выпадение волос, снижение массы тела, ухудшение иммунитета, постоянное чувство усталости, нарушение свертываемости крови.
Специалисты различают цитостатическую и цитотоксическую химиотерапию. Они различаются по механизму воздействия на клетки. Цитостатические препараты замедляют размножение клеток опухоли. Цитотоксические убивают пораженные клетки, вследствие чего начинается некроз опухоли.
К препаратам для химиотерапии относятся следующие группы средств:
- Алкилирующие агенты . Эти лекарства против рака разрушают белки, ответственные за формирование ДНК раковых клеток. Самые распространенные препараты этой группы — средства на основе действующего вещества циклофосфамид.
- Препараты платины. Этот благородный металл токсичен. Препараты платины обладают тем же действием, что и алкилирующие агенты, а именно — разрушают ДНК раковых клеток. Цитостатические средства алкилирующего типа действия широко используются для лечения рака.
- Антиметаболиты. Они воздействуют на генетический аппарат клетки, убивая ее при делении. Наиболее известными антиметаболитами являются препараты на основе гемцитабина.
- Антрациклины. Эти препараты образуют свободные радикалы, повреждающие ДНК больных клеток. Самые известные представители группы антрациклинов — средства с действующим веществом даунорубицин.
- Таксаны нарушают процесс деления раковых клеток. Препараты на основе паклитаксела — самые распространенные в этой группе.
- Винкалкалоиды разрушают цитоскелет раковых клеток, что приводит к их гибели. Относятся к мягким средствам химиотерапии, так как раковые клетки гораздо более чувствительны к воздействию этого препарата, чем здоровые. В этой группе выделяют средства с действующими веществами винбластин и винкристин.
При лечении многих видов опухолей хорошие результаты дает применение гормональных препаратов. Они наиболее эффективны при лечении гормонозависимых опухолей — рака молочной железы, матки, простаты, а также при опухолях поджелудочной железы, почек, при меланомах.
Эстрогенсодержащие препараты назначаются для подавления андрогенов (например, при раке простаты), а андрогенсодержащие, наоборот, подавляют выделение эстрогенов. Препараты последней группы назначают при таких видах онкологии, как рак молочной железы и т.д.
Несмотря на эффективность, у гормональных препаратов много минусов — они способны ослаблять действие химиотерапевтических препаратов, при долгом лечении у многих больных вырабатывается резистентность к подобным средствам.
Некоторые виды рака развиваются вследствие деятельности вирусов (например, вируса папилломы человека). Кроме того, организм, ослабленный агрессивной химиотерапией, подчас не может самостоятельно защитить себя от вирусных инфекций. Именно поэтому в комплексной терапии рака используются и противовирусные лекарства, в частности — препараты на основе тилорона и их аналоги.
К ферментам относятся активные белковые соединения, которые способны разрушать аминокислоты, необходимые для роста клеток опухоли. Для лечения опухолей применяют аргиназу, аспаргиназу и некоторые другие ферменты. Эффективность такой терапии под вопросом, так как резистентность вырабатывается очень быстро: человеческая иммунная система начинает вырабатывать антитела к ним. Однако исследования показывают, что ферментотерапия значительно смягчает последствия химиотерапии.
При лечении рака большое внимание уделяется не только воздействию на саму опухоль, но и улучшению качества жизни пациента, в частности — борьбе с болью. Чаще всего боль вызывается ростом опухоли, но иногда болевой синдром — побочный эффект некоторых лекарств от рака.
Выбор обезболивающих препаратов зависит от стадии болезни. ВОЗ разработала трехступенчатую схему, которая предполагает переход ненаркотических анальгетиков к слабым опиатам, а затем — к сильным опиатам. Эта схема позволяет добиться заметного улучшения состояния у 9 из 10 пациентов.
- Адъювантные средства . Эти лекарства не являются обезболивающими в строгом смысле слова, однако они уменьшают побочные эффекты сильных опиоидов и усиливают их болеутоляющее действие (к примеру, клонидин). Определенный эффект дают и антидепрессанты.
- Ненарктотические анальгетики . Это первый шаг в снятии болевого синдрома при онкологических заболеваниях. Для этих целей применяются препараты на основе парацетамола, а также нестероидные противовоспалительные препараты (ибупрофен).
- Слабые опиаты . К этим средствам относятся кодеин, трамадол и некоторые другие. Это сильнодействующие препараты, которые тем не менее отличаются хорошей переносимостью. Они дают особенно заметный эффект в сочетании с ненаркотическими анальгетиками.
- Сильные опиаты . В случаях, когда боль становится слишком сильной и иные средства не помогают, врач назначает сильные опиаты на основе морфина, фентанила и т.д. Они воздействуют напрямую на ЦНС, подавляя нервные импульсы.
Онкологические заболевания распространены очень широко, количество больных раком увеличивается с каждым годом, причем врачи отмечают, что рак молодеет — все чаще этот диагноз ставится людям, не достигшим и 40 лет. Все это делает исследования в области разработки новых препаратов от рака приоритетом для международного фармацевтического сообщества. Исследования проводятся постоянно, и уже есть определенные результаты.
Возможно, уже через несколько лет подобные вакцины станут доступными, а таргетная терапия разовьется достаточно, чтобы полностью заменить химиотерапию. Однако пока эти направления являются экспериментальными.
Обезболивающая терапия при онкологических заболеваниях — один из ведущих методов паллиативной помощи. При правильном обезболивании на любых стадиях развития рака пациент получает реальную возможность сохранять приемлемое качество жизни. Но как должны назначаться обезболивающие препараты, чтобы не произошло необратимого разрушения личности наркотическими средствами, и какие альтернативы опиоидам предлагает современная медицина? Обо всем этом в нашей статье.

Боль как неизменный спутник рака
Боль при онкологии чаще возникает на поздних стадиях заболевания, вначале доставляя пациенту существенный дискомфорт, а впоследствии делая жизнь невыносимой. Около 87% раковых больных испытывают боли той или иной степени выраженности и нуждаются в постоянном обезболивании.
Онкологические боли могут быть вызваны:
- самой опухолью с поражением внутренних органов, мягких тканей, костей;
- осложнениями опухолевого процесса (некрозы, воспаления, тромбозы, инфицирование органов и тканей);
- астенизацией (запоры, трофические язвы, пролежни);
- паранеопластическим синдромом (миопатия, нейропатия и артропатия);
- противоопухолевой терапией (осложнение после хирургических операций, химиотерапии и лучевой терапии).
Онкологическая боль также может быть острой и хронической. Возникновение острой боли нередко свидетельствует о возникновении рецидива или распространении опухолевого процесса. Она, как правило, имеет ярко выраженное начало и требует короткого по времени лечения препаратами, дающими быстрый эффект. Хроническая боль при онкологии обычно необратима, имеет тенденцию к усилению и поэтому требует длительной терапии.
По интенсивности боль при раке может быть слабой, умеренной и сильной.
Онкологические боли также могут подразделяться на ноцицептивные и невропатические. Ноцицептивная боль вызывается повреждением тканей, мышц и костей. Невропатическая боль обусловлена поражением или раздражением центральной и/или периферической нервной системы.
Невропатические боли возникают спонтанно, без видимых причин и усиливаются при психоэмоциональных переживаниях. Во время сна они, как правило, ослабевают, тогда как ноцицептивная боль не изменяет своего характера.
Медицина позволяет достаточно эффективно управлять большинством видов боли. Одним из лучших способов контроля боли является современный комплексный подход, сочетающий медикаментозные и немедикаментозные методы обезболивания при раке. Роль обезболивания в терапии онкологических заболеваний является исключительно важной, поскольку боль у раковых больных не является защитным механизмом и не носит временного характера, причиняя человеку постоянные страдания. Обезболивающие препараты и методики применяют для того, чтобы предотвратить негативное воздействие боли на пациента и по возможности сохранить его социальную активность, создать приближенные к комфортным условия существования.
Всемирная организация здравоохранения (ВОЗ) разработала трехступенчатую схему обезболивания онкологических больных, в основе которой лежит принцип последовательности применения препаратов в зависимости от интенсивности боли. Очень важным является немедленное начало фармакотерапии при первых признаках появления боли, чтобы предупредить ее трансформацию в хроническую. Переход со ступени на ступень необходимо производить только в тех случаях, когда лекарственный препарат неэффективен даже в своей максимальной дозировке.
Внутримышечные инъекции наркотических анальгетиков очень болезненны и не обеспечивают равномерного всасывания препарата, поэтому этого способа следует избегать.
Для достижения максимального эффекта следует вместе с анальгезирующими средствами использовать и адъювантные, такие как кортикостероиды, нейролептики и антиконвульсанты. Они усиливают эффект обезболивания в том случае, если боль вызвана поражениями нервов и нейропатией. При этом доза обезболивающих может быть существенно уменьшена.
В оценке болевого синдрома врач также должен ориентироваться на следующие показатели состояния пациента:
- особенности роста опухоли и их связь с болевым синдромом;
- функционирование органов, влияющих на активность человека и качество его жизни;
- психическое состояние — тревожность, настроение, болевой порог, коммуникабельность;
- социальные факторы.
Кроме того, врач обязательно должен собрать анамнез и провести физикальное обследование, включающее:
- этиологию боли (рост опухоли, обострение сопутствующих заболеваний, осложнения в результате лечения);
- локализацию очагов боли и их количество;
- время появления боли и ее характер;
- иррадиацию;
- методы лечения боли в анамнезе;
- наличие депрессии и психологических расстройств.
При назначении обезболивания врачами иногда допускаются ошибки в выборе схемы, причина которых кроется в неправильном установлении источника боли и ее интенсивности. В некоторых случаях это происходит по вине пациента, который не хочет или не может правильно описать свои болевые ощущения. Среди типичных ошибок можно выделить:
- назначение опиоидных анальгетиков в тех случаях, когда можно обойтись менее сильными препаратами;
- неоправданное увеличение дозы;
- неправильный режим приема обезболивающих средств.
При грамотно выбранной схеме обезболивания не происходит разрушения личности пациента, при этом его общее состояние значительно улучшается.
Общее обезболивание (аналгезия) — это состояние, характеризующееся временным выключением болевой чувствительности всего организма, вызванное воздействием наркотических веществ на центральную нервную систему. Больной находится в сознании, но поверхностная болевая чувствительность отсутствует. Общее обезболивание устраняет осознанное восприятие боли, но не обеспечивает блокады ноцицептивных импульсов. Для общего обезболивания в онкологии применяются в основном фармакологические препараты, принимаемые перорально или путем инъекций.
Местное (регионарное) обезболивание основывается на блокировании болевой чувствительности на определенном участке тела пациента. Применяется для лечения болевых синдромов и в комплексной терапии травматического шока. Один из видов регионарной анестезии — блокада нервов местными анестетиками, при которой препарат вводится в область крупных нервных стволов и сплетений. При этом устраняется болевая чувствительность в области блокируемого нерва. Основные препараты — ксикаин, дикаин, новокаин, лидокаин.
Спинальное обезболивание — один из видов местной анестезии, при котором раствор препарата вводят в позвоночный канал. Анестетик действует на нервные корешки, в результате чего происходит анестезия части тела, находящейся ниже места прокола. В том случае, если относительная плотность введенного раствора меньше плотности спинномозговой жидкости, то возможно обезболивание и выше места пункции. Вводить препарат рекомендуется до позвонка Т12, поскольку в противном случае может произойти нарушение дыхания и деятельности сосудодвигательного центра. Точным показателем попадания обезболивающего препарата в позвоночный канал является вытекание жидкости из иглы шприца.
Эпидуральные методики — вид местного обезболивания, при котором анестезирующие средства вводятся в эпидуральное — узкое пространство, находящееся снаружи позвоночного канала. Обезболивание обуславливается блокадой спинномозговых корешков, спинальных нервов и непосредственным воздействием обезболивающих средств. При этом не оказывается воздействия ни на головной, ни на спинной мозг. Обезболивание захватывает большую зону, поскольку препарат опускается и поднимается по эпидуральному пространству на весьма значительное расстояние. Такой вид обезболивания может проводиться однократно через иглу шприца или многократно через установленный катетер. При подобном методе с использованием морфина требуется доза во много раз меньше дозы, применяемой при общем обезболивании.
Нейролизис. В тех случаях, когда больному показана постоянная блокада, проводится процедура нейролизиса нервов, основанная на денатурации белков. При помощи этилового спирта или фенола разрушаются тонкие чувствительные нервные волокна и другие виды нервов. Эндоскопический нейролизис показан при хроническом болевом синдроме. В результате процедуры возможно повреждение окружающих тканей и сосудов, поэтому он назначается только тем больным, у которых исчерпаны все другие возможности обезболивания и с предполагаемым сроком жизни не более полугода.
Введение препаратов в миофасциальные триггерные пункты. Триггерными пунктами называют небольшие уплотнения в мышечных тканях, возникающие в результате различных заболеваний. Боль возникает в мышцах и фасциях (тканевой оболочке) сухожилий и мышц. Для обезболивания применяют медикаментозные блокады с применением прокаина, лидокаина и гормональных средств (гидрокортизон, дексаметазон).
Вегетативные блокады являются одним из эффективных местных методов обезболивания при онкологии. Как правило, они используются при купировании ноцицептивной боли и могут применяться для любого отдела вегетативной нервной системы. Для проведения блокад используются лидокаин (эффект 2–3 часа), ропивакаин (до 2 часов), бупивакаин (6–8 часов). Вегетативные медикаментозные блокады также могут быть однократными или курсовыми в зависимости от тяжести болевого синдрома.
Нейрохирургические подходы применяются в качестве метода местного обезболивания при онкологии в том случае, когда паллиативные средства не справляются с болью. Обычно такое вмешательство применяется для разрушения путей, по которым болевые ощущения передаются от пораженного органа к головному мозгу. Этот метод назначается довольно редко, поскольку может вызвать серьезные осложнения, выражающиеся в нарушении двигательной активности или чувствительности определенных участков тела.
Анальгезия, контролируемая пациентом. По сути, к анальгезии такого типа можно отнести любой метод обезболивания, при котором больной сам контролирует потребление анальгетиков. Самая распространенная ее форма — это применение в домашних условиях ненаркотических препаратов типа парацетамола, ибупрофена и других. Возможность самостоятельно принимать решение об увеличении количества препарата или его замене в случае отсутствия результата дает пациенту ощущение владения ситуацией и снижает тревогу. В стационарных условиях под контролируемой анальгезией понимают установку инфузионного насоса, который подает больному дозу внутривенного или эпидурального обезболивающего каждый раз, когда тот нажимает кнопку. Количество подач лекарства в сутки ограничено электроникой, особенно это важно для обезболивания при помощи опиатов.
Обезболивание при онкологии — одна из важнейших проблем здравоохранения во всем мире. Эффективная борьба с болью является первоочередной задачей, сформулированной ВОЗ, наряду с первичной профилактикой, ранним выявлением и лечением заболевания. Назначение вида противоболевой терапии проводится только лечащим врачом, самостоятельный выбор препаратов и их дозировки недопустим.
Итак, опухоль выявлена. Вдохнули-выдохнули, попросили о поддержке близких. И действуем по следующему алгоритму.
Почему и зачем?
Во-первых, это необходимо для статистического учета, из которого планируется финансирование каждого региона по количеству наблюдаемых и вновь выявленных онкологических больных.
Во-вторых, для личной уверенности в том, что вы бесплатно будете обеспечены дорогими исследованиями, лечением и динамическим наблюдением в последующие годы. А при необходимости – и крайне недешевыми таргетными препаратами или недоступными без онколога специальными обезболивающими средствами.
Безотлагательно – это не прямо завтра, но и не откладывая на пару месяцев.
Почему и зачем?
Важно!Стартовое обследование в обязательном порядке должно включать в себя:
КТ (компьютерную томографию); комплексное УЗИ (щитовидной и молочных желез с регионарными лимфатическими узлами, органов брюшной полости и забрюшинного пространства с парааортальными лимфатическими узлами, органов малого таза с тазовыми, подвздошными и паховыми лимфатическими узлами); радиоизотопное исследование костей скелета (сцинтиграфию скелета); МРТ головного мозга.
По возможности также необходимо сделать МСКТ (мультиспиральную компьютерную томографию) всего тела с контрастированием и ПЭТ КТ (позитронно-эмиссионную томографию).
А именно – укреплять свой иммунитет для борьбы с раком.
Почему и зачем?
Во-первых, для того, чтобы опухолевые клетки медленнее размножались. Чем выше у здоровых клеток способность вырабатывать собственный интерферон, тем лучше организм противостоит разрастанию опухоли и появлению метастазов. Если эта возможность снижена, необходимо поддерживать организм готовыми интерфероновыми препаратами. В своей клинической практике я часто использую, например, виферон в виде свечей как дополнительное лечебное средство. Оно обеспечивает противоопухолевую активность, противовоспалительное и детоксикационное действие, лучшую переносимость агрессивных лекарственных средств и снижение лучевых реакций у пациентов, перенесших или получающих лучевую терапию. Свечи с интерфероном особенно показаны при раке шейки матки и яичников, раке почки и предстательной железы, раке толстой кишки, печени и поджелудочной железы, молочной и щитовидной желез, лимфоме. В некоторых СМИ сегодня есть информация о том, что интерфероны вызывают рак. Но это в корне неверно: интерфероны, наоборот, используются во всем мире для лечения онкологических заболеваний.
Почему и зачем?
Во-первых, для того чтобы использовать для лечения самые современные и эффективные препараты. Скажем, в последние годы активно развивается иммунотерапия злокачественных опухолей моноклональными антителами. Это дорогостоящие препараты, имеющие очень четкие показания к применению. Кстати, для того чтобы получать не только нужную информацию, но и сами подобные лекарства, и необходимо встать на учет к районному онкологу.
Почему и зачем?

Врач-онколог разрабатывает программу лечения, исходя из типа, локализации, стадии опухоли, состояния здоровья больного. С пациентом работает команда специалистов, которая может включать онкологов, терапевтов, химиотерапевтов, радиологов, анестезиологов, психоонкологов, реабилитологов, хирургов-онкологов.
В данной статье будут рассмотрены основные методы лечения онкологических заболеваний, мы коротко остановимся на каждом из них и расскажем о важных моментах.
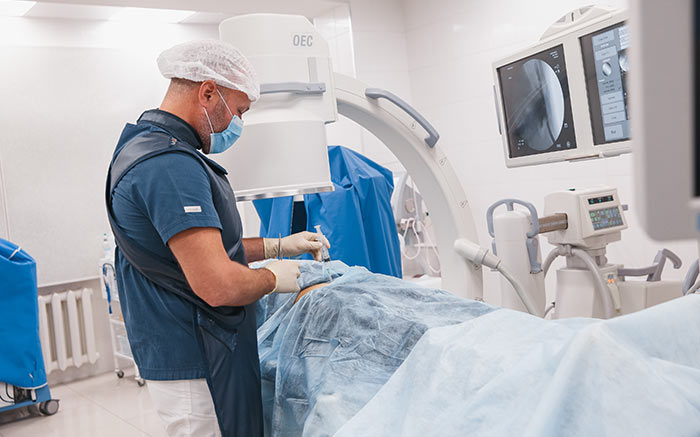
Хирургическое лечение
Во время операции хирург удаляет опухолевую ткань, пораженные близлежащие лимфатические узлы. Цели хирургического лечения могут быть разными:
- Удаление опухоли целиком.
- Удаление части опухоли (циторедуктивные операции). От рака это не излечит, но поможет повысить эффективность химиотерапии и других методов лечения.
Паллиативные операции обычно выполняют на поздних стадиях рака. Они помогают уменьшить боли, частично восстановить функции пораженного органа.
Иногда можно прибегнуть к миниинвазивному лапароскопическому вмешательству, в других случаях приходится делать большой разрез. Это зависит от размеров и локализации опухоли. При больших новообразованиях приходится удалять много тканей или даже целые части тела, например, молочную железу. В дальнейшем восстановить внешность помогают реконструктивно-пластические операции, протезы.
В случаях, когда это возможно, современные хирурги обходятся без скальпеля и прибегают к криохирургии (разрушение новообразования при помощи низкой температуры), лазерной хирургии, фотодинамической терапии (введение в опухоль специального препарата, который делает её чувствительной к свету, с последующим облучением).
Химиотерапия
Химиопрепараты уничтожают быстро делящиеся клетки. Химиотерапия может применяться как самостоятельно, так и в сочетании с другими методами, например, хирургическими вмешательствами, лучевой терапией. Химиотерапия может преследовать разные цели:
- Уменьшить опухоль перед хирургическим вмешательством или курсом лучевой терапии. В данном случае химиотерапия будет называться неоадъювантной.
- Уничтожить раковые клетки, которые остались в организме пациента после операции. Такую химиотерапию называют адъювантной.
- Повысить эффективность других методов лечения рака.
- Предотвратить рецидив после операции, лучевой терапии.
- Облегчить боль и другие симптомы, вызванные опухолью.
Химиопрепараты применяют в виде таблеток и капсул, внутривенных инъекций, также их могут вводить в организм другими способами.

Лучевая терапия
Лучевая терапия применяет ионизирующее излучение, которое, как и химиопрепараты, уничтожает быстро делящиеся клетки. Её можно использовать как для уничтожения опухоли, так и для облегчения боли и других симптомов.
Существуют две разновидности лучевой терапии:
- При внешнем облучении аппарат находится на расстоянии от пациента и посылает пучок лучей в область тела, где находится опухоль.
- При внутреннем облучении источник излучения вводят в тело пациента. Если источник излучения представляет собой твердый предмет (капсулу или ленту), такой вид лечения называется брахитерапией. В качестве источника излучения может выступать и жидкость, которую вводят внутривенно. Она распространяется по всему организму и уничтожает раковые клетки в разных органах. Такую методику используют, в частности, при раке щитовидной железы.
Лучевую терапию нередко сочетают с хирургическим лечением:
- Перед операцией она помогает уменьшить размеры опухоли.
- Во время операции хирург имеет возможность облучать опухоль непосредственно, так, чтобы лучи не проходили через кожу.
- После операции лучевая терапия помогает уничтожить оставшиеся раковые клетки.

Гормональная терапия
Рост злокачественных опухолей простаты и молочной железы сильно зависит от гормональных эффектов. Если раковые клетки имеют рецепторы к мужским или женским половым гормонам, врач назначит гормональную терапию. Препараты, которые при этом применяются, могут бороться с опухолью двумя путями:
Гормональную терапию очень редко назначают отдельно, чаще всего она дополняет другие виды лечения. Иногда прибегают к хирургическим вмешательствам, во время которых удаляют яичники или яички, чтобы половые гормоны в организме больше не вырабатывались.
Иммунотерапия
Современные ученые научились редактировать гены в иммунных клетках. У пациента берут Т-лимфоциты, изменяют их гены таким образом, чтобы они могли атаковать опухоль, искусственно размножают новые клетки в пробирке и возвращают в организм.
Таргетная терапия
В последние годы ученые многое узнали о молекулярных механизмах, которые помогают раковым клеткам расти, размножаться, выживать. Новые знания помогли создать новое направление в лечении рака — таргетную терапию. У таргетного препарата всегда есть конкретная цель — специфическая молекула, которая образуется в раковых клетках и нужна для роста, выживания опухоли.
Разные таргетные препараты действуют по-разному:
- работают как препараты для иммунотерапии;
- блокируют молекулярные сигналы, которые заставляют раковые клетки бесконтрольно делиться;
- блокируют молекулярные сигналы, которые нужны для роста новых сосудов и питания опухоли;
- делают клетки опухоли чувствительными к химиопрепаратам, излучению;
- вызывают естественную гибель раковых клеток — апоптоз;
- работают как препараты для гормональной терапии.
Таргетную терапию можно применять как отдельно, так и в сочетании с другими методами лечения.
Генная инженерия в лечении онкологических заболеваний
Несмотря на то, что за последние годы онкология шагнула далеко вперед, перед ней стоит еще много проблем. Даже современные методы лечения не всегда оказываются эффективными. Ученые постоянно ищут новые пути.
Ученые обнаружили, что в лаборатории с помощью CRISPR-Cas можно разрезать любые гены в нужном месте. Был открыт относительно простой, быстрый и недорогой метод редактирования генов. Он нашел применение во многих сферах, в том числе в онкологии. С помощью CRISPR-Cas изучают гены, ответственные за развитие злокачественных опухолей, создают новые лекарственные препараты, модифицируют иммунные клетки таким образом, чтобы они могли распознавать и атаковать раковые клетки. Несколько клинических исследований проводится прямо сейчас.
В 2016 году онкологам из США впервые удалось вылечить женщину от рака молочной железы IV стадии с помощью адаптивной T-клеточной иммунотерапии. 46-летняя Джуди Перкинс перенесла несколько курсов химиотерапии, но лечение оказалось безуспешным, опухоль продолжала прогрессировать, появились метастазы в печени.
В результате у женщины наступила ремиссия. В 2018 году ученые сообщили, что в ее организме вот уже два года не обнаруживаются признаки присутствия злокачественной опухоли. До этого врачи говорили, что Джуди осталось жить не более трех лет.
Лечащему врачу можно и нужно задавать вопросы. Когда пациент хорошо информирован, это идет на пользу лечению. Спросите онколога о том, какие виды лечения вам будут назначены, как будут проходить процедуры, на какой результат можно рассчитывать, какие возможны побочные эффекты, как их предотвратить и как с ними справиться. Врачи Европейской клиники применяют весь арсенал методик, которые на данный момент доступны в России. Мы постоянно следим за инновациями.
Онкологическое заболевание – это единое название для большой группы опасных патологий. Они возникают, если среди клеток человека появляются дефектные, разрастаются и образуют опухоль, которая увеличивается и затем заражает органы метастазами. Чтобы установить прогноз, назначить лечение и контролировать его результативность, а также чтобы изучать природу онкологии, выделяют стадии ее развития. Для этого используются универсальные критерии, хотя для разных типов рака характерны нюансы.
Содержание
Классификация TNM
Основные характеристики. Международным считается классификатор, принятый Американским комитетом по исследованию рака в середине прошлого века. Сегодня пользуются его восьмым изданием от 2017 года. В документе установлены 3 характеристики злокачественного образования.
- Tumor (T) – характер первичной опухоли;
- nodus (N) – распространение дефектных клеток в лимфоузлах;
- metastasus (M) – наличие либо отсутствие метастазов.
Дополнительные обозначения. Если первичного новообразования, раковых клеток в лимфоузлах или метастазов нет, к соответствующей букве приписывают 0. Когда опухоль или лимфоузел не поддается диагностике, то добавляется Х. В случае нормального обследования присваивают число, увеличение которого соотносится с ухудшением заболевания. Для T таких цифр 4, и они определяют разрастание опухоли в соседние ткани. Для N – 3, и они обозначают количество раковых клеток в лимфоузлах. Наличие либо отсутствие метастазов (М) приравнивается к цифрам 0 и 1.

Пример
Например, если у пациента диагностировали злокачественную опухоль в поджелудочной железе, которая сильно разрослась за пределы своего органа, а также небольшое количество раковых клеток в лимфоузлах и первые метастазы, то его диагноз может выглядеть как T4N1M1. Данное заключение может дополняться буквой, обозначающей тип диагностики, в ходе которой была определена стадия:
- P – исследование кусочка опухоли, взятой во время пункции или операции;
- C – неинвазивные методы обследования.
Упрощенная классификация
Во врачебной практике используется более простая типология, которая опирается на классификатор TNM. Выделяют 5 онкологических этапов, обозначенных римскими цифрами. Первую стадию называют нулевой, поэтому последняя больше известна под номером 4.
I (начальная).Возникает небольшое образование, также не выходящее за пределы своего органа. При раке 1-й стадии языка, поджелудочной железы, груди появляются симптомы. Однако их легко перепутать с указывающими на менее опасное заболевание. Лечение рака 1-й стадии также осуществляется с помощью операции. Почти все пациенты излечиваются.
II.Опухоль 2-й стадии больше, чем на предыдущем этапе, и глубже внедрена в ткани. Возможно распространение раковых клеток в лимфатические узлы. Можно лечить рак второй степени как иссечением образования, так и с помощью постоперационных мероприятий. При некоторых онкологиях мозга на данном этапе дают инвалидность (1-я группа для 2-й стадии рака).
III.Во время 3-й стадии рака опухолевый процесс выходит за пределы органа, сопровождаясь оттоком злокачественных клеток в лимфоузлы, иногда метастазами. Этап отличается тяжелой симптоматикой, которая толкает обратиться к врачу. К сожалению, ремиссия наступает редко.
IV.Терминальная стадия характеризуется метастазами в отдаленных от первоначальной опухоли органах. Выздоровления почти не наступает, и акцент в терапии переносится с излечивания на обезболивание и друге виды паллиативной помощи. Наибольшую опасность представляет рак 4-й стадии 3-й степени злокачественности либо 4-й.
Степень злокачественности
Агрессивность заболевания зависит от типа раковых клеток. Чем больше они отличаются от нормальных, тем тяжелее болезнь. Изучив их под микроскопом, можно определить эффективность будущей терапии, вероятность заболеть повторно и клинический прогноз. В классификации индекс злокачественности определяется буквой G.
- GX – невозможно определить уровень злокачественности клетки.
- G1 – опухоль по своей структуре мало отличается от органа, в котором находится (низко дифференцирована). Поэтому она почти неагрессивна, редко дает метастазы и хорошо поддается лечению.
- G2 – опухолевая ткань меньше похожа на нормальную (средне дифференцирована). Рак 2-й степени злокачественности наносит больший вред и хуже реагирует на терапевтические процедуры.
- G3 – клетки опухоли настолько нетипичны, что определить тип ткани их опухоли почти невозможно (малая степень дифференцированности).
- G4 – недифференцированная ткань, состоящая из клеток высокой агрессивности с обширными метастазированием.
Виды постоперационных опухолей
Постоперационную классификацию применяют, чтобы определить эффективность хирургического лечения и уточнить клинический прогноз.
- RX – не представляется возможным оценить количество опухолевой ткани, оставшейся после вмешательства.
- R0 – злокачественное образование вырезано без остатка.
- R1 – в ходе микроскопического исследования выявляется злокачественная ткань.
- R2 – опухоль сохраняется почти целиком и прощупывается.
Диагностика стадий
Обследования показывают различную степень достоверности и информативности. Поэтому методы онкологической диагностики имеют условные обозначения.
- С1 – онкологическая стадия определена инструментами базовой диагностики, включающей врачебный осмотр, рентген и эндоскопию.
- С2 – этап развития рака выявлен с помощью более точных не хирургических обследований: МРТ, КТ, усложненных методов рентген-исследований, а также ПЭТ-сканирования (томографии внутренних органов) и эндосонографии (эндоскопического УЗИ).
- С3 – инвазивный метод диагностики, в ходе которого извлекается часть злокачественного образования. Стадия выявлена после микроскопического изучения клеток и тканей этой части.
- С4 – исследование фрагмента опухоли, полученного во время операции по ее удалению. Иногда вырезают и исследуют ближайший к образованию лимфоузел, предварительно введя в место опухолевого очага специальный краситель, который помогает установить наличие в нем раковых клеток.

Стадии рака по типам онкозаболеваний
Ниже представлены степени развития рака разных частей организма. Патологии головного мозга и молочных желез наиболее агрессивные. При этом случаи онкологии крови, нервной системы и детской рассматриваются в отдельных классификациях.
Легкие
- Рак 0 степени развития и первой бессимптомный, а опухоль не превышает 30 мм. Выявление онкологии обычно приводит к выздоровлению, вероятность летального исхода при своевременном лечении практически равна 0.
- На второй стадии она увеличивается вдвое, появляется сухой кашель и утомляемость. Раковые клетки переходят в лимфатические узлы, шанс выздороветь падает до 50 %.
- Третья стадия выявляет дальнейший рост опухоли и распространение злокачественных клеток в последующие лимфоузлы вместе с появлением симптомов бронхита: слизистым кашлем, болями в грудине, кровохарканьем. 10 % ремиссий.
- На последнем этапе опухоль выходит за пределы легких и дает метастазы в отдаленные участки тела. Срок жизни при поздней диагностике – 1 год.
Молочные железы
- На начальных этапах опухоль занимает не более 20 мм, но ее можно найти при самостоятельном осмотре у возрастных пациентов. Лечение рака начальной стадии имеет положительный исход.
- Ко второй опухоль вырастает до 50 мм, а клетки уже начинают проникать в лимфоузлы. Все еще есть шанс выздороветь.
- Третья стадия связана с метастазированием в ближайший орган. Излечение невозможно, привлекается паллиативная медицина.
- Последний этап болезни предполагает расширение зоны метастазирования. Время жизни больного – около 1 года.
Шейка матки
- Нулевой стадии предшествует предраковое состояние дисплазии. Оба этапа поддаются полному излечиванию. Диагностировать их, как и последующие, легко.
- К первой стадии образование растягивается на 40–50 мм, но не покидает матку. Прогноз лечения благоприятный.
- На второй опухоль выходит за пределы органа, но метастазирования не происходит. Клиническая картина также показывает полное выздоровление.
- Заключительные приходят с метастазированием в органы пищеварения и мочеполовые. Лечению не поддаются.
Яичники
- На первой стадии опухоль развивается только в 1 яичнике. Лечение рака на ранних стадиях усложнено отсутствием симптомов.
- На втором этапе появляются незначительные признаки. Прогноз умеренно-благоприятный.
- В ходе третьей стадии образование вырастает во второй яичник и может продвигаться в фаллопиевы трубы, матку, брюшную полость. Больные жалуются на боли и тяжесть внизу живота, увеличение его размера, затрудненное опорожнение. Это опасная фаза с доживаемостью в 5 лет у не более 10 % пациенток.
- Последний этап связан с обширным метастазированием и не лечится. Болевой синдром дополнен слабостью и сильным похудением.
Пищевод
- На первой стадии опухоль находится в слизистой оболочке, протекает бессимптомно. Лечение имеет позитивный исход.
- На следующей она прорастает в брюшную стенку, но не выходит за пределы пищевода. Появляются признаки желудочного расстройства: боли в животе, отсутствие аппетита, вздутия, бледность. Шансы излечиться падают в два раза.
- Рак 3-й степени злокачественности переносится в лимфатические узлы. Кровоточивость опухоли является поводом для начала химиотерапии. В кале находят скрытую кровь. Выживаемость составляет от 15 до 35 %.
- Во время терминального этапа наблюдается множество метастазов, показано паллиативное лечение. Среди признаков: малокровие, острые боли, интоксикация и похудение, лихорадка.
Простата
- На первом этапе рост опухоли ограничен местом ее появления, а увидеть ее можно только с помощью микроскопического исследования. Данный рак 1-й стадии излечим.
- Ко второму этапу болезни образование также еще не прорастает в ближайшие ткани, но его уже можно диагностировать с помощью УЗИ.
- На 3-й стадии начинается инвазивный рост в ближайшие структуры, в лимфоузлах находят раковые клетки.
- Во время терминального этапа метастазы попадают также в легкие, кости и печень.
Головной мозг
- На начальном этапе опухоль не агрессивна и не распространяется. Показана операция, процент выживаемости большой. Симптоматика отсутствует.
- Вторая стадия характеризуется прорастанием образования в соседние структуры и зараженными лимфоузлами. Хирургическое вмешательство заканчивается успешно, если опухоль имеет четкие очертания и не находится глубоко в мозге.
- К третьей стадии у больного появляются тошнота, рвота, болевой синдром, головокружение. Операцию из-за низкой эффективности почти не назначают.
- Терминальная стадия с дальним метастазированием отличается деградацией функций организма (нарушение органов чувств, речи, двигательных возможностей, появление судорог и онемений и т. д.).
Скорость развития рака
Иногда в ходе деления клетки мутируют и начинают бесконтрольно делиться. Организм защищен от этого благодаря противоопухолевому иммунитету и другим встроенным механизмам. Но иногда они перестают работать, клетки разрастаются и формируют злокачественную опухоль. Почти никогда нельзя сказать, сколько времени занял этот процесс. В клинической медицине скорость развития болезни измеряется так называемым временем удвоения объема опухоли. Показатель у разных типов рака не одинаков. Агрессивным считается удвоение за 223 дня, неагрессивным – за 545. Аденокарцинома кишечника удваивается за 303, плоскоклеточный кожный рак – за 77, а мелкоклеточной тип онкологии легкого всего за 70 суток. Эти скорости значительны при размере опухоли более нескольких кубических сантиметров. Но чтобы дорасти до 1 см в кубе, опухоли необходимо в 30 раз больше времени. Поэтому раковые клетки некоторых типов развиваются годами (срок развития аденокарциномы в среднем составляет 20 лет).
Выживаемость по стадиям
В терапии онкозаболеваний критерием выздоровления является пятилетняя выживаемость с момента постановки диагноза – ремиссия. Почти всегда можно сказать, сколько живут с раком 1-й стадии и нулевой: случаи полного излечения стремятся к 100 %. На следующем этапе заболевание принимает более серьезный характер, но шанс вылечиться все еще высокий. 3-я стадия чаще всего характеризуется низкой ремиссией, целью терапии становится повышение качества жизни больного. Заключительный этап крайне редко заканчивается выздоровлением, больным назначаются обезболивающие процедуры.
Читайте также:

