Интерфероны в лечений хронического миелолейкоза
При невозможности аллотрансплантации костного мозга назначают интерферон альфа.
Интерфероны являются биологически активными веществами белковой природы, которые вырабатываются эукариотическими клетками в ответ на воздействие вирусов, антигенов, митогенов.
Известны три группы интерферонов: альфа, бета и гамма. С лечебной целью чаще всего применяют препараты интерферона альфа .
Биологические эффекты интерферонов многочисленны и разнообразны. Они обладают бактерицидным, противовирусным, иммуномодулирующим и цитостатическим действием. Интерфероны ингибируют ангиогенез , активируют клеточный иммунитет , подавляют экспрессию некоторых онкогенов и выработку цитокинов . В то же время они усиливают продукцию интерферон-регулирующего фактора 1 (активатора транскрипции с противоопухолевой активностью), молекул адгезии и антигенов HLA .
Конкретный механизм лечебного действия интерферонов неизвестен.
Дозы интерферона альфа показания к его применению и побочные эффекты были определены в неконтролируемых испытаниях. Оптимальная доза интерферона альфа при хроническом миелолейкозе составляет 5 млн МЕ/сут п/к. Препарат эффективен только в том случае, если лечение начато в первый год заболевания. Накопленный опыт показывает - чем позже начато лечение и чем хуже прогноз на момент постановки диагноза, тем меньше эффективность интерферона альфа.
Побочные эффекты интерферона альфа можно разделить на острые и хронические. К острым относится гриппоподобный синдром , который появляется в первые дни лечения и исчезает через 1-2 нед. В большинстве случаев он купируется парацетамолом . К хроническим побочным эффектам относятся утомляемость , сонливость , похудание , артралгия и миалгия . Они наблюдаются примерно у половины больных и могут потребовать снижения дозы препарата. Некоторые больные жалуются на кашель , зуд в носоглотке , сухость кожи . В числе редких осложнений описаны аутоиммунные тромбоцитопения и гемолитическая анемия .
Длительное лечение интерфероном альфа чревато аутоиммунными нарушениями, в частности гипотиреозом .
Лечению интерфероном альфа всегда сопутствуют неврологические расстройства . Чаще всего наблюдается сонливость . У 20% больных неврологические расстройства снижают работоспособность и нарушают жизненный уклад. Кроме того, терапевтические дозы препарата нередко вызывают импотенцию . Для ослабления этих побочных эффектов пытаются применять антидепрессанты , в частности амитриптилин .
Установлено также, что интерферон альфа обладает опиоидной активностью.
Налоксон блокирует эти эффекты интерферона aльфа in vitro и in vivo.
В Онкологическом центре М. Д. Андерсона (г. Хьюстон, штат Техас) проводится клиническое испытание другого блокатора опиатных рецепторов - налтрексона .
Гематологическая ремиссия достигается обычно через 1-2 мес после начала лечения интерфероном альфа. В некоторых случаях в течение первых нескольких месяцев лечения наблюдаются циклические колебания уровня лейкоцитов: сначала число лейкоцитов прогрессивно снижается, а затем развивается лейкоцитоз. Эти колебания не препятствуют достижению ремиссии.
Цитогенетический ответ начинается через 3-12 мес после начала лечения. Для достижения полной цитогенетической ремиссии в большинстве случаев достаточно 12-18 мес, но в некоторых случаях требуется от 6 мес до 4 лет.
По результатам неконтролируемых испытаний, полной цитогенетической ремиссии при монотерапии интерфероном альфа достигают 26% больных.
В контролируемых исследованиях изучалась сравнительная эффективность интерферона альфа и химиотерапии ; оказалось, что оба метода позволяют добиться гематологической ремиссии.
Частота гематологических и цитогенетических ремиссий при лечении интерфероном альфа в контролируемых испытаниях оказалась намного ниже, чем в неконтролируемых. Это, по-видимому, объясняется меньшими дозами препарата, неоднородностью больных (в исследования включали больных из группы высокого риска (по индексу Сокала; см. " Хронический миелолейкоз: прогноз "), отсутствием единого подхода к снижению дозы интерферона а и преждевременным прекращением лечения.
В трех контролируемых исследованиях (Итальянской многоцентровой исследовательской группы, Британского Совета медицинских исследований и Исследовательской группы по лейкозам Министерства здравоохранения и социального обеспечения Японии) было показано, что среди получающих интерферон альфа больных выживаемость выше. Интересно, что в первых двух исследованиях выживаемость возросла только в той группе, в которой был получен цитогенетический ответ, но в самой этой группе какой-либо связи между выраженностью цитогенетического ответа и выживаемостью не было.
Четвертое исследование (Немецкой исследовательской группы по хроническому миелолейкозу) не обнаружило увеличения выживаемости среди получающих интерферон альфа больных. Этот результат, вероятно, объясняется включением в исследование больных на поздних стадиях хронического миелолейкоза.
Принципиально новый этап в терапии хронического миелолейкоза (ХМЛ) начался с 80-х годов XX в. после появления в арсенале лечебных средств ИФН-а. При хроническом миелолейкозе препарат впервые начали применять в США в М. D. Anderson Cancer Center в 1981 г. Уже в первой публикации сообщалось, что при назначении человеческого лейкоцитарного ИФН-а в хронической стадии болезни в дозе от 3 до 9 MU сут (1 MU = 1 000 000 ME) в течение 2—3 мес у большинства больных получены гематологические ремиссии. Дальнейшие исследования показали, что ИФН-а является уникальным препаратом для лечения больных ХМЛ, так как позволяет получить гематологическую ремиссию и снизить уровень лактатдегидрогеназы и витамина В12, чего никогда не удавалось добиться цитостатическими препаратами. Сенсационным оказалось сообщение о том, что у 41 % больных уменьшилось количества Ph-позитивных клеток.
С внедрением в клиническую практику рекомбинантного ИФН-а во всех странах началось его активное использование, в том числе при хроническом миелоидном лейкозе (ХМЛ). Была изучена эффективность различных доз и режимов применения препарата. При ежедневной дозе 2—4 MU/m2 частота гематологического ответа с количеством лейкоцитов 9•109/л и менее и нормализацией лейкоцитарной формулы регистрировалась в 31—38 %, частота цитогенетического ответа — у 18—22 %, а полные цитогенетические ремиссии получены у 0—6—7 % больных. Даже в тех исследованиях, в которых с помощью указанных доз интерферона было получено большое число полных гематологических ремиссий, частота цитогенетического ответа не превышала указанных значений.
В то же время при ежедневной дозе ИФН-а 5 MU/м2 гематологический ответ был достигнут у 59—80%, цитогенетический — у 55—56%, полные цитогенетические ремиссии — у 26—32 % больных. Отечественный опыт подтверждает эти данные. В РАМН при начале лечения ИФН-а на первом году хронической стадии в дозе 3—5 MU через день цитогенетический ответ получили у 33 % больных, а в дозе 5—10 MU сут — у 84 %. Достоверное достижение лучших результатов при дозе интерферона 5 MU/м2 в день по сравнению с меньшими ежедневными дозами или назначением 5 MU/m2 3 раза в неделю подтверждено рандомизированными исследованиями.
Лечение интерфероном впервые привело к получению большого числа не только клинико-гематологических, но и цитогенетических ответов. Для реальной оценки и корректного сравнения результатов разных авторов были установлены следующие единые критерии гематологической и цитогенетической ремиссии, которые в настоящее время являются общепринятыми для оценки эффективности терапии ХМЛ:
- полная гематологическая ремиссия: количество лейкоцитов не превышает 10•10 9 /л, лейкоцитарная формула нормальная, количество тромбоцитов не более 450•10/л, симптомы болезни отсутствуют.
- частичная гематологическая ремиссия: количество лейкоцитов не превышает 10•10 9 /л, но в крови обнаруживаются незрелые гранулоциты, или остается увеличенной селезенка, или тромбоцитоз, однако эти признаки по величине не должны составлять более 50 % от исходных.
Цитогенетический ответ:
- полная онтогенетическая ремиссия: в крови и костном мозге цитогенетическими методами, в том числе методом FISH, не удается обнаружить Рп-по-зитивных клеток;
- частичная цитогенетическая ремиссия: удается обнаружить от 1 до 34 % Ph-позитивных клеток;
- большой цитогенетический ответ: сумма полных и частичных цитогенетических ремиссий;
- минимальный цитогенетический ответ: обнаруживается от 35 до 95 % Ph-позитивных клеток;
- отсутствие цитогенетического ответа: все исследованные клетки крови и костного мозга являются Ph-позитивными.
Анализ результатов многочисленных публикаций об использовании ИФН-а показал, что его применение позволяет получить полные гематологические ремиссии у 70—80 % ранее не леченных больных и почти у такого же числа уже получавших лечение цитостатическими препаратами. Цитогенетический ответ зарегистрирован почти у 60 % больных, в том числе большой цитогенетический ответ — у 20—40 % больных. Частота полных цитогенетических ремиссий составляет 13—32 %. Семь рандомизированных исследований, проведенных в разных странах и включавших суммарно данные о более 2000 больных в хронической стадии хроническим миелоидным лейкозом, показали достоверное увеличение продолжительности жизни при лечении ИФН-а: медиана выживаемости при лечении миелосаном или гидроксимочевиной составляла 41—56 мес, интерфероном — 61—72 мес, а в отдельных наблюдениях еще более.
Так, по данным Н. Kantarjian и соавт., общая медиана выживаемости при лечении интерфероном составила 89 мес, а в группе больных с благоприятным прогнозом — 104 мес. Даже у больных с неблагоприятным прогнозом медиана выживаемости при лечении ИФН-а превышает таковую у больных, леченных миелосаном или гидроксимочевиной. Метаанализ показал, что лечение интерфероном на 15 % увеличило 5-летнюю выживаемость по сравнению с полученной при цитоста-тической терапии. Предполагаемая на основании этих расчетов 10-летняя выживаемость должна составить 40 %, а для больных с полной цитогенетической ремиссией — 80 %. Как известно по данным всех публикаций, при цитостатической терапии 10-летний срок переживают лишь 5 %, в редких наблюдениях — 10 % больных.

В большинстве исследований показано, что продолжительность жизни связана с цитогенетическим ответом на терапию. Так, по данным М. D. Anderson Cancer Center, при лечении интерфероном 5-летняя выживаемость составила 90 % среди больных с полной цитогенетической ремиссией, 88 % — с частичной, 76 % — с малым цитогенетическим ответом и 38 % среди больных с отсутствием цитогенетического ответа. Аналогичные данные получены в других исследованиях: 3 года прожили 100 % больных при наличии цитогенетического ответа, 72 % — при его отсутствии, 5-летняя выживаемость составила 100 % в группе больных с полной цитогенетической ремиссией, 92 % — с частичной, 59 % — с малым цитогенетическим ответом, 47 % — с отсутствием цитогенетического ответа.
К сожалению, когда не только цитогенетическими методами, но и с помощью ПЦР не удается определить наличие Ph-позитивных клеток, полная цитогенетическая ремиссия в большинстве случаев оказывается временной. Показано, однако, что даже при отсутствии цитогенетического ответа 5-летняя выживаемость больных, получающих интерферон, выше, чем при лечении цитостатическими препаратами без интерферона, — 47 % и 34 % соответственно. Наши наблюдения подтверждают эти данные. Это показывает, что даже при отсутствии цитогенетического ответа, но при хорошей переносимости ИФН-а и отсутствии объективных побочных проявлений терапию интерфероном следует продолжать на протяжении всей хронической стадии заболевания.
При использовании ИФН-а в дозе 5 MU/м2 ежедневно у подавляющего числа больных гематологическая ремиссия достигается в течение 3—6 мес, а цитогенетический ответ в тех случаях, когда его удается получить, —в течение 12 мес. У ряда больных, вначале продемонстрировавших лишь минимальный ответ, в течение 18—24 мес удается получить большой цитогенетический ответ. Это показывает, что оценку чувствительности больного к ИФН-а следует проводить не ранее указанного срока.
Отмечена связь продолжительности жизни и времени ответа на терапию ИФН-а. Достоверно выше 5-летняя выживаемость среди больных, у которых полная гематологическая ремиссия получена в течение первых 8 мес терапии и цитогенетическая — в течение 24 мес, чем у ответивших на терапию ИФН-а позже (соответственно 78 и 48 % для гематологической ремиссии, 88 и 65 % для цитогенетической). Наиболее часто большой цитогенетический ответ удается получить у больных, у которых полная гематологическая ремиссия достигается в течение первых 3 мес лечения гидроксимочевиной и интерфероном. В этой же группе получена наилучшая 5-летняя выживаемость.
В костно-мозговом пунктате у больных хроническим миелоидным лейкозом в состоянии полной цитогенетической ремиссии обнаруживаются Ph-позитивные CD34+-клетки. В связи с этим высказывается мнение, что лечебное действие ИФН-а при хроническом миелоидном лейкозе (ХМЛ) обусловлено не элиминацией Ph-позитивных клеток, а восстановлением нормальных взаимоотношений между ними и микроокружением. Это обеспечивает подавление роста чрезмерно пролиферирующего клона, каковым является Ph-позитивный клон при хроническом миелоидном лейкозе (ХМЛ). Может иметь значение и обнаруженное при воздействии ИФН-а увеличение активности натуральных киллеров (NK-клеток).
Интерферон вводят подкожно или внутримышечно. При внутривенном введении препарат быстро выводится из организма, и эффект его действия значительно снижается. В большинстве случаев лечение сопровождается рядом побочных явлений. После первой инъекции практически всегда развивается гриппоподобный синдром с повышением температуры тела нередко до 38—39 °С с ознобом, тахикардией, общим недомоганием, миалгиями, иногда артралгиями. Этот синдром не представляет реальной опасности и быстро снимается приемом жаропонижающих средств. Все эти явления бывают выражены значительно слабее при профилактическом приеме жаропонижающих средств (лучше всего панадол или парацетамол) за 20—30 мин до инъекции препарата. Изредка возникают тошнота и рвота. К редким побочным явлениям относятся повышение или снижение артериального давления, появление цианоза конечностей, повышение уровня трансаминаз, протеинурия. У большинства больных при каждой следующей инъекции побочные явления выражены все слабее и постепенно стихают в первые 1—2 нед лечения.
При нерезко выраженных побочных явлениях многие больные предпочитают инъекции интерферона в вечерние часы, чтобы к утру не испытывать неприятных ощущений.
К поздним побочным эффектам, развивающимся у 10—20 % больных в результате длительного приема препарата, относятся снижение массы тела, редко — выпадение волос, периферические неврологические расстройства, чувство постоянной усталости, бессонница, депрессия, которая чаще возникает у пожилых пациентов; возможны явления паркинсонизма. Менее чем у 2 % больных развиваются гипоплазия костного мозга и аутоиммунная анемия или тромбоцитопения. К очень редким поздним аутоиммунным эффектам относятся гипотиреоидизм и синдром, напоминающий системную красную волчанку, появление плеврального или перикардиального выпота.
Развитие депрессии, паркинсонизма, системной красной волчанки и других аутоиммунных синдромов является показанием к немедленной отмене интерферона. Отмена препарата и назначение стероидных гормонов быстро ликвидируют все симптомы аутоиммунного процесса. Депрессия требует более длительного лечения с применением специальных средств и тщательного наблюдения за больным, так как она может сопровождаться суицидальными действиями.
Иногда после длительного периода хорошей переносимости ИФН-а периодически начинает повышаться температура тела, при этом отмечается снижение лечебного эффекта препарата. Нередко это объясняется образованием антител к интерферону. В подобных случаях целесообразно заменить препарат (интрон А на роферон А или наоборот).
Показано, что острые гриппоподобные явления при лечении больных хроническим миелоидным лейкозом ИФН-а выражены тем сильней, чем больше количество лейкоцитов. Это объясняют высвобождением цитокинов из гемопоэтических клеток, которые при хроническом миелоидном лейкозе содержат большое количество лейкотриенов, полипептидов, обусловливающих повышение температуры тела при воспалении.
Интерферон в качестве единственного препарата не следует назначать больному с высоким лейкоцитозом еще и потому, что под его влиянием количество лейкоцитов снижается очень медленно.
Лечение следует начинать с назначения цитостатического препарата, лучше всего гидроксимочевины. При снижении количества лейкоцитов до 10— 15•10 9 /л начинают лечение ИФН-а. Его можно использовать одновременно с цитостатическим препаратом в тех случаях, когда при отмене цитостатика обнаруживается тенденция к увеличению количества лейкоцитов. Если при лечении ИФН-а количество лейкоцитов стабильно сохраняется менее 5•109/л, лечение обычно проводят только интерфероном, хотя в отдельных наблюдениях получена лучшая выживаемость больных, получавших комбинацию ИФН-а с гидроксимочевиной или бусульфаном. В рандомизированном исследовании, проведенном в Германии (376 больных в хронической стадии ХМЛ), показано преимущество комбинированной терапии по сравнению с применением каждого препарата в отдельности: интерферон быстрей вызывает цитогенетическую ремиссию, гидроксимочевина — уменьшение опухолевой массы, а полная гематологическая ремиссия достигается значительно быстрей при комбинации препаратов.
Для уменьшения побочного действия интерферона рекомендуется начинать лечение с дозы 3 MU в день в течение недели. Затем дозу увеличивают до 5 MU в день на неделю, а затем назначают лечебную дозу 5 MU/м2 в день. Наш опыт показывает, что большинство больных хорошо переносят более быстрое наращивание дозы интерферона с выходом на лечебную дозу уже к концу 1-й недели.
У многих больных после нескольких месяцев лечения количество лейкоцитов снижается до 2,0— 1,5•10 9 /л, нередко с одновременным уменьшением количества тромбоцитов. В таких случаях лейкоцитарная формула оказывается нормальной, и обычно достигается та или иная степень цитогенетического ответа. Лечение интерфероном таких пациентов следует продолжить, снизив частоту введения препарата, поскольку назначение ИФН-а даже 1—3 раза в неделю в подобных случаях позволяет сохранить полную клинико-гематологическую, а нередко и цитогенетическую ремиссию на протяжении очень долгого времени, иногда на годы.
Существуют рекомендации снижать дозу интерферона только при содержании лейкоцитов 2•10 9 /л и тромбоцитов 50•10 9 /л, однако не все согласны с такими рекомендациями. Мы всегда уменьшаем дозу интерферона уже при количестве лейкоцитов менее 3•109/л и тромбоцитов менее 100•109/л. Большинство авторов снижают дозу интерферона и в тех случаях, когда у больного полная цитогенетическая ремиссия сохраняется на протяжении 2 лет.
Показано, что даже при длительном лечении ИФН-а у большинства пациентов не отмечается развития миелофиброза — постоянного спутника продолжительной миелосанотерапии. Предотвратить развитие миелофиброза удается только при использовании полных лечебных доз ИФН-а. При дозе 5 MU/м2 в день, особенно в комбинации с малыми дозами цитозин-арабинозида, удавалось не только предотвратить развитие миелофиброза, но и добиться его обратного развития.
Лечение ИФН-а существенно изменило прогноз при хроническом миелоидном лейкозе. Международной европейской группой экспертов разработана новая прогностическая модель на основании сопоставления клинико-гематологических признаков у 1303 больных хроническим миелоидным лейкозом до лечения и продолжительности их жизни при лечении ИФН-а. Эта прогностическая модель, получившая название Европейской модели, в настоящее время широко используется так же, как модель Sokal. Она имеет следующий вид:
0,6666 х индекс возраста [0, если возраст менее 50 лет, 1 — во всех других случаях] + 0, 0420 х размеры селезенки [сантиметры ниже реберной дуги] + 0,0584 х процент бластных клеток в крови + 0, 0413 х процент эозинофилов в крови + 0, 2039 х индекс базофилов [0, если базофилов в крови менее 3 %, 1 — во всех других случаях] + 1,0956 х х индекс тромбоцитов [0, если количество тромбоцитов менее 1500•109/л, 1— во всех других случаях] х 1000.
При прогностическом индексе менее 780 пациент относится к группе благоприятного прогноза, при индексе более 780, но менее 1480 — промежуточного, при индексе более 1480 — неблагоприятного прогноза. Медиана выживаемости при лечении ИФН-а оказалась равной 98 мес для больных с благоприятным прогнозом, 65 мес — с промежуточным и 42 мес — с неблагоприятным прогнозом, а 5-летняя выживаемость — соответственно 76, 55 и 25 %. Ценность этой прогностической модели подтверждена разными исследовательскими группами при использовании ее для определения предполагаемой выживаемости больших групп больных при лечении ИФН-а. Получено практически полное совпадение расчетных и истинных результатов.
Наилучшие результаты по длительности хронической стадии болезни и выживаемости при лечении ИФН-а достигаются в тех случаях, когда полная клинико-гематологическая ремиссия получена после 6 мес лечения, частичная цитогенетическая ремиссия — не поздней 12 мес, полная — к концу 2-го года лечения.

Что такое хронический миелолейкоз?

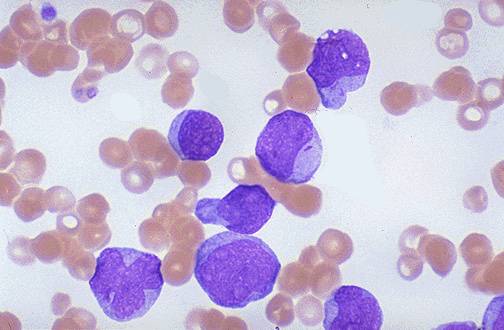
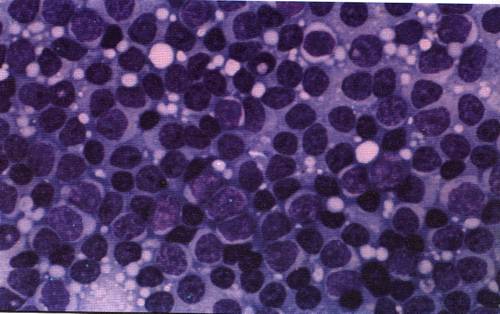
Мазок крови пациента с хроническим миелолейкозом
Хронический миелолейкоз (ХМЛ) — злокачественное новообразование кроветворной ткани, сопровождающееся прогрессирующей пролиферацией незрелых гранулоцитов. Заболевание изначально обладает вялотекущим характером, постепенно перетекая в стадию обострения с выраженной симптоматикой и образованием системных нарушений. Является одной из самых опасных и инвалидизирующих болезней.
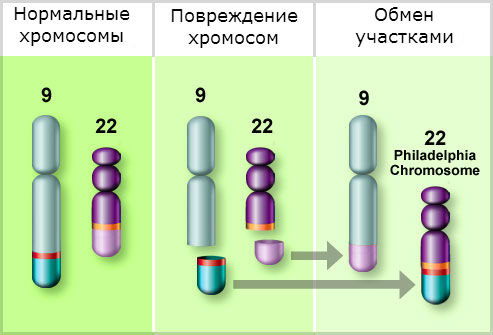
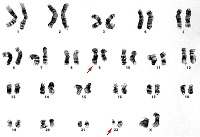
ХМЛ — первое онкологическое заболевание, у которого определена связь между развитием канцерогенеза и мутацией в гене. Характерная аномалия основана на транслокации 9-й и 22-й хромосом, то есть участки данных хромосом меняются местами, образуя аберрантную хромосому. Выявлена мутировавшая хромосома исследователями из Филадельфии, поэтому она получила название филадельфийская или Ph-хромосома.
Причины развития

Негативное воздействие на кроветворение оказывают ядохимикаты
Заболевание известно науке с 1811 года, но до сих пор факторы, провоцирующие мутацию в гене, определить не удалось. Существует ряд причин, способствующих развитию патологии:
- радиоактивное облучение, в том числе при лучевой терапии;
- химиотерапия иных онкологических заболеваний;
- ряд генетических заболеваний, характеризующихся хромосомной аномалией (например, синдром Дауна);
- взаимодействие с химическими соединениями (нефтепродукты, пестициды).
Патогенез хронического миелолейкоза

Патогенез хронического миелолейкоза
Гибридный ген BCR-ABL 1, образованный в результате транслокации хромосом, продуцирует синтез белка BCR-ABL. Данный белок представляет собой тирозинкиназу, которая в норме способствует передаче сигнальных импульсов для роста клетки. Созданная путём мутации тирозинкиназа становится активным фактором пролиферации клеток, они начинают делиться и распространяться уже независимо от факторов роста. Происходит процесс создания клонов мутировавшей клетки.
Бесконтрольное деление сопровождается нарушением апоптоза — запрограммированной гибели клеток. Также гибридная тирозинкиназа подавляет естественные функции восстановления в молекулах ДНК, создавая предпосылки для последующих мутаций, что усугубляет патологический процесс.
Размножающиеся клетки являются незрелыми, бластными предшественниками полноценных элементов крови. Постепенно бластные клетки вытесняют функциональные эритроциты, тромбоциты и лейкоциты. Добавляются нарушения и в других хромосомах, что запускает ускоренный процесс разрушения организма в целом.
Стадии хронического миелолейкоза

Бластный криз — одна из стадий миелолейкоза
- Хроническая — 30% бластных клеток. Стадия характеризуется агрессивным характером мутировавших клеток, состояние пациента резко ухудшается. Дополнительные аномалии как в гене BCR-ABL, так и в геноме в целом, провоцируют цепь патологических реакций, которые уже практически не поддаются лечению. На этом этапе могут поражаться ткани внутренних органов, кожные покровы и слизистые оболочки, миелоидные клетки преобразовываются в саркому.
Симптомы и признаки

Признаки ХМЛ становятся заметны ближе к прогрессирующей стадии.
- Симптомы опухолевой интоксикации: снижение массы тела, быстрая утомляемость, волнообразное повышение температуры, кожный зуд, тошнота, суставные боли.
- Симптомы опухолевой пролиферации — увеличение селезёнки и печени, боль в левом подреберье, поражение кожных покровов.
- Анемический синдром — головокружение, выраженная бледность, учащённое сердцебиение, чувство нехватки воздуха.
- Геморрагический синдром — склонность к кровоточивости слизистых оболочек, сыпь в виде красных точек, длительное кровотечение при незначительных порезах.
Диагностика заболевания

Один из методов диагностики заболевания — рентгенологический
Диагностика ХМЛ включает:
- Первичный осмотр пациента с изучением анамнеза, жалоб, а также исследование при помощи пальпации размеров селезёнки и печени.
- Общий анализ крови выявляет число и характеристики форменных элементов крови.
- Биохимический анализ проводится для определения уровня билирубина, электролитов, глюкозы, ЛДГ, АСТ, АЛТ.
- Гистологическое исследование костного мозга определяет скопления бластных клеток.
- Цитогенетический анализ выявляет транслокацию хромосом.
- На 3-й стадии проводится иммунофенотипирование для идентификации бластных клеток.
- Метод генного секвенирования применяется для выявления генных мутаций.
- Проводится УЗИ внутренних органов, в первую очередь селезёнки и печени.
- Дополнительно назначают рентгенографию органов грудной клетки, ЭКГ, эхокардиографию, ИФА на маркеры различных заболеваний, коагулограмму и другие исследования.
Лечение

Основа лечения — ингибиторы тирозинкиназы
Выбор препарата и доза определяются в зависимости от стадии ХМЛ и риска побочных эффектов. Обычно лечение начинается с приёма иматиниба в дозировке 400 мг/день при начальной стадии, 600 мг/день при последующих стадиях, затем дозу могут увеличивать или снижать. Различные аберрации в генах обусловливают низкую чувствительность к препаратам, поэтому пациенту могут менять одни ингибиторы на другие.

Трансплантация костного мозга
Если терапия не оказывает действия, рекомендуется аллогенная трансплантация костного мозга. Новые стволовые клетки могут выработать здоровые элементы кровеносной системы. Но операция сопряжена с рядом высоких рисков.
Терапия препаратами интерферона назначается обычно в 1-й стадии ХМЛ, так как не обладает эффективностью при последующих.
Для уменьшения массы опухоли и при отсутствии результата в лечении ингибиторами проводится химиотерапия. В стадии бластного криза используется полихимиотерапия аналогично лечению острого лейкоза.
Лучевая терапия может быть назначена в случае выраженной спленомегалии. При риске разрыва селезёнки проводят спленэктомию.
Профилактика и прогноз

Прогноз заболевания определяет врач
Причина образования ХМЛ не установлена, поэтому профилактикой являются меры по избеганию контактов с канцерогенными веществами, воздействия радиоактивного облучения.
Прогноз определяется стадией и тяжестью болезни. Одна из прогностических моделей (Kantarjian H.M.) включает факторы:
- преклонный возраст пациента при постановке диагноза;
- концентрация бластных клеток в крови ≥ 3%, в костном мозге ≥ 5%;
- концентрация базофилов ≥ 7%;
- концентрация тромбоцитов ≥ 700*10 9/л;
- выраженная спленомегалия.
Хронический миелолейкоз - опухолевое заболевание крови. Характеризуется бесконтрольным ростом и размножением всех ростковых клеток крови, при этом молодые злокачественные клетки способны созревать до зрелых форм.
Во время хронического миелолейкоза в крови повышается содержание особой разновидности лейкоцитов – гранулоцитов. Они образуются в красном костном мозге в огромном количестве и выходят в кровь, не успевая до конца созреть. Одновременно содержание всех остальных видов лейкоцитов снижается.
Причины хронического миелолейкоза
Причины хромосомного нарушения, приводящего к хроническому миелолейкозу, до сих пор изучены недостаточно.
Считается, что имеют значение следующие факторы:
![]()
Слабые дозы радиации. Их роль доказана только у 5% больных.- Электромагнитные излучения, вирусы и некоторые химические вещества – их влияние не доказано окончательно.
- Применение некоторых лекарственных препаратов. Известны случаи возникновения хронического миелолейкоза при лечении цитостатиками (противоопухолевые препараты) в сочетании с лучевой терапией.
- Наследственные причины. Люди с хромосомными нарушениями (синдром Клайнфелтера, синдром Дауна) имеют повышенный риск хронического миелоидного лейкоза.
- Клетки размножаются неконтролируемо, как раковые.
- Для этих клеток перестают работать естественные механизмы гибели.
Фазы хронического миелолейкоза
- Хроническая фаза. В этой фазе находится большинство пациентов, которые обращаются к врачу (около 85%). Средняя продолжительность – 3 – 4 года (зависит от того, насколько своевременно и правильно начато лечение). Это стадия относительной стабильности. Пациента беспокоят минимальные симптомы, на которые он может не обращать внимания. Иногда врачи выявляют хроническую фазу миелолейкоза случайно, при проведении общего анализа крови.
- Фаза акселерации. Во время этой фазы патологический процесс активируется. Количество незрелых белых кровяных телец в крови начинает быстро нарастать. Фаза акселерации является как бы переходной от хронической к последней, третьей.
- Терминальная фаза. Финальная стадия болезни. Возникает при нарастании изменений в хромосомах. Красный костный мозг практически полностью замещается злокачественными клетками. Во время терминальной стадии пациент погибает.
Проявления хронического миелолейкоза
![]()
Вначале симптомы могут полностью отсутствовать, либо они выражены настолько слабо, что больной не придает им особого значения, списывает на постоянное переутомление. Заболевание выявляется случайно, во время очередной сдачи общего анализа крови.- Нарушение общего состояния: слабость и недомогание, постепенная потеря веса, снижение аппетита, повышенная потливость по ночам.
- Признаки, обусловленные увеличением размеров селезенки: во время приема пищи больной быстро наедается, боли в левой части живота, наличие опухолевидного образования, которое можно прощупать.
- Признаки, связанные с нарушением функции тромбоцитов и белых кровяных телец: различные кровотечения либо, напротив, образование тромбов.
- Признаки, связанные с повышением количества тромбоцитов и, как следствие, повышением свертываемости крови: нарушение кровообращения в головном мозге (головные боли, головокружения, снижение памяти, внимания и пр.), инфаркт миокарда, нарушение зрения, одышка.
- Резкая слабость, значительное ухудшение общего самочувствия.
- Длительные ноющие боли в суставах и костях. Иногда они могут быть очень сильными. Это связано с разрастанием злокачественной ткани в красном костном мозге.
- Проливные поты.
- Периодическое беспричинное повышение температуры до 38 - 39⁰C, во время которого возникает сильный озноб.
- Снижение массы тела.
- Повышенная кровоточивость, появление кровоизлияний под кожей. Эти симптомы возникают в результате уменьшения количества тромбоцитов и снижением свертываемости крови.
- Быстрое увеличение размеров селезенки: живот увеличивается в размерах, появляется чувство тяжести, боли. Это происходит за счет роста опухолевой ткани в селезенке.
Диагностика заболевания
| Название исследования | Описание | Что выявляет? |
| Общий анализ крови | Рутинное клиническое исследование, выполняется при подозрении на любые заболевания. Общий анализ крови помогает определить общее содержание лейкоцитов, их отдельных разновидностей, незрелых форм. Кровь для анализа берут из пальца или вены в утренние часы. |
Симптомы
- Приапизм – болезненная, чрезмерно длительная эрекция.
Данные симптомы это предвестники тяжелого состояния (бластного криза), появляются за 6- 12 месяцев до его начала.
- Снижается эффективность лекарств (цитостатиков)
- Развивается анемия
- Увеличивается процент бластных клеток в крови
- Ухудшается общее состояние
- Увеличивается селезенка
- Симптомы соответствую клинической картине при остром лейкозе (см. Острый лимфолейоз).
Как лечат миелолейкоз?
Цель лечения снизить рост опухолевых клеток и уменьшить размеры селезенки.
Лечение заболевания должно быть начато сразу после того, как установлен диагноз. От качества и своевременности терапии во многом зависит прогноз.
Лечение включает различные методы: химиотерапия, лучевая терапия, удаление селезенки, пересадка костного мозга.
Химиотерапия
- Классические препараты: Миелосан (Милеран, Бусульфан), Гидроксиуреа (Гидреа, Литалир), Цитозар, 6-меркаптопурни, альфа-интерферон.
- Новые препараты: Гливек, Спрайсел.
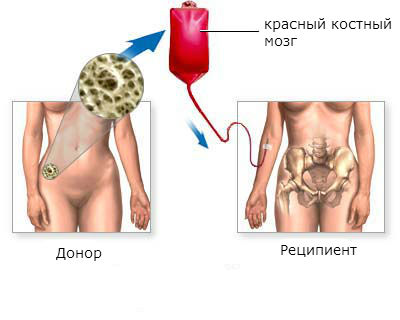
Пересадка костного мозга даёт возможность полностью выздороветь больным хроническим миелолейкозом. Эффективность пересадки выше в хронической фазе заболевания, в остальных фазах гораздо ниже.
Трансплантация красного костного мозга является наиболее эффективным методом лечения хронического миелоидного лейкоза. Более чем у половины пациентов, которым была произведена пересадка, наступает стойкое улучшение в течение 5 лет и дольше.
Чаще всего выздоровление происходит в том случае, когда красный костный мозг пересаживают больному моложе 50 лет в хроническую фазу заболевания.
Этапы трансплантации красного костного мозга:
- Поиск и подготовка донора. Лучшим донором стволовых клеток красного костного мозга является близкий родственник больного: близнец, брат, сестра. Если близких родственников нет, или они не подходят, ищут донора. Проводят ряд тестов для того, чтобы убедиться, что донорский материал приживется в теле пациента. Сегодня в развитых странах созданы большие банки доноров, в которых находятся десятки тысяч донорских образцов. Это дает шанс быстрее найти подходящие стволовые клетки.
- Подготовка пациента. Обычно этот этап продолжается от недели до 10 дней. Проводят лучевую терапию и химиотерапию для уничтожения как можно большего количества опухолевых клеток, предотвращения отторжения донорских клеток.
- Собственно пересадка красного костного мозга. Процедура похожа на переливание крови. В вену пациента заводят катетер, через который в кровь вводят стволовые клетки. Они какое-то время циркулируют в кровотоке, а потом оседают в костном мозге, приживаются там и начинают работать. Для предотвращения отторжения донорского материала врач назначает противовоспалительные и противоаллергические средства.
- Снижение иммунитета. Донорские клетки красного костного мозга не могут прижиться и начать функционировать сиюминутно. Для этого нужно время, обычно 2 – 4 недели. В течение этого срока у больного сильно снижен иммунитет. Его помещают в стационар, полностью ограждают от контакта с инфекциями, назначают антибиотики и противогрибковые средства. Этот период является одним из самых сложных. Сильно повышается температура тела, в организме могут активироваться хронические инфекции.
- Приживление донорских стволовых клеток. Самочувствие пациента начинает улучшаться.
- Восстановление. В течение нескольких месяцев или лет функция красного костного мозга продолжает восстанавливаться. Постепенно пациент выздоравливает, восстанавливается его работоспособность. Но он все еще должен находиться под наблюдением врача. Иногда новый иммунитет не может справиться с некоторыми инфекциями, в этом случае примерно через год после пересадки костного мозга делают прививки.
Проводится в случаи отсутствия эффекта от химиотерапии и при увеличенной селезенке после приема медикаментов (цитостатиков). Метод выбора при развитии локальной опухоли (гранулоцитарная саркома).
В какой фазе заболевания применяется лучевая терапия?
Лучевая терапия используется в развернутой стадии хронического миелолейкоза, которая характеризуется признаками:
- Значительное разрастание опухолевой ткани в красном костном мозге.
- Рост опухолевых клеток в трубчатых костях 2.
- Сильное увеличение печени и селезенки.
Применяется гамма-терапия – облучение области селезенки гамма-лучами. Основная задача – уничтожить или прекратить рост злокачественных опухолевых клеток. Лучевую дозу и режим облучения определяет лечащий врач.
| К длинным трубчатым костям относят кости плеча, предплечья, пальцев, голени, бедра. В детстве эти кости целиком заполнены красным костным мозгом. У взрослого человека красный костный мозг сохраняется только в головках костей, а в теле кости он замещается на желтый костный мозг (жир). При хроническом миелоидном лейкозе желтый костный мозг может быть вытеснен опухолевой тканью. |
Удаление селезенки используется редко по ограниченным показаниям (инфаркт селезенки, тромбоцитопения, выраженный дискомфорт в животе).
Операцию обычно проводят в терминальную фазу заболевания. Вместе с селезенкой из организма удаляют большое количество опухолевых клеток, тем самым облегчая течение заболевания. После операции обычно увеличивается эффективность медикаментозной терапии.
Каковы основные показания к операции?
- Разрыв селезенки.
- Угроза разрыва селезенки.
- Значительное увеличение органа в размерах, что приводит к сильному дискомфорту.
При высоких уровнях лейкоцитов (500,0 · 10 9 /л и выше), могут использовать лейкаферез для предотвращения осложнений (отек сетчатки, приапизм, микротромбозы ).
При развитии бластного криза, лечение будет таким же, как при острых лейкозах (см. острый лимфолейкоз).
Лейкоцитаферез – лечебная процедура, напоминающая плазмаферез (очищение крови). У пациента берут определенное количество крови и пропускают через центрифугу, в которой она очищается от опухолевых клеток.
В какой фазе заболевания проводят лейкоцитаферез?
Так же, как и лучевую терапию, лейкоцитаферез проводят во время развернутой стадии миелолейкоза. Нередко его применяют в тех случаях, когда отсутствует эффект от применения лекарственных средств. Иногда лейкоцитаферез дополняет медикаментозную терапию.
Читайте также: