Хирургическое лечение рака желудка современные аспекты
Рак желудка — это диагноз, который пугает каждого человека. С современной экологией и принципами образа жизни, количество людей с подобным диагнозом растет с каждым годом. В 90% случаев — причина развития злокачественного процесса – хронический гастрит ассоциированный с Helicobacter Pylori.
Как любая онкологическая патология, заболевание имеет 3 типа лечебного воздействия:
3. Симптоматическое лечение – лечение направленно на устранение симптомов заболевания, без удаления первичной опухоли. Выполняется пациентам с 4 стадией заболевания, либо при больших местнораспространённых опухолях.

Выбор оперативного вмешательства всегда решается индивидуально для каждого пациента, исходя из множества факторов.
Радикальные хирургические вмешательства
Эндоскопические методики – это одни из самых современных направлений в желудочной хирургии рака, которые впервые совершили прорыв в лечении в Японии. Суть метода заключается в том, что врач — эндоскопист во время проведения ФГДС иссекает опухоль в пределах жизнеспособных тканей. И пациент без выполнения больших и травматичных операций продолжает жить дальше! Но у данного метода существуют значительные ограничения: он показан пациентам только с самым ранним раком желудка, на том этапе, пока опухоль локализуется только в поверхностных слоях эпителия. К сожалению, на данной стадии рак абсолютно не имеет никаких симптомов, а подобные операции в России носят скорее казуистический характер.
Резекция (удаление части органа) – является органосохраняющей операцией. Суть состоит в удалении части органа с опухолью и окружающими опухоль лимфоузлами (лимфодиссекция). Резекции желудка бывают двух видов: дистальная и проксимальная. Выбор вида резекции зависит от того в какой части органа растёт опухоль.
Операция завершается восстановлением непрерывности желудочно-кишечного тракта при помощи подшивания тонкой кишки к стенке резецированного органа с формированием анастомоза (искусственного соустья).
Самая объёмная операция на желудке при раке — гастрэктомия. Она заключается в полном удалении органа. Эту операцию выполняют, при наличии хотя бы одного из следующих условий:
- рак тела желудка;
- диффузно-инфильтративный характер роста опухоли;
- недифференцированные формы рака (перстневидноклеточный).
Восстановление непрерывности желудочного – кишечного тракта после удаления органа заключается в подшивании к пищеводу тонкой кишки.
Резекцию желудка и гастрэктомию выполняют также и в качестве паллиативных операций при развитии жизнеугрожающих состояниях для пациента.
Симптоматические хирургические вмешательства
Как уже было сказано, основная цель симптоматического лечения – это повышение качества жизни пациента, вылечить которого уже по тем или иным причинам невозможно. Опухоль на этом этапе разрастается настолько сильно, что перекрывает просвет органа, делая невозможным питание пациента. Наиболее частые жалобы: тошнота, ощущение переполнения желудка даже при приёме незначительного количества пищи, рвота съеденной едой. Главная миссия врачей – восстановить возможность питания.
Итак, рассмотрим наиболее типовые операции.
Гастростомия – операция, суть которой сводится к формированию соустья (гастростома) между желудком и внешней средой. Показанием для такого вида лечения являются неудалимые опухоли пищеводно-желудочного перехода. Гастростома позволяет пациенту принимать пищу не через рот, а сразу в желудок, что спасает его от истощения.
Гастроэнтероанастомоз – это обходной анастомоз, который формируется между непоражённой частью органа и тонкой кишкой при больших опухолях выходного отдела. Таким образом, пища сначала попадает в желудок, затем эвакуируется сразу в тонкую кишку, минуя опухоль.
Этот вид симптоматической операции является наиболее физиологичным для пациента.
Это, пожалуй, самый последний предел хирургического лечения, применяемый при тотальном поражении желудка раковой опухолью, когда стенка проросла новообразованием во всех отделах, и нет возможности выполнить какую-либо другую операцию. В таком случае начальный участок тонкой кишки подшивается к передней брюшной стенке и формируется соустье между кишкой и внешней средой (еюностома). Питание пациент получает непосредственно в кишку, что позволяет ему не умереть от мучительной голодной смерти.
Одним из самых современных видов симптоматического лечения является расширение опухолевого стеноза. При этом методе врач — эндоскопист раздвигает участок ракового сужения при помощи стента (своеобразная каркасная распорка), позволяя пациенту питаться через рот достаточно длительное время. К сожалению, в настоящее время метод практикуется не во всех лечебных учреждениях.
Консультации врача при появлении первых жалоб и ежегодный скрининг органов ЖКТ помогут выявить рак на начальной стадии. Это сэкономит потраченное на лечение время, деньги, здоровье. И нужно всегда помнить, что рак излечим при своевременном обращении. Необходимость удаления всего органа (или другая операция при раке желудка) и срок жизни после операции напрямую зависит от стадии процесса, когда началось лечение. Рак желудка после операции требует от пациента особого подхода, который заключается в радикальном изменении образа жизни, принципов питания и трудового режима.

В последнее время наметилась четкая тенденция в сторону улучшения всех показателей, связанных с хирургией рака желудка: возрастает резектабельность опухоли, снижается послеоперационная летальность, улучшаются отдаленные результаты. Увеличение резектабельности и улучшение отдаленных результатов являются прямым результатом изменения подходов к хирургическому лечению рака желудка, а именно применения расширенной лимфодиссекции при раке желудка [32, 33]. Лимфодиссекция при РЖ позволяет превентивно удалить лимфоузлы первого, второго и третьего этапов метастазирования (при этом установить истинную распространенность процесса), повысить радикальность операции, тем самым улучшить результаты хирургического лечения.
На IV Международном Конгрессе по Раку Желудка (New-York, USA, 2001) и на 18 Всемирном Конгрессе по Хирургии Желудочно-Кишечного Тракта (Hong Kong, 2002) лимфодиссекция D2 определена как стандартный объем радикального хирургического вмешательства, т.к. достоверно снижает частоту рецидивов и улучшает отдаленные результаты лечения. Считается, что при лимфодиссекции D2 должно удаляться не менее 27 лимфоузлов, при D3 - не менее 40 лимфоузлов. На сегодняшний день можно постулировать, что больные, которым при оперативном лечении не произведена лимфодиссекция D2, должны считаться пациентами с неустановленной стадией [5, 7, 18].
Японские сообщения, использующие ретроспективный (исторический) анализ и японские системы распространения и стадирования, показали, что выполнение расширенной лимфаденэктомии при потенциально излечимом РЖ безопасно и может улучшить отдаленные результаты по сравнению с полученными в период до применения операций D2 [60, 61, 62].
Особенностью британского рандомизированного исследования было стадирование во время лапаротомии. Из 737 пациентов только 400 попали в рандомизацию. Послеоперационная летальность в группе D2 составила 13 %, в группе D1 - 6,5 %, частота прочих осложнений - 46 и 28 % (в том числе несостоятельность анастомоза соответственно в 26 и 11 % случаев). 5 лет выжили 33 % после D2 диссекции, а после D1 - 35 %. Таким образом, по результатам двух рандомизированных исследований было сделано заключение, что диссекция лимфоузлов по D2 не может быть включена для стандартного использования в практике лечения РЖ [IARC, 1994].
Голландские, английские и южноафриканские исследователи считают, что рост осложнений после диссекции по D2 в первую очередь связан с резекцией поджелудочной железы и удалением селезенки [44, 76]. В двух японских публикациях поддерживается европейская точка зрения об ответственности спленопанкреатоэктомии за ухудшение отдаленных результатов при D2 и увеличение числа послеоперационных осложнений [54, 55]. Вместе с тем, существуют исследования [25, 26, 60, 61], в которых было показано, что выполнение расширенных операций с лимфодиссекцией в объеме D2 позволяет снизить частоту местных рецидивов с 40 до 22 %. Так, Итальянская Группа Исследования Рака Желудка провела кооперативное исследование эффективности расширенной лимфаденэктомии [35]. Летальность составила 3,1 %, хирургические осложнения развились у 16,7 % больных. Средняя продолжительность госпитализации равнялась 17 дням. Другой итальянский коллектив хирургов проанализировал отдаленные результаты операций D2/D3 по сравнению с D1 и получил значительную разницу: 5-летняя выживаемость составила 66,3 % против 41,5 %. Также имеются данные итальянских авторов по результатам лечения распространенного РЖ за 30-летний период. При сравнении данных за более ранний период (когда применялась субтотальная резекция желудка с региональной лимфодиссекцией D1) с более поздним периодом (когда стала применяться тотальная гастрэктомия с расширенной лимфодиссекцией D2) частота лечебных лимфодиссекций повысилась с 28 до 60 %, смертность уменьшилась с 22 до 8 %, 2-летняя выживаемость увеличилась с 20 до 35 % [41].
Первичным основанием для удаления регионарных лимфоузлов при раке желудка является высокая частота обнаружения в них метастазов у больных с резектабельными опухолями. Метастазы в лимфоузлы группы N1 по японской классификации обнаруживались с частотой 12-49 %, в группе N2 - от 4-23 % [61, 62, 70, 73]. М. Sasako et al. [70, 71, 72] постулировали, что удаление каждой конкретной группы лимфоузлов имеет смысл, только если:
1) частота метастазирования в узлы данной локализации достаточно высока;
2) есть примеры отдаленного выживания после изолированного хирургического удаления данных метастатических узлов.
По данным этих же авторов, среди больных с гистологически подтвержденными метастазами в узлы анатомической группы N2 после их полного хирургического удаления 5 лет переживают от 20 до 40 %. В последующем похожие цифры были получены в других японских и европейских институтах [52, 67]. Эти факты послужили достаточным основанием для того, чтобы считать обоснованность операций D2 доказанной.
В настоящее время спленэктомия является комбинированной операцией, и, согласно требованиям Японской классификации, она обязательно должна выполняться при лимфаденэктомии Д2 при опухолях верхней и средней третей желудка - т.е. практически при всех гастрэктомиях. В хирургической среде сложилось ошибочное представление о том, что роль селезенки в организме взрослого человека незначительна, а выполнение спленэктомии можно сравнить с утратой рудиментарного органа. Современные исследования показали, что сама спленэктомия, особенно в хирургии рака желудка, имеет для пациента много нежелательных последствий [37, 78, 79]. Как утверждают эти исследователи, спленэктомия может приводить к увеличению до 20 % послеоперационных осложнений, в основном за счет гнойно-септических, таких как поддиафрагмальный абсцесс, панкреатический свищ и пневмония. При этом большинство авторов считают, что спленэктомия не влияет на послеоперационную летальность [13, 34].
Отношение к стандартной спленэктомии по-прежнему неоднозначно, и существует большое количество данных, указывающих, что удаление селезенки ухудшает непосредственные и даже отдаленные результаты [28, 29, 42, 56, 80]. J.R. Griffith et al. [42] сообщили, что после гастрэктомии со спленэктомией частота послеоперационных осложнении и летальность составили 41,5 и 12 %, а без нее - 35 и 14 % соответственно.
Изучение влияния спленэктомии на непосредственные и отдаленные результаты гастрэктомии указывает на некоторое ухудшение непосредственных результатов при вмешательствах, сопровождавшихся спленэктомией. При анализе отдаленных результатов лечения при разных стадиях рака желудка выяснилось, что у больных со спленэктомией при I стадии отдаленные результаты лечения рака ухудшаются с 58,2 до 50 %, а при II стадии - улучшаются с 42,5 до 62,5 % соответственно. При III и IV стадии статистическая разница не достоверна - соответственно 24,2 и 25 % [3]. По данным R. Martin [63, 64] частота осложнений после изолированной гастрэктомии составляет 28 %, после нее же со спленэктомией - 38 %. Кроме того, при расширенной гастрэктомии удаление селезенки является фактором риска формирования левостороннего поддиафрагмального абсцесса. Так, в группе расширенных операций в 50 % случаев выявлен поддиафрагмальный абсцесс в ложе удаленной селезенки, Н.Н. Симонов [20] отмечал левосторонние абсцессы в 11 % наблюдений, в то же время адекватное дренирование брюшной полости позволяло ликвидировать возникшее осложнение. Объяснение этому факту уже представлено в литературе: спленэктомия ведет к острой иммуносупрессии и повышению частоты абсцессов и других гнойно-септических осложнений [28, 29, 77]. Подавление функции Т-лимфоцитов настолько заметно, что для ее коррекции даже предлагается аутотрансплантация селезенки [66]. Некоторые авторы считают, что спленэктомия вообще должна выполняться только по специальным показаниям у больных раком III-IV стадий [80], при низкодифференцированных опухолях, раке верхней трети желудка, диффузной форме рака желудка [13].
В зарубежной литературе последних лет активно дискутируется вопрос о целесообразности спленэктомии при раке желудка [57, 69, 80]. В Японии с 2002 года начато рандомизированное исследование (протокол JCOG 0110-MF) по оценке влияния спленэктомии у больных проксимальным раком желудка на выживаемость и послеоперационные осложнения.
По данным разных исследователей, частота метастазирования в лимфатические узлы ворот селезенки при поражении средней трети желудка составляет до 1,9 %, тогда как при локализации рака в верхней трети она достигает 15,5 %, при тотальном поражении желудка - 26,7 % [29, 56]. H.R. Numberger et al. выявили метастазы рака желудка в лимфатических узлах ворот селезенки только у пациентов с III и IV стадиями заболевания. Наличие метастазов в лимфатических узлах 10-й группы значительно снижает 5-летнюю выживаемость больных раком желудка. По данным Н. Maruoka et al, она равна 19,5 %, а при отсутствии метастазов - 52,8 % [49].
К сожалению, в настоящее время нет методов диагностики, которые бы определяли объем операции в зависимости от поражения лимфатических узлов ворот селезенки. Основными критериями выбора хирургической тактики являются данные ретроспективного анализа результатов патоморфологического исследования материала после расширенных операций. На основании этого опыта определяются факторы прогноза вероятности поражения лимфатических узлов 10-й группы. Так, большинство авторов не обнаружили метастазов в лимфатических узлах ворот селезенки у пациентов при локализации рака в средней и проксимальной третях желудка с распространением опухоли до субсерозной оболочки. Что свидетельствует о том, что спленэктомия не увеличивает радикализм при вышеуказанной глубине инвазии опухоли [45, 54, 65, 69]. К. Yoshino et al. [80] в своей работе показали, что при раннем раке 5-летняя выживаемость была выше в группе пациентов с сохранением селезенки.
Коллективы хирургов Т. Kaetsu et al., Н. Ito et al. в исследовании показали, что метастазы в лимфоузлы 10-й группы возникают, если опухоль проксимального отдела желудка прорастает глубже мышечного слоя стенки, более 5 см в диаметре, обладает инфильтративным типом роста и расположена на задней стенке или большой кривизне. При опухолях малой кривизны и меньшего распространения, считают они, в спленэктомии необходимости нет [49].
По данным А.Ф. Черноусова и соавт. [22], метастазы в лимфоузлы № 10 не встречаются при локализации рака в нижней трети желудка и обнаруживаются в 10 и 6 % при его преимущественном расположении в верхней и средней третях соответственно. Во всех случаях это были низкодифференцированные, в том числе перстневидно-клеточные и муцинозные, опухоли инфильтративно-язвенной или диффузной макроскопических форм.
Из представленных данных следует, что метастазы в лимфоузлы селезенки встречаются только при опухолях верхней и средней трети желудка, прорастающих серозу, и низкодифференцированной структуры. Расположение опухоли в пределах отдела (кривизна, стенка) значения не имеет. Следовательно, этими параметрами (локализация в верхней и средней третях органа и категории ТЗ-Т4) можно ограничить показания к принципиальной спленэктомии при раке желудка и не рекомендовать ее при опухолях Т1-2, или при локализации опухоли в нижней трети органа.
По данным Е.В. Демина [12], у 33 из 78 больных по наличию плотных лимфатических узлов в воротах селезенки заподозрены метастазы, при этом гистологически подтвердились метастазы только у 20 больных. А.А. Клименков и соавт. [15], сравнив интраоперационные данные визуального и пальпаторного обследования с результатом гистологического исследования, установили, что у больных, которым произведена спленэктомия по поводу подозрительных на метастазы лимфатических узлов ворот селезенки после операции гистологически, выявили метастазы лишь в 21,2 % случаев. На основе анализа 158 гастрэктомий со спленэктомией при раке желудка М. Takahachi et al. (1995) пришли к выводу, что метастазы в лимфатические узлы ворот селезенки визуально определялись у 16,5 %, а были морфологически подтверждены у 6,3 % больных.
Вопрос о выживаемости больных, перенесших спленэктомию, и больных с сохранением селезенки остается дискутабельным. Выделить спленэктомию как фактор неблагоприятного прогноза выживаемости при раке желудка чрезвычайно сложно. Однако подобного плана исследования проводятся в мире [67, 68, 75].
Ряд исследователей отмечают увеличение безрецидивного периода после радикальных операций с сохранением селезенки [68, 69, 80, 81, 82]. Другие авторы не выявили различий в 5-летней выживаемости у больных раком желудка, перенесших гастрэктомию со спленэктомией и без нее [34, 56]. По некоторым данным, резекция поджелудочной железы и селезенки при отсутствии прорастания в них не дает какого-либо эффекта относительно выживаемости и связана с частыми осложнениями (панкреатические свищи и др.), поэтому ее надо избегать [76]. Совершенно противоположного мнения придерживаются авторы, наблюдавшие повышение 5-летней выживаемости у больных проксимальным раком желудка, которым они выполняли гастрэктомию в сочетании со спленэктомией. Правда, в группе сравнения зачастую были пациенты, после гастрэктомий с оставлением селезенки, но без лимфодиссекции в ее воротах [51]. Так, по данным Т. Suzuki et al. (2001), 5-летняя выживаемость у пациентов, перенесших спленэктомию, по сравнению с группой больных, у которых селезенка была сохранена при ША стадии заболевания, составила 35 % против 8 %, а при IV стадии 3-летняя выживаемость составила 11 % против 0 % соответственно. О повышении 10-летней выживаемости после гастрэктомии в сочетаний со спленэктомией сообщают
М. Yamamoto и соавт. [74].
В 1994 году М. Kominishi et al. предложили альтернативный метод лимфаденэктомии с сохранением селезенки, ее сосудов и поджелудочной железы. В последнее время имеются сообщения о разработках методик спленосохранных операций без ущерба радикализму. Так, В.Н. Савельев и соавт. [19] разработали и предложили способ сохранения панкреатолиенального комплекса во время расширенной лимфаденэктомии. И.С. Стилиди и соавт. [21] сообщают о применении в ряде случаев при раке тела и проксимального отделов желудка методики D2 лимфодиссекции с сохранением селезенки и выполнением полной лимфодиссекции в ее воротах, назвав эти операции спленосохранными.
Таким образом, проводя анализ литературы по вопросу принципиальной спленэктомии как компонента расширенной гастрэктомии при хирургическом лечении рака желудка, можно сделать вывод, что в литературе не существует твердого убеждения о целесообразности спленэктомии в зависимости от локализации процесса, наличия или отсутствия регионарных метастазов и др.
Критически оценивая возможности хирургического лечения рака желудка, необходимо отметить, что расширенные и комбинированные хирургические вмешательства улучшают результаты лечения этой категории пациентов, однако не могут в полной мере решить проблему лечения данной патологии. Увеличение объема лимфодиссекции позволяет реально улучшить результаты лечения, и расширение объема операций дает возможность более точно установить стадию онкологического процесса и определить его прогноз. Дальнейший прогресс в лечении рака желудка все же должен быть связан с эффективной диагностикой ранних стадий заболевания и лежать на пути решения фундаментальных проблем биологии опухоли [55].
Рецензенты:
На сегодняшний день единственным радикальным видом лечения рака желудка является хирургическое вмешательство. Среди видов хирургического лечения рака желудка можно выделить два основных направления.
Первое направление – проведение малоинвазивных локальных операций при раннем раке желудка (сегментарные резекции желудка, различные методы деструкции опухоли, в том числе фотодинамическая терапия, эндоскопические резекции слизистой у больных I и IIа типы по японской эндоскопической классификации), однако выполнение подобных операций возможно лишь в ограниченном числе наблюдений, так как к сожалению, рак желудка зачастую диагностируют на поздних стадиях опухолевого процесса. В подобных ситуациях выполнение эндоскопического ультразвукового исследования является обязательным методом для определения глубины опухолевой инвазии и состояния перигастральных лимфоузлов.
Второе направление – это осуществление расширенных и/или комбинированных (с резекцией соседних органов и анатомических структур) операций больным на более поздних стадиях рака желудка.
Выбор объема оперативного вмешательства обусловлен прежде всего расположением опухоли в желудке, а также её распространением и наличием метастазов в других органах.
Основными типами радикальных операций при раке желудка являются:
- Дистальная субтотальная резекция желудка, которая заключается в удаление дистальных, то есть низлежащих отделов желудка. Показанием к дистальной субтотальной резекции является рак антрального отдела желудка.
- Гастрэктомия – удаление желудка целиком. Эту операции выполняют при локализации опухоли выше угла желудка, субтотальном или тотальном поражении органа.
- Проксимальная субтотальная резекция желудка – удаление проксимальных (верхних) отделов желудка. Эту операцию выполняют редко по строгим показаниям при раке I-II стадии кардиального и субкардиального отделов желудка. Большинство хирургов считают, что вместо проксимальной резекции целесообразнее выполнять гастрэктомию.
При местнораспространенном раке желудка выполняют комбинированные вмешательства, когда в случае её распоространения на соседние анатомические структуры, помимо удаления самой опухоли, производят резекцию поджелудочной железы, поперечной ободочной кишки, диафрагмы, левой почки и надпочечника и других пораженных органов.
В настоящее время при выполнении радикальных операций по поводу рака желудка, удаляют не только саму опухоль в переделах здоровых тканей (отсутствие раковых клеток по линии резекции, то есть отсечения органа), но и лимфатические узлы, в которых могут быть опухолевые клетки - метастазы. Объем лифаденэктомии при раке желудка оказывает существенное влияние на прогноз заболевания. Радикальная операция подразумевает расширенную лимфаденэктомию в объеме D2.
При раке желудка выполняют 3 основных вида лимфодиссекции (удаления лимфатических узлов):
- D0 удаление части желудка без лимфатических узлов
- D1 Резекция или гастрэктомия с удалением перигастральных лимфатических узлов
- D2 Кроме D1 + супрадуоденальные, инфрадуоденальные лимфатические узлы и узлы по ходу чревного ствола, печеночной, селезеночной, левой желудочной (перевязывают в области устья) артерий, с удалением переднего листка мезоколон, капсулы поджелудочной железы
- D3 D2 + удаление лимфатических узлов по ходу нижнего отрезка пищевода, позади и ниже поджелудочной железы около аорты, нижней полой и почечных вен, часто в сочетании со спленэктомией и резекцией хвоста поджелудочной железы
Больные раком желудка перед проведением радикальной операции нуждаются в серьезной подготовке. До операции, независимо от степени выраженности нутритивного (питательного) дефицита, необходима коррекция белковых и водно-электролитных нарушений, анемии (снижения уровня гемоглобина крови), максимально возможное устранение снижения иммунитета, а так же лечение и стабилизация сопутствующих, чаще всего сердечно-легочных, заболеваний.
После операции помимо коррекции кровопотери, восполнения дефицита питания, коррекции водно-электролитных и белковых нарушений, продолжающейся иммунотерапии, большое значение приобретает профилактика послеоперационного панкреатита, и образования патологических жидкостных скоплений в брюшной полости. Расширенная лимфаденэктомия с удалением парапанкреатической клетчатки неизбежно вызывает явления реактивного панкреатита, подавление избыточного выделения сока поджелудочной железы позволяет предупредить развитие панкреонекроза.
Показанием к паллиативным операциям являются различные осложнения рака желудка у больных с IV стадией заболевания, таких, как кровотечение из опухоли (если это технически возможно) выполняют паллиативную дистальную резекцию или гастрэктомию.
При непроходимости кардии, из-за большого размера опухоли, когда пациент не может самостоятельно питаться через рот формируют гастростому или устанавливают стент в область сужения.
В последние годы наметилась тенденция к выполнению так называемых циторедуктивных операций у больных резектабельным раком желудка IV стадии с последующим проведением химиотерапии.
Частота послеоперационных осложнений после радикальных операций на желудке достигает 25-30%, а летальность 4-8%.

В современной медицине существует несколько методов лечения рака желудка.
Основным методом лечения данного заболевания является комбинированный метод, включающий в себя хирургическое вмешательство, совмещенное с проведением активной лучевой и химической терапии.
Хирургическое вмешательство часто сочетается с лимфодиссекцией, суть данной процедуры заключается в том, что удаляются не только зоны первичной опухоли, но и зоны лимфогенного метастазирования.
Выделяют 3-и вида хирургического вмешательства при раке желудка:
- Гастроэктомия
- Субтотальная проксимальная резекция желудка
- Субтотальная дистальная резекции желудка
Наиболее широкое применение имеет гастрэктомия, на нее приходится порядка 70% всех подобных операций.
Гастроэктомия – тип хирургического вмешательства, при котором осуществляется удаление желудка. Показанием для гастроэктомии является локализация опухоли в средней или верхней части желудка, либо инфильтративный тип роста опухоли (вне зависимости от локализации).
Гастроэктомия – является крайне сложным процессом, требующим скрупулезного проведения всех этапов оперативного вмешательства. Перед операцией проводится определение границ развития опухоли и установление тем самым объема необходимого оперативного вмешательства. Также крайне внимательно анализируется состояние расположенных вблизи желудка органов, на предмет их поражения. Результатом гастроэктомии является удаление желудка и сращивание на его месте пищевода и тонкой кишки.
Метод субтотальной резекции желудка
Данный тип оперативного лечения рака желудка применяется при локализации опухоли язвенного характера в нижней части желудка. Данная операция подразумевает удаление нижней части желудка, в частности зоны, пораженной раковой опухолью, с сохранением среднего и верхнего отделов желудка. После удаление, проводится сращивание оставшейся части желудка с тонкой кишкой.
Органосохраняющий метод лечения рака желудка
Вне зависимости от наличия или отсутствия метастазов в лимфатических узлах, ранней стадией развития рака желудка принято считать опухоль злокачественного характера, поражающую слизистую оболочку и подслизистый слой стенки желудка. Именно на ранней стадии развития заболевания, лечение рака желудка является наиболее эффективным, обычно это выражается в применении органосохраняющего метода оперативного вмешательства. Суть данного метода состоит в том, что эндоскопическая резекция пораженной части слизистой оболочки желудка выполняется в пределах неизмененных тканей.
Первоначально определяются размеры поражения слизистой оболочки желудка. Для этих целей используются специальные красители. Затем делается разметка границ резекции, которая выполняется при помощи электрокоагуляции. Для профилактики перфорации стенки желудка и визуального контроля слоев производится гидропрепаровка тканей. Резекция желудка выполняется специальным электроножом, который проводится через инструментальный канал эндоскопа.
Показанием к применению органосохраняющего метода лечения рака желудка является выявление ранних форм опухоли на дооперационном этапе. Именно по этой причине, в настоящее время, так распространена ранняя диагностика раковых заболеваний.
По сравнению с традиционными методами, органосохраняющий метод лечения рака желудка является наиболее эффективным и легче переносится пациентами. Он позволяет уменьшить время пребывания больного в стационаре и сократить в целом период послеоперационной реабилитации. Данный метод требует обязательного послеоперационного наблюдения и активной медикаментозной терапии.
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Рак желудка в XXI веке стал сдавать позиции по заболеваемости, но только в развитых странах. С 1970-х годов в США вдвое выросла когорта излеченных пациентов — каждый третий с новообразованием может быть уверенным в здоровом будущем.
Как и сто лет назад основной способ спасения от рака желудка — операция, но современная онкология склоняется в сторону уменьшения объёма удаляемых тканей с максимальным сохранением функциональных возможностей всего желудочно-кишечного тракта.

Методы лечения рака желудка
Большинство методик хирургического лечения злокачественных процессов желудка было разработано в конце XIX и первую половину XX века, в дальнейшем вмешательства модифицировали и усложняли до комбинированных операций с удалением всего желудка и прилежащих органов. Расширению объемов вмешательства способствовали успехи анестезиологии и совершенствование послеоперационного восстановления больных.
Сегодня в арсенале онкологов множество модификаций стандартных операций, начиная с эндоскопической резекции — удаления слизистой оболочки при раннем раке желудка до резекции части и всего органа — гастрэктомии, в комбинации с удалением селезенки, резекции поджелудочной железы и масштабными реконструкциями кишечника для восстановления физиологического движения пищи.
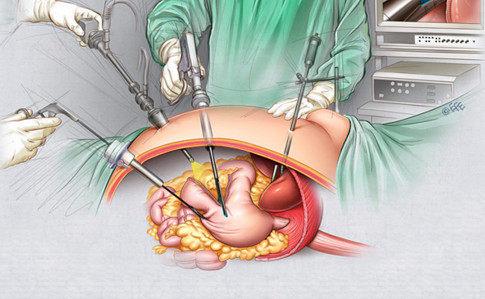
Абсолютно равноценны по результату классический разрез и лапароскопический доступ, но после лапароскопии восстановление проходит быстрее.
Первоначально неоперабельный рак нередко удаётся прооперировать на втором этапе после двух-трёх месяцев неоадъювантной химиотерапии, предотвращая возможное метастазирование и рецидив заболевания последующим полугодовым курсом адъювантной химиотерапии.
При технической невозможности операции из-за вовлечения в раковый конгломерат важнейших анатомических структур брюшной полости есть альтернатива в виде локальной лучевой терапии с цикловым лекарственным противоопухолевым лечением.
Кроме индивидуальных особенностей онкологического больного в успехе лечения соучаствуют талант хирурга-онколога, клинический опыт операционной бригады и профессионализм реабилитационной команды.
Лечение рака желудка с метастазами
Практически каждый второй пациент с впервые выявленной опухолью желудка имеет отдалённые метастазы, что исключает радикальную операцию при любом размере первичного новообразования. Тем не менее, такие опасные для жизни осложнения рака, как кровотечение вследствие опухолевого распада, разрыв истончённой желудочной стенки, циркулярное перекрытие выходного отдела — абсолютные показания к паллиативной операции, нередко, в виде полноценной резекции или гастрэктомии.

Единственно возможное лечение в метастатической стадии — химиотерапия, при отсутствии дальнейшего прогрессирования рака ограничиваются 6–8 курсами. После завершения первого блока лекарственного лечения, останавливаются на достигнутом до появления признаков прогрессии. Нечувствительное к первоначально выбранной схеме заболевание — основание к смене комбинации цитостатиков. В последние годы курсы цитостатиков дополняются таргетными препаратами, улучшающими общий результат терапии. Чаще всего — почти в 40% при 4 стадии имеется метастатическая диссеминация по брюшной полости с выработкой асцитической жидкости.
Для желудочной карциномы типично метастазирование в яичники, нередко это единственный метастатический очаг. При операбельном первичном новообразовании стараются одномоментно выполнить радикальную операцию на желудке и удалить поражённые придатки. В большинстве случаев продолжительность жизни таких больных не отличается от популяции изначально операбельных.
Лечение рака желудка отзывы
Обследование подтвердило, что операция на первом этапе невозможна из-за распространения процесса на сосудисто-нервные пучки, поджелудочную железу и с метастазами в лимфатические узлы. Пришлось вынести 9 недель не самого приятного лечения цитостатиками, как показало последующее обследование — весьма успешного.
Желудок пациенту удалили полностью, но выбранная методика реконструкции позволила максимально снизить вероятность тяжких последствий в виде демпинг-синдрома. Через полтора месяца после вмешательства началась профилактическая химиотерапия. По истечении двух лет пациент чувствует себя хорошо и продолжает работать по специальности.
Рак желудка народные способы лечения
Эффективность народной медицины в терапии рака вообще и карциномы желудка в частности подтверждается только народными слухами, в реальности не было ни одного случая излечения злокачественного процесса отваром или настоем трав.
Ни отдельно, ни в сборах ни одно растение не способно убить клетку рака. Опухоль активно противостоит напору цитотоксичных химиопрепарата, наивно верить, что она отступит под воздействием сбора лекарственных трав и продуктов пчеловодства.

Печально и преступно, что кроме безобидного для опухоли настоя ромашки или чабреца, всевозможными целителями и на сайтах в интернете предлагается регулярное употребление настоек ядовитых растений аконита и болиголова, вызывающими хроническое отравление. Настой чистотела и зверобоя гарантируют ожег слизистой желудка, что однозначно не прибавит здоровья онкологическому пациенту.
Цена лечения рака желудка
Оперативные вмешательства на органах брюшной полости относятся к категории высокой сложности и требуют активной послеоперационной реабилитации, отсюда и значительная их стоимость.
Читайте также:





