Хирургическое лечение рака полости рта
Орофарингеальная область является анатомически сложной, что обусловливает специфичность клинического течения и лечения развивающихся здесь опухолей. Среди злокачественных опухолей головы и шеи рак слизистой органов полости рта по частоте занимает второе место после рака гортани [6].
Заболеваемость населения России раком слизистой оболочки полости рта в 2013 году составила 5,55 на 100 000 жителей и ротоглотки – 3,28. Среднегодовой темп прироста заболеваемости с 2003 по 2013 год составил для рака полости рта 2,41 %, для рака ротоглотки 1,81 % [3].
Рак слизистой оболочки органов полости рта и ротоглотки по праву считается одним из наиболее агрессивных и трудно излечиваемых. Длительное время данная патология может симулировать различные параопухолевые процессы, не сопровождаться болевым синдромом. В результате большинство пациентов начинает специфическое лечение, имея опухоль существенных размеров, хотя рак слизистой оболочки полости рта и ротоглотки – заболевание доступное для визуализации и врачебного осмотра [2].
На протяжении многих лет в большинстве клиник России была традиционна тактика комбинированного и комплексного лечения рака слизистой органов полости рта и ротоглотки с ПХТ и лучевой терапией на первом этапе и оперативным лечением в последующем. Первично-хирургический подход к лечению рака органов полости рта и ротоглотки уже не новое направление, а современная методика. Отсутствие боязни послеоперационных осложнений и возможности современной пластической хирургии позволяют выполнять обширные резекции органов полости рта и ротоглотки с одномоментным восстановлением функции с последующим химиолучевым лечением [3].
Пятилетняя выживаемость, с учетом всех стадий, за последние десять лет, при комплексном лечении не превышает 50 %. При этом, в 30–55 % наблюдений развивается местный рецидив [9], а в 30–52 % появляются регионарные метастазы [1].
Наиболее тяжелую категорию больных представляют те, у которых злокачественная опухоль поражает задние отделы полости рта и ротоглотки. При наличии опухоли данной локализации часто бывает невозможным определить до операции истинное распространение опухоли в пределах пораженного органа и возможное распространение опухоли в пределах пораженного органа и возможное распространение на соседние анатомические области [7]. Возникают определенные сложности для оперативного вмешательства, когда хирургу предстоит выбрать доступ, который бы позволил радикально удалить опухоль.
В целях повышения эффективности хирургического этапа лечения больных раком слизистой оболочки задних отделов полости рта и ротоглотки, в отделении опухолей головы и шеи ФГБУ РНИОИ с 2012 года, разработан и успешно используется метод модифицированной срединной мандибулотомии (патент на изобретение № 2556604 от 16 июня 2015 г.), который позволяет радикально удалить опухоль и улучшить качество жизни оперированных больных.
Из анамнеза. За три месяца до поступления в РНИОИ обращался по месту жительства к ЛОР-врачу с жалобами на боли при глотании. По поводу хронического фарингита получал противовоспалительную терапию, без эффекта. При нарастании болей и неэффективного противовоспалительного лечения самостоятельно обратился в РНИОИ. При обследовании гистологическое исследование установило злокачественную природу опухоли. Локальный статус: лимфатические узлы не пальпируются. Открывание рта болезненное, но в полном объеме. При орофарингоскопии в области корня языка слева определяется опухолевый инфильтрат 5,0х3,5 см с изъязвлением и распространением на боковую стенку глотки. При пальпации язык резко болезненный.
В отделении опухолей головы и шеи РНИОИ больной получил неоадъювантный курс полихимиотерапии (карбоплатин и фторурацил). Противопоказаний к оперативному вмешательству после проведения полихимиотерапии у больного выявлено не было, и через 2 дня больному проведена радикальная операция с применением предложенного нами способа.
Под в/в комбинированной анестезией с искусственной вентиляцией легких произведен разрез кожи шеи в левой подчелюстной области, расположенной на 1,5 см ниже края нижней челюсти, до точки, расположенной на 1,5 см ниже края нижней челюсти правой стороны (рис.1).
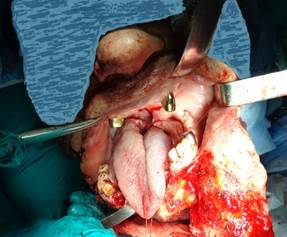
Рис.1. Обзор опухоли в области корня языка и ротоглотки после выполнения мандибулотомии
Далее произведен разрез от угла рта справа до разреза на шее, обнажен передний отдел нижней челюсти, распил тела нижней челюсти произведен по вертикальной средней линии, вначале от ее верхнего края вниз на 1,0 см, а затем – под углом в 135 ° относительно линии распила в правую сторону (противоположную локализации опухолевого процесса). Края нижней челюсти мобилизованы от мышц диафрагмы дна полости рта, разведены (рис. 2).
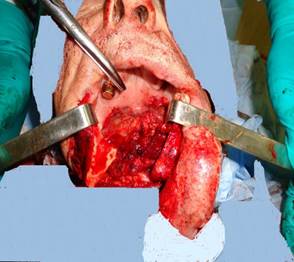
Рис. 2. Вид операционной раны после выполнения мандибулотомии и удаления макропрепарата
Проведена ревизия операционной раны, определены границы опухоли языка и глотки. Опухоль удалена в пределах здоровых тканей. Далее выполнено закрытие послеоперационного дефекта языка и боковой стенки глотки местными тканями. Гемостаз. Остеосинтез нижней челюсти осуществлен сведением краев нижней челюсти и фиксацией их с помощью титановой минипластины, расположенной под прямым углом к косой линии распила (рис. 3).
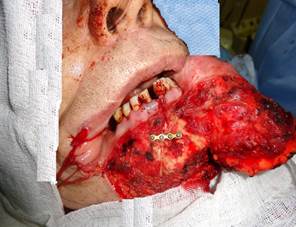
Рис. 3. Этап остеосинтеза при помощи титановой минипластины
Рана послойно ушита. Далее выполнена превентивные шейная лимфаденэктомия слева и трахеостомия. Гемостаз. Швы. Введена трахеотомическая трубка (рис. 4).
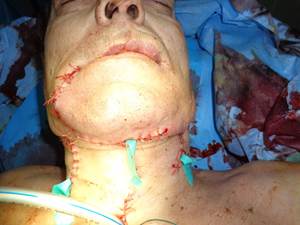
Рис. 4. Вид больного после операции
Патогистологический диагноз № 43061-062/15 - G2 плоскоклеточный рак с ороговением, №43063-064/15 – метастаза рака нет.
В послеоперационном периоде у больного заживление произошло первичным натяжением, На 5 сутки после операции больной деканулирован. Самостоятельное глотание и речь восстановились через неделю после операции, однако, из-за производимой мандибулотомии назогастральный зонд не удалялся. После контрольного рентгенологического исследования нижней челюсти через 1 месяц отмечена консолидация фрагментов челюсти – назогастральный зонд был удален, и пациент перешел на самостоятельное питание. Далее больной получил адъювантную дистанционную лучевую терапию до СОД 40Гр. Длительность наблюдения за прооперированным больным составляет более 1 года, без рецидива.
Особую категорию представляют больные, у которых злокачественная опухоль поражает слизистую оболочку задних отделов полости рта и ротоглотки. Перед хирургами встает вопрос о радикальности выполнения оперативного вмешательства, исходя из анатомических и функциональных особенностях челюстно-лицевой области.
Однако некоторые из этих доступов влекут за собой развитие грубых косметических нарушений (выраженная деформация лица, образование грубых рубцов, а и иногда сквозные дефекты), гнойно-воспалительных осложнений в области послеоперационной раны.
Наибольший клинический интерес представляет срединная мандибулотомия. При этом остеотомия производится между первыми резцами по средней линии, и фрагменты нижней челюсти разводятся в сторону. Этот доступ создает хороший обзор операционного поля для точной визуальной и пальпаторной оценки распространенности опухолевой инфильтрации, а также определения поражения близлежащих органов, удаления опухоли в пределах здоровых тканей в едином блоке. Кроме того, данный доступ в значительной степени облегчает одномоментное пластическое замещение образовавшегося дефекта [8,10].
Исходя из вышеперечисленного, нами разработан и успешно используется с 2012 года метод модифицированной срединной мандибулотомии. Следует отметить, что преимуществом данного метода является то, что остеотомия выполняется под углом в 135° относительно линии распила. Это предотвращает расхождение фрагментов нижней челюсти, тем самым создает оптимальные условия для консолидации нижней челюсти и предотвращает развитие послеоперационных осложнений, связанных с возможной лабильностью костных фрагментов.
Заключение. Высокий уровень заболеваемости раком связан не только с канцерогенной ситуацией, но и с состоянием онкологической помощи населению и профилактической направленностью Здравоохранения [4]. Позднее обращение больного по поводу рака слизистой оболочки полости рта и ротоглотки в специализированное онкологическое учреждение и необходимость проведения ему расширенной операции можно объяснить двумя факторами. Это отсутствие онкологической настороженности и длительное противовоспалительное лечение у стоматологов и ЛОР- врачей, как правило, без эффекта, и быстрый темп роста рака указанных локализаций. Доказано, что своевременная диагностика рака слизистой оболочки полости рта и ротоглотки способствует выполнению меньшего по объему хирургического вмешательства, тем самым снижает риск инвалидизации таких пациентов.
Предложенный и используемый нами способ мандибулотомии при лечении местно- распространенных процессов в полости рта и ротоглотке прост в исполнении, обеспечивает хороший доступ к опухоли и радикальное ее удаление с одномоментной пластикой образовавшегося дефекта, отличается низким уровнем развития гнойно-септических послеоперационных осложнений, не влечет за собой развитие грубых косметических нарушений.
К трем основным методам лечения рака полости рта относятся хирургическое удаление, лучевая терапия и химиотерапия. На ранних стадиях (I—II) можно использовать лишь один метод лечения (хирургическая резекция или лучевая терапия).
При распространенных опухолях (III—IV) необходимо использовать как минимум два метода, в запущенных случаях требуются все три метода лечения. Если опухоль имеет признаки агрессивного роста (экстракапсулярное распространение, периневральная или сосудистая инвазия), то даже на ранних стадиях требуется комбинированное лечение.
Основные цели лечения: (1) излечить рак; (2) сохранить или восстановить форму и функцию пораженного органа; (3) свести к минимуму возможные побочные эффекты от лечения.
При планировании лечения также необходимо оценить положение опухоли в переднезаднем направлении, ее близость к костям, глубину инвазии, гистологический тип. Небольшие опухоли, располагающиеся в передних отделах полости рта, могут быть удалены внутриротовым доступом, какие-либо функциональные нарушения минимальны.
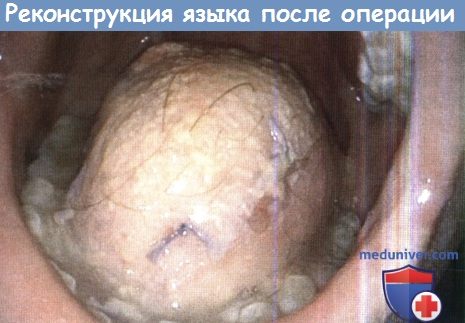
Реконструкция ротовой части языка при помощи свободного латерального лоскута бедра после практически тотальной глоссэктомии.
Пациент может есть и разборчиво говорить.
При опухолях ранних стадий предпочтительным методом лечения является хирургический, поскольку лучевая терапия сопровождается значительным риском развития ксеростомии, кариеса зубов, остеорадионекроза. Опухоли языка и дна полости рта со значительной инвазией в подлежащие ткани достаточно часто метастазируют в лимфатические узлы, поэтому если принято решение об их хирургическом удалении, даже при клинической N0 стадии поражения лимфоузлов необходимо выполнять селективную шейную лимфодиссекцию.
У пациентов с клиническими признаками поражения лимфоузлов при пальпации рекомендуется выполнять шейную лимфодиссекцию уровней I-V.
При больших опухолях рекомендуемым методом лечения является их хирургическое удаление с реконструкцией и последующей лучевой или химиолучевой терапией. Метод хирургического удаления зависит от локализации очага. К возможным доступам относятся мандибулотомия, верхний щечный лоскут, нижний щечный лоскут, visor flap.
В зависимости от степени поражения костной ткани или близости к ней может планироваться выполнение вертикальной, горизонтальной, либо сегментарной резекции нижней челюсти. Наиболее часто для восстановления формы и функции полости рта используют свободный малоберцовый лоскут, радиальный лоскут предплечья, антеро-латеральный лоскут бедра.
В некоторых случаях могут использоваться лоскуты на ножке, например, мышечно-кожный лоскут большой грудной мышцы или местные ротационные лоскуты, но их использование не является оптимальным.
Пациенты с тяжелыми сопутствующими заболеваниями могут не перенести длительных операций по пересадке свободных лоскутов с наложением микроваскулярных анастамозов, поэтому у них должны использоваться другие методы реконструкции, подразумевающие менее короткие сроки операции.
При дефектах, требующих реконструкции для предотвращения функциональных нарушений (например, при фиксации языка), но недостаточно больших для свободного лоскута с микрососудистым анастомозом приемлемы местные тканевые лоскуты и/или кожные трансплантаты.
К возможным осложнениям операции относятся кровотечение, аспирационная пневмония, формирование фистул. Возможные поздние осложнения: низкая разборчивость речи, нарушения жевания и глотания.
Ранними побочными эффектами лучевой терапии являются мукозит и нарушения вкуса, а поздними — перманентная ксеростомия, кариес зубов, остеорадионекроз. Химиотерапия может осложняться подавлением функции костного мозга, тошнотой и рвотой, аллопецией, мукозитом, нарушением функции легких, печени, почек, нейропатией, включая ото- и вестибулотоксичность вследствие поражения VIII пары черепных нервов.
Прогноз в первую очередь зависит от того, на какой стадии было выявлено заболевание. Общая пятилетняя выживаемость при заболевании I и II стадии составляет 80% и 70% соответственно; на III и IV стадиях выживаемость составляет 55% и 30%.
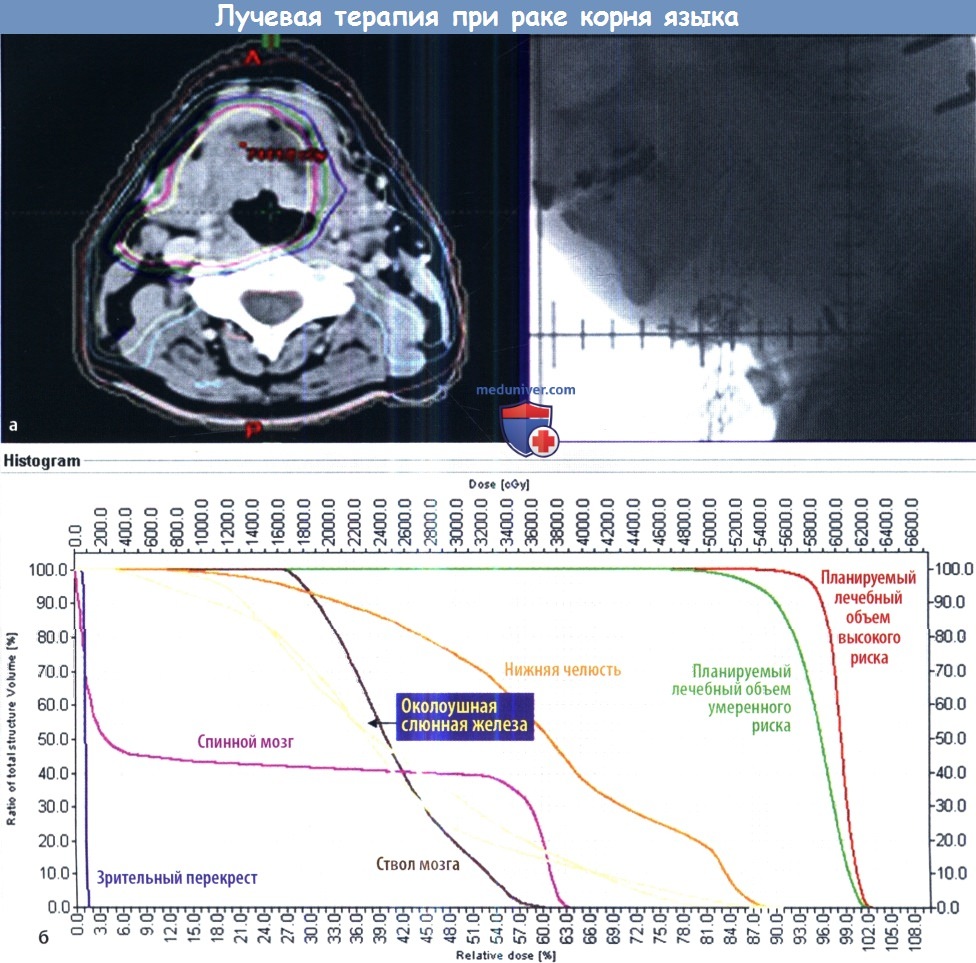
(а) Мужчина 62 лет болен раком корня языка стадии T2N2bM0. Проводилась наружная дистанционная лучевая терапия в сочетании с химиотерапией, брахитерапия и лимфодиссекция.
Облучение очага и первичных лимфоузлов проводилось в пониженной дозе в 5940 сГр, после чего проводился сеанс брахитерапии в дозе 20 Гр.
(б) Гистограмма доза-объем, демонстрирующая распределение дозы облучения в курсе лучевой терапии с модулированной интенсивностью.
В полости рта развиваются различные злокачественные новообразования, при этом в большинстве случаев — это плоскоклеточный рак. По локализации чаще остальных регистрируется рак языка. На его передние две трети приходится 75% злокачественных поражений. Следующими по встречаемости локализациями являются злокачественные новообразования слизистой оболочки щек и дна полости рта.
У мужчин рак слизистой полости рта отмечается втрое чаще, чем у женщин, при этом пик заболеваемости приходится на пожилой возраст, хотя патология встречается во всех возрастных группах, включая детей.
Факторы риска
Большинство злокачественных опухолей полости рта возникают в уже измененных тканях. Обычно это длительно протекающие воспалительные изменения и различные предраковые состояния. Предрак — особое состояние тканей, при котором в определенный момент может произойти их злокачественное перерождение, хотя возможным исходом могут оказаться и доброкачественная опухоль и полное возвращение к нормальному состоянию. Причины предраковых состояний и их прогрессии в злокачественный процесс достоверно неизвестны. Ученые предполагают, что это зависит от иммунобиологического статуса человека и особенностей воздействия канцерогена.
Факторами, которые способствуют появлению предраковых изменений, могут быть как внешние повреждающие агенты, так и различные нарушения в организме:
- Постоянное механическое воздействие — аномалии прикуса, плохо подогнанные протезы.
- Химические агенты — алкоголь, табачный дым, пряности, производственные раздражители.
- Температурные агенты — постоянное употребление очень горячей пищи, горячий табачный дым, работа в горячих цехах.
- Биологические агенты: различные микроорганизмы полости рта, как откровенно болезнетворные, так и условно-патогенные, которые дают знать о себе лишь при благоприятных для себя условиях.
- Ионизирующее излучение, в том числе вследствие медицинских процедур.
- Заболевания системы пищеварения.
- Некоторые системные поражения, в частности — красная волчанка.
Среди перечисленных факторов одним из важнейших является биологический. Доказана связь между предраковыми изменениями слизистой оболочки полости рта с кариесом и болезнями десен вследствие избыточного роста бактерий. Вторым, но не менее важным фактором, является курение — у курильщиков заболевание регистрируют в 6 раз чаще, чем у некурящих.
Клинические проявления
Симптомами злокачественного образования полости рта могут быть:
- уплотнение и отек пораженного участка;
- длительно незаживающая язва;
- белые или красные пятна на слизистой;
- ослабление корней зубов;
- кровоточивость десен;
- нарушение речи;
- необъяснимое снижение веса;
- болезненность в полости рта;
- общее недомогание.
Большинство этих симптомов неспецифичны и отмечаются при хронических заболеваниях зубочелюстной системы, поэтому нередко игнорируются пациентом.
Стадии рака
N2 — вовлечение одного узла со стороны поражения с его увеличением от 3 до 6см, или в несколько узлов Вид лучевой терапии и количество сеансов курса определяется врачебной комиссией индивидуально для каждого пациента исходя из локализации, нозологии опухоли и с учетом анамнеза.
Хирургическое лечение
В зависимости от места расположения и распространенности онкологического процесса, для хирургического лечения новообразований полости рта применяются различные операции, которые могут захватывать подлежащие костные ткани. Помимо этого иногда требуется также проведение реконструктивных вмешательств. На первой и второй стадии хирургическое лечение обычно назначается в самостоятельном варианте, на более поздних — сочетается с лучевой или химиолучевой терапией. В ходе операции, помимо вмешательства на первичном очаге, при необходимости и технической возможности проводится удаление пораженных регионарных лимфоузлов. Альтернативой операции на ранних стадиях может выступать схема, сочетающая дистанционную лучевую терапию с брахитерапией, которая подразумевает размещение источника радиоактивного излучения непосредственно в пораженные ткани.
Радиотерапевтическое лечение
Лучевая терапия при раке полости рта может быть дистанционной и контактной — брахитерапия, когда источник радиации находится не в ускорителе частиц, а непосредственно в организме пациента. Дистанционная лучевая терапия применяется в трех вариациях:
- Самостоятельно на первичный очаг и регионарные лимфоузлы при небольших размерах новообразования и невозможности хирургического лечения.
- Адъювантная лучевая терапия — проводится после оперативного лечения рака слизистой рта на его поздних, стадиях. Рекомендовано начать послеоперационную лучевую терапию в течение 6 недель после вмешательства.
- В составе адъювантной химиолучевой терапии при неполном удалении опухоли, прорастании капсулы лимфоузла и некоторых других неблагоприятных факторах на поздних стадиях процесса.
В ходе этой брахитерапии в опухоль устанавливаются специальные иглы — интрастаты, через которые по шлангам из контейнера подается радиоактивный кобальт или иридий (иногда другие элементы). Брахитерапия позволяет создать высокую дозу радиации непосредственно в опухоли, минимально затрагивая здоровые ткани, однако имеет несколько недостатков, которые ограничивают ее применение. К их числу относятся необходимость хирургического вмешательства и достаточно сложной подготовки. Процедура абсолютно противопоказана при инфильтрации опухоли в костную ткань и крупные сосуды, а также активная инфекция в месте установки интрастатов.
Химиотерапия
Химиотерапия — применение препаратов, обладающих возможностью сдерживать рост опухоли. В современных реалиях, мы чаще говорим о полихимиотерапии — одновременном приеме нескольких препаратов с разным механизмом действия.
При лечении рака полости рта самостоятельная химиотерапия применяется только в паллиативных целях, чтобы облегчить симптомы болезни. При этом побочные эффекты химиотерапии требуют индивидуального и взвешенного подхода к решению вопроса об ее целесообразности. Частичную регрессию удается получить в 25-40% случаев с предполагаемой продолжительностью жизни 6-10 месяцев.
Основное же место химиотерапии — это ее комбинация с радиотерапевтическим лечением, преимущественно, в составе адъювантной химиолучевой терапии.
Томотерапия рака полости рта
Использование дистанционной лучевой терапии сопровождается двумя проблемами: повреждение здоровых тканей и недостаточная регрессия новообразования. Побочные эффекты при этом иногда полностью нивелируют достигнутый результат лечения и увеличивают риск развития послеоперационных осложнений. Решить эти проблемы и увеличить эффективность радиологического лечения способна лучевая терапия с модулированной интенсивностью (IMRT), и в частности технология TomoTherapy HD.
TomoTherapy HD — комплекс, объединяющий компьютерный томограф и современный ускоритель частиц. Система позволяет точно доставить дозу радиации в опухоль какой бы сложной формы она ни была (локализовать опухоль, запланировать лечение и проводить его), оберегая от лучевой нагрузки здоровые ткани. Такой подход позволяет значительно снизить риск нежелательных проявлений.
Возможность подать дозу радиации с минимальным воздействием на здоровые ткани позволяет оказать более выраженное влияние на опухоль и снизить вероятность выраженных побочных эффектов в будущем
Часто задаваемые вопросы
Сколько стоит курс лечения?
Курс лечения вместе с предлучевой подготовкой стоит 258 000 рублей. Есть возможность оформления рассрочки на весь период лечения.
Есть ли онлайн-консультация?
Для жителей других регионов, а также для тех, кому визит к врачу затруднителен, наш центр предоставляет возможность бесплатной онлайн - консультации.
Документы, которые необходимы для получения онлайн-консультации?
Для получения консультации о возможности получения томотерапии, вам необходимо направить нам все имеющиеся у вас медицинские выписки и обследования, включая гистологическое заключение. Направление на бесплатную консультацию не требуется.
Возможно ли лечение детей?
Томотерапия наиболее благоприятна для лечения детей, так как лучевая терапия проходит щадящим методом, не задевая здоровые органы и ткани развивающегося ребенка.
На какой стадии можно применять лучевую терапию?
В современной онкологии возможности лучевой терапии применяются очень широко на любой стадии. Однако каждому пациенту требуется индивидуальный подход, так как выбор тактики и плана лечения зависит от многих факторов: расположения опухоли, сопутствующих заболеваний, возраста и общего состояния пациента. Поэтому для получения информации о возможности лечения, необходимо получить консультацию врача-радиотерапевта.
Полость рта является основным и единственным инструментом вербального общения между представителями человеческого вида. Однако кроме речевой функции, она имеет множество дополнительных, но не менее важных подфункций, в том числе подготовки и образования болюса (комка пищи, предназначенного для глотания), формирования вкуса и процесса глотания.
Целостность полости рта в целом необходима для предотвращения аспирации, сохранения правильной речи. Поэтому лечение различных форм рака ротовой полости опасно нарушением целостности этой области тела. Зачастую после таких операций проводят восстановительную физиотерапию и, при необходимости, реконструкцию части лица, челюсти, десны.
Рак дна полости рта может иметь разрушительные последствия. Начинается заболевание обычно с образования безболезненного узлового или язвенного поражения, которые могут быть незаметными для пациента. Опухолевые новообразования дна полости рта располагаются вне зоны постоянного наблюдения. Из-за этого многие больные обращаются к врачу на продвинутой стадии рака. Как правило, в этот период опухоль или язва уже становится болезненной и вызывает функциональные нарушения.
Строение дна ротовой полости
Дно полости рта представляет собой подковообразную полость под языком. Оно простирается от передней внутренней стороны (язычной поверхности) нижней десны и альвеолярного отростка нижней челюсти в боковом направлении по отношению к передней части языковой миндалины. Эта поверхность ограничена свободной нижней поверхностью языка. Её вогнутость имеет решающее значение для эффективного глотания слюны.
Спереди дно ротовой полости разделено на две части язычной уздечкой. Кроме того, на этом участке находится подъязычная складка, покрытая слизистой оболочкой с многослойным плоским эпителием. Под поверхностью слизистой оболочки располагаются две большие слюнные железы. Подъязычные и подчелюстные железы впадают в дно полости рта, проходя через канал бартолиновой железы и вартонов проток. Расстояние между сублингвальными железами и подбородочноязычной мышцей составляет около 5 см.

Рис. 1. Схема расположения раковой опухоли дна ротовой полости
В средней линии дна полости рта подбородочноязычная мышца отделяет подъязычные слюнные железы. Подъязычная железа имеет несколько мелких отверстий в дополнение к бартолиновому протоку, расположенному в подъязычной складке.
Мировая статистика заболеваемости раком ротовой полости, факторы риска
По статистике, рак головы и шеи занимает 15% от общего количества случаев рака всего тела. Встречается такое заболевание с частотой 9,5 случаев на 100 тысяч населения. Злокачественные опухоли полости рта составляют примерно 30% от общего числа опухолей головы и шеи. Например, в США 5% всех случаев рака занимают именно случаи рака полости рта и различных частей рта. Рак дна полости рта составляет около 35% от этих случаев.
По всему миру уровень заболеваемости значительно колеблется. В Индии, например, раком полости рта болеют 50% населения от всего числа людей, имеющих злокачественные опухоли. Это различие обусловлено принципиально разным подходом к гигиене рта и зубов, а также жеванием бетеля. Рак ротовой полости чаще встречается у мужчин, чем у женщин (примерно 3:1).
Предрасположенность к раку дня полости рта может быть семейной, генетической или приобретенной (иммуносупрессия, сифилис, синдром Пламмера-Винсона, хронический кандидоз). Эти факторы риска и основной патогенез не исчезают после хирургического иссечения или лучевой терапии рака. Органы остаются чувствительными. Если пациент продолжает пить, курить и подвергаться воздействию других раздражителей, риск развития вторичной опухоли возрастает на 40%. Кроме того, уменьшается ответ организма на лучевую терапию.
Диагностика и симптомы злокачественной опухоли дна ротовой полости
Диагностика рака дна полости рта проводится при полном осмотре ротовой полости: языка, зубов, десен, внутренней стороны щек. Дно полости рта врач пальпирует рукой для оценки расположения, размера и степени первичной опухоли. Бимануальная экспертиза также позволяет оценить вовлечение в злокачественный процесс органов и тканей подчелюстного треугольника. Осмотр головы и шеи проводится с учетом ушей, носа, ротоглотки и пальпации шеи.
Наиболее частым видом опухоли дна полости рта является безболезненная язва с плохо очерченными краями. В 20% случаев в окружающих тканях наблюдается лейкоплакия (ороговение слизистого эпителия). Она может предшествовать появлению язвы или появиться уже после неё. Небольшие язвы или узловые поражения могут оставаться бессимптомным в течение длительных периодов времени, так что пациент может не обращаться за медицинской помощью. Болевые симптомы слизистой оболочки могут быть связаны с афтозными язвами. Менее чем в половине случаев язва локализуется лишь на половине дна ротовой полости. Если же пациент пренебрегает первичными признаками заболевания, опухоль может распространиться на всю область дна полости рта с метастазами в шею или другие органы.
Злокачественные опухоли полости рта быстро растут, для них характерно частое и раннее метастазирование в окружающие регионарные лимфатические узлы. Наличие региональных метастазов в лимфоузлах на момент первоначального клинического обследования составляет 30-35%. Клинические симптомы вызываются ростом поражения и вторжением его в глубокие слои тканей. Края злокачественного новообразования становятся более нечеткими, основание язычка и лингвальная часть альвеолы могут быть также поражены.
Основные симптомы злокачественной опухоли дна полости рта:
- неприятный запах изо рта;
- боль в ухе (воздействие на язычный нерв);
- кровотечение;
- некроз краев язвы;
- тошнота, потеря веса, рвота, отсутствие аппетита;
- нарушение двигательной активности языка;
- трудности с глотанием, жеванием, потеря чувствительности языка;
- отсутствие вкуса ранее знакомых блюд.
Лечение рака дна ротовой полости
Выбор метода лечения основывается на оценке индивидуальных потребностей пациента и клинических показателей заболевания, а также опыта врачей. Хирургическая резекция или лучевая терапия, как правило, эффективны для лечения I и II стадий рака. По отдельности эти методы неэффективны на III и IV стадии. Таким образом, в большинстве случаев для лечения поздних стадий рака применяется комбинация двух и более методов.
Химиотерапия и облучение обычно используются для лечения крупных опухолей. Препараты могут помочь в послеоперационный период, когда есть необходимость щадящего воздействия на орган. Предоперационная лучевая терапия хороша в управлении крупными опухолями. В любом случае первичные опухоли следует рассматривать радикально, с тщательной оценкой состояния лимфатических шейных узлов.
Радикальный и наиболее часто используемый метод лечения – хирургическое иссечение. Популярна и криотерапия, лазерное удаление, а также комбинация нескольких способов. В каждом конкретном случае лечение зависит от анатомического расположения, размера и степени развития первичной опухоли, наличия или отсутствия метастазов в области шеи, возраста пациента и общего состояния здоровья до заболевания.
Профилактические меры:
- отказ от алкоголя, курения, жевания табака;
- противораковая диета (больше свежих овощей, зелени и фруктов, рыбы, орехов и сырых масел, меньше жареной пищи, мяса и рафинированных продуктов, фастфуда);
- разумные нагрузки, употребление необходимого количества жидкости;
- регулярные профилактические осмотры, анализы крови;
- соблюдение гигиены полости рта.
Веселящий газ сможет заменить эпидуральную анестезию во время родов
Читайте также:

