Химиолучевая терапия рака полости рта
Целесообразно проводить лечение в специализированных клиниках, персонал которых представлен хирургами, радиологами и онкологами. Основные принципы лечения больных с опухолями полости рта различной локализации, в общем, одинаковы и рассматриваются совместно. Исключение составляет карцинома губы.
Лечение небольших доступных опухолей (Т1) полости рта
Эти опухоли успешно вылечиваются методом радикальной лучевой терапии с сохранением функции ротовой полости. Часто эффективна имплантация источников излучения, поскольку при этом возможно облучить небольшой объем ткани в высокой дозе. Эта техника неприменима для лечения новообразований на губе. В качестве источников используют радиоактивные изотопы радия, цезия, золота, тантала и иридия, обладающие одинаковой эффективностью.
Обычно этим методом пользуются для лечения новообразований языка, букальной слизистой, дна ротовой полости, неба и нижней зубной альвеолы. Для небольших опухолей (менее 1 см) можно ограничиться имплантацией источника, не прибегая к дополнительному внешнему облучению. Тем не менее большинство радиологов в случаях несколько более крупных опухолей, однако по размерам не подходящих для введения имплантанта (Т1 и небольшие Т2), предпочитают использовать наряду с имплантацией источника также внешнее облучение.
При имплантированном источнике суммарная очаговая доза 60 Гр обычно достигается через 4-7 дней. При совместном применении импланта и внешнего облучения многие радиологи рекомендуют после облучения опухоли от имплантированного источника в суммарной очаговой дозе 50 Гр (за 5-7 дней) проводить фракционированное облучение внешним пучком в течение 3 недель до достижения суммарной дозы 30 Гр. В ряде клиник небольшие опухоли на кончике языка предпочитают удалять хирургическим путем. Иногда для этой цели используется лазерный метод.
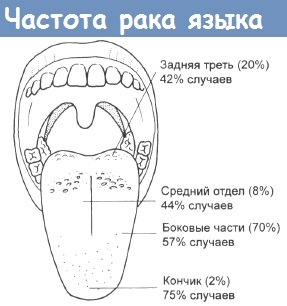
Относительная частота (в скобках) и эффективность контроля над ростом карцином языка различной локализации.
Лечение больших опухолей полости рта (Т2-Т4)
Традиционно эти опухоли лечили облучением внешним пучком, однако в последнее время все чаще используется комбинация лучевой и химиотерапии. При внешнем облучении обычно эффективной оказывается суммарная доза 60 Гр, назначаемая фракциями в течение 6 недель, причем переносимость дозы зависит от облучаемого объема ткани. Облучают с применением боковых полей без клиновидного фильтра или с применением фильтра. В поля включают место расположения первичной опухоли и ближайшую к ней группу лимфатических узлов. При раке языка, дна ротовой полости и нижней челюсти, можно избежать облучения неба с помощью роторасширителя, фиксирующего язык в нижнем положении.
Вопросы лечения метастазов в лимфатические узлы шеи остаются дискуссионными. Во многих клиниках больным с подвижными узлами рекомендуют их радикальное удаление. При профилактическом удалении лимфатических узлов без признаков патологии в значительном количестве случаев в них были обнаружены очаги микрометастазирования. Большинство радиологов предпочитают проводить профилактическое облучение шеи у больных без признаков поражения лимфатических узлов (N0).
При этом обычно используют дозу ниже радикальной (50 Гр за 5 недель или в эквиваленте), исходя из предположения о наличии скрытых поражений лимфатических узлов, и меньшей вероятности возникновения рецидивов. В большинстве клиник для контроля над состоянием шейных лимфатических узлов используют облучение внешним пучком, иногда в сочетании с хирургическим методом. Однако, независимо от метода лечения, выживаемость среди больных в стадии N2 или N3 крайне низкая,
Появление рецидива и общая выживаемость среди больных тесно связаны с размером опухоли и стадией ее развития. По данным одного из крупномасштабных исследований, кумулятивная выживаемость больных с опухолями подвижной части языка и дна ротовой полости, без признаков лимфоаденопатии, составляла 57%, в то время как у больных с пальпируемыми лимфатическими узлами она снижалась до 42% (24). Если при обследовании больного обнаружено поражение лимфатических узлов, то, несмотря на интенсивные методы, лечение первичной опухоли не приводит к благоприятному результату.
В отдельных случаях удается контролировать появление ограниченного рецидива опухоли (обычно на прежнем месте) с помощью имплантации радиоактивного источника, однако позже может потребоваться радикальное хирургическое вмешательство, поскольку эффект носит непродолжительный характер.

При появлении рецидива после первичной лучевой терапии, в клиниках Великобритании обычно используют хирургический метод. Однако все чаще в качестве первичной меры рекомендуется хирургическое вмешательство, а не лучевая терапия. Это связано с развитием в полости рта отдаленных побочных эффектов облучения. Как правило, проводится обширная резекция с последующей реконструктивной операцией.
Использование техники микрососудистой пересадки свободного кожного лоскута привело к существенному улучшению косметических результатов операции. Однако необходимость радикального удаления пораженной области часто приводит к значительному локальному повреждению ткани и к утрате ее функциональной активности. Типичная операция по поводу рецидива опухоли дна ротовой полости включает проведение гемиглоссэктомии, иссечение участка дна ротовой полости, гемимандибулоэктомию и иссечение шейных лимфатических узлов.
В полости рта развиваются различные злокачественные новообразования, при этом в большинстве случаев — это плоскоклеточный рак. По локализации чаще остальных регистрируется рак языка. На его передние две трети приходится 75% злокачественных поражений. Следующими по встречаемости локализациями являются злокачественные новообразования слизистой оболочки щек и дна полости рта.
У мужчин рак слизистой полости рта отмечается втрое чаще, чем у женщин, при этом пик заболеваемости приходится на пожилой возраст, хотя патология встречается во всех возрастных группах, включая детей.
Факторы риска
Большинство злокачественных опухолей полости рта возникают в уже измененных тканях. Обычно это длительно протекающие воспалительные изменения и различные предраковые состояния. Предрак — особое состояние тканей, при котором в определенный момент может произойти их злокачественное перерождение, хотя возможным исходом могут оказаться и доброкачественная опухоль и полное возвращение к нормальному состоянию. Причины предраковых состояний и их прогрессии в злокачественный процесс достоверно неизвестны. Ученые предполагают, что это зависит от иммунобиологического статуса человека и особенностей воздействия канцерогена.
Факторами, которые способствуют появлению предраковых изменений, могут быть как внешние повреждающие агенты, так и различные нарушения в организме:
- Постоянное механическое воздействие — аномалии прикуса, плохо подогнанные протезы.
- Химические агенты — алкоголь, табачный дым, пряности, производственные раздражители.
- Температурные агенты — постоянное употребление очень горячей пищи, горячий табачный дым, работа в горячих цехах.
- Биологические агенты: различные микроорганизмы полости рта, как откровенно болезнетворные, так и условно-патогенные, которые дают знать о себе лишь при благоприятных для себя условиях.
- Ионизирующее излучение, в том числе вследствие медицинских процедур.
- Заболевания системы пищеварения.
- Некоторые системные поражения, в частности — красная волчанка.
Среди перечисленных факторов одним из важнейших является биологический. Доказана связь между предраковыми изменениями слизистой оболочки полости рта с кариесом и болезнями десен вследствие избыточного роста бактерий. Вторым, но не менее важным фактором, является курение — у курильщиков заболевание регистрируют в 6 раз чаще, чем у некурящих.
Клинические проявления
Симптомами злокачественного образования полости рта могут быть:
- уплотнение и отек пораженного участка;
- длительно незаживающая язва;
- белые или красные пятна на слизистой;
- ослабление корней зубов;
- кровоточивость десен;
- нарушение речи;
- необъяснимое снижение веса;
- болезненность в полости рта;
- общее недомогание.
Большинство этих симптомов неспецифичны и отмечаются при хронических заболеваниях зубочелюстной системы, поэтому нередко игнорируются пациентом.
Стадии рака
N2 — вовлечение одного узла со стороны поражения с его увеличением от 3 до 6см, или в несколько узлов Вид лучевой терапии и количество сеансов курса определяется врачебной комиссией индивидуально для каждого пациента исходя из локализации, нозологии опухоли и с учетом анамнеза.
Хирургическое лечение
В зависимости от места расположения и распространенности онкологического процесса, для хирургического лечения новообразований полости рта применяются различные операции, которые могут захватывать подлежащие костные ткани. Помимо этого иногда требуется также проведение реконструктивных вмешательств. На первой и второй стадии хирургическое лечение обычно назначается в самостоятельном варианте, на более поздних — сочетается с лучевой или химиолучевой терапией. В ходе операции, помимо вмешательства на первичном очаге, при необходимости и технической возможности проводится удаление пораженных регионарных лимфоузлов. Альтернативой операции на ранних стадиях может выступать схема, сочетающая дистанционную лучевую терапию с брахитерапией, которая подразумевает размещение источника радиоактивного излучения непосредственно в пораженные ткани.
Радиотерапевтическое лечение
Лучевая терапия при раке полости рта может быть дистанционной и контактной — брахитерапия, когда источник радиации находится не в ускорителе частиц, а непосредственно в организме пациента. Дистанционная лучевая терапия применяется в трех вариациях:
- Самостоятельно на первичный очаг и регионарные лимфоузлы при небольших размерах новообразования и невозможности хирургического лечения.
- Адъювантная лучевая терапия — проводится после оперативного лечения рака слизистой рта на его поздних, стадиях. Рекомендовано начать послеоперационную лучевую терапию в течение 6 недель после вмешательства.
- В составе адъювантной химиолучевой терапии при неполном удалении опухоли, прорастании капсулы лимфоузла и некоторых других неблагоприятных факторах на поздних стадиях процесса.
В ходе этой брахитерапии в опухоль устанавливаются специальные иглы — интрастаты, через которые по шлангам из контейнера подается радиоактивный кобальт или иридий (иногда другие элементы). Брахитерапия позволяет создать высокую дозу радиации непосредственно в опухоли, минимально затрагивая здоровые ткани, однако имеет несколько недостатков, которые ограничивают ее применение. К их числу относятся необходимость хирургического вмешательства и достаточно сложной подготовки. Процедура абсолютно противопоказана при инфильтрации опухоли в костную ткань и крупные сосуды, а также активная инфекция в месте установки интрастатов.
Химиотерапия
Химиотерапия — применение препаратов, обладающих возможностью сдерживать рост опухоли. В современных реалиях, мы чаще говорим о полихимиотерапии — одновременном приеме нескольких препаратов с разным механизмом действия.
При лечении рака полости рта самостоятельная химиотерапия применяется только в паллиативных целях, чтобы облегчить симптомы болезни. При этом побочные эффекты химиотерапии требуют индивидуального и взвешенного подхода к решению вопроса об ее целесообразности. Частичную регрессию удается получить в 25-40% случаев с предполагаемой продолжительностью жизни 6-10 месяцев.
Основное же место химиотерапии — это ее комбинация с радиотерапевтическим лечением, преимущественно, в составе адъювантной химиолучевой терапии.
Томотерапия рака полости рта
Использование дистанционной лучевой терапии сопровождается двумя проблемами: повреждение здоровых тканей и недостаточная регрессия новообразования. Побочные эффекты при этом иногда полностью нивелируют достигнутый результат лечения и увеличивают риск развития послеоперационных осложнений. Решить эти проблемы и увеличить эффективность радиологического лечения способна лучевая терапия с модулированной интенсивностью (IMRT), и в частности технология TomoTherapy HD.
TomoTherapy HD — комплекс, объединяющий компьютерный томограф и современный ускоритель частиц. Система позволяет точно доставить дозу радиации в опухоль какой бы сложной формы она ни была (локализовать опухоль, запланировать лечение и проводить его), оберегая от лучевой нагрузки здоровые ткани. Такой подход позволяет значительно снизить риск нежелательных проявлений.
Возможность подать дозу радиации с минимальным воздействием на здоровые ткани позволяет оказать более выраженное влияние на опухоль и снизить вероятность выраженных побочных эффектов в будущем
Часто задаваемые вопросы
Сколько стоит курс лечения?
Курс лечения вместе с предлучевой подготовкой стоит 258 000 рублей. Есть возможность оформления рассрочки на весь период лечения.
Есть ли онлайн-консультация?
Для жителей других регионов, а также для тех, кому визит к врачу затруднителен, наш центр предоставляет возможность бесплатной онлайн - консультации.
Документы, которые необходимы для получения онлайн-консультации?
Для получения консультации о возможности получения томотерапии, вам необходимо направить нам все имеющиеся у вас медицинские выписки и обследования, включая гистологическое заключение. Направление на бесплатную консультацию не требуется.
Возможно ли лечение детей?
Томотерапия наиболее благоприятна для лечения детей, так как лучевая терапия проходит щадящим методом, не задевая здоровые органы и ткани развивающегося ребенка.
На какой стадии можно применять лучевую терапию?
В современной онкологии возможности лучевой терапии применяются очень широко на любой стадии. Однако каждому пациенту требуется индивидуальный подход, так как выбор тактики и плана лечения зависит от многих факторов: расположения опухоли, сопутствующих заболеваний, возраста и общего состояния пациента. Поэтому для получения информации о возможности лечения, необходимо получить консультацию врача-радиотерапевта.
Определение понятия
Одновременная химиолучевая терапия - это одновременное применение лучевой терапии и химиотерапии. В отличие от комбинированной терапии, в которой эти методы используются последовательно (= один за другим), одновременное применение данных двух методов лечения позволяет использовать дополнительные эффекты, которые являются результатом их тесного временного взаимодействия .
Теоретические основы
Из клинических и экспериментальных исследований можно определить следующие преимущества одновременной химиолучевой терапии по сравнению с однократной лучевой терапией или химиотерапией или последовательной комбинацией обоих методов (таблица 1):
- Лучевая и химиотерапия имеют разные цели на клеточном уровне . Менее радиочувствительные клетки, которые пропускают лучевую терапию, теоретически могут быть уничтожены посредством химиотерапии и наоборот .
- Некоторые цитостатики при их одновременном применении с облучением оказывают радиосенсибилизирующее действие: в дополнение к их независимой цитотоксичности они усиливают эффект лучевой терапии в опухолевой ткани . Экспериментально этот эффект хорошо доказан, особенно на относительно нечувствительных к радиации гипоксических клетках . Радиосенсибилизация может иметь большое значение при комбинации облучения с определенными цитотоксическими агентами, такими как Цисплатин, 5-фторурацилили Таксол . Однако специфическая радиосенсибилизация в конечном итоге может быть четко продемонстрирована только в условиях in vitro. Играет ли она также значительную роль в клинической картине, пока не доказано.
- В случае быстро пролиферирующих опухолей важно вводить цитотоксическое лечение в максимально короткие сроки, чтобы противодействовать ускоренному клеточному делению (репопуляции), происходящему в опухоли во время терапии . При одновременном сочетании лучевой терапии и химиотерапии оба метода лечения применяются в очень короткий общий период лечения. Эта интенсификация, вероятно, играет особенно важную роль . Превосходство одновременной и последовательной химиолучевой терапии (последовательное проведение лучевой и химиотерапии) было недавно продемонстрировано на примере плоскоклеточного раке области головы и шеи в мета-анализах всех рандомизированных исследований, а в этих опухолях скорость роста особенно высока .
Исходя из этих соображений, можно выделит конкретные условия, при которых одновременная химиолучеваятерапия (ХЛТ) кроме лечебной цели имеет еще и теоретическую целесообразность:
- вероятность определенного локального контроля опухоли при проведении только лучевой терапии ограничена ,
- гистологически опухоль является чувствительной к воздействию радио- и химиотерапии ,
- (потенциальная) скорость роста опухоли достаточно высока ,
- применяемые химиотерапевтические агенты хорошо сочетаются с лучевой терапией в плане токсичности .
Как гистологический объект, плоскоклеточный рак и уротелиальный рак, в частности, соответствуют этим требованиям . Плоскоклеточный рак относительно чувствителен к воздействию лучевой терапии и реагирует на различные цитотоксические агенты. Кроме того, они часто имеют высокие темпы роста; потенциальное время удвоения таких опухолей в области головы и шеи составляет, например, в среднем всего 4,5 дня. Многочисленные клинические данные показывают, что скорость излечения этих опухолей зависит от продолжительности лечения, и что улучшение эффективности лечения за счет сокращения общего времени лечения может улучшить локальный контроль опухоли.
Радиобиологические эффекты одновременной химиолучевой терапии
Эффект
Радиационно-биологическое обоснование
Клиническое значение
Аддитивный противоопухолевый эффект
Больший цитотоксический эффект за счет добавления отдельных эффектов лучевой терапии и химиотерапии
Различные точки атаки
Химиотерапия убивает радиорезистентные клетки и наоборот
Химиотерапия может повышать интенсивность внутриклеточного облучения, в частности, например, в гипоксических клетках
Побочные эффекты распространяются на разные системы органов, следует избегать токсических доз соответствующих методов лечения
Интенсификация благодаря более короткому общему времени лечения по сравнению с последовательным проведением химиолучевой терапии
Влияет на пролиферацию опухоли (репопуляцию) во время нескольких недель лучевой- или химиолучевой терапии
Протоколы лечения для одновременной химиолучевой терапии
Основой протоколов клинического лечения обычно является режим лучевой терапии с дозой облучения в диапазоне от 50 до 60 Грей. Следует избегать соответствующего снижения дозы облучения, поскольку химиотерапия не может заменить лучевую терапию. Одновременно с лучевой терапией выполняются инъекции одного или двух цитостатических средств, которые являются наиболее эффективными в соответствующей опухолевой структуре, их вводят в эффективной дозировке, которая также является обычной в случае проведения только химиотерапии. В течение нескольких недель лучевой терапии обычно могут быть проведены два или три курса химиотерапии. При этом выбор наименования и дозировки цитостатиков проходит таким образом, что нет необходимости достигать соответствующих компромиссов в лучевой терапии, являющейся основным терапевтическим элементом.
Клинические результаты и текущий спектр показаний
Первым опухолевым заболеванием, при котором было предпочтительной одновременная химиолучевая терапия, была плоскоклеточная карцинома анального канала. Одновременная ХЛТ дает те же результаты в отношении выживаемости при анальных карциномах, что и радикальная операция с удалением прямой кишки и наложением стомы . Тем не менее, в отличие от операции она способна поддерживать функцию мышцы сфинктера примерно у 80 процентов пациентов и позволяет избежать искусственного выведения кишечника. Только около 20 процентов пациентов, несмотря на первоначальное успешное консервативное лечение, вынуждены в дальнейшем перенести радикальную операцию в результате рецидивов. Превосходство одновременной химиолучевой терапии основано на возможности сохранения функций органа или самого органа . Сходная ситуация наблюдается при локально прогрессирующих карциномах мочевого пузыря.
При таких опухолях (обычно категории T3-4) при одновременной химиолучевой терапии полная ремиссия может достигаться в более 70% случаев. В ходе клинических исследований, проведенных до настоящего времени, п оказатели пятилетней выживаемости были такими же, как и после радикальной цистэктомии, при этом примерно три четверти всех пациентов смогли сохранить функционирующий мочевой пузырь .
Одновременная химиолучевая терапия не только улучшает локальный контроль над опухолью и функциональный результат при некоторых типах опухолей, но также, по-видимому, улучшает показатели выживаемости. Это особенно касается неоперабельного плоскоклеточного рака полости рта и горла. Одновременная химиолучевая терапия приводит к значительно более высоким показателям локального контроля опухоли по сравнению с только лучевой терапией, которая до настоящего времени была стандартным методом лечения .
Поскольку при этих заболеваниях отдаленные метастазы встречаются редко, а местное рецидивирование часто является единственной причиной неэффективности терапии, повышение выживаемости также является результатом улучшения местного контроля опухоли . Большое исследование в Германии недавно снова подтвердило этот факт (Таблица 2).
Даже при неоперабельных карциномах пищевода эффективность одновременной химиолучевой терапии превосходит эффективность только лучевой терапии, хотя она также связана со значительно более высоким риском, чем паллиативное облучение, из-за часто значительно ухудшенного общего состояния у таких пациентов . Многочисленные исследования в настоящее время изучают, возможно ли достичь более благоприятных результатов лечения при карциноме пищевода с помощью окончательной или предоперационной химиолучевой терапии, чем с помощью хирургического вмешательства или только лучевой терапии.
Показание к одновременной химиолучевой терапии имеется также при карциномах прямой кишки на II и III стадии (рТ3-4 или поражение лимфатических узлов) после операции или в качестве предоперационной терапии при неоперабельных карциномах прямой кишки . Обзор текущего спектра показаний представлен в таблице 3.
Комбинации лучевой и химиотерапии являются предпочтительным лечением для многих других опухолей, тем не менее, отдельные методы лечения обычно применяются последовательно . Имеется опыт одновременного проведения ХЛТ при бронхиальной карциноме, прогрессирующем раке молочной железы и рецидиве рака молочной железы и шейки матки, недифференцированной саркоме мягких тканей и различных саркомах у детей . О днако при этих злокачественных опухолях все еще неясно, дает ли одновременная ХЛТ преимущества по сравнению с прежней методикой лечения с последовательным проведением указанных видов терапии или следует продолжать применять две терапевтические методики одну за другой с учетом их токсичности .
Превосходство одновременной химиолучевой терапии с применением Цисплатина / 5-фторурацила по сравнению с применением только лучевой терапии при локально прогрессирующих плоскоклеточных карциномах в области головы и шеи
Только лучевая терапия
Одновременная химиолучевая терапия
Клиническая значимость
Локальный контроль опухоли через три года
p Трехлетняя выживаемость
p Результаты рандомизированного исследования отдела радиационной онкологии Немецкого общества борьбы с раковыми заболеваниями (Вендт и др., 1997)
Побочные эффекты и поддерживающая терапия
Одновременное сочетание лучевой терапии и химиотерапии приводит к более острым побочным эффектам, но они часто распределяются между различными системами органов . Лучевая терапия может привести к острым побочным эффектам в пролиферативно-активных органах в области облучения (тканях, которые регулярно обновляются) и особенно острым реакциям со стороны кожи и слизистых оболочек. Напротив, острые побочные эффекты системной химиотерапии проявляются при вышеназванных онкологических заболеваниях и препаратах преимущественно в органах вне поля облучения . Только это распределение токсичности позволяет одновременно комбинировать две высокоэффективные терапии .
Тем не менее, одновременная ХЛТ может вызвать серьезные побочные эффекты из-за взаимного усиления токсичности каждого их методов лечения в данной комбинации . Например, локальное воспаление слизистой оболочки в области облучения может иметь более серьезное течение и более легко приводить к вторичным осложнениям (например, суперинфекции) при наличии у пациента лейкопении, связанной с химиотерапией . Поэтому предпосылкой для проведения одновременной ХЛТ является не только корректно установленное показание опытного радиоонколога совместно с онкологами-терапевтами и онкологами-хирургами с учетом индивидуальной пользы (лучший контроль опухоли) и риска (повышенная частота побочных эффектов), но и всестороннее медицинское наблюдение со стороны команды онкологов. Потенциальные побочные эффекты, которые могут препятствуют проведению лечения по установленной временной схеме, необходимо предотвращать или своевременно выявлять и устранять их .
Следовательно, по всем правилам лечение должно проводиться в условиях стационара. Часто требуется проведение профилактической поддерживающей диетотерапии посредством эндоскопической гастростомии (ПЭГ), мероприятий по защите слизистой оболочки и применение гематопоэтических факторов роста. В таких условиях риск летального исхода вследствие одновременной химиолучевой терапии составляет от одного до трех процентов, в зависимости от характеристики опухоли . Это благоприятное количество по сравнению с риском смертности от других видов куративной терапии в соответствующей группе пациентов.
Среди прочего, значительный риск одновременной ХЛТ является следствием ее высокой эффективности, поскольку терапевтический эффект и достигаемое в результате этого уплощение опухоли иногда происходят так быстро, что возникают перфорации или кровотечение . Следовательно, в отдельных случаях, например, при раке пищевода с трахеальной инфильтрацией, одновременная ХЛТ может быть противопоказана, так как в противном случае успешная терапия может привести к опасному для жизни осложнению, такому как пищеводно-трахеальная фистула . Согласно современному уровню знаний, при одновременной ХЛТ не следует ожидать значительного увеличения периода выраженности хронических последствий терапии по сравнению с только лучевой терапией. П оскольку цитостатическое лечение клеток, ответственных за возникновение поздних последствий лучевой терапии (фибробласты, капиллярный эндотелий), почти не влечет за собой значимых долгосрочных эффектов, значительного повышения риска поздних последствий даже теоретически ожидать не стоит.
Согласно имеющимся в настоящее время клиническим данным, по крайней мере, при установленных показаниях (таблица 3) повышенный риск поздних эффектов отсутствует, тем не менее, в данной связи необходимы дальнейшие долгосрочные наблюдения.
Показания к одновременной химиолучевой терапии (ХЛТ), согласно действующим рекомендациям Немецкого общества борьбы с раковыми заболеваниями
Вид опухоли/стадия
Эффект одновременной ХЛТ
Дополнительные методы лечения
Доза облучения
(Гр) /цитостатики
Анальные карциномы, все стадии (плоскоклеточная карцинома, базалоидная карцинома)
Выживаемость, как при радикальном хирургическом лечении, сохранение сфинктера примерно у 80%
Удаление прямой кишки при наличии остаточной опухоли или при рецидиве
около 50Гр / Митомицин С + 5-фторурацил
Прогрессирующие плоскоклеточные карциномы в полости рта и в горле (T3-4 или N3)
Лучшая выживаемость, чем при проведении только лучевой терапии, сохранение органов более чем в 90% случаев
В отдельных случаях операция по поводу остаточной опухоли или рецидива
60-70 Гр / Цисплатин + 5-фторурацил
Локально прогрессирующие карциномы прямой кишки (T4)
Предоперационно для уменьшения размеров опухоли для последующего куративного хирургического лечения
В основном резекция / экстирпация прямой кишки после химиолучевой терапии
Локально прогрессирующие карциномы прямой кишки pT3-4 или pN1-3 после куративного хирургического лечения
Улучшение выживаемости и более оптимальный локальный контроль опухоли с помощью послеоперационной ХЛТ
Дополнительная химиотерапия с 5-фторурацилом до / после ХЛТ
Неоперабельные карциномы мочевого пузыря T3-T4
Выживаемость как при радикальной операции, сохранение мочевого пузыря примерно в 70% случаев
Необходима радикальная цистэктомия при наличии остаточной опухоли или при рецидиве
54-60 Гр / Цисплатин
Неоперабельные карциномы поджелудочной железы
Наиболее эффективная терапия при неоперабельности
Выводы
В целом, результаты клинических исследований, проведенных до настоящего времени, показывают, что при некоторых онкологических заболеваниях оптимальная комбинация лучевой терапии и химиотерапии может обеспечить успешный исход терапии.
Такое оптимизированное лечение может принести пользу пациенту в отношении более высокой выживаемости и/или лучшего качества жизни (сохранение функции органов) . В дополнение к необходимым техническим и профессиональным требованиям, решающую роль в этой терапии играет тесное междисциплинарное сотрудничество специалистов в области онкологии.
Читайте также:

