Гефитиниб в лечении рака легкого

Гефитиниб – первый ингибитор тирозинкиназы рецептора эпидермального фактора роста (EGFR), который применяется в первой линии терапии местнораспространенного или метастатического немелкоклеточного рака легкого (НМРЛ) у больных с мутацией в гене EGFR.
Началось все в 1962 году, когда американский биохимик Стэнли Коэн заметил, что введенный мышатам экстракт слюнной железы взрослой мыши способствует преждевременному открытию век [1]. Коэн не сомневался, что причина этого явления кроется в стимуляции эпидермального роста и кератинизации под действием экстракта. Дальнейшие исследовательские работы биохимика привели его к выделению белка, ответственного за этот эффект. Им оказался полипептид, сотканный из 53 аминокислот. Он получил название, отражающее суть его эффекта, – эпидермальный фактор роста (EGF). Кстати, Коэн очень быстро разобрался и с тем, что EGF действует непосредственно на эпидермис, а не с помощью вторичного гормонального механизма.
Работы Коэна стали толчком к дальнейшему изучению этого белка и его возможностей. В 80-х годах прошлого века EGFR предложили использовать в качестве противоопухолевой мишени. Первопроходцем в этом направлении стал Джон Мендельсон, который в 1983 году впервые отметил, что EGF ингибирует пролиферацию эпидермоидной карциномы человека А431 [2]. Всего через год появилось еще одно исследование, показывающее, что моноклональные антитела к EGFR ингибируют рост эпидермоидной карциномы линии А431, а потому могут рассматриваться как иммунотерапевтическое средство при данном виде опухоли [3]. Приблизительно в это же время удалось расшифровать и клонировать последовательность человеческой EGFR.
В 1990 году были опубликованы результаты первого исследования, изучающего действие моноклонального антитела (Murine monoclonal antibody, MAb) [4]. Группа американских ученых во главе с тем же Джоном Мендельсоном доказала, что MAb к EGFR блокируют связывание EGF и ингибируют активацию тирозинкиназы, представляющей собой внутриклеточную часть рецептора, а также, как следствие этого, клеточную пролиферацию [4]. Это означало, что данный патофизиологический механизм может быть использован в клинической практике. Дело оставалось за созданием потенциально нового класса препаратов, которые бы ингибировали тирозинкиназу EGFR (ИТК EGFR). Первым представителем группы ИТК EFGR и стал гефитиниб.
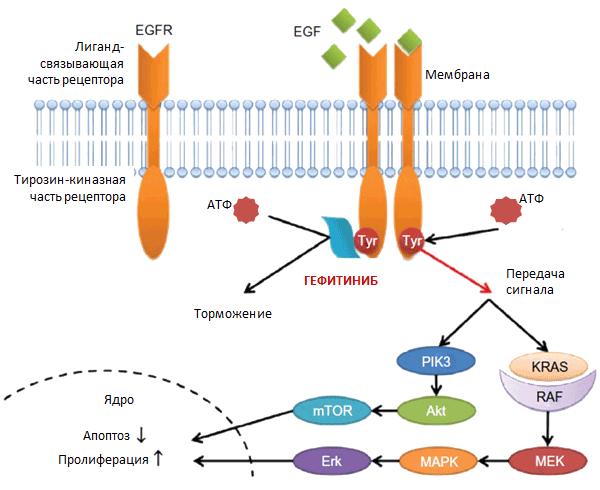
Полномасштабные клинические исследования гефитиниба начались в 1998 году. Уже во время первой фазы испытаний препарат показал благоприятную переносимость и хороший ответ на терапию НМРЛ. В 2000 году, в рамках проведения второй и третьей фазы исследования, получившего название IDEALs/ INTACTs, в связи с высокой эффективностью этой терапевтической стратегии была открыта Программа расширенного доступа к терапии гефитинибом. Она предусматривала назначение определенным группам пациентов препарата, который еще не был зарегистрирован, но уже доказал высокую эффективность.
В 2003 году были опубликованы результаты II фазы исследования IDEAL 1 и 2, свидетельствующие об эффективности гефитиниба в дозировках 250 мг в сутки [5]. Всего лишь год спустя появились данные, свидетельствующие о том, что предиктором ответа на терапию гефитинибом являются определенные генные мутации опухоли. Так, было доказано, что в категорию чувствительных к гефитинибу входят пациенты, опухоли которых имеют мутации в экзоне 21(L858R) и делеции в 19 экзоне гена EGFR а также некоторые другие, более редкие мутации [6]. Чаще всего они встречаются у больных раком легкого, которые никогда не курили, что и было показано в исследовании, опубликованном в том же 2004 году [7]. Сегодня известно, что мутации, которые ассоциируются с положительным ответом на терапию гефитинибом, чаще встречаются у женщин, чем у мужчин, у пациентов азиатской расы, а также у больных, имеющих аденокарциному в качестве морфологического варианта опухоли.
Следует отметить, что аденокарцинома с мутацией в экзоне 21(L858R) и делеции в экзоне 19 гена EGFR – довольно распространенное явление, особенно у никогда не куривших больных. Так, исследование с участием 2142 пациентов с аденокарциномой легких обнаружило данные мутации у 15% больных, куривших ранее, у 6% пациентов, которые курили в настоящем, и у 52% никогда не куривших участников [8].
Эффективность гефитиниба изучалась в нескольких крупных клинических испытаниях. Одной из первых масштабных работ стало рандомизированное исследование INTEREST, в котором участвовали 1433 пациента [9]. В нем сравнивалась выживаемость между группами пациентов, получавших гефитиниб и доцетаксел при лечении местнораспространенного или метастатического НМРЛ. Все участники перед исследованием уже получали как минимум 1 линию химиотерапии препаратами платины. Результаты исследования подтвердили не меньшую общую выживаемость в группе пациентов, получавших гефитиниб, по сравнению с контрольной группой (средняя выживаемость составила 7,6 и 8,0 месяца соответственно). Превосходство гефитиниба в группе пациентов с мутациями EGFR доказано не было. Кроме того, результаты INTEREST засвидетельствовали более благоприятную переносимость гефитиниба по сравнению с доцетакселом.
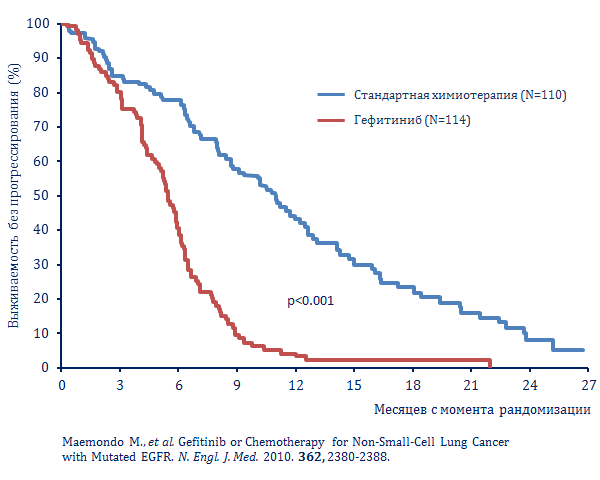
Данные еще одного крупного сравнительного рандомизированного исследования IPASS были опубликованы в 2011 году. В рамках IPASS 1217 пациентов были рандомизированы на две группы: первой был назначен гефитиниб, а второй – комбинация карбоплатина и паклитаксела [10, 11]. Большая часть пациентов с мутацией EGFR, рандомизированная в группу карбоплатина/паклитаксела (64,3%), в дальнейшем получала ИТК EGFR. Отметим, что все пациенты, участвующие в исследовании, имели клинические предикторы ответа на терапию гефитинибом: они принадлежали к азиатской этнической группе и никогда не курили в прошлом (или курили 10 или менее пачек сигарет в год и бросили курить 15 или более лет назад). У всех участников была гистологически подтверждена аденокарцинома.
Результаты IPASS показали, что общая выживаемость в группах гефитиниба и карбоплатина/паклитаксела была схожей, без значительной разницы между группами. А вот показатели выживаемости без прогрессирования в группах оказались различными. У пациентов с мутацией EGFR выживаемость без прогрессирования была выше, чем у больных контрольной группы (9,5 мес. по сравнению с 6,3 мес.). В то же время у пациентов без мутации EGFR выживаемость без прогрессирования в группе гефитиниба оказалась намного короче (в среднем 1,5 мес. по сравнению с 6,5 мес.), однако общая выживаемость все-таки не имела статистической разницы (11,2 мес. по сравнению с 12,7 мес.).
Отсутствие разницы в общей выживаемости между двумя группами участников было обусловлено кросс-овером в исследовании (тем, что гефитиниб назначали в качестве второй линии терапии участникам, предварительно получавшим карбоплатин/паклитаксел, а в группе, первоначально рандомизированной по гефитинибу, 76% больных после прогрессирования получали химиотерапию).
В исследовании, получившем название WJOG (West Japan Oncology Group), 177 пациентов с мутациями EGFR были рандомизированы на две группы: гефитиниба и комбинации цисплатина и доцетаксела [12]. Пациенты, получавшие гефитиниб, имели значительно более высокую выживаемость без прогрессирования по сравнению с участниками, рандомизированными в группу контроля (9,2 мес. по сравнению с 6,3 мес.). Тем не менее, общая выживаемость в обеих группах статистически не различалась.
Схожие результаты были продемонстрированы и еще в одном японском исследовании – North-East Japan Study Group trial [13]. В нем, так же, как и в IPASS, изучалась сравнительная эффективность гефитиниба и комбинации карбоплатина и паклитаксела, однако все 230 участников исследования имели мутацию в гене EGFR. Результаты эксперимента показали, что выживаемость без прогрессирования в группе пациентов, получавших гефитиниб, была в два раза выше, чем в группе химиотерапии (10,8 мес. и 5,4 мес. соответственно). И хотя разницы в общей выживаемости выявлено не было, способность гефитиниба значительно увеличивать выживаемость без признаков прогрессирования заболевания обеспечила препарату ведущие позиции в терапии НМРЛ у пациентов с мутациями в гене EGFR в опухоли.
Американское Управление по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) одобрило регистрацию гефитиниба в США на основании результатов мультицентрового исследования IFUM (IRESSA Follow-Up Measure). В нем участвовали 106 пациентов с ранее нелеченным НМРЛ, которые имели мутации в экзоне 21(L858R) и делеции в 19 экзоне гена EGFR [14, 15]. Частота объективного ответа на терапию гефитинибом по оценке исследователей составила 70%, а по данным слепого независимого ревью – 50%. При этом пациенты с мутациями в экзоне 21(L858R), и делециями в 19 экзоне гена EGFR отвечали на терапию идентично.
В России роль гефитиниба в лечении НМРЛ изучалась в исследовании под руководством В.М. Моисеенко [16]. В нем участвовали пациенты, проходившие лечение по поводу аденокарциномы легких в НМИЦ онкологии им. Н.Н. Петрова. В группу участников, получающих терапию гефитинибом в качестве препарата первой линии, были включены 25 пациентов с мутацией в гене EGFR. Результаты исследования засвидетельствовали полный ответ на терапию у 1 пациента, частичный ответ у 11 и стабилизацию состояния у 13 больных.
В другом российском исследовании, проведенном на базе НМИЦ онкологии им. Н.Н. Блохина, также были получены положительные результаты таргетной терапии гефитинибом больных НМРЛ с выявленными мутациями в гене EGFR в опухоли с метастазами в головном мозге [17]. Высокая эффективность ингибиторов EGFR и, в частности, гефитиниба, значимо увеличивающего частоту достижения общей эффективности и время до прогрессирования, в последующем была подтверждена и в других работах российских ученых 19. Кроме того, по данным В.М. Моисеенко, гефитиниб обладает потенциальной эффективностью у больных раком почки (при условии мутации EGFR) [22].
В Российской Федерации гефитиниб был впервые зарегистрирован в 2004 году [23] и с тех пор занял прочное место в практике врача-онколога. Сегодня российские онкологи используют гефитиниб в качестве препарата всех линий терапии НМРЛ у пациентов с мутацией в гене EGFR [20].
В Европу препарат пришел в июне 2009 года – именно тогда Европейская комиссия выдала разрешение на применение гефитиниба для лечения пациентов с местнораспространенным или метастатическим НМРЛ с мутацией в гене EGFR во всех линиях терапии. На сегодняшний день этот препарат зарегистрирован более чем в 70 странах мира. При этом и в ЕС, и в США, и во многих других странах препарат отнесен к первой линии терапии НМРЛ у больных с мутацией в гене EGFR в опухоли.
Успешные результаты клинических исследований, изучающих эффективность препарата в сравнении с карбоплатином, цисплатином и их комбинациями, а также доцетакселом стали основанием для включения препарата в международные рекомендации по лечению НМРЛ [24, 25]. Американское общество клинической онкологии (ASCO) рекомендует для лечения больных с IV стадией НМРЛ и мутацией EGFR в качестве препарата первой линии использовать гефитиниб [24]. Еще в 2009 году Европейское агентство по лекарственным средствам EMA рекомендовало утвердить гефитиниб как средство для лечения НМРЛ у пациентов с мутацией в домене ТК гена EGFR во всех линиях терапии [25]. Европейское Общество медицинской онкологии (ESMO) также рекомендует использовать ИТК EGFR (гефитиниб или эрлотиниб) в качестве препаратов первой линии у пациентов с НМРЛ, опухоли которых имеют активную мутацию EGFR в экзоне 19 и/или 21.
Появление в арсенале онкологов ингибиторов ТК EGFR в 2004 году стало прорывом в лечении диссеминированного рака легкого. Целесообразность применения таргетных ингибиторов EGFR у больных НМРЛ – носителей активирующих мутаций ни у кого не вызывает сомнений. Учитывая, что около половины пациентов с аденокарциномой легких могут быть чувствительны к ИТК EGFR [8], гефитиниб как препарат молекулярной таргетной терапии рака, определенно способствующий повышению продолжительности жизни без прогрессирования заболевания и приводящий к увеличению частоты объективных ответов, имеет огромное практическое значение в современной онкологии.
Адъювантное назначение гефитиниба не улучшает результаты лечения больных операбельным немелкоклеточным раком легкого

С.А. Тюляндин
Российский онкологический научный центр им. Н.Н.Блохина РАМН, Москва
Ингибиторы тирозинкиназы (ТKI) рецептора эпидермального фактора роста (EGFR) изменили наше представление о лечении метастатического немелкоклеточного рака легкого (НМРЛ). Во-первых, обнаружение мутации гена EGFR высветило реальный механизм развития рака легкого, в частности, у некурящих. Во-вторых, использование TKI у больных с мутацией гена EGFR было одним из первых примеров успешной таргетной терапии, позволившей увеличить продолжительность жизни диссеминированных больных как минимум вдвое. В-третьих, это инициировало персонализированный подход к лечению НМРЛ, основанный на определении генетического повреждения в опухолевой ткани – мутации гена EGFR. Столь высокая клиническая эффективность TKI у метастатических больных давала надежду, что они будут эффективны в качестве адъювантной терапии больных НМРЛ с наличием мутации гена ЕGFR.
Доктор G. Goss и коллеги опубликовали результаты незаконченного исследования BR.19 по использованию гефитиниба (Иресса) в качестве адъювантной терапии у больных НМРЛ после выполнения радикального оперативного вмешательства [1]. Это исследование планировалось и было инициировано до того, как стало известным о наличии мутации гена EGFR, которая является предсказывающей высокую эффективность назначения ТКI. Поэтому в него включались все больные НМРЛ IB, II и IIIA стадиями независимо от морфологии, у которых было выполнено радикальное оперативное лечение не позднее 16 недель от рандомизации. Больные были рандомизированы в группу плацебо или гефитиниба в дозе 250 мг, которые получали ежедневно в течение 2 лет. Больные проходили обследование с включением рентгенографии грудной клетки каждые 3 месяца в течение первых 30 месяцев, каждые 6 месяцев в течение 4 и 5 годов, затем ежегодно. Основным критерием эффективности была общая продолжительность жизни. Дополнительными критериями были безрецидивная выживаемость и токсичность. Планировалось включение 1242 больных с целью доказать статистически достоверное увеличение медианы продолжительности жизни на 25% в группе гефитиниба по сравнению с плацебо. После получения сведений о значении мутации гена EGFR для реализации эффекта гефитиниба были предприняты усилия по коллекции образцов опухоли больных, включенных в исследование для определения вышеуказанной мутации. Исследование было прекращено досрочно после получение сведений об отсутствии эффективности гефитиниба по сравнению с симптоматической терапией в исследовании ISEL [2].
За период 2002-2005 годы в исследование было включено 503 больных, характеристика которых представлена в таблице 1. Обращает на себя внимание высокий процент (более высокий, чем в обычной популяции больных) включения в исследование женщин и больных с аденокарциномой – известными клиническими факторами, предсказывающими эффективность гефитиниба.
Таблица 1. Характеристика больных
| Гефитиниб (n=251) | Плацебо (n=252) | |
|---|---|---|
| Возраст | 66 лет | 67 лет |
| Пол: – мужской – женский | 135 (54%) 116 (46%) | 136 (54%) 116 (46%) |
| Раса: – европеоидная – азиатская – другие | 223 (93%) 6 (2%) 12 (5%) | 235 (93%) 3 (1%) 14 (6$) |
| Гистология: – аденокарцинома – плоскоклеточный рак – другие | 150 (60%) 69 (27%) 32 (13%) | 149 (59%) 71 (28%) 32 (13%) |
| Опыт курения: – да – нет – неизвестно | 224 (89%) 23 (9%) 4 (2%) | 223 (88%) 19 (8%) 10 (4%) |
| Стадия: – IB – II – IIIА | 133 (53%) 87 (35%) 31 (12%) | 127 (50%) 88 (35%) 37 (14%) |
Медиана продолжительности приема гефитиниба и плацебо составила 4,8 (1-25) мес. и 8,9 (1-26) мес. соответственно. Редукция дозы была проведена у 39% больных в группе гефитиниба и у 20% в группе плацебо. Лечение было прекращено по причине токсичности у 15,3% и 3,3% больных соответственно, по инициативе больных – у 24% и 7% соответственно.
Лечение гефитинибом сопровождалось развитием кожной сыпи, диареи, анорексии и слабости 1-2 степени. Частота вышеуказанных осложнений 3-4 степени составляла 5-8%. У одного больного в каждой группе развились симптомы пневмонита. Умерли от токсичности 4 больных в группе гефитиниба и 3 больных в группе плацебо.
При медиане наблюдения 4,7 года из 503 больных умерло 219 (116 в группе гефитиниба и 103 в группе плацебо). Медиана времени продолжительности жизни составила 5,1 года в группе гефитиниба и не была достигнута в группе плацебо (HR=1.24, p=0.14). Медиана времени до прогрессирования составила 4,2 года в группе гефитиниба и не достигнута в группе плацебо (HR=1.22, p=0.15). При многофакторном анализе прием гефитиниба не влиял на медиану безрецидивной выживаемости и общей продолжительности жизни.
Среди 503 больных определение мутации гена EGFR было выполнено у 359 больных (173 и 186 в группе гефитиниба и плацебо соответственно). Мутация гена была обнаружена у 15 (4%) больных с аденокарциномой (7 в группе гефитиниба и 8 в группе плацебо). Прием гефитиниба не увеличил продолжительность времени до прогрессирования (HR=1.84, p=0.40) и общей продолжительности жизни (HR=3,16, p=0.15).
Данное исследование является единственным опубликованным опытом адъювантного назначения TKI для проведения адъювантной терапии радикально оперированным больным НМРЛ. С позиций сегодняшних знаний об эффективности TKI только у больных с наличием в опухоли мутации гена EGFR не стоит ожидать положительных результатов от адъювантного назначения гефитиниба всем больным НМРЛ.
Тем более что процент больных с мутацией в этом исследовании составил 4%, что значительно ниже обычных 9-12%, наблюдаемых в общей популяции европеоидных пациентов НМРЛ. А вот отсутствие какого-либо намека на улучшение результатов лечения у больных с мутацией вызывает удивление. Ибо это противоречит нашему успешному опыту применения TKI у метастатических больных.
Можем ли мы этот результат объяснить чисто случайным совпадением вследствие малого числа больных? Однако следует вспомнить, предсказывающий эффект мутации гена EGFR о высокой эффективности TKI был получен при анализе лечения всего 10 больных, 9 из которых достигли выраженного клинического эффекта [3]. Поэтому отсутствие даже намека на улучшение результатов лечения при лечении 7 больных скорее правда, чем артефакт.
Возможным объяснением низкой активности гефитиниба может служить кратковременность приема препарата. Вместо 24 месяцев медиана приема составила всего 4,8 месяца вследствие отказа больных от продолжения терапии или токсичности. Теоретически, отсутствие эффекта от TKI может быть объяснено меньшим значением сигнального пути EGFR для функционирования опухолевой клетки при ранних стадиях заболевания по сравнению с метастатическими больными.
Однако исследование BR.19 не способно ответить на данные вопросы. Будем надеяться, что проводимые в настоящее время исследования по адъювантному назначению ТKI у больных НМРЛ с наличием мутации гена EGFR (исследование RADIANT у европейской, китайское и японское исследования у азиатской популяции больных) дадут окончательный ответ об эффективности такого лечебного подхода. До тех пор, основываясь на результатах исследования BR.19, не следует рекомендовать назначение ТKI для адъювантной терапии больных операбельным НМРЛ, в том числе с мутацией гена EGFR в опухоли.
- Goss G, O’Callaghan C, Lorimer I, et al. Gefitinib versus placebo in completely resected non-small-cell lung cancer: results of the NCIC CTG BR.19 study. J. Clin. Oncol. 2013, 31:3320-26.
- Thatcher N, Chang A, Parikh P, et al. Gefitinib plus best supportive care in previously treated patients with refractory advanced non-small-cell lung cancer: results from a randomised, placebo-controlled, multicenter study (Iressa Survival Evaluation in Lung Cancer). Lancet 2005, 366:1527-37.
- Lynch T, Bell DW, Sordella R, et al. Activating mutations in the epidermal growth factor receptor underlying responsiveness of non-small-cell lung cancer to gefitinib. N.Engl. J.Med. 2004, 350:2129-2139.

Автореферат диссертации по медицине на тему Эрлотиниб и гефитиниб в лечении распространенного немелкоклеточного рака легкого
Коломейцева Алина Андреевна
ЭРЛОТИНИБ И ГЕФИТИНИБ В ЛЕЧЕНИИ РАСПРОСТРАНЕННОГО НЕМЕЛКОКЛЕТОЧНОГО РАКА ЛЕГКОГО
Автореферат диссертации на соискание ученой степени кандидата медицинских наук
Работа выполнена в Учреждении Российской академии медицинских наук Российский онкологический научный центр им. H.H. Блохина РАМН.
Научный руководитель: доктор медицинских наук, профессор
Вера Андреевна Горбунова
Научный консультант: доктор медицинских наук, профессор
Анатолий Юрьевич Барышников
Официальные оппоненты: доктор медицинских наук, профессор
Борне Евсеевич Полоцкий
доктор медицинских наук, профессор Эдуард Кузьмич Возный
Ведущая организация: ФГУ Московский научно-исследовательский онкологический институт им. П.А.Герцена Минздравсоцразвития России
заседании Диссертационного совета Д.001.017.01 при РОНЦ им. H.H. Блохина РАМН по адресу: 115478, Москва, Каширское шоссе, 24.
С диссертацией можно ознакомиться в библиотеке РОНЦ им. H.H. Блохина РАМН.
Ученый секретарь диссертационного совета,
доктор медицинских наук, профессор Ю.В. Шишкин
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Ежегодно раком легкого заболевает 1-1,2 млн. человек, и он остается лидирующей причиной смерти от онкологических заболеваний в мире. В Российской Федерации ежегодно регистрируется около 63 тыс. новых случаев рака легкого, составляя в структуре онкологической заболеваемости 22% у мужчин и 4% у женщин. На долю немелкоклеточного рака легкого (HMPJI) приходится примерно 85% всех случаев рака легкого (Давыдов М.И., Аксель Е.М., 2008). HMPJI представлен тремя наиболее часто встречающимися гистологическими подтипами: плоскоклеточным раком, аденокарциномой и крупноклеточным раком [Sato М. Et al., 2007].
Неудовлетворительные результаты лечения HMPJI связаны, прежде всего, с поздней выявляемостью, а также частыми рецидивами и отдаленными метастазами после радикальных операций даже на ранних стадиях процесса. Пятилетняя выживаемость для всех стадий не превышает 15%. В терапии таких больных ведущее значение приобретают консервативные методы (Горбунова В.А., Маренич А.Ф., 2005).
Высокая заболеваемость и смертность от рака легкого, а также большой процент больных с диссеминированным опухолевым процессом диктует необходимость изучения и разработки новых режимов лечения с применением современных противоопухолевых препаратов и их комбинаций. В настоящее время химиотерапия на основе препаратов платины (цисплатин или карбоплатин) в комбинации с цитотоксическими агентами 3-й генерации (гемцитабин, паклитаксел, доцетаксел, винорельбин) является стандартным подходом в терапии неоперабельных больных рецидивным и метастатическим HMPJI, имеющих удовлетворительное общее состояние [Socinski М.А., 2003]. Доцетаксел и пеметрексед одобрены для использования в монотерапии местно-распространенного и метастатического HMPJI, резистентного к платиносодержащим режимам [Han S-W. et al., 2005].
Однако в последние годы достигнут определенный предел возможностей и эффективности цитотоксической терапии.
Дальнейшее улучшение результатов лечения распространенного НМРЛ стало возможным с развитием молекулярной онкологии, изучением ключевых механизмов канцерогенеза и, как следствие, созданием новых препаратов, обладающих избирательным терапевтическим потенциалом и минимальной токсичностью. Эффекты данных препаратов направлены на инактивацию рецепторов факторов роста с целью нарушения механизмов передачи ростового сигнала в опухоли, подавлению пролиферации, дифференцировки и ангиогенеза (Носов Д.А., 2004).
Улучшение результатов лечения распространенного немелкоклеточного рака легкого за счет индивидуализации терапевтического подхода путем назначения ингибиторов рецептора эпидермального фактора роста эрлотиниба и гефитиниба.
1. Изучить эффективность и отдаленные результаты лечения ингибиторами ЕС^Я (эрлотиниб и гефитиниб) больных распространенным НМРЛ
2. Оценить переносимость ингибиторов ЕОРЯ при распространенном НМРЛ
3. Определить факторы прогноза эффективности ингибиторов ЕСРИ у больных распространенным НМРЛ с помощью молекулярно-биологических маркеров апоптоза, ангиогенеза и пролиферации (ЕСРЯ, Н1Р-1а, РТЕИ, рАН УЕОРЯ2, УЕОР)
4. Изучить взаимосвязь мутаций генов (ЯС//'7?, КЯА£>) в ткани опухоли легкого с эффективностью ингибиторов ЕСРЛ у больных НМРЛ
Впервые показана эффективность эрлотиниба и гефитиниба при распространенном НМРЛ у российских больных, прогрессирующих на стандартных режимах химиотерапии.
Изучена эффективность и безопасность эрлотиниба и гефитиниба, а также комплексная оценка взаимосвязи молекулярно-биологических маркеров (ЕСРЯ, рАМ, УБОР и др.) и мутаций генов (ЕСРК, К ЯЛ с эффективностью лечения ингибиторами тирозинкиназ распространенного НМРЛ у российских больных.
Научно-практнческая значимость работы
Выявление факторов, определяющих чувствительность клеток рака легкого к действию ингибиторов тирозинкиназ, может принципиально изменить стратегию лечения этого заболевания и выделить группы пациентов, у которых можно получить максимальную выгоду от данных препаратов, т.е. выработать индивидуальный подход к назначению гефитиниба и эрлотиниба.
Основные положения диссертации доложены 10 июня 2011 г. на совместной научной конференции отделения химиотерапии и отделений химиотерапии и комбинированного лечения злокачественных опухолей, клинической фармакологии и химиотерапии, изучения новых противоопухолевых лекарств, диагностики опухолей, торакального и радиологического отделений, лаборатории экспериментальной диагностики и биотерапии опухолей НИИ ЭДиТО, лаборатории онкогеномики, лаборатории регуляции клеточных и вирусных онкогенов НИИ канцерогенеза.
СТРУКТУРА И ОБЪЕМ ДИССЕРТАЦИИ
Диссертация представлена на 113 страницах, разделена на список сокращений, введение, 4 главы (обзор литературы, материалы и методы, результаты, обсуждение), выводы и список литературы. Работа дополнена 10
таблицами и проиллюстрирована 27 рисунками. Перечень использованной литературы включает 120 источников на русском и английском языках.
СОДЕРЖАНИЕ ДИССЕРТАЦИИ МАТЕРИАЛЫ И МЕТОДЫ
Клиническая часть исследования проводилась на базе отделения химиотерапии и отделения химиотерапии и комбинированных методов лечения РОНЦ им. Н.Н.Блохина РАМН.
В исследование было включено 86 больных неоперабельным или рецидивным HMPJI, у которых отмечалось прогрессирование на фоне проведения стандартных режимов химиотерапии. Исключение составили 5 пациентов с тяжелой сопутствующей патологией, имеющие противопоказания для проведения традиционного лекарственного лечения. Таким больным ингибиторы рецепторов тирозинкиназ назначались в первой линии терапии.
Общее состояние больных оценивали по шкале ECOG (Eastern Cooperative Oncology Group, 0-4 балла).
Лечение проводили двумя ингибиторами рецептора эпидермального фактора роста: гефитинибом в дозе 250 мг и эрлотинибом в дозе 150 мг на прием ежедневно непрерывно до прогрессирования или развития тяжелой токсичности. Эффективность лечения оценивали по четырем параметрам: 1) частоте ремиссий, 2) контролю роста опухоли, 3) времени до прогрессирования, 4) общей выживаемости.
До начала лечения и каждые последующие 2 месяца приема препаратов проводилось контрольное обследование: КТ грудной клетки, УЗИ брюшной полости и периферических лимфатических узлов. В случае поражения костей скелета выполнялось радиоизотопное исследование костной системы. Оценка ответа опухоли на лечение проводилась в соответствии с критериями RECIST (V. 1.1).
В случае прогрессирования опухолевого процесса большей части пациентов назначали специфическое лечение 3-й и последующих линий, эффективность которого специально не оценивалась. У всех пациентов была прослежена общая выживаемость.
Побочные действия ингибиторов тирозинкиназ оценивали по стандартной шкале токсичности СТС АЕ (у.3.0). Основными проявлениями токсичности были кожные высыпания, сухость кожи, диарея, ухудшение аппетита. При диарее или кожной токсичности II ст. делался перерыв в приеме препарата, назначалась соответствующая симптоматическая терапия. При уменьшении степени проявления нежелательных явлений до I ст. или их исчезновении прием препарата возобновлялся в той же дозе. В случае токсичности III ст. также делался перерыв в лечении. Далее производилась редукция дозы препарата.
Все иммуногистохимические исследования проводились в лаборатории экспериментальной диагностики и биотерапии опухолей НИИ ЭДиТО РОНЦ им. Н.Н.Блохина РАМН.
Для исследования использовали биопсийный материал опухолевой ткани легкого, полученный от 38 пациентов до начала специфического лечения. Иммуногистохимический анализ проводили на срезах с парафиновых блоков, предназначенных для стандартного морфологического исследования. Парафиновые срезы депарафинировали и регидратировали по стандартной методике. Использованные в работе первичные антитела и их разведения представлены в таблице 1.
Панель использованных в исследовании антител
EGFR 31G7 Zymed 1:25 Протеиназа К
pAkt Phosphor T308 Abeam 1:500 10 мМ нитратный буфер (рН 6,0)
HIF-la HIFlalphaö 7 Abeam 1:200 10 мМ нитратный буфер (рН 6,0)
VEGFR2 A-3 Santa Cruz Biotech 1:500 10 мМ нитратный буфер (рН 6,0)
PTEN VP-P985 Vector 1:200 10 мМ цитратный буфер (рН 6,0)
VEGF C-l Santa Cruz Biotech 1:500 10 мМ цитратный буфер (рН 6,0)
Генетические исследования проводились в лаборатории онкогеномики НИИ канцерогенеза РОНЦ им. Н.Н.Блохина РАМН.
Лиофилизованный очищенный продукт ПЦР подвергали секвенированию. Мутация онкогена выявлялась методом прямого секвенирования при содержании мутантного аллеля не менее 10-15%.
На завершающем этапе клинические данные были сопоставлены с результатами иммуногистохимического и генетического анализа.
Читайте также:

