Где в питере лечить рак легких
![]()
Андрей Каприн: дефицит онкологов в первичном звене – более 50%![]()
Главный онколог СЗФО рассказал, почему в Петербурге не снижается смертность от рака![]()
Пороки клапанов сердца: классические подходы и новые альтернативы

- Дмитрий Александрович, почему именно при раке легких такая высокая смертность?
- Во-первых, потому что этот рак очень сложно выявить рано — большинство пациентов впервые обращается к онкологу, когда заболевание достигло уже 3-4-й стадии и радикальное лечение невозможно. Даже в ходе диспансеризации выявляются чаще всего поздние стадии болезни. По России это 70-80%.
Это происходит потому, что развивается он долгое время бессимптомно, а его осложненные формы мимикрируют - скрываются за пневмониями, бронхитами, астмой, остеохондрозом, и пациент годами лечится у неврологов, пульмонологов, терапевтов. Когда появляются типичные симптомы, это уже распространенный процесс.
- Сейчас на всех уровнях власти говорят о том, что необходима программа скрининга рака легкого. В Москве она уже год действует, закуплены низкодозные компьютерные томографы (КТ). В Петербурге тоже планируется запуск такого проекта, пока пилотного. Хотя говорят, что и в рамках обычной ежегодной диспансеризации выявляются новообразования в легких.
- В некоторых странах скрининги работают уже много лет, и эксперты оценивают их эффективность по-разному.
- Поскольку смертность от рака легкого выше, чем от других онкологических заболеваний, усилия по снижению смертности должны, вероятно, направляться на его раннее выявление и лечение? Значит, нам все-таки нужен скрининг рака легкого?
- Единственный эффективный метод скрининга, и то не всеми признаваемый — низкодозная КТ. Чтобы он был действительно эффективным, необходим массовый охват населения из групп риска - курильщиков со стажем более 20-30 лет в возрасте от 40 до 75 лет. Но просто закупить КТ и всех обследовать не достаточно. Это очень чувствительный метод диагностики, по его результатам выявляются самые разные образования, в том числе не злокачественные. Но они тоже требуют внимания: дополнительной диагностики, наблюдения, причем в течение не одного года. Чтобы скрининг был эффективным, нужны грамотные рентгенологи, терапевты, пульмонологи, то есть первичное звено должно быть готово к приему таких пациентов и работе с ними. Отправлять всех к онкологам невозможно, они не в состоянии принять всех, особенно учитывая, что скрининг первые годы будет выявлять всё подряд, в том числе запущенные раки. А он нужен не только, чтобы выявлять рак легкого на ранних стадиях, но и лечить: онкологические стационары должны иметь для этого все возможности.
Дело в том, что радикальное хирургическое лечение может быть не всем доступно. Курение провоцирует развитие не только онкологических заболеваний, но и атеросклероз, ХОБЛ, ИБС, гипертонию и так далее. Сопутствующие заболевания становятся противопоказаниями для радикального лечения. У меня сейчас есть пациент с ранним раком, которому хирургия противопоказана из-за выраженной сопутствующей патологии. К счастью, есть и нехирургическое лечение первичной опухоли — стереотаксическая терапия, кибер-нож, можно провести радиочастотную абляцию опухоли, термо- или криоабляцию. В некоторых странах такие методики лечения рака легкого у пожилых входят в стандарты лечения наравне с хирургией. И мы должны развивать эти методы в условиях, когда расширяются возможности диагностики. Иначе зачем его выявлять, если лечить нечем?
- Почему эффективность скрининга с применением низкодозных КТ оценивается в странах, где он проводится, неоднозначно?
- Перед нами стоит цель - снижение смертности, это и есть показатель эффективности скрининга. Она оценивается через 6-8 лет с момента старта программы. Из существующих скринингов наш самый дорогой. И если государство тратит на него огромные деньги, а результаты незначительные — например, смертность снизилась на полпроцента, скрининг признается неэффективным.
Как показывает опыт стран, раньше нас начавших борьбу с раком легкого, с помощью многолетнего скрининга мы можем снизить смертность на 0,5-3 %, увеличив выявляемость заболевания на ранней стадии, но это неполное решение проблемы. Заметные результаты принесет исчезновение основного фактора риска - курения. Теоретические расчеты говорят о том, что если все резко бросят курить, лет через 15 мы можем получить прогнозируемое снижение смертности от онкологических заболеваний на 20-30%.
- Почему только через 15 лет?
- 15 лет — срок, по истечении которого считается, что риск, нажитый за предыдущие годы курения, нивелирован. Конечно, возникшие изменения никуда не денутся, но с каждым прожитым без сигареты годом вероятность заболевания снижается. Поэтому скрининговые программы выявления рака легких предназначены для курящих в настоящем и в прошлом – только через 15 лет человек, бросивший курить, не входит в группу риска, для которой проводится скрининг: если рак возникнет позже, курение не считается его причиной.
Есть другая теория, по которой последствия курения нивелируются ровно через столько лет, сколько лет человек курил. Скажем, если его стаж - 20 лет, значит, риск развития заболевания, спровоцированного курением, исчезает через 20 лет. С каждым годом риск уменьшается. А продолжая курить, человек увеличивает вероятность развития разных онкологических заболеваний.
- Считается, что 90% раков легких спровоцированы курением. Почему, когда все бросят курить так невелико снижение заболеваемости — 20-30%?
- Потому, что процессы канцерогенеза и превращения нормальных клеток в атипичные — неизбежность: мутации и патологические митозы (изменения клеток) накапливаются с каждым делением клетки. Даже у здоровых людей постоянно появляются либо раковые клетки, либо потенциально раковые, но они уничтожаются иммунной системой. Если она не справляется, клетки размножаются, развивается злокачественное новообразование. А факторами извне мы лишь провоцируем его появление раньше. Существует также много так называемых наследственных раков.
- Вторую стадию называют ранней, и когда она обнаружена, человек радуется — заболевание легче поддается лечению. Но, как говорит главный онколог страны, она бывает разной.
- Радоваться надо тому, что диагноз поставили правильно: не занижая и не завышая стадию. Это очень важно, потому что при правильном стадировании, правильной диагностике возможно и прогнозирование. Вообще-то, ранним раком можно называть только рак in situ – энтраэпителиальный (1-я А стадия), при котором аномальные клетки находятся там, где они возникли, — это опухоли размером до 1 см без поражения лимфоузлов. Как правило, это случайные находки. Все, что больше, уже имеет высокий риск как лимфогенного, так и гематогенного метастазирования, которое может проявиться даже спустя годы.
1-2-я - это те стадии, на которых возможен весь спектр радикальных воздействий, если нет противопоказаний по общему состоянию здоровья. А значит, и прогнозы оптимистичнее.
- Почему говорят, что рак легких раньше был другим, и его практически не лечили?
- Лечили, конечно, но безуспешно. Тогда было много плоскоклеточного рака и мелкоклеточного (самый агрессивный рак, даже при небольших размерах опухоли он очень активно метастазирует), и в основном центральных форм. С их лечением есть сложности и сегодня. Но этих видов рака стало меньше, сейчас преобладает немелкоклеточный рак.
На самом деле нет хорошего и плохого рака. Например, один вид злокачественной опухоли медленно развивается и медленно метастазирует, но плохо поддается лекарственной терапии. Более агрессивный рак чувствительнее к химиотерапии.
Рак легких — по сути не одно, а группа разных заболеваний, объединенных по локализации — органу, в котором образовалась опухоль. Он может быть мелкоклеточным и немелкоклеточным, среди немелкоклеточного есть, например, нейроэндокринные опухоли, образующиеся из бронхиальных желез, которые могут расти медленно и нечасто метастазируют. Аденокарциномы, железистый рак бывают очень злокачественными, быстро растущими, по типу мелкоклеточного метастазирующими, не имеющими мутаций и с трудом подвергающимися лекарственной терапии. И есть медленно растущие аденокарциномы. Крупноклеточный рак по злокачественности - между железистым и мелкоклеточным. У пожилых людей рак может расти 30 лет, пока перерастет в клиническую форму. Скорость развития (удвоения, метастазирования) у молодых и у пожилых разная. Обычно опухоль развивается от 5 до 15 лет до стадии 1А, то есть до той формы, в которой мы можем ее увидеть.
У каждого вида рака – свои особенности в терапии. А сейчас мы владеем и молекулярно-генетической диагностикой, что тоже разделяет и выделяет определенные группы опухолей, чувствительных к современной таргетной и иммунотерапии.
- Мы говорим, что шансов на выздоровление больше у тех, кому выполнена радикальная операция. Но за последнее десятилетие появились большие успехи в лекарственной противоопухолевой терапии рака легкого - таргетная терапия, иммунотерапия. И всякий раз с появлением новых классов лекарств мы говорим, что это прорыв в лечении. А потом оказывается, что это всего лишь шаг к прорыву.
- Торакальная хирургия, действительно, далеко продвинулась вперед, стала органосохраняющей. Но успех лечения связан сейчас не столько с ней, сколько с терапией — гормонотерапией, химиотерапией, лучевой терапией – до и после операции, а также во время хирургического вмешательства (интраоперационной). При лечении рака легкого эти методы пока слабее развиты в сравнении с лечением опухолей в других органах. Потому что искать стали поздно — раньше ведь считалось, что его вообще бесполезно лечить химиотерапией. Но сейчас эти направления активно развиваются и уже дают хорошие результаты.
Нашим пациентам доступны все методы лекарственного лечения: классическая химиотерапия, таргетная терапия, иммунотерапия. Но таргетные препараты и лекарства для иммунотерапии разработаны пока не для всех видов рака. Их, безусловно, можно назвать прорывом, в том числе в лечении рака легкого.
- Сколько пациентов в Петербурге получают таргетную терапию и можно ли сравнить ее эффективность с традиционной химиотерапией.
Но проигрывая во времени, выигрываем в лечении: если находим мишень, для которой существует таргетный препарат, мы переводим рак легкого в хроническое контролируемое заболевание.
Да, результаты лечения на таргетной терапии лучше, чем на химиотерапии, только сравнивать их нельзя. Пациенты, которые получают традиционную химиотерапию и таргетные препараты это пациенты с разными раками легкого - чтобы получать таргетную терапию надо иметь соответствующие мутации. Чаще всего они есть у некурящих женщин, и очень редко обнаруживаются у мужчин-курильщиков,
- Тут все индивидуально, у нас есть пациенты, которые более 5 лет живут на таргетной терапии без прогрессирования заболевания. Но, да, при определенной поломке гена (мутации) через несколько месяцев или год-полтора у большинства возникает резистентность. Опухоль начинает по-другому прогрессировать, у нее появляются другие мутации. То есть происходит селекция опухолевых клеток, поскольку они хотят жить и размножаться, а значит, сопротивляются воздействию препарата.
Когда развивается резистентность к таргетным препаратам 1-2 поколения, повторно проводится весь спектр молекулярно-генетической диагностики и при нахождении мишеней выбираются препараты 3-го поколения, их можно назвать политаргетными.
- Почему и иммунотерапия показана не всем? В чем ее отличие от других видов лекарственной терапии?
- Около 10% из всех иммуночувствительных опухолей дают полный и длительный ответ на иммунотерапию. Предназначенные для нее препараты включают собственную иммунную систему, чтобы она атаковала опухоль.
Разница между химиотерапией и иммунотерапией в том, что цитостатики разрушают клетку или на каком-то этапе ее жизнедеятельности блокируют деление. Причем под их воздействие попадают не только опухолевые клетки, но и здоровые.
Отличие таргетных препаратов от иммунобиологических — в том, что первые воздействуют на какую-то поломку, которая есть только в этой опухолевой клетке, а иммунобиологические запускают механизмы противоопухолевого иммунного ответа, воздействуя на определенный рецептор в клетке.
При раке легкого есть зарегистрированные в России иммунобиологические препараты 1-й, 2-й и последующих линий. Это новые, а значит дорогие препараты, поэтому закупаются они индивидуально. Для их назначения также важен отбор пациентов. В ходе исследования у пациента ищется экспрессия специальных маркеров чувствительности к иммунотерапевтическому препарату. Чем она выше, тем лучше эффективность: препараты работают только при экспрессии более 50. В этом и заключается отбор - нет смысла назначать ее всем подряд, она не каждому поможет.
Да, иммунотерапия — одно из самых перспективных направлений в онкологии. Но она предназначена для распространенных раков, а мы бы хотели выявлять его на ранних этапах и не доводить до необходимости ее применения.
Вообще, онкология - такая область медицины, в которой нельзя концентрироваться на одном направлении. Мы победим в одном, обойдут с другого. Потому что клетки независимо ни от чего делятся, мы стареем, мутации накапливаются, какие-то поломки исправляются, какие-то — нет, с возрастом количество поломок накапливается.
- Надо ждать появления других методов терапии?
- Конечно. В онкологию уже идут космические технологии. Например, запуск в кровоток диагностических маркеров, при котором задействуются роботы, наночастицы. Это не фантастика, разработки ведутся, до клинических исследований, правда, дело еще не дошло. Они начались в Америке, когда собрались на десятки лет отправлять человека в космос. Чтобы экипаж не вымер от болезни, надо понимать, не разовьется ли у него через несколько лет рак. Идея переросла в метод диагностики под названием тераностика. Это выявление заболевания и лечение одновременно. Допустим, введение наночастиц для диагностики при обнаружении опухолевых клеток позволяет одновременно воздействовать на ее клетки и разрушать их до клинических проявлений опухоли.
- Какое лечение рака легкого доступно сегодня петербуржцам?
- Большинство современных препаратов и схем лечения доступны за счет городского бюджета. Хотя, безусловно, есть и проблемы. В бюджет заложено приобретение определенного количество, допустим, таргетного препарата на уже существующих пациентов с установленной мутацией – мишенью. В течение года появляется еще 1 - 2 пациента с такой мутацией и препарата не хватает. Нужны дополнительные закупки. И тут могут возникнуть разные проблемы, поскольку лекарственное обеспечение планируется заранее — на весь год. Но даже если есть возможность организовать дополнительные закупки, это потеря времени.
Кроме того, мы должны просчитывать экономику — препарат, в отличие от химиотерапии, у которой есть ограниченное количество курсов, назначается для постоянного применения на годы. Сумеем мы обеспечить им пациента через два года? А через 5? Это не значит, что мы отказываем пациентам в таргетной терапии. Но определенные сложности есть.
Выходим из положения за счет программ расширенного доступа, которые проводятся фармкомпаниями через Минздрав - они обеспечивают пациентов препаратами, либо проходящими регистрацию, либо еще не зарегистрированными в нашей стране, но показавшими в клинических исследованиях хорошие результаты. Если пациент подходит по определенным критериям, он вступает в эту программу за счет другой формы финансирования.
- Рак легких — заболевание, которое даже после излечения будет портить человеку всю оставшуюся жизнь. Почему?
- Потому что даже избавив человека от злокачественной опухоли, мы не должны забывать, что риск развития рака у этого человека остался прежним. Допустим, мы выявили рак у пациента из группы риска: опухоль удалили, провели курс химиотерапии. Но даже если бросил курить, он остался в группе риска развития рака, пока не прошло 15 лет. То, что мы вылечили один рак легкого, не выводит его из группы риска по развитию другого рака. Это вовсе не особенность рака легкого, это особенность всех онкологических заболеваний. Скажем, при раке молочной железы — риск развития опухоли в другой железе на 30%. Вообще, если человек перенес один рак, риск развития другого вырастает на 30%, пережил два рака — еще на 30%. Но этого не следует бояться. Важно помнить о риске, своевременно обследоваться и лечиться. Потому что даже когда этот риск реализуется, люди лечатся и живут долгие годы.
Записаться на консультацию 8-921-389-56-85
Рак легких — самое распространенное онкологическое заболевание в России и мире, требующее незамедлительного лечения. Ежегодно оно поражает миллион человек. Мужчины болеют в 3 раза чаще женщин. Шесть из десяти больных умирают.
Цены на платные услуги
Ни одно из широко распространенных онкологических заболеваний не имеет такой очевидной связи с факторами окружающей среды, условиями производства, вредными привычками и индивидуальным стилем жизни, как рак легких. Канцерогенное действие на легочную ткань оказывают многие химические вещества: полициклические ароматические углеводороды, входящие в состав продуктов термической обработки угля и нефти, хлорметиловые эфиры, винилхлорид, а также мышьяк, хром, кадмий и их соединения. Однако наибольшее влияние на развитие РЛ оказывает курение табака.
При лечении по области поражения различают два основных типа рака легких:
Центральный — когда происходит поражение крупных бронхов (главного, долевого, сегментарного, субсегментарного), доступных надежной визуализации в процессе проведения гибкой бронхоскопии.
Периферический — исходит из более мелких бронхов, бронхиол или альвеол. В процессе роста при вовлечении крупных бронхов периферическая опухоль может стать центральной.
Помимо центрального и периферического рака легких, выделяют также особые редкие формы заболевания:
- Медиастинальную форму — множественное метастатическое поражение (конгломерат) средостенных лимфатических узлов без установленной локализации первичной опухоли в легком (присуща преимущественно мелкоклеточному РЛ).
- Диссеминированную форму (первичный карциноматоз) — множественное поражение легких без установленной локализации первичной опухоли в других органах.
По сводным данным зарубежных и отечественных авторов, центральный рак легких встречается в 65–75 % случаев, периферический — в 25–35 %, другие формы — в 1–5 %.
Распространенность опухолевого процесса — один из основных факторов, определяющих выбор метода лечения, объема оперативного вмешательства и прогноз. Стадия заболевания зависит от размера и распространенности первичной опухоли и ее отношения к окружающим тканям (Т), а также от регионарного лимфогенного (N) и отдаленного гематогенного (М) метастазирования.
В основу каждой международной классификации по системе TNM положен анализ выживаемости больных раком легких с учетом распространенности опухолевого процесса и проведенного лечения. Чрезвычайно важно точно определить стадию РЛ. Так, по данным многих авторов, 5-летняя выживаемость больных при I стадии составляет 40–60 %; II стадии — 20–33 %; III стадии — 5–15 %; IV стадии — 0–1 %.
Клиника, симптомы, причины, диагностика рака легких
Выраженность клинической симптоматики при РЛ зависит от клинико-анатомической формы опухоли, ее гистологической структуры, локализации, размеров и типа роста, характера метастазирования, сопутствующих воспалительных изменений в бронхах и легочной ткани.
Симптомы рака легких не имеют специфики: наиболее частым симптомом является кашель (70 %), сухой или с мокротой; кровохарканье встречается в 25 % случаев; одышку при физической нагрузке испытывает 40 % больных, дискомфорт и боли в грудной клетке на стороне поражения — 60–70 % пациентов.
Чтобы поставить диагноз, в клиниках делают:
Лечение рака легких и реабилитация пациентов
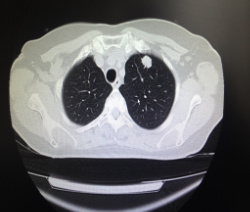
Лечебный план составляют врачи специализированных клиник с учетом стадии и локализации онкологического процесса, гистологического типа опухоли, состояния и возраста пациента. Во время хирургического лечения рака удаляют все легкое либо его часть (долю). Обязательно удаляют регионарные лимфоузлы. Операции проводятся или традиционно открыто, или с использование эндовидеохирургических технологий (видеоторакоскопическая лобэктомия).
Хирургическое лечение рака легких показано на ранних стадиях — таких больных не больше 20 %. В остальных случаях проводят предоперационную (неоадъювантную) химиотерапию — введение лекарственных средств, избирательно подавляющих раковые клетки. После 2–3 циклов предоперационной химиотерапии оценивают лечебный эффект и решают вопрос о хирургическом этапе.
Могут также назначить прием инновационных иммунологических препаратов — моноклональных антител. Как правило, консервативные методы лечения рака легких в современных клиниках комбинируют.
В период реабилитации показаны:
- регулярные контрольные обследования;
- дыхательная гимнастика и ЛФК;
- вентиляция легких;
- кислородотерапия через носовой катетер;
- дренаж дыхательных путей;
- использование специальных аэрозолей;
- лечение сопутствующих заболеваний.
При неоперабельных формах рака или отказе больного от операции химиотерапия (лучевая терапия) проводится в качестве самостоятельного лечения.
Паллиативную помощь назначают неизлечимым больным для улучшения их состояния и качества жизни. В терапевтическую схему включают облучение, химиотерапию, обезболивание, симптоматическую терапию, детоксикацию, психотерапию.
Без терапии 87 % больных умирают в течение 1 года. Пятилетней выживаемости после операции достигают 30 %, а при комбинированном лечении — до 40 % пациентов с раком легких в России. При обнаружении опухоли на ранней стадии шанс на выздоровление — до 80 %.
Методы лечения рака легких
Как лечить рак легких? Выбор метода лечения рака легкого определяется типом опухоли, а также распространенностью заболевания, возрастом пациента, наличием сопутствующих патологий.
Существует два основных типа рака легких:
- Немелкоклеточный рак легкого, который встречается в 85% случаях и подразделяется на различные гистологические подтипы - аденокарцинома легкого, плоскоклеточный рак легкого, крупноклеточный рак легкого.
- Мелкоклеточный рак легкого - он диагностируется у 15% пациентов и является более агрессивным, склонен к быстрому распространению и рецидивам.
- arrow_forwardХимиотерапия при раке легкого
- arrow_forwardТаргетная терапия при раке легкого
- arrow_forwardИммунотерапия при раке легкого
- arrow_forwardХирургический метод лечения рака легкого
- arrow_forwardЛучевая терапия при раке легкого
- arrow_forwardПаллиативная помощь
Химиотерапия при раке легких
В современной онкологии химиотерапия является одним из главных методов лечения рака легких.
В зависимости от типа опухоли и стадии заболевания, химиотерапия при раке легкого может применяться в качестве самостоятельного метода или как часть комбинированного лечения вместе с лучевой терапией и хирургическим лечением.
В частности, адъювантная химиотерапия при раке легких проводится после операции в случае отсутствия отдаленных метастазов, а также с профилактической целью, но при наличии метастазов в лимфоузлах.
За последние десятилетия в химиотерапии рака легкого достигнут значительный прогресс. Существует достаточное количество протоколов химиотерапии, которые отражены в рекомендациях ведущих международных онкологических сообществ – NCCN (Национальная всеобщая онкологическая сеть) и ESMO (Европейское общество медицинской онкологии).
В европейские и американские схемы химиотерапии входят такие цитостатики, как Доцетаксел, Карбоплатин, Цисплатин, Гемцитабин, Паклитаксел, Этопозид, Иринотекан, Пеметрексед, Навельбин. Химиопрепараты применяются как в монорежиме, так и в определенных комбинациях друг с другом.

Современная онкология не стоит на месте. В химиотерапию при раке легких специалисты продолжают внедрять новые высокоактивные противоопухолевые препараты, что позволяет добиться существенных результатов и увеличить продолжительность жизни пациента. Например, новый цитостатик Пеметрексед (коммерческое название Алимта) успешно применяется при химиотерапии злокачественной мезотелиомы плевры и немелкоклеточного рака легкого. Он является многоцелевым антифолатом, ингибирующим тимидилат-синтетазу (TS), тем самым эффективно нарушает пролиферацию опухолевых клеток.
Алимта внесена в европейские стандарты лечения в сочетании с препаратами платины (Цисплатин, Карбоплатин) и Гемзаром. Сравнительные исследования показали увеличение общей продолжительности жизни у пациентов, получающих химиотерапию с участием Пеметрекседа, чем у группы пациентов, получающих стандартную химиотерапию.
Химиотерапия является ведущим методом лечения рака легкого 4 стадии. 4 стадия рака легкого означает, что опухоль распространилась за пределы легкого, в другое легкое, лимфоузлы или другие органы организма. Наличие метастазов говорит о том, что возможное противоопухолевое лечение, в том числе и химиотерапия, будет паллиативным.
Цель паллиативной химиотерапии – уменьшить опухоль, снизить дискомфорт, связанный с ней, предотвратить дальнейшее распространение рака легкого и продлить жизнь пациента.
Побочные эффекты химиотерапии при раке легкого зависят от назначенных химиопрепаратов и применяемой дозы и могут включать слабость, повышенную частоту инфекций, тошноту и рвоту, выпадение волос, потерю аппетита, диарею, снижение показателей крови, онемение и покалывание в руках и ногах (ладонно-подошвенный синдром).
При длительной инфузии химиопрепаратов (24 часа или 48 часов) мы устанавливаем специальные инфузионные помпы, которые обеспечивают равномерное введение цитостатиков и в то же время позволяют пациенту находиться дома, в привычных условиях.
Также мы специализируемся на проведении подготовки к сеансам химиотерапии при раке легких и восстановлению после нее.
Уварова Светлана Николаевна
Главный врач, онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Базылев Андрей Сергеевич
Онколог-химиотерапевт, врач паллиативной медицины
Тверезовская Ирина Александровна
Онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Буйнякова Анна Игоревна
Онколог-химиотерапевт, к.м.н., врач высшей категории, врач паллиативной медицины
Тверезовский Сергей Александрович
Хирург-онколог, онкодерматолог, маммолог, к.м.н, врач высшей категории
Круглова Марина Сергеевна
Онколог-химиотерапевт, врач высшей категории, врач паллиативной медицины
Баженова Елена Анатольевна
Кардиолог, терапевт, к.м.н., врач высшей категории
Таргетная терапия при раке легкого
За последние 10 лет в онкологии произошли значительные изменения, лекарственное лечение поднялось на качественно новый уровень. Появились новые методы лечения рака легких, и один из них – таргетная терапия.
Таргетная терапия рака легкого – лечение, направленное на специфические гены, белки или ткани, участвующие в росте и жизнедеятельности опухоли. Таргетные препараты, используемые при раке легкого, блокируют рост и распространение раковых клеток, практически не повреждая здоровые.
Для лечения рака легкого мы применяем следующие виды таргетной терапии:
1. Антиангиогенная терапия, которая направлена на блокирование процесса формирования новых кровеносных сосудов. Поскольку для роста и распространения опухоли требуются питательные вещества, доставляемые через кровеносные сосуды, цель антиангиогенной терапии – лишить опухоль питания.
- Активно применяется Бевацизумаб (торговое название Авастин) - моноклональное антитело, которое связывается с биологически активным фактором роста эндотелия сосудов (VEGF) и нейтрализует его. Тем самым опухолевая ткань не может сгенерировать сосудистую сеть, и остается без питания. Авастин подавляет связывание VEGF с его рецепторами на поверхности эндотелиальных клеток, что приводит к снижению васкуляризации и угнетению роста опухоли. По данным исследований, добавление Авастина к стандартным схемам химиотерапии, достоверно увеличивает продолжительность жизни на 20%, чем проведение стандартной химиотерапии.
2.Ингибиторы рецептора эпидермального фактора роста (EGFR) – ученые доказали, что препараты, блокирующие рецептор эпидермального фактора роста, способны остановить или замедлить рост рака легкого. Таргетные препараты данного класса – это:
- Эрлотиниб (коммерческое название Тарцева) - препарат, активно применяющийся при лечении метастатического немелкоклеточного рака легкого. Он блокирует рецептор фактора роста HER1/EGFR, тем самым ингибирует деятельность присутствующего в рецепторе фермента тирозинкиназы и способствует блокированию передачи биоинформации в опухолевой клетке, задерживая таким образом её функционирование и размножение. Данные исследований позволяют судить о том, что Тарцева продлевает жизнь больным метастатическим немелкоклеточным раком легких на 42% (по сравнению с группой-плацебо), а также способствует снижению сопутствующих данному заболеванию симптомов (кашля, затрудненного дыхания, болей). Еще одним преимуществом препарата является то, что он принимается перорально.
- Гефитиниб (торговое название Иресса) - является селективным ингибитором тирозинкиназы рецепторов эпидермального фактора роста, экспрессия которых наблюдается во многих солидных опухолях. Иресса тормозит рост различных линий опухолевых клеток человека, метастазирование и ангиогенез, ускоряет апоптоз опухолевых клеток, повышает противоопухолевую активность химиотерапевтических препаратов, лучевой и гормональной терапии. Клинические данные свидетельствуют о том, что Иресса обладает объективным противоопухолевым действием и статистически достоверно увеличивает время до прогрессирования у пациентов с поздними стадиями местно-распространенного или метастатического немелкоклеточного рака легкого, до 25% по сравнению с химиотерапией. Эффективность Ирессы значительно возрастает у больных восточного происхождения и у некурящих больных.
- Афатиниб (торговое название Гиотриф) - новый препарат для лечения пациентов больных немелкоклеточным раком легкого, признанный FDA лекарственным препаратом номер один в таргетной терапии рака легкого с мутацией гена EGFR. Теоретически и практически доказано его блокирующее действие на функционирование мутированных генов, что приводит к остановке роста злокачественных клеток. Применяется в монотерапии у пациентов, ранее не получавших ингибиторы тирозинкиназы, для лечения местнораспространенного или метастатического немелкоклеточного рака легкого с мутацией рецептора эпидермального фактора роста. Недавно, была опубликована информация о новых результатах по показателю общей выживаемости, полученных после обобщения данных двух исследований фазы III (LUX-Lung 3 и LUX-Lung 6). Этот анализ показал, что пациенты с немелкоклеточным раком легких (НМРЛ) с распространенными мутациями в рецепторе эпидермального фактора роста (EGFR) жили дольше, если получали в качестве лечения первой линии Афатиниб, а не химиотерапию.
- Осимертиниб (торговое название Тагриссо) - ингибитор тирозинкиназы EGFR 3 поколения, полученный благодаря новым научным разработкам. Осимертиниб применяется у пациентов с местно-распространенным или метастатическим немелкоклеточным раком легкого, имеющим мутацию Т790М в гене рецептора эпидермального фактора роста (EGFR).
Мутация Т790М определяется в тех случаях, когда в процессе лечения ингибиторами тирозинкиназ EGFR 1 и 2 поколений у пациента отмечается потеря чувствительности к лечению, и заболевание прогрессирует - по контрольным очагам или отмечается появление новых опухолевых очагов. Наличие мутации Т790М – это показатель приобретенной в процессе лечения резистентности опухоли к ингибиторам тирозинкиназ.
Применение таргетного препарата Тагриссо у пациентов с выявленной мутацией Т790М позволяет значительно увеличить продолжительность жизни (в сравнении с контрольной группой в 2 раза), Осимертиниб является препаратом выбора по отношению к химиотерапии, эффективен у пациентов с метастазами в головной мозг. Помимо высокой эффективности, Осимертиниб демонстрирует хорошую переносимость у пациентов, к которым многократно применялись различные схемы лечения.
Прием Тагриссо сопровождается малой токсичностью, наиболее часто возникали диарея и сыпь 1 или 2 стадии вполне контролируемые осложнения, не требующие отмены препарата. Осимертиниб выпускается в таблетированной форме, что позволяет пациенту находиться дома, а случае возникновения побочных эффектов лечащий врач может легко скорректировать дозировку.
В мае 2018 года FDA одобрило новое показание для Осимертиниба: в I линии терапии местно-распространенного или метастатического НМРЛ – имеющих мутацию в гене EGFR.
3. Ингибиторы ALK. Еще один вид таргетной терапии рака легких – воздействие на ген ALK, стимулирующий рост рака легкого при наличии мутации в нем.
- Кризотиниб (торговое название Ксалкори) - единственный зарегистрированный в России на данный момент препарат для лечения немелкоклеточного рака легких с наличием мутации ALK. При немелкоклеточном раке легких происходит слияние двух генов (ALK и EML4), что приводит к выработке фермента, усиливающего рост раковых клеток. Препарат Кризотиниб подавляет активность этого фермента, одновременно разрушая измененные клетки. Эффективность препарата оценивают как 87% из всех случаев применения, что является достаточно высоким показателем. Кризотиниб работает по принципу молекулярных маркеров, поэтому перед его применением необходимо сдать анализы на наличие мутации ALK. Препарат Ксалкори был зарегистрирован в 2013 году, и с тех пор показывает отличные результаты в лечение немелкоклеточного рака легкого с наличием ALK мутации.
- Церитиниб (торговое название Зикадия) - новейший таргетный препарат для лечения немелкоклеточного рака легких с наличием мутации ALK. Церитиниб одобрен FDA для лечения ALK-позитивного немелкоклеточного рака легких и в марте 2018 года внесен в реестр лекарственных средств России.
- Алектиниб (коммерческое название Алеценса) - также одобрен FDA и применяется в лечении ALK-позитивного метастатического немелкоклеточного рака легких.
- Бригатиниб (торговое название Алунбриг) - используется в терапии больных метастатическим ALK-позитивным немелкоклеточным раком легкого с прогрессированием заболевания на терапии Кризотинибом или его индивидуальной непереносимости.
Читайте также: