Фотодинамическая терапия злокачественных опухолей мозга
Фотодинамическая терапия является многообещающим методом лечения опухолей головного мозга. Такой метод лечения внедряется в разных областях онкологии, и не только в нейрохирургии. Принцип такого метода лечения заключается в том, что некоторые препараты клетки опухоли делают довольно чувствительными к световому излучению. После облучения в таких клетках происходит реакция, вследствие которой клетки опухоли просто разрушаются.
Что необходимо для фотодинамической терапии при опухолях?
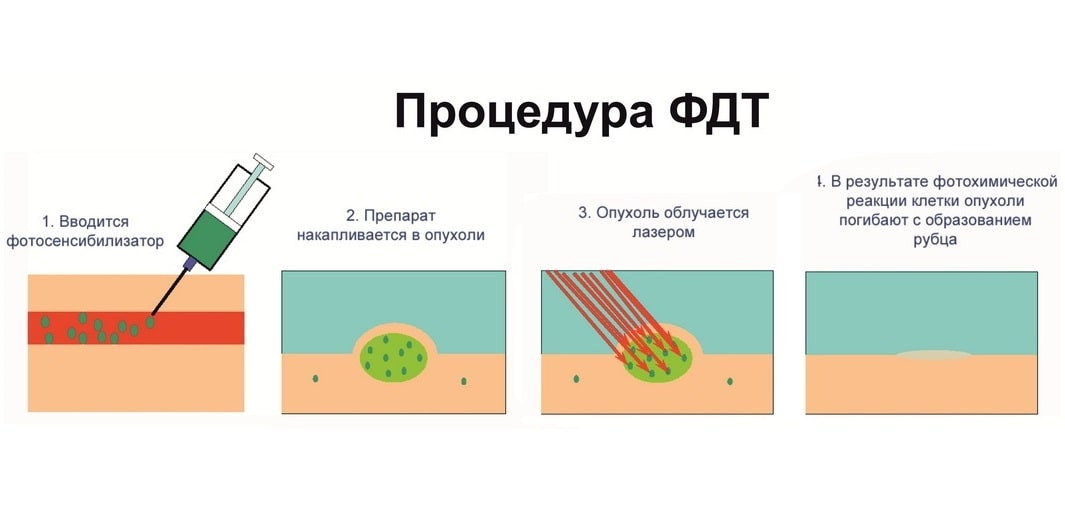
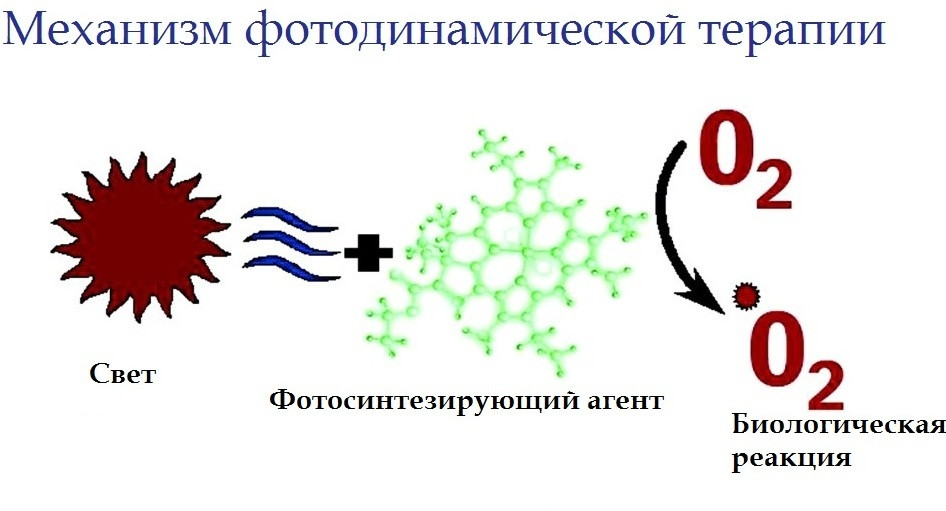
Фотодинамическая терапия введена в медицине была еще в 80-ых годах для лечения рака. Необходимо для этого три ключевых компонента. Это фотосенсибилизатор, свет и кислород в тканях. Активируется фотосенсибилизирующий агент светом определенной длины волны, а это приводит к созданию в клетках опухоли активированной молекулы кислорода, которая разрушает ее изнутри. Фотодинамическая терапия считается альтернативным лечением для многих видов рака.
Важно то, что в большинстве случаев для достижения положительного эффекта – разрушения опухоли – необходима всего одна процедура. На месте опухоли после данной операции практически никакого следа не остается. Поэтому дополнительных косметических операций не требуется. Пациенты обычно переносят процедуру легко. Самое неприятное для них – это укол для внутривенного однократного введения лекарства. Воздействие низкоинтенсивного лазерного луча безболезненно.
Что происходит при данной терапии при опухолях головного мозга?
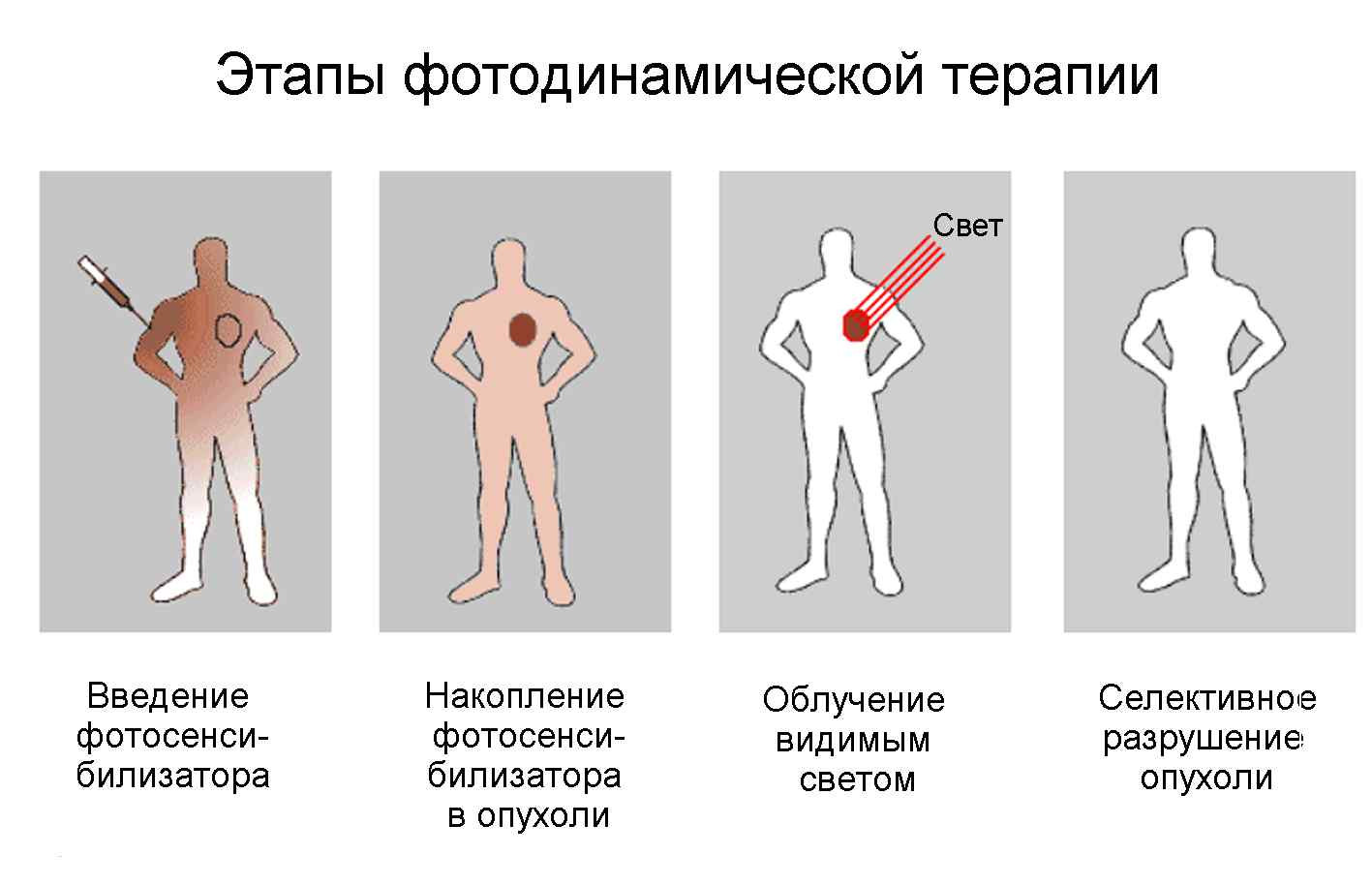
Фотосенсибилизатор селективно накапливается в опухоли головного мозга с последующим в ней развитием (под локальным влиянием лазерного излучения определенной для конкретного случая длины волны, для каждого фотосенсибилизатора индивидуальной) фотохимической реакции. В процессе этой реакции выделяются постепенно токсические метаболиты кислорода, а также кислородсодержащие свободные радикалы, которые разрушают генетический аппарат опухолевой клетки и вызывают гибель эндотелиальных клеток сосудов, которые снабжают опухоль, а это ведет к сильному нарушению питания опухоли и в конце концов – к гибели клеток опухоли головного мозга.
НИЖЕ ПРЕДСТАВЛЕНЫ ЛУЧШИЕ СПЕЦИАЛИСТЫ ВАШЕГО РЕГИОНЫ

Фотодинамическая терапия в два этапа
В самом начале вводят внутривенно (в вену) фотосенсибилизирующих агентов. Все ткани организма впитывают наркотик, но клетки раковой опухоли поглощают гораздо большее количество таких агентов. Через некоторое время после инъекции фотосенсибилизирующего агента, наркотик из нормальных клеток удаляется, однако в раковых клетках остается.
Второй этап проводится через четыре дня после введенной инъекции. На раковые клетки направляется свет от лазера, активируя при этом фотосенсибилизирующее средство, содержащееся в раковых клетках, и убивает их.
Преимущества фотодинамической терапии в лечении опухолей головного мозга
Фотодинамическая терапия имеет преимущества перед химиотерапией т лучевой терапией, при комбинированном лечении новообразований головного мозга. Во-первых, это форма (локальная) терапии, обладающая низкой системной токсичностью. Далее - к настоящему времени данных о вероятности развития устойчивости при неоднократном применении данной терапии не получено. В связи с огромной поглощающей способностью сенсибилизированной ткани самой опухоли, проникает ограниченно свет, в связи с чем даже возможно многократное проделывание этой терапии, что, вероятнее всего, приведет к возрастанию медианы выживаемости пациентов с опухолями головного мозга. Чтобы добиться терапевтического оптимального эффекта лазерного облучения требуется длительное облучение опухолевых инфильтрирующих клеток, которые являются не удаленными во время резекции.
Полный текст:
- Аннотация
- Об авторах
- Список литературы
- Cited By
Фотодинамическая терапия является актуальным и перспективным направлением для применения в области клинической нейроонкологии. Применение современных разработок в области лазерных технологий и новых фотосенсибилизаторов позволяет относить данное направление к высокотехнологичным. По данным различных авторов, включение фотодинамической терапии в схемы комбинированного и комплексного лечения пациентов со злокачественными опухолями головного мозга позволяет достигнуть медианы общей выживаемости пациентов от 11 до 26 мес для первичной формы глиобластомы и от 7,5 до 15 мес - для рецидивных форм глиобластомы. Достигнуты определенные результаты в лечении пациентов с метастатическим поражением головного мозга. В данной публикации авторами проанализированы и систематизированы результаты основных клинических исследований в области флуоресцентной диагностики и интраоперационной фотодинамической терапии при первичных, рецидивных и метастатических формах злокачественных новообразований головного мозга.
1. Carlsson S.K., Brothers S.P., Wahlestedt C. Emerging treatment strategies for glioblastoma multiforme // EMBO Mol Med. - 2014. - Vol. 6, No. 11. - P. 1359-1370.
2. Patel M.A., Kim J.E., Ruzevick J., et al. The future of glioblastoma therapy: synergism of standard of care and immunotherapy // Cancers. - 2014. - Vol. 6, No. 4. - P. 1953-1985.
3. Thomas A.A., Brennan C.W., DeAngelis L.M., Omuro A.M. Emerging therapies for glioblastoma // JAMA Neurol. - 2014. - Vol. 71, No. 11. - P. 1437-1444.
4. Stupp R., Mason W.P., van den Bent M.J., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma // N. Eng. J. Med. - 2005. - Vol. 352 (10) - P. 987-996.
5. Куржупов М.И., Филоненко Е.В., Лошаков В.А., Зайцев А.М. Фотодинамическая терапия в нейроонкологии // Рос. онкол. журн. - 2010. - № 4. - С. 45-48.
6. Stummer W., Pichlmeier U., Meinel T., et al. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomized controlled multicentre phase III trial // Lancet Oncol. - 2006. - Vol. 7. - P. 392-401.
7. Muragaki Y., Akimoto J., Maruyama T., et al. Phase II clinical study on intraoperative photodynamic therapy with talaporfin sodium and semiconductor laser in patients with malignant brain tumors // Neurosurg. - 2013. - Vol. 119, No. 4. - P. 845-852.
8. Quirk B.J., Brandal G., Donlon S., et al. Photodynamic therapy (PDT) for malignant brain tumors - Where do we stand? // Photodiagnosis Photodyn. Ther. - 2015. - Vol. 12(3). - P. 530-544.
9. Dougherty T.J., Gomer C.J., Henderson B.W., et al. Photodynamic therapy // J. Nat. Cancer Inst. - 1998. - Vol. 90, No. 12. - P. 889-905.
10. Castano A.P., Mroz P., Hamblin M.R. Photodynamic therapy and anti-tumor immunity // Nature Rev. (Cancer). - 2006. - Vol. 6. - P. 535-545.
11. Abdel-Kader M.H. Photodynamic therapy. From theory to application. - Verlag, Berlin, Heidelberg: Springer, 2014. - 312 p.
12. Rapozzi V.G., Jori R. Resistance to photodynamic therapy in cancer. - Switzerland: Springer International Publishing, 2015. - 248 p.
13. Bacellar I.O., Tsubone T.M., Pavani C., Baptista M.S. Photodynamic 10. efficiency: from molecular photochemistry to cell death // Int. J. Mol. Sci. - 2015. - Vol. 15. - P. 20523-20559.
14. Agostinis P., Berg K., Cengel K.A., et al. Photodynamic therapy of cancer: an update // CA Cancer J. Clin. - 2011. - Vol. 61(4). - P. 250-281.
15. Kostron H., Obwegeser A., Jakober R., et al. Experimental and 13. clinical results of mTHPC (Foscan')-mediated photodynamic therapy for malignant brain tumors // SPIE Proceedings. - 2009. - Vol. 3247. - 0277 - 786X.
16. Perria C., Capuzzo T., Cavagnaro G., et al. First attempts at the photodynamic treatment of human gliomas // J. Neurosurg. Sci. – 1980. - Vol. 24(3-4). - P. 119-129.
17. Kaye A.H., Morstyn G. Photoradiation therapy causing selective tumor kill in a rat glioma model // Neurosurg. - 1987. - Vol. 20, No. 3. - P. 408-415.
18. Dereski M.O., Chopp M., Garcia J.H., Hetzel F.W. Depth measurements and histopathological characterization of photodynamic therapy generated normal brain necrosis as a function of incident optical energy dose // Photochem. Photobiol. - 1991. - Vol. 54(1). - P. 109-112.
19. Tudge S.H., Kaye A.H., Hill J.S. Modulation of light delivery in photodynamic therapy of brain tumours // J. Clin. Neurosci. - 1999. - Vol. 6(3). - P. 227-232.
20. Madsen S.J., Sun C., Tromberg B.J., Hirschberg H. Development of a novel indwelling balloon applicator for optimizing light delivery in photodynamic therapy // Laser Surg. Med. - 2001. - Vol. 29. - P. 406-412.
21. Olzowy B., Hundt C.S., Stocker S., et al. Photoirradiation therapy of experimental malignant glioma with 5-aminolevulinic acid // Neurosurg. - 2002. - Vol. 97. - P. 970-976.
22. Perria C. Photodynamic therapy for human gliomas by hematoporphyrin and helium-neon laser // IRCS Med. Science. - 1981- Vol. 9. - P. 57-58.
23. Muller PJ., Wilson B.C. Photodynamic therapy for malignant newly diagnosed supratentorial gliomas // J. Clin. Laser Med. Surg. - 1996. - Vol. 14(5). - P. 263-270.
24. Muller PJ., Wilson B.C. Photodynamic therapy for malignant malignant brain tumors // Can. J. Neurol. Sci. - 1990. - Vol. 17. - P. 193-198.
25. Stylli S.S., Kaye A.H., MacGregor L., et al. Photodynamic therapy of high grade glioma - long term survival // J. Clin. Neurosci. - 2005. - Vol. 12(4). - P. 389-398.
26. Johansson A., Palte G., Schnell O., et al. 5-Aminolevulinic acid- induced protoporphyrin IX levels in tissue of human malignant brain tumors // Photochem. Photobiol. - 2010. - Vol. 86(6). - P. 1373-1378.
28. Vanaclocha V., Sureda M., Azinovic I., et al. Photodynamic therapy in the treatment of brain tumours. A feasibility study // Photodiagnosis Photodyn. Ther. - 2015. - Vol. 12(3). - P. 422-427.
29. Тиглиев Г.С., Олюшин В.Е., Чеснокова Е.А. и др. Фотодинамическая терапия в нейроонкологии: первый опыт проведения и краткий обзор литературы // Рос. биотер. журн. - 2004. - Т. 3, № 1. - С. 83-90.
30. Muragaki Y., Akimoto J., Maruyama T., et al. Phase II clinical study on intraoperative photodynamic therapy with talaporfin sodium and semiconductor laser in patients with malignant brain tumors // J. Neurosurg. - 2013. - Vol. 119(4). - P. 845-852.
31. Akimoto J., Haraoka J., Aizawa K. Preliminary clinical report on safety and efficacy of photodynamic therapy using talaporfin sodium for malignant gliomas // Photodiagnosis Photodyn. Ther. - 2012. - Vol. 9(2). - P. 91-99.
32. Боровский А.А. Эффективность интраоперационной фотоди- 31. намической терапии с препаратом фотолон у пациентов с глиобластомой // Рос. биотер. журн. - 2016. - Т. 15, № 1. - С. 15-16.
33. Stummer W., Pichlmeier U., Meinel T. Fluorescence-guided surgery with 5-aminolevulinic acid for resection of malignant glioma: a randomised controlled multicentre phase III trial // Lancet Oncol. - 2006. - Vol. 7. - P. 392-401.
34. Muller P., Wilson B. Photodynamic therapy of brain tumors--a work in progress // Lasers Surg Med. - 2006. - Vol. 38(5). - P. 384-389.
35. Eljamel M.S., Goodman C., Moseley H. ALA and photofrin fluorescence-guided resection and repetitive PDT in glioblastoma multiforme: a single centre Phase III randomized controlled trial // Lasers Med. Sci. - 2008. - Vol. 23. - P. 361-367.
36. Lyons M., Phang I., Eljamel S. The effects of PDT in primary malignant brain tumours could be improved by intraoperative radiotherapy // Photodiagnosis Photodyn. Ther. - 2012. - Vol. 9. - P. 40-45.
37. Kennedy J.C., Pottier R.H., Pross D.C. Photodynamic therapy with endogenous protoporphyrin IX: basic principles and present clinical experience // J. Photochem. Photobiol. B. - 1990. - Vol. 6. - P. 143-148.
38. Malik Z., Lugaci H. Destruction of erythroleufemic cells by photoactivation of endogenous porphyrines // Br. J. Cancer. - 1987. - Vol. 56. - P. 589-595.
39. Wharen R.E., Anderson R.E., Laws E.R. Quantification of hematoporphyrin derivativein human gliomas, experimental central nervous system tumors and normal tissue // Neurosurg. - 1983. - Vol. 12. - P.446-450.
40. Tsai J.C., Hsiao Y.Y., Teng L.J., et al. Comparative study on the ALA photodynamic effects of human glioma and meningioma cells // Lasers Surg. Med. - 1999. - Vol. 24. - P. 296-305.
41. Schucht P., Beck J., Abu-Isa J., et al. Gross total resection rates in contemporary glioblastoma surgery: results of an institutional protocol combining 5-aminolevulinic acid intraoperative fluorescence imaging and brain mapping // J. Neurosurg. - 2012. - Vol. 71(5). - P. 927-935.
42. Archavlis E., Tselis N., Birn G., et al. Salvage therapy for recurrent glioblastoma multiforme: a multimodal approach combining fluorescence-guided resurgery, interstitial irradiation, and chemotherapy // Neurol. Res. - 2014. - Vol. 36(12). - P. 1047-1055.
43. Kamp M.A., Felsberg J., Sadat H., et al. 5-ALA-induced fluorescence behavior of reactive tissue changes following glioblastoma treatment with radiation and chemotherapy // Acta Neurochir. (Wien). - 2015. - Vol. 157(2). - P. 207-213.
44. Stummer W., Hassan A., Kempski O. Photodynamic therapy within edematous brain tissue: consideration sensitizer dose and time point of laser irradiation // J. Photochem. Photobiol. B. - 1996. - Vol. 36(2). - P. 179-181.
45. Hickmann A.K., Nadji-Ohl M., Hopf N.J. Feasibility of fluorescence- guided resection of recurrent gliomas using five-aminolevulinic acid: retrospective analysis of surgical and neurological outcome in 58 patients // J. Neurooncol. - 2015. - Vol. 122(1). - P.151-160.
46. Stummer W., Beck T., Beyer W., et al. Long-sustaining response in a patient with non-resectable, distant recurrence of glioblastoma multiforme treated by interstitial photodynamic therapy using 5-ALA: case report // J. Neurooncol. - 2008. - Vol. 87(1). - P. 103-109.
47. Muller PJ., Wilson B.C. Photodynamic therapy for recurrent supratentorial gliomas // Semin. Surg. Oncol. - 1995. - Vol. 11(5). - P. 346-354.
48. Beck T.J., Kreth F.W., Beyer W., et al. Interstitial photodynamic therapy of nonresectable malignant glioma recurrences using 5-aminolevulinic acid induced protoporphyrin IX // Lasers Surg. Med. - 2007. - Vol. 39(5). - P. 386-393.
49. Schroeteler J., Schipmann S., Molina E.S. 5-ALA-based Photodynamic therapy in recurrent malignant glioma - a pilot study // Neuro-Oncol. - 2014. - Vol. 16, suppl. 5. - P. 19.
50. Pollock B.E., Brown P.D., Foote R.L., et al. Properly selected patients 49. with multiple brain metastases may benefit from aggressive treatment of their intracranial disease // J. Neurooncol. - 2003. - Vol. 61(1). - P. 73-80. 50.
51. Posner J.B., Chernik N.L. Intracranial metastases from systemic cancer // Adv. Neurol. - 1978. - Vol. 19. - P. 579-592.
52. Зайцев А.М., Куржупов М.И., Потапова Е.А., Кирсанова О.Н. Лечение метастатического поражения головного мозга // Исследования и практика в медицине. - 2015. - Т. 2, № 2. - С. 8-14.
53. Куржупов М.И., Лошаков В.А., Филоненко Е.В. и др, Интраоперационная флуоресцентная диагностика и фотодинамическая терапия у больных с метастатическим поражением головного мозга // Вопр. нейрохир. - 2012. - Т. 76, № 2. - С. 50-57.
54. Решетов И.В., Зайцев А.М., Филоненко Е.В., Куржупов М.И. Наблюдение эффективного комбинированного лечения внутримозговых метастазов рака яичника // Рос. онкол. журн. - 2012. - № 3. - С. 39-41.
55. Куржупов М.И., Зайцев А.М., Филоненко Е.В. Длительный безрецидивный период у больного с метастазом рака почки после хирургического удаления и интраоперационной фотодинамической терапией // Рос. онкол. журн. - 2011. - № 1. - С. 41-42.
56. Зайцев А.М., Куржупов М.И., Решетов И.В., Филоненко Е.В. Комбинированное лечение (ФДТ и ДЛТ) метастатического поражения головного мозга при раке молочной железы // Онкохирургия. - 2013. - Т. 5, № 3. - С. 35-38.
57. Рябова А.И., Новиков В.А., Завьялов А.А. и др. Опыт лечения позднего церебрального метастаза рака легкого с применением фотодинамической терапии // Сиб. онкол. журн. - 2013. - № 5. - С. 66-69.
58. Yumita N., Iwase Y., Nishi K., et al. Involvement of reactive oxygen species in sonodynamically induced apoptosis using a novel porphyrin derivative // Theranostics. - 2012. - Vol. 2(9). - P. 880-888.
59. Wang H., Wang X., Zhang S. Sinoporphyrin sodium, a novel sensitizer, triggers mitochondrial-dependent apoptosis in ECA-109 cells via production of reactive oxygen species // Int. J. Nanomedicine. - 2014. - Vol. 9. - P. 3077-3090.
60. Kenyon J.N., Fulle R.J., Lewis T.J. Activated cancer therapy using light and ultrasound - a case series of sonodynamic photodynamic therapy in 115 patients over a 4 year period // Current Drug Therapy. - 2009. - Vol. 4. - P. 179-193.

Контент доступен под лицензией Creative Commons Attribution 4.0 License.
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Злокачественные заболевания остаются одной из острейших медико-социальных проблем. Онкологическая заболеваемость в России неуклонно растет. Особую сложность представляет оказание помощи больным, не подлежащим радикальному лечению из-за распространенности опухолевого процесса или при неэффективности проводимой терапии. В решении этой задачи одно из ведущих мест в современной онкологии заняла лазерная медицина, и, в частности, фотодинамическая терапия (ФДТ).
ФДТ при первичном и метастатическом поражении плевры
Накопление жидкости в плевральной полости – частое клиническое проявление злокачественного поражения плевры и является, как правило, конечной стадией развития опухолевого процесса многих локализаций. Для лечения метастатического плеврита применяют системную полихимиотерапию, внутриплеврально вводят противоопухолевые, неспецифические препараты. Приостановление накопления жидкости в плевральной полости при системной химиотерапии происходит в 30-60% наблюдений.
В последние годы для лечения опухолевого плеврита при первичном и метастатическом поражении плевры стали применять внутриплевральную пролонгированную ФДТ с препаратом фотосенс. Лазерное облучение плевральной полости выполняют через цилиндрические диффузоры, которые устанавливают на весь период лечения к местам наибольшего опухолевого поражения. По данным ряда авторов, проведение пролонгированной внутриплевральной ФДТ у больных с мезотелиомой и метастатическим поражением плевры позволяет добиться стойкого прекращения внутриплевральной экссудации (выхода жидкой части крови через сосудистую стенку в воспаленную ткань) у 92% больных при сроке наблюдения до 3,5 года.
Таким образом, пролонгированная внутриплевральная ФДТ злокачественных плевритов позволяет добиться хорошего длительного эффекта и может являться методом выбора лечения при злокачественном плеврите. Внутриплевральная ФДТ позволяет создать благоприятные условия (прекращение накопления жидкости в плевральной полости) для дальнейшего противоопухолевого лечения и на длительный период улучшить качество жизни этой многочисленной категории больных.
ФДТ в лечении стенозирующего рака верхних отделов пищеварительного тракта
Тяжесть состояния онкологических больных и низкое качество жизни нередко обусловлены опухолевым поражением пищеварительного тракта. В течение последних десятилетий рак пищевода имеет самый высокий показатель смертности в России.
Дисфагия при раке пищевода существенно ухудшает функциональное состояние больного и качество жизни. Одним из альтернативных методов оказания паллиативной помощи у неоперабельных больных стенозирующим раком верхних отделов пищеварительного тракта является ФДТ. Опубликованы результаты проведения эндоскопической ФДТ с отечественными фотосенсибилизаторами (вещество, способное к фотосенсибилизации биологических тканей, то есть увеличению их чувствительности к воздействию света) у 147 пациентов.
При рецидиве дисфагии после стентирования вследствие прорастания опухоли через стенки протеза или роста опухоли выше или ниже стента ФДТ является единственно возможным методом ликвидации опухолевой стриктуры. Паллиативная ФДТ показана также при рецидиве рака в пищеводно-желудочном анастомозе после проксимальной резекции желудка, при высоком распространении рецидивного процесса по пищеводу. Эффект реканализации длится в среднем 3 мес.
При рецидиве дисфагии повторная ФДТ также оказывает благоприятный эффект. Целесообразным является проведение многокурсовой ФДТ для достижения наиболее высокого качества жизни больных данной группы. Таким образом, в сравнении с другими методами паллиативной помощи инкурабельным больным со стенозирующим раком пищевода и желудка эндоскопическая ФДТ является оптимальным вариантом комплексного лечения. Получено достоверное повышение показателей выживаемости и уровня качества жизни. Средняя продолжительность жизни составила, по данным различных авторов, от 9,3 до 14 месяцев.
ФДТ в лечении стенозирующих злокачественных новообразований дыхательных путей
В течение последних десятилетий рак легкого устойчиво занимает первое место в структуре заболеваемости и смертности от злокачественных новообразований. Ателектаз легкого и пневмония, вызванные обтурацией просвета бронха, ухудшают качество жизни пациентов и оттягивают сроки начала специализированного лечения у большинства больных. ФДТ является альтернативным методом лечения для оказания паллиативной помощи у неоперабельных больных.
В литературе имеются сведения о проведении ФДТ с отечественными фотосенсибилизаторами у 55 больных со стенозирующими злокачественными опухолями легкого центральной локализации. После проведенного лечения у данной группы пациентов наблюдался положительный клинический эффект за счет снижения уровня опухолевого стеноза бронхов разной степени выраженности, что, в свою очередь, приводит к улучшению качества жизни пациентов.
ФДТ при метастатическом поражении кожных покровов
Наряду с первичными и рецидивными злокачественными опухолями особое место занимает метастатическое поражение кожных покровов. По данным литературы, частота метастазов рака внутренних органов в кожу колеблется от 0,29 до 3,3%. Из метастатических злокачественных опухолей кожи наибольшую группу составляет рак молочной железы. Метастазы чаще локализуются на грудной стенке вблизи от первичной опухоли и преимущественно развиваются после хирургического лечения.
Основным методом лечения больных с внутрикожными метастазами рака молочной железы остается химио или гормонотерапия с многократным повторением курсов лечения. Второй по частоте причиной метастазов в кожу после рака молочной железы является меланома. Кожные и подкожные метастазы появляются примерно в 2-10% случаев. Метастазы могут быть единичные или множественные, располагаться вблизи первичного очага или отдаленно от него.
При лечении внутрикожных метастазов меланомы возможно применение хирургического лечения, лучевой терапии, комбинированного лечения. Однако при появлении новых очагов болезни в коже их применение становится сомнительным. Рост метастазов на фоне неэффективности традиционных методов лечения ухудшает прогноз жизни больных, способствует появлению впоследствии болевого синдрома, отека, интоксикации, что отрицательно сказывается на общем и психоэмоциональном состоянии больных, и снижения качества их жизни.
Именно такие пациенты нуждаются в лечении другими альтернативными методами, обладающими высокой противоопухолевой эффективностью. Одним из таких методов является ФДТ. Группой авторов проведена ФДТ с отечественными фотосенсибилизаторами у 36 пациентов с внутрикожными метастазами. При применении пролонгированной ФДТ у больных с внутрикожными метастазами рака молочной железы и меланомы полная регрессия опухолей получена в 39,3% и 38% соответственно, частичная – в 46% и 52,4%. У всех больных на фоне ранее проводимой традиционной терапии отмечена резистентность опухоли к традиционному лечению.
Таким образом, проведение ФДТ в значительной степени влияет на улучшение качества жизни этой сложной категории пациентов.
ФДТ при саркоме Капоши
Саркома Капоши – редкое ангиопролиферативное заболевание, связанное с герпесвирусом человека 8-го типа. Несмотря на нарастание частоты идиопатического типа саркомы Капоши в последние годы, метод его радикального лечения не разработан, лечение в большинстве своем является паллиативным, обеспечивающим временный эффект. Перспективным методом лечения саркомы Капоши является ФДТ. Опубликованы результаты лечения 15 пациентов с внутриопухолевым введением отечественных фотосенсибилизаторов. На фоне проведения ФДТ отмечался положительный клинический эффект за счет улучшения общего состояния пациентов, уменьшения площади опухолевого поражения, что, в свою очередь, приводит к улучшению качества жизни пациентов.
ФДТ при метастатическом поражении брюшины
Рак желудка остается одной из самых распространенных злокачественных опухолей и занимает второе место в структуре онкологической смертности. У 70% больных к моменту установления диагноза опухолевый процесс носит местно распространенный или генерализованный характер, что и определяет крайне высокую летальность на первом году с момента установления диагноза. Высокий уровень хирургической техники, разработка комбинированных и расширенных операций с максимальным соблюдением онкологических принципов не исключает развития перитонеальной диссеминации – основного варианта прогрессирования рака желудка. Учитывая особенности механизмов развития перитонеальной диссеминации, ведется поиск новых методов специализированного лечебного воздействия на область операционного поля и брюшину с целью снижения риска развития перитонеального канцероматоза, повышения уровня абластики и антибластики и увеличения безрецидивного периода при местнораспространенном и диссеминированном раке желудка.
Одним из таких методов является интраоперационная ФДТ с отечественными фотосенсибилизаторами. Данные литературы свидетельствуют о достаточно эффективном и безопасном применении интраоперационной ФДТ у больных с перитонеальной диссеминацией при диссеминированном раке желудка в сочетании с паллиативным хирургическим лечением для увеличения длительности безрецидивного периода и общей выживаемости больных данной группы.
Литература:

Центр является признанным лидером в российском здравоохранении в разработке новых методик фото диагностики и фотодинамической терапии онкологических заболеваний

Пациенты из любого региона РФ
ОМС, талон на ВМП

Руководитель Центра, врач-онколог, д.м.н, профессор, Елена Вячеславовна Филоненко
Задать вопрос врачу
Оставьте заявку и получите консультацию нашего специалиста
Основные направления деятельности Центра лазерной и фотодинамической диагностики и терапии опухолей Минздрава России

Данное изображение позволяет оценить каждое пигментное новообразование и, в соответствии с разработанной в отделении рабочей классификацией оценки спектрофотометрического изображения, на доморфологическом этапе определить доброкачественное пигментное образование, диспластический пигментный невус, меланому кожи. Использование данного метода позволяет неинвазивно диагностировать меланому кожи с чувствительностью - 96%, специфичностью 99%, диагностической точностью 99%.
Наиболее сложная для дифференциальной диагностики доброкачественного и злокачественного опухолевого поражения кожи является группа больных с множественными образованиями кожи неуточненной морфологической структуры. Применяемый в отделении неинвазивный метод флуоресцентной диагностики (ФД) позволяет исследовать кожные покровы человека тотально, а также прицельно выявленное новообразование. ФД проводится с целью: определения границ опухолевого поражения перед проведением специализированного противоопухолевого лечения (курс ФДТ, хирургическое лечение); поиска скрытых очагов первичного и/или рецидивного рака кожи и слизистой оболочки органов различной локализации; инраоперационная ФД при хирургическом лечении рака различной локализации с целью определения объема резекции тканей (определение границ опухолевого поражения).
Аппаратурным обеспечением при проведении ФД являются: диодный источник света с синим фильтром (длина волны 385-460нм), очки или специальной оборудование со светофильтрами, флуоресцентная фотокамера, диагностическое устройство для проведения флуоресцентной диагностики со встроенной видеокамерой, лазерная электронно-спектральная установка позволяющая локально определять степень накопления фотосенсибилизатора в любых органах пациента, доступных для волоконно-оптического зонда; эндоскопическая флуоресцентная аппаратура и флуоресцентные микроскопы различных фирм. Методика ФД успешно применяется при проведении специализированного противоопухолевого лечения рака кожи, слизистых оболочек, метастатического поражения головного мозга, рака щитовидной железы, злокачественных новообразований органов грудной и брюшной полости и др.


Фотодинамическая терапия (ФДТ) – метод противоопухолевого лечения, обладающий высокой эффективностью и практически не имеющий побочных эффектов и осложнений. Метод основан на способности ряда лекарственных препаратов – фотосенсибилизаторов селективно накапливаться и удерживаться в ткани злокачественных опухолей. Под действием энергии лазерного излучения в сенсибилизированных клетках и тканях развиваются фотохимические реакции с выделением синглетного кислорода и свободных радикалов, что приводит к гибели и разрушению опухолевых клеток без негативного влияния на здоровые ткани и органы. ФДТ не сопровождается токсическими эффектами, осложнениями и может быть повторно проведена в зоне предшествующего лечения.
Современные направления использования ФДТ в онкологии очень часто применяются в комбинации с лучевой терапией, хирургическим лечением, химиотерапией, что позволило не одной тысяче больных получить эффективную высокотехнологичную медицинскую помощь.
| Рассчитана на полное излечение, при ранних стадиях рака кожи, меланомы, нижней губы, языка, слизистой оболочки полости рта, трахеобронхиального дерева, желудка, пищевода, мочевого пузыря и других органов в качестве альтернативы лучевому и хирургическому методам лечения, при высоком риске оперативного вмешательства или невозможности его выполнения по иным причинам. |
| Этот метод противоопухолевого лечения обладает высокой эффективностью и практически не имеет побочных эффектов и осложнений при лечении перитонеального карциономатоза. Метод основан на способности ряда лекарственных препаратов – фотосенсибилизаторов селективно накапливаться и удерживаться в ткани злокачественных опухолей. Под действием лазерного излучения определенной длины волны в сенсибилизированных клетках и тканях развиваются фотохимические реакции с выделением синглетного кислорода и свободных радикалов, что приводит к гибели и разрушению опухолевых клеток при минимальном воздействии на здоровые ткани и органы. |
| Рак кожи, рак верхней и нижней губы, рак полости рта и языка, рак вульвы, центральный рак легкого, рак желудка и пищевода, метастазы рака молочной железы в кожу, метастазы меланомы в кожу, саркома Капоши, атрофическая дистрофия вульвы (крауроз вульвы) |
| в сочетании с методами комбинированной терапии у больных III-IV стадией онкологического заболевания различной диссеминации: меланома, рак яичников, рак молочной железы, рак легкого, злокачественные новообразования желудочно-кишечного тракта и плевры. |
| Для реканализации пищевода и желудка, трахеи, крупных бронхов, желчных протоков при далеко зашедших процессах, опухолевых стенозах, а также при некоторых метастатических поражениях. |

Индивидуальный подход к каждому пациенту — залог эффективности в работе Центра лазерной и фотодинамической диагностики и терапии опухолей Минздрава России

При этом, пациентам, госпитализированным в стационар МНИОИ им. П.А. Герцена комплекс реабилитационных мероприятий, начинают выполнять уже на этапе подготовки к хирургическому лечению, затем в раннем послеоперационном периоде. Далее, при наличии показаний курсовое лечение проводят после завершения специализированного противоопухолевого лечения и выписки больного из стационара.
- применение физических факторов с целью лечения лучевых воспалительных реакций и повреждений кожи и слизистых оболочек;
- применение физических факторов для лечения локальных осложнений лекарственной противоопухолевой терапии (флебит)
- применение физических факторов для профилактики и лечения гнойно-воспалительных послеоперационных осложнений (рис. 6);
- применение физических факторов с целью предупреждения гемодинамических расстройств в пересаженных тканях и улучшение функциональных результатов при реконструктивно-пластических операциях.
На II этапе реабилитации:
- разработка и внедрение комплексных методик реабилитации больных с постмастэктомическим отеком верхней конечности (рис. 7);
- разработка и внедрение комплексных методик реабилитации больных с отеком нижней конечности после хирургического лечения сопровождавшегося расширенной лимфаденэктомией у пациентов онкогинекологического и онкоурологического профиля;
- разработка и внедрение комплексных методик реабилитации больных с постлучевым циститом и/или ректитом;
- применение физических факторов с целью профилактики и купирования явлений пареза нерва.

Ключевые преимущества
- Безболезненное воздействие
- Нет необходимости в реабилитации
- Удобное положение во время операции
- Лечение опухолей любой локализации
- Нет необходимости в
анестезии - Лечение инфаркта и ишемической болезни сердца
- Пациент свободно дышит и удобно лежит во время исследования
- Без разрезов и шрамов
- Селективное разрушение злокачественных новообразований, что обеспечивается избирательным накоплением предварительно введенного фотосенсибилизатора и локальному воздействию лазерного облучения определенной длины волны
- Возможность одновременного проведения диагностических и лечебных процедур
- Широкое поверхностное воздействие без выраженного поражения подлежащих тканей, что позволяет получить наиболее благоприятные функциональные и эстетические результаты
- Лечение методом ФДТ может проводиться повторно и многократно в отличие от хирургического вмешательства или лучевой терапии
- Непродолжительный срок лечения (пребывание в стационаре 3-5 суток)
- Отсутствие системных токсических и иммунодепрессивных реакций
- Хорошая переносимость ФДТ позволяет использовать данный метод лечения у пожилых пациентов и у больных с тяжелой сопутствующей патологией, у которых применение традиционного лечения сопровождается высоким риском развития осложнений.
- Лечение пациентов из любого региона РФ, ближнего и дальнего зарубежья

Ключевые преимущества применения лазерной и фотодинамической терапии в лечении онкологических заболеваний

Процесс подготовки и лечения
Междисциплинарный консилиум врачей на до госпитальном этапе
Выполнение необходимых диагностических исследований.
Госпитализация и операция
Фотогалерея отдела









Для пациентов
Гордость отдела – высококвалифицированные специалисты!
На базе отделения
проходит обучение и подготовка врачей, аспирантов и ординаторов. Отделение тесно сотрудничает с ведущими российскими онкологическими диспансерами и центрами.
Современные методы диагностики и лечения!
Всесторонняя
помощь онкологическим больным проводится благодаря работе научных и исследовательских кафедр, наличию первоклассного оборудования и специалистов в лечении и диагностировании рака.
Информация о пациенте
1. Жалобы пациента.
2. Диагноз, если он уже установлен.
3. Данные о проведенном ранее лечении и обследованиях..
4. Гистологическое заключение.
5. Анализы.
Можно ли провести лечение по ВМП (квоте)?
Лечение значительной части заболеваний, можно провести по ОМС и ВМП (квоте).
О Центре

Для решения вопроса о лечении в Центре лазерной и фотодинамической диагностики и терапии опухолей Минздрава России необходимо обратиться в информационно-контактный центр и получить направление в поликлинику для консультации с врачом. Возможно будет назначено обследование или до-обследование, после чего будет проведен консилиум с участием врачей хирургов, онкологов и химиотерапевтов, на котором будет выбран метод противоопухолевого лечения. Необходимо помнить, что лечение при злокачественных новообразованиях выполняется по ОМС или талонам ВМП (высокотехнологичная медицинская помощь) и финансируется из государственного бюджета. Получить талон на ВМП можно непосредственно в поликлинике МНИОИ им П.А. Герцена. Позвоните нам сегодня, чтобы мы смогли Вам помочь! 8 495 150 11 22
История подразделения берет свое начало с 1965 года, когда в Институте медицинской радиологии АМН СССР было открыто хирургическое отделение. Возглавила его замечательный человек и хирург, участница Великой Отечественной войны, ученица А.А. Вишневского, доктор медицинских наук, профессор Прасковья Павловна Фирсова.
Прасковья Павловна была наставником и руководителем целого поколения ученых и врачей, впоследствии ставших профессорами и заведующими отделениями, ей присвоено звание "Заслуженный деятель науки РСФСР". Талантливый ученый и новатор, автор 7 изобретений, совершенствующих технику операций на легком и средостении, П.П. Фирсова большое внимание уделяла повседневной работе в отделении. Ее школу отмечает бережное и чуткое отношение к больным.
С 1988 по май 2012 гг. отделением руководил Виктор Николаевич Медведев, продолживший научную и практическую деятельность по разработке и изучению новых методов комбинированного и комплексного лечения рака легкого и рака молочной железы.
С мая 2012 по май 2018 г.г. отделением руководил к.м.н. Юрий Александрович Рагулин. За эти годы в отделении научная и практическая деятельность были продолжены, а также апробированы и внедрены методики интраоперационной лучевой терапии, фотодинамической терапии, лазерной хирургии, внедрены методики малоинвазивных операций. Научная и практическая работа по указанным направлениям продолжается и в настоящее время.
С мая 2018 г. отделением заведует к.м.н. Сергей Викторович Гамаюнов. Продолжается развитие комбинированного и комплексного лечения опухолей легкого, пищевода и желудка, подходы к малоинвазивным методам диагностики, персонификация терапии, внедрение молекулярно-генетических исследований.
Читайте также:





