Есть ли экспериментальные лечения рака
По данным Минздрава РФ, только в 2018 году в мире было зарегистрировано около 18 миллионов новых случаев рака и других злокачественных новообразований. Всемирная организация здравоохранения (ВОЗ) утверждает, что с онкологическими заболеваниями сталкивается каждый пятый мужчина и каждая шестая женщина.
Новые методы лечения рака позволяют помочь пациентам, которые ранее могли рассчитывать только на паллиативную помощь.
Люди, далекие от медицины и сами врачи связывают терапию онкологических заболеваний с массивными, калечащими операциями, изнуряющей химиотерапией, которая переносится тяжелее, чем сами симптомы болезни, долгим восстановлением и постоянным страхом, что болезнь вернется.
Как развивается рак
Клетки организма размножаются делением и начинают умирать после 50-52 циклов. Процесс естественной гибели называется апоптоз. Зараженные вирусом, мутирующие клетки выставляют на своих оболочках специальные маркеры. Их распознает и немедленно уничтожает иммунная система. Соседние клетки утилизируют продукты распада.
Бесконтрольное размножение приводит к тому, что клетки не успевают созревать, утрачивают свои свойства. Они распространяются в окружающие ткани или мигрируют с кровью, лимфой, образуя метастазы. Канцерогенез - процесс перерождения обычных клеток в атипичные.
Как работает традиционное лечение
Стандартные современные методы лечения рака направлены на уничтожение опухоли различными способами:
- оперативное вмешательство;
- введение химиопрепаратов;
- лучевая или радиотерапия
- иммунотерапия
При хирургическом лечении врач удаляет массив атипичных клеток. К недостаткам метода относят невозможность убедиться на месте, что рак удален в полном объеме, и сложность проведения операции в труднодоступных местах.
Во время химиотерапии пациент получает лекарства, которые нарушают жизнедеятельность, тормозят размножение клеток опухоли или стимулируют их апоптоз. Препараты воздействуют и на здоровые ткани организма, что ухудшает переносимость лечения. У ряда пациентов рак может и не реагировать на стандартные средства.
Радиотерапия борьба с опухолью различными видами излучения. Она повреждает ДНК быстро делящихся клеток, приводя к их гибели. Недостаток метода заключается в невозможности прицельного воздействия только на патологический очаг.
Чтобы стандартное лечение помогло пациенту, необходимо стечение обстоятельств:
- небольшой размер и хорошая доступность первичной опухоли,
- низкая злокачественность и хороший ответ на препараты,
- хорошая переносимость курса терапии.
А как же быть тем, чья история борьбы с раком осложнена отягчающими обстоятельствами? В области онкологии новости лечения связаны с преодолением стандартных проблем терапии:
- нечувствительность рака к препаратам или облучению;
- невозможность воздействия только на клетки опухоли;
- большой объем образования и риск непереносимости терапии;
- риск оставить рак на месте после операции.
Если иммунная система пропускает начало опухолевого процесса, болезнь прогрессирует. Раковые клетки действуют хитростью, маскируя свои рецепторы специальными белками.
Микробиологи изобрели так называемые моноклональные антитела. Это белковые молекулы, имеющие сродство только к определенным рецепторам. Антитела связываются с раковыми клетками, не только делая их видимыми для иммунной системы, но активируя их уничтожение.
Моноклональные антитела созданы для молекул, отвечающих за развитие разных заболеваний. Этот принцип лег в основу таргетной (прицельной) терапии. Например, препарат Ритуксимаб эффективен при лечении B-клеточных лимфом, Цетуксимаб для борьбы с раком толстой и прямой кишки, опухолями головы и шеи. Бевацизумаб применяют при опухоли молочной железы, толстого кишечника, головного мозга и немелкоклеточном раке легких.
Эти медикаменты доступны и в России. Первое время их производством занимались только иностранные компании. Пациенты с нечувствительностью к стандартной химиотерапии могли опасаться, что препарат не придет вовремя или будет стоить дороже. С 2012 года российская компания Biocad производит биоаналоги: Гертикад, Авегра, Ацеллбия.
CAR-T – найти и уничтожить
Универсальный рецептор на поверхности позволяет настраивать иммунитет против разных опухолевых антигенов. T-клетки легко проникают внутрь раковой опухоли. Так CAR-T позволяет уничтожать самые мелкие метастазы в головном и спинном мозге, снижая риск рецидива. Генную терапию считают более эффективной по сравнению с моноклональными антителами.
Достижения иммунной терапии
Среди последних новостей в онкологии – официальное разрешение американской федерации FDA на применение CAR-T в борьбе с B-клеточными лимфомами. Препарат Yescarta - лишь второе такое средство за всю историю генной терапии.
Ученые доказали, что применение моноклональных антител в комплексе с CAR-T – один из самых эффективных методов лечения рака у пациентов с плохой переносимостью и резистентностью к традиционной химиотерапии. Так у пациентки с 4 стадией карциномы молочной железы уменьшился в объеме первичный очаг и его метастазы.
В 2018 году Нобелевская премия за метод лечения рака была присуждена двум ученым Джеймсу Эллисону (США). Их исследования продолжались более 20 лет и привели к открытию белка PD-1 и рецепторов CD152 на лимфоцитах, мешающих иммунитету находить и уничтожать раковые клетки. Затем ученые синтезировали препараты, которые решают эту проблему. В перспективе средства позволят увеличить выживаемость при опухолях различной локализации, в том числе при наличии метастазов.
Эти новые методы лечения рака доступны и в России. Среди зарегистрированных зарубежных препаратов: Китруда, Ервой, Тецентрик.
Диагностика и лечение с помощью света
Фотодинамическая терапия основана на использовании светочувствительных веществ (фотосенсибилизаторов) и лазерной установки. Их молекулы поглощают кванты света, уничтожая раковые клетки и разрушая сосуды, питающие опухоль. Невозможность прицельного воздействия лазера позволяла применять его только для видимых кожных опухолей.
Нижегородские ученые синтезировали флуоресцентный белок, который позволяет обнаруживать клетки опухолей. В 2012 году они получили патент на воспроизведение пептида, уничтожающего рак шейки матки в поле лазера.
Прицельное воздействие на опухоль
Радиотерапия сопряжена с риском получения массивного облучения. Во время лечения повреждаются не только раковые, но и здоровые клетки. К самым сложным локализациям опухоли относят голову и шею ввиду опасности повреждения головного мозга и крупных сосудов. Поражение зрения, слуха неизбежно снижает качество жизни пациента. Кроме того, до ряда опухолей нельзя добраться хирургическим путем.
Уничтожить такой рак помогает стереотаксическая гамма-терапии (или гамма-нож). Лучевые диагносты определяют точную локализацию и размеры образования, после чего в патологический очаг направляют до 200 лучей из разных точек. Единственная процедура занимает несколько часов и дает результат, сопоставимый с 30 сеансами облучения.
Гамма-нож – неинвазивная хирургическая процедура, которая позволяет пациентам возвращаться домой в день ее проведения. В 2019 году в России действует 6 установок, позволяющих помочь 3 тысячам пациентов в год. Новости онкологии в этой области обнадеживают онкобольных перспективами открытия 20 таких центров в стране.
Снизить повреждение окружающих тканей возможно благодаря замене рентгеновского излучения на протонное. Оно лучше концентрируется в очаге. В 2018 году немецкие ученые из Центра им. Гельмгольца Дрезден-Россендорф успешно соединили протонную терапию с МРТ-сканером. Ранее визуализацию опухолей выполняли с помощью компьютерной томографии, на которой хорошо отображаются только неподвижные костные образования. Среди новостей в лучевом лечении рака в 2019 году – создание прибора, позволяющего ввести протонное облучение в клиническую практику.
Экспериментальное лечение рака
Внедрение новых методик терапии возможно благодаря клиническим исследованиям. В ходе экспериментального лечения используются методы, эффективность и безопасность которых полностью не изучена. Онкологи проводят набор пациентов с определенным заболеванием. Они полностью обследуют кандидатов и отсеивают тех, кто не подходит по состоянию здоровья.
Лица, прошедшие скрининг, получают бесплатную экспериментальную терапию. К ней относят:
- генное лечение;
- локальное замораживание тканей;
- точечный нагрев тканей;
- применение бактерий-анаэробов;
- вакцины против рака;
- лечение лазером;
- нанотехнологии.
Участие в клинических исследованиях дает шанс выйти в ремиссию пациентам, которым не помогают стандартные схемы лечения.
Можно ли считать, что экспериментальная терапия позволяет победить рак? Исследователи рассказывают о протоколах с ошеломляющими результатами. Так при испытании препарата Китруда в 2013 году около 76% участников почувствовали облегчение, а полностью излечилось от рака около 20%. Так препарат был включен в схемы лечения различных агрессивных опухолей.
При обнаружении немедленных или отсроченных негативных последствий протоколы закрывают, а средства или методы не допускают до рутинной практики.
С 2018 года работает сервис, позволяющий онкологам России искать больницы, в которых проводят экспериментальную терапию, и направлять туда пациентов. Он создан непосредственно Агентством клинических исследований и Российским онкологическим обществом RUSSCO.
Последние новости в онкологии: что ожидать в 2019 году?
Специалисты в области клинической иммунологии, радиологии, регенеративных технологий из России принимали японских коллег. Трансляция семинара позволила коллегам из 38 регионов получить актуальную информацию о применении новых дендритно-клеточных вакцин от рака, культивировании стволовых клеток с помощью роботов, инженерных методиках.
Кроме того, среди новостей онкологии 2019 года в России - успешное внедрение органосохраняющих операций при раке легких и эндоскопическое удаление новообразования желудка и толстого кишечника.
Злокачественная опухоль (рак) — бесконтрольное разрастание изменившихся клеток ткани. Во время роста злокачественная опухоль нарушает нормальную работу организма. Этот термин объединяет группу из более чем 100 заболеваний.
Все онкологические заболевания очень отличаются друг от друга. Для борьбы с онкологическими заболеваниями медицина, опирающаяся на науку, предлагает три основных вида лечения: химиотерапия, лучевая терапия и оперативное вмешательство.
Многие пациенты, потерявшие надежду излечиться посредством традиционных методов терапии, соглашаются опробовать на себе экспериментальную клиническую медицину.
Экспериментальные методы терапии онкологии — это методы лечения раковых опухолей, которые на сегодняшний день не до конца апробированы и не включены в протоколы ВОЗ, находятся на стадии клинических испытаний и требуют дальнейшего изучения.
Среди экспериментальных методов лечения рака можно выделить следующие:
- Генная терапия — разработана для людей, у которых по результатам личных исследований можно предположить генетическую предрасположенность к развитию злокачественных опухолей. Основан этот метод на том, что больному вводятся в опухоль гены, побуждающие клетки погибать, или, как минимум, препятствующие их размножению.
- Криоабляция — этот метод призван заморозить пораженную ткань и ввести ее в состояние некроза. Правда, прилегающие здоровые клетки пострадают тоже.
Высокоинтенсивный сфокусированный ультразвук (HIFU) — призван разрушить пораженные клетки. - Ангиостатические лекарства — их действие направлено на препятствование образованию капилляров в опухоли. Для того, чтобы существовать и расти, опухоли необходим приток крови. После того, как разрушаются капилляры, опухоль должна погибнуть.
- Лазеротерапия — во время подобного лечения энергия светового лазерного луча трансформируется в тепловую. Способ, призванный высокой температурой погубить раковые клетки.
Также в некоторых центрах лечения онкологических заболеваний используются анаэробные бактерии, уничтожающие самый центр опухоли, иногда остающийся частично недосягаемым для других лекарственных средств, тогда как периферийная часть опухоли гибнет под воздействием химиотерапии.
Нанотерапия — один из самых смелых и фантастичных экспериментальных способов лечения рака. Введенные в организм ракового больного наногильзы с крошечными частицами золота могут сами обнаружить в организме злокачественный очаг и полностью его уничтожить.
Одним из экспериментальных методов лечения является иммунотерапия. Ее цель заключается в стимуляции иммунной системы на борьбу с раковыми клетками. Противоопухолевая вакцинация — это способ создания активного специфического противоопухолевого иммунитета в организме с помощью вакцины, содержащей иммуногенные антигены.
Таргетная терапия или "терапия цели" — последняя технология лечения раковых опухолей, основанная на принципах целевого воздействия на фундаментальные молекулярные механизмы, лежащие в основе того или иного заболевания. Она вызывает только гибель опухолевых клеток, практически не оказывая неблагоприятного воздействия на здоровые ткани организма, и, следовательно, не вызывая таких побочных эффектов.
В последнее время в развитых странах все шире используется метод химиоэмболизации, сочетающий в себе эмболизацию опухоли (т.е. прекращение в ней кровотока, что уже само по себе оказывает лечебное воздействие), а также доставку в ее ткани химиопрепарата, который концентрируется именно в опухоли и оказывает фокусированное локальное воздействие.
К экспериментальным методам лечения рака прибегают только тогда, когда все традиционные клинические способы уже испробованы и не дали результатов. В основном на экспериментальные методы решаются люди с обильно метастазирующей опухолью, а также те, к кому уже применяется не радикальное, а паллиативное лечение.
По мнению некоторых специалистов-онкологов, реальная эффективность экспериментального лечения злокачественных опухолей варьируется от 11 до 27% (в среднем эффективность равна 22%).
Новым трендом в медицине становится персонифицированный подход, при котором лечение подбирается в зависимости от молекулярно-генетических особенностей конкретного пациента. Поскольку персонифицированная медицина только начинает зарождаться, то никто из врачей не может гарантировать пациенту, что дорогостоящая химиотерапия вместо лечения его не убьет, или таргетный препарат не вызовет появления новых типов опухолей и т.д.
Каждая страна имеет свои особенности лечения. Лечение рака в США отличается высокими ценами, однако новейшие разработки лучших онкологов позволяют достигать неизменно высокого процента ремиссии у детей с диагностированным раком. Лечение рака в Германии отличается использованием классических методов, которые полностью безопасны и эффективны. Несмотря на применение оборудования последнего поколения, использование экспериментальных методов лечения не приветствуется. В Израиле использование экспериментальных технологий и препаратов значительно шире, что позволяет добиваться стабильно высоких результатов в лечении.
Одним из крупнейших и старейших медицинских центров в мире, специализирующихся на онкологии, является Мемориальный онкологический центр им. Слоуна-Кеттеринга (Memorial Sloan-Kettering Cancer Center, MSKCC) в Нью-Йорке (США). В учреждении проводятся операции по эмболизации опухоли, процедуры химической и термической абляции и др., применяются новейшие методы химиотерапии.
Немецкий центр изучения рака (DKZF) при университете Гейдельберга — один из самых авторитетных онкологических центров не только в Германии, но и в мире. Центр ионно-лучевой терапии при университете Гейдельберга активно применяет одно из самых перспективных открытий в лечении злокачественных опухолей — облучение тяжелыми ионами.
Один из самых известных частных медицинских центров Израиля — клиника Топ Ихилов (Top Ichilov Clinic). Клиника располагается на территории крупной израильской государственной больницы "Ихилов" в Тель-Авиве. Здесь применяются все известные в настоящее время методы лечения онкологических заболеваний, в том числе иммунотерапия, выжигающая терапия (воздействие на опухоль ультразвуком высокой частоты), генотерапия, воздействие на мембраны клеток опухоли. В процентном соотношении, стоимость услуг израильских специалистов ниже стоимости обслуживания в странах Европы примерно на 40% и ниже стоимости медицинских услуг в США на 60%.
Клиники Индии предлагают высокий уровень лечения онкологических заболеваний, такой же что и ведущие страны Западной Европы, Израиль и США, но по ценам в несколько раз ниже. Среди лучших онкологических клиник Индии — больница Дхарамшила (Dharamshila) в Нью-Дели и Мемориальная больница Тата (Tata Memorial) в Мумбаи, при которой работает всемирно известный Центр лечения, исследований и образования в онкологии (ACTREC). Мемориальная больница Тата — лидер в области клинических исследований. Кроме того, эта больница изыскивает возможности, чтобы бесплатно лечить почти 70% своих пациентов.
Многие экспериментальные программы проводятся в Китае, который является разработчиком целого ряда экспериментальных препаратов. Есть разработки у Японии и Южной Кореи.
В России крупнейшими государственными клиническими учреждениями онкологического профиля являются Московский научно-исследовательский онкологический институт им. П.А. Герцена, Российский онкологический научный центр им. Н.Н. Блохина РАМН, НИИ онкологии им. Н.Н. Петрова Минздрава РФ, Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева. Среди крупных частных клиник — Научно-практический центр современной хирургии и онкологии (Европейская клиника), Европейский медицинский центр (в составе сети клиник, которые функционируют по всей Европе), Швейцарская университетская клиника SwissClinic.
Многие федеральные и региональные клиники России проводят многоцентровые рандомизированнные (со случайным отбором кандидатов) контролируемые исследования по изучению новых противоопухолевых агентов, часть из которых, пройдя все фазы исследования и регистрацию, получают статус противоопухолевого лекарства на основании большой доказательной базы (так называемая "доказательная медицина"). Но до завершения этих исследований и регистрации препарата запрещено публиковать какие-либо данные, относящиеся к конкретному протоколу лечения. Сам же больной обязательно подписывает информационное согласие на участие в экспериментальном лечении.
По мнению специалистов, экспериментальных программ в России мало, нет значимых отечественных разработок. В стране ученые работают примерно со 150 лекарственными молекулами, а в мире их разрабатывается 2,5 тысячи.
В тех случаях, когда возможности отечественной медицины исчерпаны и есть возможность продолжить лечение за границей, российские онкологи сами предлагают это сделать. И тут очень нужна помощь благотворительных фондов, если не получается быстро получить государственные средства.
Внутри благотворительных фондов существует механизм принятия решения. Например, с фондом помощи детям с онкогематологическими и иными тяжелыми заболеваниями "Подари жизнь" работают медицинские эксперты — ведущие детские онкологи и гематологи страны. Именно они принимают все решения о том, будет фонд оказывать помощь или нет. Помощь фонд оказывает только в том случае, если эксперты подтвердят: лечение, которое необходимо ребенку для полного выздоровления, нельзя провести в России, но можно в зарубежной клинике. Если это не так — фонду приходится отказывать родителям. Также фонд не вправе собирать средства, если ребенку можно помочь в российской клинике, но родители хотят лечить его только за границей. В таком случае родителям приходится самим искать деньги. Если фонд собирает больше средств, чем нужно конкретному ребенку, то передает их на лечение других детей.
Уровень и квалификация российских специалистов ни в чем не уступает специалистам лучших западных онкологических центров. Многие из разрабатываемых лекарственных препаратов, включая таргетные препараты и противоопухолевые вакцины, тестируются совместно европейскими, американскими и российскими центрами с набором больных из Европы, Северной Америки и Российской Федерации.
Материал подготовлен на основе информации РИА Новости и открытых источников
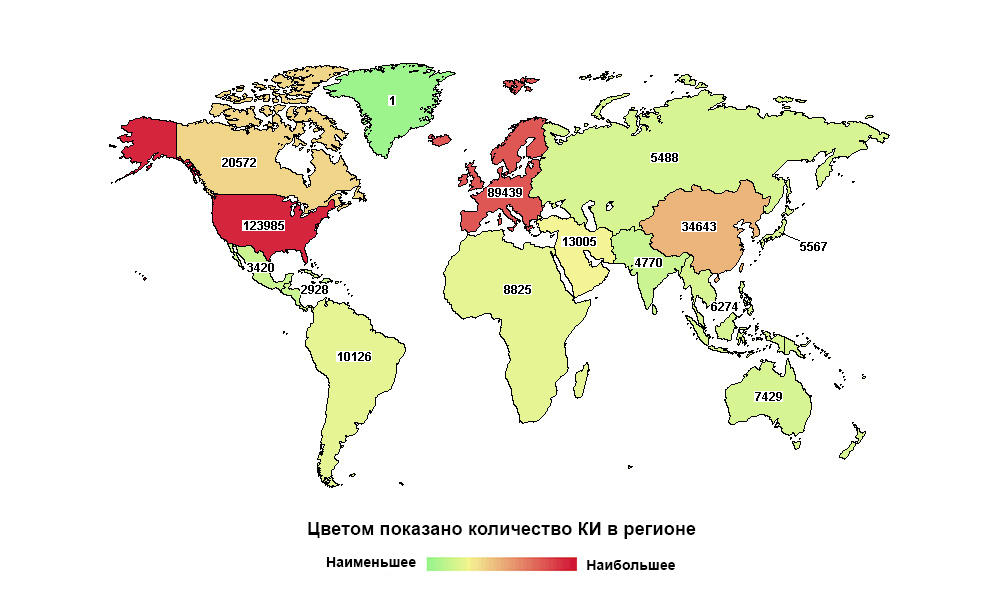
Россия далеко не на первом месте в мире, но первая по количеству исследований в своем макрорегионе
Для частных клиник практика необычная: минимум коммерческой выгоды, слишком много сложностей в организации процесса и строгие требования к лечебному учреждению. Обычно только крупным федеральным центрам удается им соответствовать.
А ведь для многих пациентов в России клиническое испытание препарата – единственный шанс получить бесплатное лечение от смертельной болезни. Но среди российских онкопациентов 30% просто не знают, что такое клиническое исследование, и лишь немногие принимали в них участие.
Поэтому мы хотим, чтобы как можно больше людей узнали и проверили: возможно, у них есть шанс получить препарат, который может спасти им жизнь.
В этой статье мы расскажем, зачем нужны и как устроены клинические исследования, кто и как может туда попасть.
Клиническое исследование/испытание (далее – КИ)– научное исследование с участием людей в качестве испытуемых, которое проводится с целью оценки эффективности и безопасности нового лекарственного препарата или расширения показаний к применению уже известного. Кроме лекарств, КИ могут также изучать эффективность и безопасность новых методов лечения и диагностики.
Медицина эволюционирует и превращается в точную науку, которая не обходится без статистики.
Когда медицина стала массовой, у врачей возникла необходимость вырабатывать действительно безошибочные тактики лечения. Определенные лекарства должны были помогать в заданных условиях большинству пациентов.
И именно клинические исследования – основа доказательной медицины.
До середины XX (!) века не было никакого регулирования исследований новых препаратов. Чтобы навести порядок, как часто бывает, понадобилась пара трагедий.

Мамы этих детей пили снотворное, не проверенное на людях
С тех пор лекарства перед регистрацией очень тщательно изучают. Регулируется это Международными гармонизированными трехсторонними правилами Надлежащей клинической практики (ICH Harmonized Tripartite Guideline for Good Clinical Practice, сокращённо — ICH GCP). С 1996-97 г. они действуют в США, Японии и ЕС, а с 2003 года введены и в России.
Весь процесс создания препарата можно поделить на 3 крупных фазы.
1. Поиск идеи и доклинические исследования – в пробирках и на животных.
2. Если на этом все не закончилось – то начинаются клинические исследования, с людьми: сначала осторожные, потом более массовые.
3. Затем препарат регистрируется в регуляторных органах, чтобы стать привычным наименованием в медицинских справочниках.
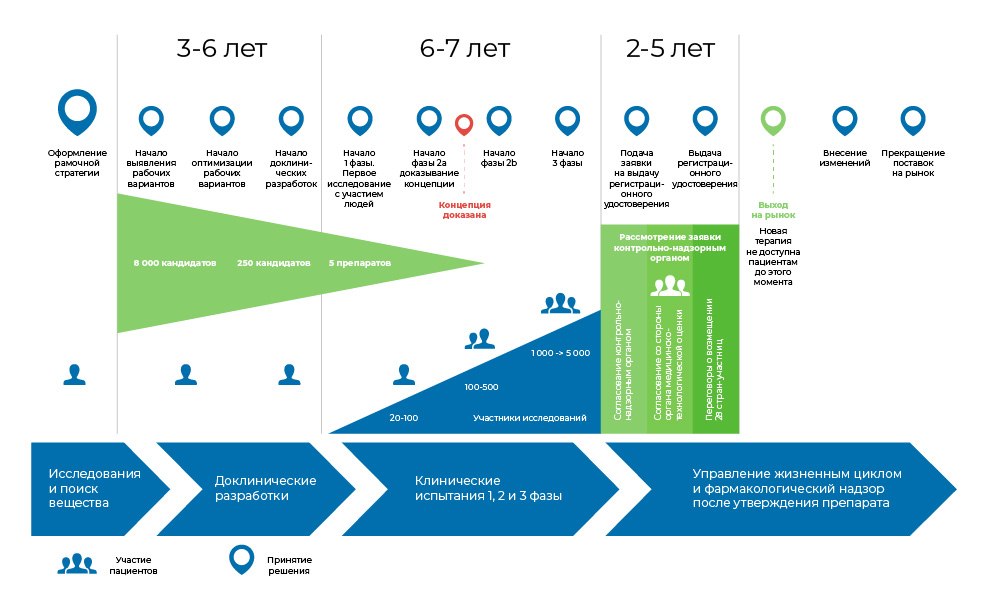
Процесс разработки медицинского препарата. С момента создания молекулы до момента начала продажи лекарства проходит от 8 до 20 лет.
Значит, это кому-нибудь нужно? Онкология — одна из самых вопиющих сфер медицины в плане неудовлетворенной потребности в лекарствах. По данным Всемирной организации здравоохранения, в 2018 году онкологические заболевания убили 9,6 миллиона человек. Часто опухоли обнаруживают на поздних стадиях, когда остается лишь паллиативное лечение.
При этом открытия в сфере молекулярной биологии и генетики позволили понять механизмы, которые способствуют развитию и прогрессированию рака, улучшилось понимание работы противоопухолевого иммунитета.
И сегодня разработка противоопухолевых препаратов – одно из самых наукоемких и востребованных направлений медицины.
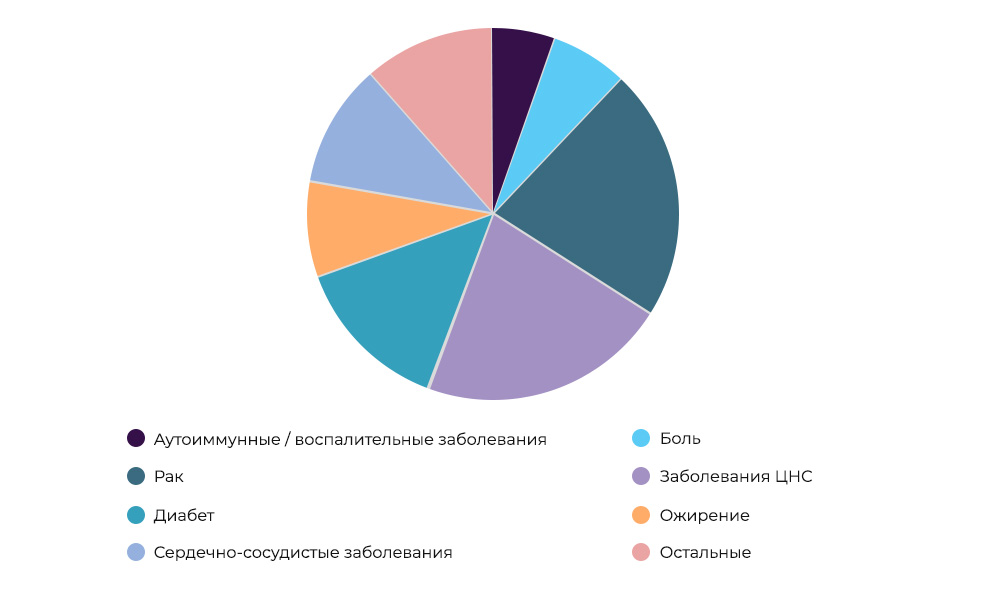
Исследования противораковых препаратов – 23% всех КИ в мире
Раньше многие фармкомпании проводили исследования самостоятельно, силами своего штата ученых. Сейчас медицинское учреждение, которое прошло аккредитацию и соответствует определенным требованиям, может стать площадкой и исполнителем для эксперимента.

Механизм работы таргетных препаратов при колоректальном раке. Раковые клетки прекращают делиться, либо приращивать к опухоли дополнительные кровеносные сосуды, либо препарат предохраняет соседние клетки от превращения в злокачественные
Чтобы найти такие вещества, а потом выбрать из кандидатов подходящие, требуется много ресурсов и времени на исследования in vitro и in silicio – то есть в пробирке или с помощью компьютерного моделирования.
Выбранное вещество запасают в нужном количестве – производят по специальным правилам (в России это ГОСТ Р 52249-2009), без примесей и нарушения технологии. И с этими пробирками ученые отправляются тестировать препарат на животных.
Мышь – двигатель прогресса. После проверки идей в пробирке ученый с запасом своего потенциального препарата идет в виварий – нужно проверить, как поведет себя прототип в теле млекопитающего (in vivo).
И до сих пор в медицине без опытов на животных – не обойтись. Львов и коней, правда, оставили в покое. Доклинические исследования во всем мире происходят, в основном, на мышах, морских свинках и кроликах.

Лабораторным мышкам даже поставили памятник в Новосибирском Академгородке
На этом этапе проверяют, насколько вреден/безопасен препарат:
- вызывает ли аллергию,
- оказывает ли токсичное влияние на ткани и органы,
- как влияет на способность животных к размножению и нормальному развитию плода и т.п.
Кроме того, наблюдают, как кандидат в лекарства ведет себя внутри организма зверька (фармакокинетика):
- скорость всасывания и нарастание концентрации в крови,
- каковы максимальная и минимальная доза,
- как быстро выводится из организма, и т.п.
Все эти данные нужны, чтобы решить: можно ли применять исследуемое вещество для людей. И если да – то сколько его нужно.
Неизбежное зло. Бюрократия. За правильным ходом КИ следят Департамент гос. регулирования обращения лекарственных средств Минздрава и Федеральная служба по надзору в сфере здравоохранения (Росздравнадзор).
Если ученый пришел к моменту, когда нужно переходить к клиническим исследованиям на людях – пора готовить заявку на проведение КИ. Для этого ему нужно несколько документов.
- Досье исследуемого лекарственного препарата. Все, что уже выяснили о препарате: данные о фармакокинетике, эффективности, токсичности и т.п.
- Протокол исследования. В нем подробно описан план будущего исследования и методики оценки результатов;
- Брошюра исследователя. Краткая шпаргалка, чтобы понятно объяснить суть исследования волонтерам и пациентам и получить их информированное согласие.
Этический комитет. Следующий этап квеста – получить оценку и заключение комитета по этике.
Комитет по этике – это независимая группа врачей, ученых, медицинского персонала и неспециалистов (представителей общественности). Они изучают протокол исследования и информированное согласие, чтобы до старта исследования удостовериться, что между пациентом, исследователями, фармкомпанией и национальным компетентным органом регулирования достигнуто согласие, ничьи права не нарушены, никто не подвергается принуждению и никому не прищемили свободу воли.
После проверки всех документов и одобрения этического комитета потенциальный препарат переходит в стадию клинических испытаний – на людях.
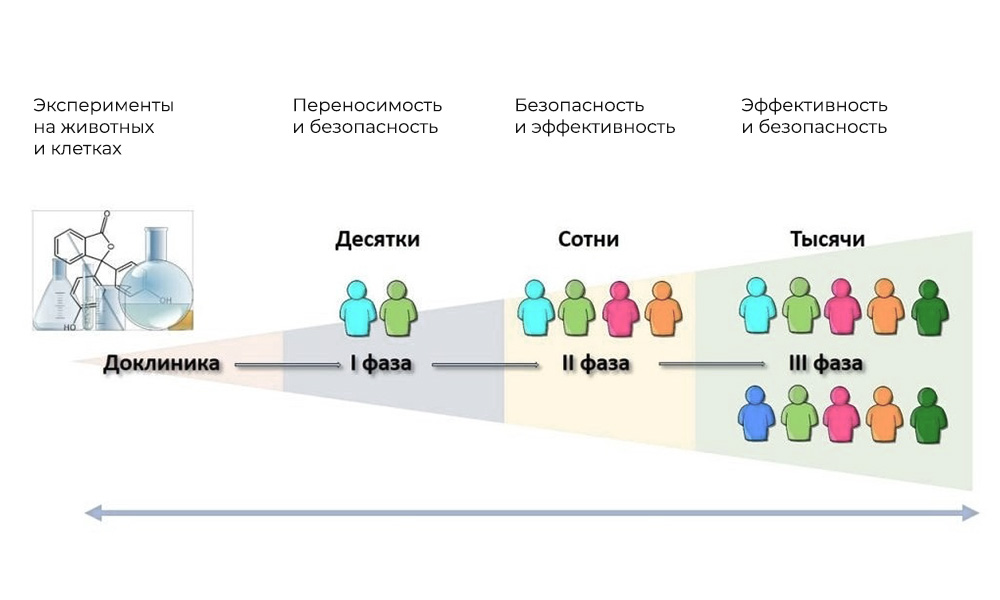
Основные фазы клинических исследований – на людях
Участники: 20 – 100 человек.
Длительность: от нескольких месяцев до 1 года.
Цель: изучить переносимость, фармакодинамику и фармакокинетику.
Проверяется, действует ли вещество на людей так же, как на животных, безопасно ли оно.
В первой фазе клинического исследования должны, теоретически, участвовать здоровые добровольцы, но в онкологии тестирование сильнодействующих веществ на здоровом организме нельзя назвать этичным. Поэтому участвуют люди с соответствующим заболеванием, против которого может быть эффективен будущий препарат.
Участникам постепенно вводят все бОльшие дозы препарата, начиная с минимальной и до максимально допустимой. После каждого введения отслеживается состояние пациента.
Оценивают фармакокинетику: скорость всасывания и экскреция (выделение неизменённого вещества), распределение по тканям и органам. Также оценивается фармакодинамика: действие препарата на клетки опухоли, на другие такни и органы, побочные эффекты. Выясняется предпочтительный вариант применения и уровень дозировки.
Кроме исследований с нарастающими дозами, в фазе I проверяют:
- действие пищи на препарат;
- взаимодействие с другими препаратами;
- влияние прочих заболеваний, которые могут повлиять на нужные дозы препарата (например, у пациента с почечной недостаточностью).
По данным FDA, первую фазу КИ успешно проходят 70% препаратов.
Участники: 100 – 500 пациентов.
Длительность: от нескольких месяцев до 2 лет.
Цель: проверка эффективности при определенных показаниях
Необходимо изучить, насколько новый препарат эффективнее по сравнению с плацебо или уже существующим лечением. Плюс, большее количество участников позволяет обнаружить более редкие побочные эффекты, которые не выявлены в фазе I.
Обычно на этой стадии исследования проводятся как двойные слепые рандомизированные плацебо-контролируемые.
Двойное ослепление: ни врач, ни пациент не знают, кто получает активное вещество, а кто – плацебо или оптимальное существующее на данный момент лечение.
Рандомизация подразумевает, что пациенты делятся на группы случайным образом – с помощью генератора случайных чисел. Повлиять на этот процесс не может ни врач, ни участник КИ.
Плацебо-контроль означает, что участники одной группы будут получать плацебо в таких же условиях, что и участники другой группы, которым дают активное вещество.

Всем – одинаковые на вид, вкус и запах лекарства.
Согласно данным FDA, лишь 33% препаратов, дошедших до фазы II, успешно проходят КИ и переходят в следующую фазу.
Количество участников: 300 – 3 000 и более.
Продолжительность: от года до нескольких лет.
Цель: подтверждение эффективности и безопасности исследуемого вещества на больших выборках.
Это самая крупномасштабная, сложная и дорогостоящая часть процесса разработки препарата. Цель таких исследований — подтвердить эффективность и безопасность исследуемого вещества при применении большим количеством пациентов.
По результатам этой фазы производители препарата получают разрешение для вывода его на рынок.
В фазе III могут принимать участие тысячи пациентов из разных стран. Все должно быть спланировано до мелочей, чтобы во всех местах проведения исследования его дизайн и значимые условия были абсолютно одинаковыми.
Дизайн исследования настолько узкий, что в него может попасть не только умирающий, но и пациент с прогнозом на стойкую ремиссию. Препарат должен быть настолько безопасным, чтобы его можно было давать практически здоровому человеку – и качество жизни не снижалось.
Перед началом фазы III проводится множество консилиумов и обсуждений между исследователями и сторонними экспертами: очень важно продумать дизайн экспериментов так, чтобы не упустить важное и получить все нужные данные.
В ходе фазы III окончательно подтверждается эффективность и безопасность нового лекарства, зависимость эффекта от дозы.
Анализируется соотношение преимуществ и рисков. По результатам контролирующий орган принимает решение о том, можно ли выводить препарат на рынок. Для этого нужно, чтобы соблюдались условия:
- препарат более эффективен, чем ранее известные аналоги,
- дает меньше побочных эффектов/лучше переносится,
- эффективен, когда не работают ранее известные препараты,
- более выгоден экономически,
- проще в применении.
Процесс рассмотрения заявки надзорным органом занимает 12-18 месяцев.
По данным FDA, третья фаза клинических исследований заканчивается положительным результатом лишь в 25-30% случаев от всех, что были на старте третьей фазы.
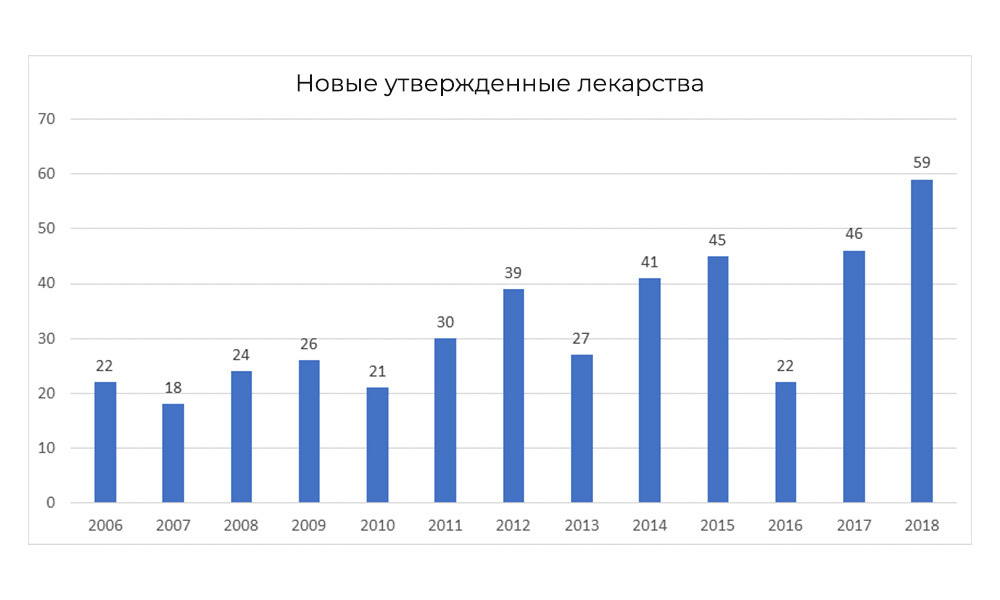
Тем не менее, в 2018 FDA побила собственный рекорд по числу одобренных препаратов
У контроля за новыми препаратами в России есть свои баги (или фичи, как посмотреть). По закону, одобренные зарубежные препараты должны пройти дополнительные клинические испытания в России: якобы, это повысит качество зарубежных препаратов.
Когда препарат уже прошел 3 фазы, вышел в продажу на мировой рынок, в нашей стране он еще может быть не зарегистрирован. Мы знаем, что он работает, в его инструкции на иностранных языках есть показания, подтвержденные 3 фазами исследований в США, или Канаде, или Европе.
Скажем, 12 показаний – 12 диагнозов, при которых препарат будет эффективен. Но в России еще не все эти показания подтвердили официально, только 6 из 12. И если у пациента именно тот вид рака, для лечения которого препарат еще пока официально не зарегистрирован в РФ, такой препарат бесплатно, в рамках ОМС, он не получит.
Это на 2-3 года замедляет пациентам доступ к новым лекарствам.
К сожалению, нас таких мало. Не всякая клиника может принимать у себя КИ.
Во-первых, у клиники должен быть сертификат GCP, Good Clinical Practice.
Во-вторых, исследователей должно быть минимум двое. У них тоже сертификаты, и не так-то просто их добыть: выдаются контролирующим органом страны-производителя препарата. В нашем случае это США и Франция. Проверяли двух врачей полгода.
В-третьих, сама клиника. Обязательно отделение реанимации, своя лаборатория, сертифицированные медсестры, правильная калибровка нужных автоматов, определенные помещения для хранения препаратов и документов, анонимные помещения, где нет камер – для пациентов. Чтобы запуститься в первый раз – пришлось переоборудовать некоторые кабинеты и палаты: вплоть до новых кроватей, все по дизайну КИ.

Для разных препаратов – разные холодильники
Словом, те клиники и врачи, которые хотят этим заниматься, должны еще постараться, чтобы создать определенные условия.
Набираем 2 или 3 группы пациентов, подписываем с ними информированное согласие.
Обычно на участие в клинических исследованиях люди соглашаются по 2 причинам:
- отсутствие эффективных методов лечения их болезни,
- желание сделать вклад в развитие науки.
В любом случае это исключительно добровольное решение. Исследователи обязаны в письменном виде предоставить пациенту информацию о цели КИ, о том, как оно будет проводиться, какое лекарство будет применяться, и т.п. Все это отражено в особом документе —информированном согласии. Каждый участник исследования застрахован от причинения вреда жизни и здоровью.
Наши пациенты пока ни разу не отказывались – для них это невероятный шанс получить лечение, причем бесплатное, когда остальные методы терапии уже исчерпали себя.
Но онкологических пациентов у нас много. Если клиент признается, что денег на лечение нет – мы обязательно проверяем требования к участникам исследования. Вполне возможно, что ему найдется место.
В данный момент открыт набор в 18 крупномасштабных исследований.
Конечно, масштабы в частной клинике – совсем не то, что в большом НИИ, но обычно 3-4 пациента в неделю попадают в протокол исследования. Это немало: не менее 10 человек в месяц, которые получают самое продвинутое передовое лечение – бесплатно.
И у них самих появляется дополнительный шанс, и будущие пациенты скорее смогут получить этот препарат, когда закончится КИ.
Пациенты вовсе не обязательно постоянно находятся в клинике – если это не запрещено дизайном КИ и пациент чувствует себя хорошо – он участвует амбулаторно. Приходит, получает свою капельницу и уходит. Есть и такие, кому лучше остаться в клинике, под присмотром.
В результате долгих месяцев скрупулезного выполнения длинного списка требований, постоянного мониторинга состояния пациента, консолидации данных по десяткам параметров мы делаем исследования, которые будут опубликованы, а пользоваться результатами – расширенной возможностью применения новых препаратов – будут все врачи из всех онкоцентров страны. И несколько десятков человек получают шанс на лечение прямо сейчас.
Надеемся, этот текст был для вас просто интересным чтением.
Читайте также:

