Crispr cas9 в лечении рака
В ходе клинических испытаний китайские ученые используют собственные клетки пациента — T-лимфоциты. Эти клетки отвечают за распознавание и уничтожение других клеток с чужеродными антигенами.

Павел Волчков Фото: пресс-служба МФТИ
Павел Волчков
Технологию взяли в клинические испытания для терминальных раковых больных. Для тех пациентов, которым уже не помогают другие существующие методы лечения, это более-менее обоснованно. Но это плохо для самой технологии, потому что вероятность получить позитивный результат для таких пациентов крайне мала. Больные уже обременены рядом побочных эффектов: обычно у них множественные дисфункции органов, проблемы с выделительной системой (плохо работают почки), печенью, легкими, различные воспалительные процессы в результате образования метастазов в органах и от совокупности предыдущих терапий. Осложнение может вызвать банальная пневмония.
Это минусы любого онкологического клинического испытания на терминальных больных — все проблемы вылезают и доминируют, так что трудно достоверно показать роль вашего исследования. Но на более ранних стадиях рака никто бы не разрешил китайским ученым проводить такие исследования. Тогда как по соображениям национальной политики для них было особенно важно запустить его первыми.
Это не очень хорошо — с момента создания системы до первого клинического испытания прошло слишком мало времени. Всевозможные риски связаны с тем, что технология сырая и ее еще надо доработать, чтобы в клинических условиях она не давала сбоев.
Поэтому можно дать прогноз с большой вероятностью: будет негативный результат и показать эффективность терапии не удастся, что сейчас с китайским клиническим испытанием и происходит. Что они собирались сделать? Уничтожить ген PD-1 в T-клетках, которые берутся у онкологических пациентов, с тем чтобы эти клетки начали атаковать опухолевые клетки. Но еще до того, как китайские ученые собирались это делать, было очевидно, что это повлечет сильную аутоиммунную реакцию. Системное удаление у T-лимфоцитов, полученных из периферии крови, ведет к увеличению аутоиммунного ответа против своих неопухолевых клеток — будут таргетироваться не только опухолевые клетки, но и, допустим, клетки сердца, если есть кардиомиопатия. Это не негативный эффект самого инструмента CRISPR/Cas9, а того, как его решили использовать.
Каждый день мы пишем о самых важных проблемах в нашей стране. Мы уверены, что их можно преодолеть, только рассказывая о том, что происходит на самом деле. Поэтому мы посылаем корреспондентов в командировки, публикуем репортажи и интервью, фотоистории и экспертные мнения. Мы собираем деньги для множества фондов — и не берем из них никакого процента на свою работу.
Пожалуйста, подпишитесь на любое пожертвование в нашу пользу. Спасибо.
На Ваш почтовый ящик отправлено сообщение, содержащее ссылку для подтверждения правильности адреса. Пожалуйста, перейдите по ссылке для завершения подписки.
Исключительные права на фото- и иные материалы принадлежат авторам. Любое размещение материалов на сторонних ресурсах необходимо согласовывать с правообладателями.
По всем вопросам обращайтесь на mne@nuzhnapomosh.ru
Нашли опечатку? Выделите слово и нажмите Ctrl+Enter
- О фонде
- Контакты
- Отчеты
- Для НКО
- Персональные данные
- Пожертвовать
- Стать волонтером
- Частые вопросы
- ВКонтакте
- Telegram
- Youtube
- Дзен
Нашли опечатку? Выделите слово и нажмите Ctrl+Enter
(Протокол № 1 от 20.01.2020 г.)
Благотворительный фонд помощи социально-незащищенным гражданам "Нужна помощь"
Адрес: 119270, г. Москва, Лужнецкая набережная, д. 2/4, стр. 16, помещение 405
ИНН: 9710001171
КПП: 770401001
ОГРН: 1157700014053
Номер счета получателя платежа: 40703810238000002575
Номер корр. счета банка получателя платежа: 30101810400000000225
Наименование банка получателя платежа: ПАО СБЕРБАНК РОССИИ г. Москва
БИК: 044525225
Персональные данные обрабатываются Фондом для целей исполнения договора пожертвования, заключенного между Вами и Фондом, для целей направления Вам информационных сообщений в виде рассылки по электронной почте, СМС-сообщений. В том числе (но не ограничиваясь) Фонд может направлять Вам уведомления о пожертвованиях, новости и отчеты о работе Фонда. Также Персональные данные могут обрабатываться для целей корректной работы Личного кабинета пользователя Сайта по адресу my.nuzhnapomosh.ru.
Персональные данные будут обрабатываться Фондом путем сбора Персональных данных, их записи, систематизации, накопления, хранения, уточнения (обновления, изменения), извлечения, использования, удаления и уничтожения (как с использованием средств автоматизации, так и без их использования).
Передача Персональных данных третьим лицам может быть осуществлена исключительно по основаниям, предусмотренным законодательством Российской Федерации.
Персональные данные будут обрабатываться Фондом до достижения цели обработки, указанной выше, а после будут обезличены или уничтожены, как того требует применимое законодательство Российской Федерации.

Исследовали объединили два передовых подхода: CRISPR и Т-клеточную терапию в борьбе против рака.
Фото Global Look Press.
В течение многих лет учёные приспосабливают технологию редактирования генов CRISPR для лечения всевозможных заболеваний, включая рак. Недавно же исследователи из США отредактировали клетки иммунной системы трёх пациентов с онкологией и выяснили, что модифицированные "бойцы" не вызвали никаких опасных побочных эффектов.
Напомним, что медики не первый год пытаются повысить оборонные способности иммунитета человека и помочь ему таким образом бороться с раком, который часто остаётся невидимым для защитных систем организма. Но лишь недавно исследователи добились значительных успехов в этой области. Один из способов заключается в перепрограммировании "ударных войск" иммунной системы. Речь идёт о Т-лимфоцитах, или Т-клетках, которые способны атаковать раковые клетки.
В рамках такого лечения учёные выделяют Т-клетки из крови пациента и модифицируют их в лаборатории. В результате, после возвращения в кровоток, они получают возможность преследовать клетки опухоли в организме пациента.
Подобное лечение уже продлевает жизнь людям, страдающим от рака, с которым нельзя бороться иными способами . Но у этого метода есть и свои недостатки.
Изменённые Т-лимфоциты могут приводить к слишком активной работе иммунной системы, что также способно создать угрозы жизни человека. Кроме того, не все модифицированные клетки выживают или остаются эффективными необходимое время.
Всё это заставило учёных искать новые способы изменения Т-клеток. Как объясняет автор работы Карл Джун (Carl June) из Пенсильванского университета, его исследовательская группа решила присмотреться к CRISPR.
Ранее авторы проекта "Вести.Наука" (nauka.vesti.ru) подробно рассказывали об этой технологии. Вкратце напомним, что система CRISPR состоит из искусственно созданной наводящей РНК и фермента Cas9. Этот комплекс загружается в безобидный аденоассоциированный вирус (AAV) и с его помощью доставляется в клеточное ядро. Молекула РНК содержит копию небольшого фрагмента ДНК, соответствующего месту, где нужно совершить разрез. Она прикрепляется к заданному участку, после чего белок Cas9 разрезает цепочку.
Иными словами, CRISPR позволяет учёным вносить достаточно точные изменения в гены живых клеток, удалять "вредные" гены и внедрять "полезные". Успешные испытания этой методики на животных позволили заговорить о больших перспективах в лечении целого ряда заболеваний: рака, мышечной дистрофии и ВИЧ.
В последние годы специалисты начали проверять эту методику и на людях. Тем не менее существуют опасения, что CRISPR является не совсем безопасным инструментом из-за риска возникновения непреднамеренных мутаций.
Специалисты решили расставить все точки над i и провели первое в США испытание этой методики на трёх онкопациентах.
Исследователи собрали Т-клетки из крови трёх человек в возрасте 60 лет с прогрессирующим раком. Организмы этих пациентов не реагировали на традиционные методы лечения. У одного из них была саркома, у других – множественная миелома.
При помощи CRISPR учёные удалили три гена из Т-клеток, что повысило их способность искать и уничтожать раковые клетки.
Например, учёные убрали "контрольно-пропускной" белок PD-1, который рак часто "захватывает" и таким образом останавливает атаку иммунной системы. Другая "редактура" привела к устранению определённых рецепторов с поверхности Т-клеток, что дало возможность осуществить четвёртую правку. Специалисты ввели новый искусственный Т-клеточный рецептор. Последний направляет клетки иммунной системы к определённому раковому антигену. После всех манипуляций модифицированные клетки были введены в организм пациентов.
Учёные называют результаты вмешательства впечатляющими. Отредактированные клетки прекрасно прижились в организме всех испытуемых (использовалась только одна доза).
Последующие исследования показали, что изменённые клетки продолжают уничтожать раковые спустя девять месяцев после проведения процедуры. (Более ранние работы демонстрировали, что модифицированные "бойцы" остаются эффективными лишь несколько дней, что, конечно, недостаточно для достижения результата.)
К сожалению, ни один из пациентов не отреагировал должным образом на терапию. Но специалисты не считают это провалом, поскольку испытание было предназначено исключительно для оценки безопасности метода.
В этом отношении исследование, напротив, можно назвать успешным: учёные не наблюдали никаких серьёзных побочных явлений.
Специалисты уже работают над проведением более масштабного исследования на людях, в рамках которого они будут тестировать CRISPR с целью улучшения Т-клеточной терапии CAR. Авторы проекта "Вести.Наука" подробно писали об этом типе лечения.
Что касается пациентов, то один впоследствии умер, двое других живы и проходят курсы химиотерапии. Как добавляет Джун, двум пациентам может быть предложено участие в следующем испытании. Но это будет зависеть от условий, продиктованных Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США.
Научная статья по итогам исследования опубликована в издании Science.

Появление современной технологии редактирования генома CRISPR-Cas9 дало надежду как врачам, так и пациентам – она продемонстрировала огромный потенциал в лечении множества заболеваний, включая такие тяжелые, как рак. Впервые команда американских ученых доказала, что иммунные клетки, отредактированные с помощью новой методики, могут безопасно использоваться у пациентов с онкологическими болезнями.
CRISPR – революционная технология редактирования генов высших организмов, которая позволяет ученым легко модифицировать структуру ДНК, удаляя из нее определенные участки или заменяя их другими, и тем менять функции генов. Она продемонстрировала перспективность применения в самых разных областях, включая исправление генетических дефектов, повышение урожайности и предотвращение заболеваний.
CRISPR-терапия рака
Прошлой весной команда ученых в США начала важное исследование, на первом этапе которого отредактировала геном иммунных клеток трех пожилых пациентов с продвинутыми стадиями рака – саркомой и миеломой. Модифицированные клетки затем были возвращены в организм больных. Второй этап испытания, целью которого было проверить безопасность новой терапии, не выявил серьезных побочных эффектов.
Эти результаты, по словам исследователей, свидетельствуют о перспективе появления нового метода иммунотерапии рака, которая на сегодняшний день считается самым революционным направлением онкологии. Ее суть в настройке собственной иммунной системы пациента на распознавание и уничтожение злокачественных клеток. Делать это можно разными способами: например, воздействовать на механизмы, которые клетки рака используют, чтобы скрываться от иммунной системы или блокировать ее реакцию.
Еще один способ заключается в перепрограммировании Т-клеток, или Т-лимфоцитов. Это главные клетки иммунной системы, которые играют важную роль в адаптивном, то есть не врожденном, иммунном ответе. Именно они борются в нашем организме с опухолевыми клетками, микробами и другими чужеродными агентами.
Первые клинические испытания на людях, проведенные американскими исследователями, доказывают безопасность и жизнеспособность сложного редактирования Т-клеток с помощью CRISPR-Cas9 у пациентов с видами рака, трудно поддающимися лечению. Они показали, что модифицированные Т-лимфоциты, являющиеся главными борцами с онкологией, выживали в организме в среднем в течение девяти месяцев, что говорит о том, что лечение является эффективным и может использоваться как иммунотерапия.
Иммунные клетки, запрограммированные на борьбу с раком

Но несмотря на видимую схожесть обеих методик, у них есть различия. В ходе исследования ученые выделили Т-клетки из крови пациентов, но вместо того, чтобы снабдить их рецептором против белка CD19, являющегося биомаркером нормальных и злокачественных В-лимфоцитов, они использовали технологию генетического редактирования CRISPR для удаления трех генов.
Сначала команда удалила естественные рецепторы на поверхности Т-лимфоцитов, чтобы их легче было перепрограммировать на выработку синтетических рецепторов, которые бы позволили иммунным клеткам разыскивать и убивать раковые клетки. Затем ученые удалили PD-1, белок, присутствующий в Т-клетках, который помогает контролировать иммунную реакцию организма и иногда блокирует их, мешая им выполнять свою работу.
Последний анализ крови всех трех пациентов подтвердил, что по прошествии времени отредактированные клетки по-прежнему содержали все три правки, доказав жизнеспособность такого подхода, отмечают исследователи. По их словам, это первое подтверждение способности технологии CRISPR-Cas9 изменять сразу несколько генов у людей. Результаты нового исследования демонстрируют ее потенциал в лечении многих заболеваний, на сегодняшний день считающихся неизлечимыми.
Три гена, включая ген, кодирующий белок PD-1, были удалены с использованием этой методики, после чего модифицированные клетки были помещены обратно в организм больных раком через шесть недель. Все три пациента прожили не менее девяти месяцев.
Впрочем, как отмечают авторы исследования, новое лечение, хоть и выглядит многообещающим, работает не для всех. В некоторых случаях метод сначала дает результат, но впоследствии болезнь все равно возвращается. Ученые надеются продолжить изучение этой методики и выяснить, может ли ее сочетание с другими видами противораковой терапии сделать ее более эффективной.
У них также есть опасения по поводу безопасности новой технологии. CRISPR может стать причиной нежелательных изменений в геноме, что может стимулировать развитие рака. К тому же, существует риск того, что отредактированные гены могут способствовать злокачественной трансформации клеток или атаковать здоровые клетки организма. Также есть вероятность, что клетки с модифицированными генами под действием определенных лекарств могут перейти в режим саморазрушения.
Ученые признают необходимость дополнительных исследований, прежде чем можно будет начать использование методов генной инженерии CRISPR в лечении рака.
- 4139
- 3,4
- 2
- 8
Модифицированные с помощью CRISPR-Cas9 иммунные клетки получают возможность лучше атаковать опухоль.
![]()
Антон Кротов
![]()
Антон Чугунов![]()
Ольга Волкова
- CRISPR/CAS
- Генетика
- Генная инженерия
- Генная терапия
- ДНК
- Здравоохранение
- Онкология
- Фармакология

Биология в Московском физтехе
Лаборатория геномной инженерии МФТИ — молодая и интенсивно развивающаяся лаборатория со многочисленными проектами и планами. Реализация большей части из них связана с использованием в качестве основного инструмента технологии CRISPR-Cas9. Одним из самых привлекательных направлений использования данной технологии является персонализированная медицина [1], желающая поставить себе на вооружение метод высокоточного геномного редактирования для борьбы со многими тяжелыми наследственными заболеваниями или злокачественными опухолями. Молекулярная технология CRISPR-Cas9 успешнее других претендует на роль этого универсального оружия, и первые шаги по ее применению к реальным пациентам подобны первым полевым испытаниям.
Откуда мы знаем про CRISPR-Cas9?
Превращение механизма бактериального иммунитета в инструмент редактирования геномов высших организмов потребовало решения ряда сложных задач, связанных, главным образом, с повышением точности определения участка ДНК, который распознается и вырезается комплексом белка Cas9 со специальной молекулой РНК, служащей для белка гидом к этому участку. Однако труды генных инженеров увенчались успехом и уже к 2013 году позволили создать удобный способ доставки молекулярного комплекса CRISPR-Cas9, который был опробован на культуре человеческих клеткок [6]. Будучи успешно испытанной на клетках многих модельных организмов и доказав свою эффективность на этой стадии, технология CRISPR-Cas9 приковала всеобщее внимание как перспективный инструмент в клинической практике для лечения многих заболеваний, включая наследственные и онкозаболевания. На настоящий момент развитие технологии вплотную подошло к проверке ее эффективности в клинических испытаниях.
Первый рывок в гонке клинических испытаний CRISPR-Cas
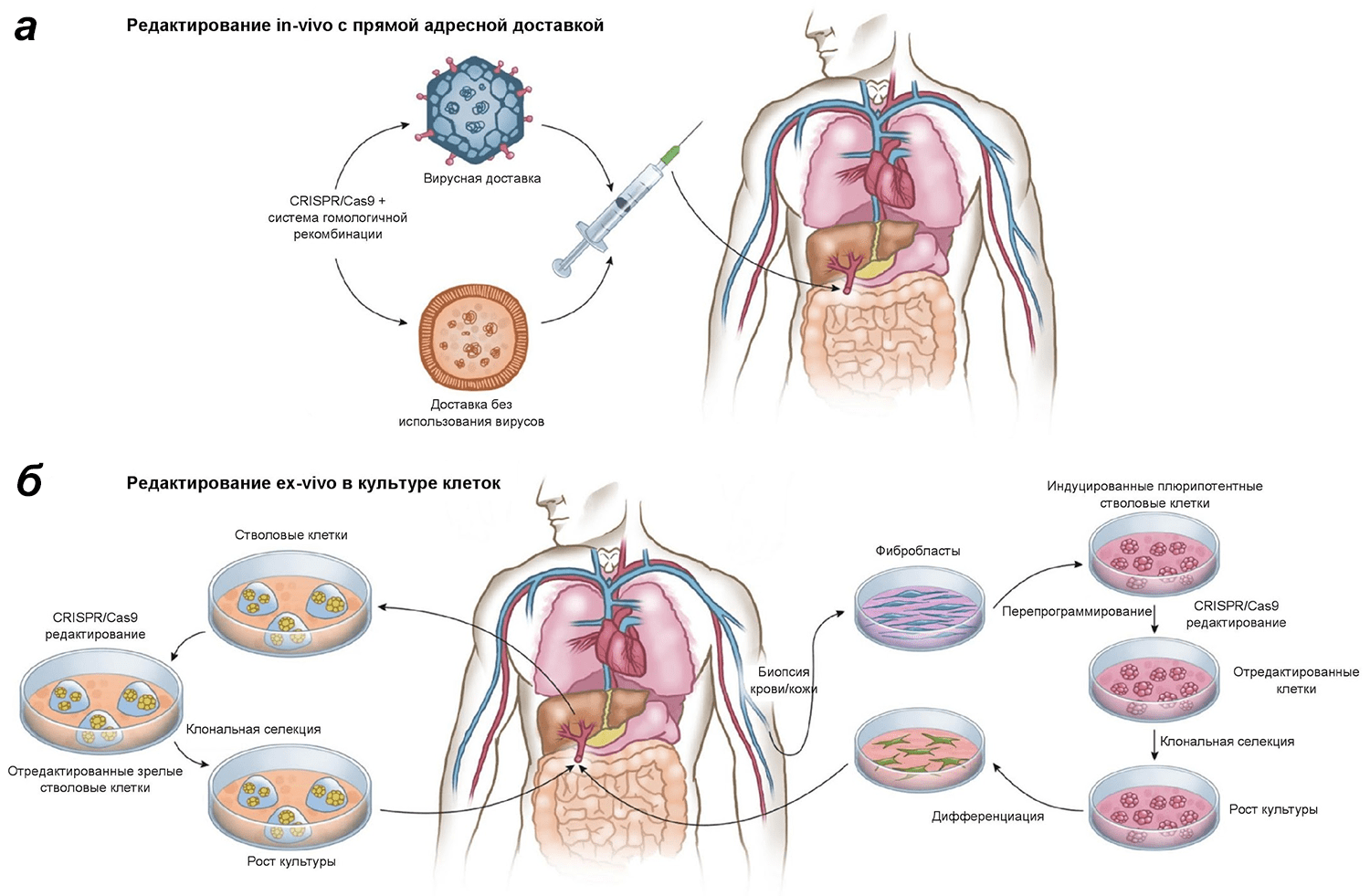
Рисунок 1. In vivo и ex vivo подходы к использованию CRISPR-Cas9 в генной терапии. Китайские исследователи использовали ex vivo подход к редактированию клеток пациента. Однако он — лишь один из двух возможных вариантов лечения патологий с помощью CRISPR-Cas9. а — In vivo CRISPR-Cas9-система доставляется прямо в организм пациента с использованием специальных векторов вирусного или не вирусного происхождения и позволяет произвести редактирование в организме самого пациента. б — Ex vivo редактированию с помощью CRISPR-Cas9 подвергаются, например, соматические стволовые или прогениторные клетки, которые были первоначально взяты у пациента. После редактирования клетки с измененным геномом отбирают, растят в культуре и трансплантируют (инъецируют) обратно пациенту.
Детальные результаты проведенного китайскими исследователями испытания пока не сообщаются, однако уже заявлено, что пациенту была произведена вторая инъекция. Также авторы поделились своими планами по проведению дальнейших испытаний с участием еще 10 пациентов. Каждому из них планируется произвести от двух до четырех инъекций, а затем всех будут тщательно наблюдать в течение последующих шести месяцев для выявления возможных серьезных негативных последствий. Независимо от первого успеха китайских коллег, американские исследователи еще в июле заявили о готовности развернуть в 2017 году масштабные клинические испытания с использованием CRISPR-Cas9 против рака простаты, почек и мочевого пузыря. Старт запланирован на начало 2017 года.
Уникальна ли CRISPR-Cas в качестве технологии геномного редактирования?
Несмотря на явное преимущество по уровню информационного освещения, технология CRISPR-Cas9 не является единственной технологией редактирования ДНК, которая может использоваться для лечения реальных заболеваний.
Однако эффективность редактирования оказалась невысокой — только в 25% клеток редактирование нужного гена прошло успешно. Тем не менее после инъекции редактированных клеток в прогнозе пациентов были отмечены позитивные изменения — у всех 12 человек после прекращения антиретровирусной терапии уровень ВИЧ восстанавливался гораздо медленнее, чем в норме, а уровень Т-лимфоцитов оставался достаточно высоким в течение нескольких недель. Интересно, что у одного из пациентов уровень вируса не восстанавливался в течение целых 12 недель после остановки терапии. Авторы, исследовав геном пациента, обнаружили, что он имеет одну мутировавшую копию гена CCR5, что, по всей видимости, и позволило ему лучше сопротивляться вирусу по сравнению с другими пациентами. Несмотря на достигнутые положительные результаты, испытание данной технологии выявило ряд сложностей, делающих их использование в терапии затруднительным. Во-первых, это недостаточная точность редактирования ДНК в клетках пациентов. Во-вторых, в ходе испытания у пациентов отмечались некоторые малоприятные побочные эффекты, вызванные инъекцией. Например, не исчезающий в течение нескольких дней ужасный запах, исходящий от тел пациентов, возникающий вследствие метаболизма диметилсульфоксида (ДМСО), который используется в качестве криоконсерванта для клеточной культуры [14].
Вторым видом технологии геномного редактирования стало использование фермента TALEN (Transcription activator-like effector nuclease) для спасения маленькой однолетней пациентки с лейкемией в Британии [15]. Испытать подобную технологию авторы исследования решились после того, как все остальные способы лечения ребенка потерпели неудачу. Исследователи использовали Т-лимфоциты, взятые у здорового донора, повысив их устойчивость к противоопухолевым препаратам и модифицировав с помощью технологии UCART (Universal Chimeric Antigene Receptor T-cells), позволяющей им атаковать опухолевые клетки, но не причинять вреда здоровым клеткам пациентки. Авторы признались, что инъекция подобных иммунных клеток с редактированной ДНК не позволяет однозначно вылечить заболевание, однако у пациента появляется шанс дождаться подходящего донора костного мозга. И в данном случае такой донор был найден. Модифицированные иммунные клетки позволили организму девочки побороть опухолевые клетки, а трансплантация — восстановить иммунную систему, сильно пострадавшую в ходе курса химиотерапии и борьбы с опухолью. Случай выздоровления юной пациентки получил широкий общественный резонанс и позволил технологиям редактирования генетической информации еще на шаг приблизиться к применению в клинической практике.
Комментарий Павла Волчкова, заведующего лабораторией геномной инженерии МФТИ

Рисунок 2. Павел Юрьевич Волчков, заведующий лабораторией геномной инженерии МФТИ
Первые шаги в виде первых клинических испытаний очень важны для внедрения технологии в клиническую практику. Они хорошо привлекают общественное внимание, что в свою очередь довольно хорошо стимулирует скорость интеграции технологии, а также увеличивает количество сопряженных разработок и позволяет привлечь дополнительное финансирование. Если смотреть на историю развития подходов к редактированию генома, то, начиная с 90-х годов, она будет идти плавно и поступательно с небольшими пиками, соответствующими тем или иным громким событиям, например, попыткам применения определенной технологии на пациентах. В 2014 и 2015 годах такими событиями стали первые применения ZNFs и TALEN для лечения пациентов с ВИЧ и лейкемией соответственно.
Важно понимать, что сам молекулярный механизм, производящий редактирование ДНК, это важная составляющая будущего клинического продукта, но одной ее недостаточно для того, чтобы лечить пациентов. В список сопутствующих технологий, необходимых для использования геномного редактирования в терапии, входят методы культивирования клеток, которые предполагается редактировать (например, Т-клетки иммунной системы), а также технологии доставки редактирующей молекулярной системы (например, использование вирусных векторов). Кроме того, развитие технологий геномного редактирования толкает вперед развитие приборостроения, поскольку машин, которые автоматически выполняли ли бы всю работу, связанную, например, с отобранными клетками, в клинике сейчас нет. Однако такие машины просто необходимы, поскольку нам важны время и автоматизация процесса для эффективной терапии.
Что же касается заболеваний, в лечении которых планируется попробовать использовать CRISPR-Cas9, то их список достаточно обширен. Editas — одна из крупнейших и многообещающих компаний, разрабатывающих клинические продукты на основе CRISPR-Cas9, — решила сфокусировать свое внимание на заболеваниях, лечение для которых на настоящий момент практически отсутствует или является недостаточно эффективным (см. таблицу).
| Наши программы | Механизм редактирования | Способы доставки | Коммерческие права |
|---|---|---|---|
| Заболевания глаз | |||
| Амавроз Лебера | NHEJ — небольшие делеции | AAV локальная инъекция | Editas |
| Генетические и инфекционные заболевания глаз Синдром Ушера, вирус простого герпеса первого типа (HSV-1) | NHEJ | AAV локальная инъекция | Editas |
| Редактирование Т-клеток | |||
| Редактирование генов в Т-клетках для терапии рака | NHEJ | RNP ex vivo | Juno Therapeutics |
| Дополнительные исследовательские программы | |||
| Доброкачественные гематологические заболевания Бета-талассемия, серповидноклеточная анемия | HNJEJ & HDR | RNP ex vivo | Editas |
| Генетические заболевания мышц Миодистрофия Дюшенна | NHEJ — малые и большие делеции | AAV или LNP | Editas |
| Генетические заболевания легких Муковисцидоз | HNJEJ & HDR | AAV или LNP | Editas |
| Генетические и инфекционные заболевания печени Дефицит альфа-1-антитрипсина | HNJEJ & HDR | AAV или LNP | Editas |
Основные клинические направления, которые Editas выбрала для исследований, можно разделить на три группы.
В дополнительную группу также можно выделить инфекционные заболевания, например, герпетическое поражение глаз, для которых существуют методы лечения, однако они недостаточно эффективны или подразумевают сильное хирургическое вмешательство.
Для всех групп заболеваний в качестве корректирующего механизма Editas планирует использовать технологии, основанные на разных способах репарации ДНК после ее разрезания Cas9. Эти технологии включают в себя такие механизмы репарации, как негомологичное соединение концов (non-homologous end joining, NHEJ) и гомологичную рекомбинацию (homology directed repair, HDR) [16].
Старт клинических испытаний намечен на 2017 год, и Editas — не единственная компания, заявившая о них. Подобные схемы будущих испытаний уже предложили другие крупные компании — Intellia Therapeutics и Crispr Therapeutics.
Никто не застрахован от ошибок
Несмотря на громкий успех китайских исследователей, менее чем через неделю это событие оказалось омрачено печальной новостью из США. В ходе клинический испытаний, проводимых компанией Juno Therapeutics по редактированию Т-лимфоцитов пациентов с острым лимфобластным лейкозом, двое пациентов скончались по причине проявившихся осложнений после трансплантации редактированных клеток. На данный момент FDA — Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (Food and Drug Administration) — приостановило испытания до полного выяснения обстоятельств и причин гибели пациентов. Некоторые эксперты предполагают, что данный прецедент может серьезно ограничить Juno в дальнейших разработках технологии CAR (chimeric antigen receptor) для модификации иммунных клеток онкопациентов.
Случившиеся последовательно успех и неудача использования CRISPR-Cas9 в клинических испытаниях — хороший пример того, насколько сложен путь вхождения технологий геномного редактирования в практику для лечения реальных пациентов. Отбросив весь информационный шум, объективно можно сказать, что говорить об эффективности технологии, а главное о ее безопасности — довольно рано. Пока у нас нет данных успешных клинических испытаний с участием большого числа пациентов, ажиотаж вокруг развивающейся генной терапии будет подкрепляться исключительно общественными ожиданиями, но никак не реальными клиническими показателями. Тем не менее наши ожидания от технологий геномного редактирования огромны, и на настоящий момент представить ближайшее будущее без этих технологий довольно сложно (см. видео).
видео сделала группа Kurzgesagt и перевёл портал Naked Science
Читайте также:




