Что такое паллиативное лечение при раке пищевода
Рак пищевода представляет собой заболевание, при развитии которого на стенках органа образуется злокачественная опухоль. Это состояние весьма распространено, оно находится на шестом месте в списке наиболее часто встречающихся раковых патологий. Самым первым симптомом обычно становится затрудненное глотание во время употребления грубой пищи. Это объясняется сужением пищевода.
Симптоматика
- На первоначальном этапе, когда образование еще имеет небольшой размер, у пациента обычно отсутствуют какие-либо признаки рака. Однако потом начинает казаться, будто проглоченная еда застревает в пищеводе и ее надо запить жидкостью.
- Следующим симптомом является боль в области грудины. Еще через некоторое время пациент страдает от пищеводной рвоты или срыгивания, которое возникает из-за закупорки. В результате вся пища возвращается назад. Из-за застоя остатков продуктов появляется неприятный запах из ротовой полости.
- Когда опухоль распространяется на другие органы, может появиться одышка, сильная боль в грудине, осиплость голоса, утомляемость, сонливость и апатия.
Чтобы надеяться на благоприятный прогноз лечения, не следует игнорировать появление первых симптомов.

Стадии
- На предраковой стадии клетки располагаются на поверхности органа, не попадая вглубь стенок.
- На 1-й стадии раковое новообразование прорастает вглубь слизистой оболочки, но при этом не поражает мышечные ткани. Метастазирование отсутствует, однако опухоль хорошо заметна.
- На 2-й стадии могут появиться трудности во время глотания. Опухоль прорастает в мышечные ткани. Могут образоваться метастазы в соседних лимфатических узлах.
- Для 3-й стадии характерно выраженное нарушение глотания, резкое похудение. Новообразование прорастает сквозь все слои пищевода. Появляются метастазы на близнаходящихся лимфатических узлах и других органах.
- На 4-й стадии метастазы затрагивают отдаленные лимфоузлы и органы. Терапия на данном этапе развития заболевания затруднена, а прогноз будет неблагоприятным.

Методы лечения
Выбор лечения при злокачественных опухолях пищевода определяется типом и стадией рака, общим состоянием здоровья пациента, наличием у него сопутствующих заболеваний. На ранних стадиях обычно прибегают к хирургическому лечению после курса неоадъювантной химиолучевой терапии. На более поздних стадиях, когда удаление опухоли невозможно, химиолучевая терапия становится основным методом лечения.
Хирургическое лечение
Обычно хирургическое лечение при раке пищевода проводят после предварительного курса неоадъювантной химиолучевой терапии. Чаще всего выполняют эзофагэктомию: удаляют пораженный опухолью участок с захватом здоровой ткани выше и ниже. Затем оставшуюся часть пищевода соединяют с желудком. Если остался слишком короткий участок, который не удается подтянуть к желудку, используют отрезок кишки. Если рак находится в месте соединения пищевода с желудком, удаляют также часть желудка. Эзофагэктомию можно выполнить двумя способами:
- Классический вариант — открытая операция через разрез.
- При миниинвазивном вмешательстве хирург делает несколько небольших проколов и вводит через них специальные эндоскопические инструменты. Миниинвазивные вмешательства менее травматичны, после них быстрее происходит восстановление, но они возможны не всегда и требуют от хирурга специальных навыков, а от операционной — соответствующего оснащения.
Если опухоль не получается удалить, возможно паллиативное хирургическое лечение (о нём речь пойдет ниже).

Химиотерапия
При раке пищевода обычно назначают следующие комбинации химиопрепаратов: карбоплатин + таксол, цисплатин + 5-фторурацил, эпирубицин + цисплатин + 5-фторурацил, доцетаксел + цисплатин + 5-фторурацил, цисплатин + капецитабин, оксалиплатин + 5-фторурацил/капецитабин. Химиотерапия, как правило, не может полностью уничтожить опухоль. Обычно её применяют с другими целями:
- Перед хирургическим вмешательством, чтобы сократить размеры опухоли и упростить её удаление (неоадъювантная химиотерапия).
- После хирургического лечения, чтобы уничтожить оставшиеся раковые клетки и снизить риск рецидива (адъювантная химиотерапия).
- В качестве основного лечения, в сочетании с лучевой терапией, если опухоль невозможно удалить, либо имеются иные противопоказания к хирургическому лечению.
- В качестве паллиативного лечения, чтобы избавить от боли и облегчить глотание.
Новое направление в лечении рака пищевода — таргетная терапия
- В некоторых раковых клетках присутствует слишком много копий гена HER2. В итоге на их поверхности увеличивается количество молекул одноименного белка, который способствует их размножению. Заблокировать белок HER2 помогает препарат трастузумаб.
- Некоторые опухоли выделяют много вещества под названием VEGF, которое стимулирует рост новых сосудов, снабжающих раковые клетки кислородом и питательными веществами. В данном случае применяют таргетный препарат рамуцирумаб.
Лучевая терапия
Как и химиотерапия, лучевая терапия при раке пищевода бывает неоадъювантной, адъювантной, может (в сочетании с химиотерапией) выступать в качестве основного метода лечения, в том числе паллиативного.
Чаще всего процедуры проводят по классической методике: на определенном расстоянии от пациента устанавливают аппарат и направляют излучение на проекцию места, в котором находится опухоль. Иногда прибегают к брахитерапии: миниатюрный источник излучения при помощи эндоскопа помещают внутрь пищевода. При этом излучение уничтожает раковые клетки, но мало затрагивает здоровые ткани.
Борьба с осложнениями рака пищевода
Одно из основных осложнений рака пищевода на поздних стадиях — непроходимость, когда больному становится трудно глотать даже жидкую пищу. При этом врач может назначить разные виды паллиативного лечения:
- Может быть выполнена гастростомия или еюностомия. Хирургическим путем в стенке брюшной полости создают отверстие и подшивают к нему желудок или тощую кишку. Через получившееся отверстие (стому) больной получает питание в обход пищевода. Это помогает нормализовать вес и общее состояние, чтобы пациент мог перенести курс лучевой терапии и химиотерапии.
- Дилятация — искусственное расширение пищевода. В его просвет вводят специальный баллон в спущенном состоянии и, достигнув места сужения, раздувают его. Процедуру можно повторять.
- Стентирование — эндоскопическое вмешательство, во время которого в пищевод устанавливают стент — полый металлический каркас с сетчатой стенкой. Он расширяет просвет органа и позволяет нормально проходить пище.
- Фотодинамическая терапия предусматривает обработку опухоли специальным веществом — фотосенсебилизатором — с последующим облучением светом определенной длины волны. Это приводит к разрушению раковых клеток.
- Электрокоагуляция и криодеструкция — процедуры, во время которых опухолевую ткань, соответственно, разрушают при помощи электрического тока или низкой температуры.
Паллиативное лечение на поздних стадиях также включает химиолучевую терапию, которая помогает уменьшить опухоль и продлить жизнь больного, борьбу с болью и другими симптомами.
Каковы прогнозы на разных стадиях?
Шансы на победу над раком наиболее высоки, если опухоль находится в пределах стенки пищевода и не распространяется на соседние структуры. При этом пятилетняя выживаемость составляет 40–41%, то есть почти половина больных остаются живы спустя 5 лет после постановки диагноза.
При прорастании опухолевой ткани в соседние органы и лимфоузлы выживаемость падает почти вдвое — до 21–23%. При появлении отдаленных метастазов прогноз в большинстве случаев неблагоприятный, пятилетняя выживаемость составляет не более 4–5%.
*Импакт фактор за 2018 г. по данным РИНЦ
Журнал входит в Перечень рецензируемых научных изданий ВАК.
Читайте в новом номере
В статье обсуждаются разные методы паллиативного лечения рака пищевода. В частности, при опухолях до 2 см в диаметре на стадии Т1 лучшим методом является эндоскопическое разрушение. В 15% случаях на стадиях 1, 2А методом выбора является резекция пищевода. Лазерная деструкция опухоли и установка металлических стентов являются главными процедурами при эндоскопическом паллиативном вмешательстве.
Обсуждаются показания к установке стента и проведению лазерной фото-деструкции опухоли пищевода. Отмечается, что химио– и радиотерапия позволяет достичь значительного уровня выживаемости (30 – 38%), что практически сравнимо с показателями хирургических вмешательств, проводимых с лечебной целью.
Esophagial resection was the best method of choice in 15 percent of cases at stages 1, 2А. Laser destruction of a tumor and insertion of metallic stents are the main procedures during endoscopic palliative interventions. Indications for stent insertion and laser photo destruction of an esophagial tumor are also discussed. It is noted that radio chemotherapy enables high survival rate (30-38%) to be achieved, which is practically comparable with those from surgical interventions used in the treatments .
О.К. Скобелкин, З.А. Топчиашвили,
М.Ю. Тельных, М.Ю. Коньков
Научный центр лазерной медицины Минздрава РФ, кафедра пропедевтики внутренних болезней ММА им. И.М. Сеченова
O.K. Skobelkin, Z.A. Topchiashvili, M.Yu. Telnykh, M.Yu. Konkov
Research Center of Laser Medicine, Ministry of Health of the Russian Federation; Department of Internal Propedeutics, I.M. Sechenov Moscow Medical Academy
Е сли главной задачей консервативной хирургии рака пищевода является абсолютная ликвидация опухоли, то цель паллиативного лечения (при неполном устранении опухоли) – борьба с наиболее тяжелым симптомом – дисфагией, при достижении минимальной смертности и максимальной продолжительности жизни.
Паллиативное лечение и хирургия
Хирургическое устранение дисфагии осуществляется либо с помощью анастомоза, либо путем резекции пищевода. Описаны различные виды анастомозов. Резекция производится при трансторакальной или трансхиатальной эзофагоэктомии. Если поражается нижняя треть пищевода, применяется методика no touch, при которой резекция осуществляется en bloc. Резекция считается паллиативной, если остается какой-либо микроскопический компонент опухоли. Поэтому простая эзофагоэктомия с реконструкцией пищевода обеспечивает эффективное устранение дисфагии даже при неполном иссечении опухоли.
Излечение после хирургического вмешательства маловероятно, если отмечается смещение оси пищевода, значительное расширение средостения, увеличение лимфатических узлов (компьютерная томография) и наличие опухоли размером более 8 см.
При этом результаты наложения анастомоза и паллиативной резекции пищевода плохие и среднее время выживаемости не превышает 12 мес. Поэтому в настоящее время на смену паллиативной хирургии приходит паллиативное эндоскопическое лечение.
Паллиативное лечение и эндоскопия
В США и Европе все шире применяются эндоскопические паллиативные процедуры при раке пищевода [1, 9, 19, 29]. Чаще всего используется дилатация стенозированного просвета пищевода [25]. Среди различных методик (резиновые бужи, утяжеленные ртутью, металлические оливы, раздуваемые баллоны) по показателю безопасность/эффективность лучше всего себя зарекомендовали гибкие бужи Savry Gilliurd Silastic. Сама по себе дилатация не может считаться эффективным методом лечения дисфагии, однако она является ценным дополнением двух серьезных паллиативных процедур – интубации и разрушения опухоли. При невозможности выполнения паллиативных эндоскопических манипуляций альтернативой служит гастростомия.
Интубация с помощью пищеводного протеза
Введение пищеводного протеза является методом выбора при эзофагореспираторных фистулах и инфальтративных кольцевых опухолях в средней и нижней трети пищевода или кардии [4, 30]. Стенты, которые выполняются из пластика усиленной структуры, позволяют сохранять просвет пищевода диаметром от 9 до 12 мм. Они несжимаемы и при их установке отмечаются высокая частота заболеваемости и смертность. Поэтому в настоящее время предпочтение отдается расширяющимся металлическим стентам [22, 30]. Они выполняются либо в виде Z-образной сетки в модели Gianturio [30], вязанной сетки из тантала или различных сплавов, таких как железо с кобальтом или никель с титаном [2, 22], или пружины из никель-титанового сплава [10, 16]. Расширение стента после его установки может обеспечиваться с помощью различных механизмов: баллонной дилатации, механически с помощью проведения катетера через стент, перемещая давление с помощью сокращающейся мембраны или при растворении желатиновой оболочки фирмы “Nicrovasive”, когда стент постепенно расширяется в месте стеноза благодаря термической памяти сплава.
Расширяющиеся стенты очень эффективны благодаря их большому просвету (15 – 25 мм), их установка под контролем флюороскопии выполняется просто, требует легкой премедикации седативными препаратами и, кроме того, не всегда возникает потребность в предварительной дилатации. К недостаткам стентов можно отнести их высокую стоимость и постепенное сужение просвета через 2 мес после установки вследствие прорастания опухолью или развития воспаления. Попытка восстановить проходимость с помощью лазера, электрокоагуляции и дилатации обычно приводит к повреждению стента. Следует отметить, что проходимость просвета стента можно поддерживать в течение 1 года при использовании умеренной дилатации и химической некротизации. Металлические Z-образные или сетчатые стенты покрывают с обеих сторон силиконовой резиной для предотвращения прорастания опухолью и коррекции дыхательных фистул [27, 30].
Лазерная фотодеструкция и внутрипросветное разрушение
Процедурой выбора является лазерная фотодеструкция, которая обычно проводится с помощью термального Nd/Vag-лазера [7].
Основным осложнением является перфорация [7, 28]. Заболеваемость и смертность при лазерных процедурах значительно ниже, чем при использовании жестких стентов. Для паллиативного лечения рака пищевода применялась и нетермическая фотодинамическая лазерная терапия с применением производных фотофрина [13, 17]. Однако по сравнению с Nd/Vag – лазером соотношение безопасность/эффективность при этой процедуре не столь благоприятно.
Электрокоагуляция или резекция
Резекция с помощью петли помогает разрушать большие полиповидные опухоли. Обычно это предварительная манипуляция перед лазерной фотодеструкцией, которая позволяет сократить продолжительность процедуры при больших размерах опухоли. При этом можно использовать биполярный зонд Bicap, в котором сочетается электрокоагуляция и дилатация, однако в этом случае повышается риск возникновения перфорации. Аналогичная степень облегчения дисфагии [83 %] достигается с помощью обеих методик в проспективном исследовании на материале 128 больных [21]. Зонд Bicap следует применять только в том случае, когда невозможно использовать лазер (инфильтративные циркулярные опухоли) и нельзя подобрать стент.
Химическая некротизация опухоли
Химическая некротизация опухоли с помощью игольчатых катетеров при введении нескольких миллилитров чистого этанола является недорогой процедурой и, следовательно, высокоэффективной методикой как в сочетании с облучением Nd/Vag-лазером, так и при отсутствии источника лазерного излучения. Показанием к выполнению этой процедуры является наличие обтурационных опухолей пищевода. В настоящее время также изучается внутриопухолевое введение цитотоксических (пепломицин) или иммуноактивных ( стрептококковая суспензия ОК 432) препаратов. Однако эти процедуры предназначены скорее для воздействия на метастазы в лимфатические узлы как компонента радикальной операции, чем паллиативного вмешательства [12, 23].
Брахиотерапия
В качестве паллиативной терапии и компонента лечебных процедур сейчас предлагается внутриполостное облучение пищевода [6]. Облучение с помощью проволоки из иридия-192 или цезия-137 проводится аппаратом с дистанционным управлением в дозе 21 Гр за 3 процедуры с недельными интервалами [6]. Лазер– и брахиотерапия отличаются хорошей переносимостью [18]. Однако показания к их применению с паллиативной целью ограничены, так как зависят от доступности источника радиоактивного облучения.
Гастростомия
Несмотря на значительный прогресс в восстановлении проходимости просвета пищевода, установление обходного пути для пищи через гастростому по-прежнему необходимо при локализации опухоли в области верхнего пищеводного сфинктера или если над дисфагией преобладает анорексия. Причем в настоящее время процедурой выбора является чрескожная установка зонда, а предпочтителен эндоскопический контроль проведения зонда. В случае жесткого стеноза пищевода используется ультразвуковой контроль.
Эндоскопия и лечебные методики
Применение эндоскопических процедур для паллиативного вмешательства оправдано стремлением достичь полной эрадикации мелких опухолей (до 2 см в диаметре) на стадии T1 [14, 24]. При плоскоклеточном раке резекция производится с помощью прозрачной трубки, которая имеет щель на конце или боковое окно, либо с помощью наконечника, аналогичного инструменту для перевязывания сосудов пищевода, установленного на дистальном конце эндоскопа [14, 15]. Хорошие результаты отмечаются при применении ФДГ при раке пищевода либо изолированно, либо в сочетании с радиотерапией. При этом общая 5-летняя выживаемость составляет 21%. При аденокарциноме пищевода также рекомендуется применение ФДГ в случае поверхностного варианта опухоли [24].
Таблица 1. Сравнительные результаты паллиативного лечения рака пищевода (1-летний УВ)
Паллиативное лечение и радиоактивное облучение
Хотя радиоактивное облучение является одним их главных методов лечения рака пищевода [5, 11], в изолированном аспекте его эффект неполный и процент рецидивов очень высокий. Поэтому облучение как монотерапия сейчас не используется при раке пищевода, а применяется в сочетании с эндоскопическим лечением и химеотерапией [5, 8]. В стандартном варианте полный курс лечения включает дозу 2 Гр ежедневно по 5 дней в неделю в течение 5 нед. Прерывистые курсы с сеансами облучения в дозе 3 или 4 Гр рекомендуются при неоадъювантных схемах или для паллиативного лечения. В настоящее время существует тенденция к использованию фракционных 3-недельных курсов (1,5 – 2 Гр 2 раза в неделю). В табл. 1 представлены сравнительные результаты паллиативного лечения рака пищевода.
Как видно из табл. 1 , синергизм и увеличение УВ наблюдаются при эндоскопии с использованием Nd/Vag-лазера в комбинации с брахиотерапией и облучением. В настоящее время химио– и радиотерапия считается более предпочтительным методом по сравнению с проведением одного послеоперационного облучения.
Таблица 2. Нехирургическое лечение рака пищевода (2-летний УВ): сравнительные результаты изолированной лучевой терапии и в комбинации с химиотерапией
Паллиативное лечение и химиотерапия
У больных плоскоклеточным раком и аденокарциномой пищевода лечение только цитотоксическими препаратами дает положительный эффект лишь в 15 – 40% случаев. Поэтому более предпочтительными методами являются химиотерапия и радиактивное облучение [20, 26]. Для химиотерапии применяют такие препараты, как 5-ФУ, блеомицин, виндезин, митомицин и цисплатин. Однако наилучшее соотношение безопасность/эффективность наблюдается при применении сочетания 5-ФУ и цисплатина. При плоскоклеточном раке пищевода химио– и радиотерапия подавляет развитие опухоли в 25-40% случаев. Однако при этом побочные эффекты наблюдаются довольно часто, смертность составляет 3% [3]. В табл. 2 приведены результаты сравнительного лечения рака пищевода при изолированной лучевой терапии и ее комбинации с химиотерапией. При этом синергизм между химио– и радиотерапией нагляден. Поэтому назначение одновременно химиотерапии и облучения является разумной заменой эзофагоэктомии при первичном лечении плоскоклеточного рака пищевода. Аналогичное лечение эффективно и при аденокарциноме пищевода. В частности, хороший эффект при эндоскопии наблюдается в 70 случаях из 77 при плоскоклеточном раке пищевода и в 21 из 28 при аденокарциноме кардии [8].
С химио– и радиотерапией могут действовать синергично и другие факторы. В частности, при полипоидном варианте опухоли ее деструкция может быть усилена проведением сеанса лазерного облучения после химиотерапии [20].
1. При раке пищевода 1, 2А стадий, частота которого составляет примерно 15%, при отсутствии противопоказаний методом выбора является резекция пищевода. Прогноз после радикальной операции благоприятен и показатели общей выживаемости превышают таковые при нехирургических схемах лечения. При небольших опухолях (до 2 см в диаметре) на стадии Т1, если рак не выходит за пределы слизистой оболочки пищевода, приемлемой альтернативой является проведение эндоскопического разрушения опухоли.
2. При эндоскопическом паллиативном вмешательстве двумя главными процедурами являются лазерная деструкция опухоли и установка металлических стентов. Показаниями к установке стента являются циркулярный или инфильтративный характер опухоли, наличие эзофагобронхиальной фистулы, развитие стенотического фиброза после повторных процедур лазерного облучения. Показаниями к лазерной фотодеструкции служат нециркулярный, полиповидный характер опухоли, необходимость расширения просвета перед установкой стента, разрастание опухоли на проксимальный или дистальный конец нерасширяющегося стента.
3. Паллиативная хирургия – скорее резекция, чем наложение анастомоза, является лучшим методом паллиативного лечения дисфагии , однако прогноз очень плохой – низкое СВВ, значительный уровень вторичной заболеваемости. Поэтому предпочтение отдается менее инвазивным нехирургическим процедурам.
4. Радикальные неоперативные схемы лечения, основанные на химио– и радиотерапии, позволяют достичь значительный (30-38%) уровень выживаемости, что практически сравнимо с показателями хирургических вмешательств, проводимых с лечебной целью.
5. Существенное влияние на выбор лечебной тактики и решение вопроса о проведении операции при раке пищевода оказывает наличие сопутствующих заболеваний. При плоскоклеточном раке пищевода заболеваемость и смертность от сопутствующих заболеваний связана с алкогольным циррозом печени, кардиомиопатией или раком другой локализации. При аденокарциноме пищевода наиболее частым противопоказанием к оперативному лечению является престарелый возраст или хронический бронхит.
1. Bremner RM, DeMeester TR. Surgical treatment of Esophagela carcinoma. Gastroenteral Clin North Am, 1991;20:743-63.
2. Bethe N, et al. Self-expanding metal stents for pallation of malignant esophageal obstruction: A pilot study of eight patients. Endocopy 1992;24:411-5.
3. Coia LR, et al. Long term results of infusional SFU, mitomycin C and radiation US primary management of esophageal carcinoma. Int J. Radiat Oncol Biol Phys, 1991;20:29-36.
4. Cusumano A, et al. Push-through intubation: Effective palliation in 409 patients with cancer of the esophagus and cardia. Ann. Thorac. Surg. 1992;55: patients with cancer of the esophagus and cardia. Ann. Thorac. Surg. 1992;55:70-264.
5. Diehl LE. Radiation and chemotherapy in the treatment of esophageal cancer. Gastroenteral Clin North Am, 1991;20:74-765.
6. Ell C, et al. New bougie applicator system for intraluminal “high dose rate” afterloading radiotherapy of esophageal carcinoma. Endoscopy, 1993;25:236-9.
7. Fleischer D. Endoscopic treatment of upper gastrointestinal tumors. In: Jensen DM, Brunetand JM, eds., Medical laser endoscopy. Dordrecht: Kluwer, 1990:163-76.
8. Gill PG., Jamieson GG, et al. Treatment of adenocarcinoma of the cardia with synchronous chemotology and radiotherapy. Br J Surg, 1990;77:1020-3.
9. Gomes MN. Esophageal cancer:Surgical approach. In:Ahlgren J, Macdonald J, eds. Gastrointestionaloncology. Lippincott JB,1992:89-121.
10. Goldin E, Beyar M, et al. A new self-expandable, nickel titanium coil stent for esophageal obstruction: A preliminary report. Gastrointest Endosc., 1994;40:64-7.
11. Harter KW. Esophageal cancer: Management with radiation. In:Ahlgren J, Macdonald J, eds. Gastrointestinaloncology. Lippincott JB, 1992:123-34.
12. Hagiwara A. et al. Endoscopic local injection of a new drug-delivery format of peplomycin for superficial esophageal cancer: A pilot study. Gastroenterology, 1993;104:1037-43.
13. Heier SK, Bothman K, et al. Final results of a randomized trial: photodynamic therapy VS ND: Yag Laser therapy. Gastroenterology, 1993;104:A 408.
14. Inoue H, Endo M. Endoscopic esophageal mucosal resection using a transparent tube. Surg Endosc 1990;4:198-201.
15. Inoue H, Endo M. Endoscopic resection of early-stage esophageal cancer. Surg Endosc 1991;5:59-62.
16. Khyrim K., Wagner J, et al. A controlled trial of an expansile metal stent for pallation of esophageal obstruction due to inoperable cancer. N. Engl J. Med. 1993;329:1302-7.
17. Likier HM, et al. Photodynamic therapy for completely obstructing esophageal carcinoma. Gastrointest. Endosc 1991;34:75-8.
18. Low DE, Pagliero KM. Prospective randomized clinical trial comparing brachytherapy and laser photoablation for pallation of esophageal cancer. J Thoras Cardiovasc Surg 1992;104:173-8.
19. Lambert R, et al. Endoscopic management of upper gastrointestinal cancer. Gastroenteral Int, 1993;4:212-20.
20. Matsuda H, Baba K, et al. Hyperthermo-chemoradioterapy for patients with early carcinoma of the esophagus. Hepatogastroenterology, 1993;40:217-21.
21. Mannoury Y, Brunetaud JM, et al. Endoscopic pallation for inoperable malignant dysphagia: Long term Followup. 1992;33:1602.
22. Nephaus H, Hoffman W, et al. Implantation of self-expanding esophageal metal stents for pallation of malignant dysphagia. Endoscopy, 1992;24:405-10.
23. Nukai M, et al. Combination therapy of local administration of OK 432 and radiation for esophageal cancer. Int J Radiat Oncol Biol Phys 1992;1047-52.
24. Overholt B, et al. Photodynamic therapy for treatment of early adenocarcinoma in Barrett’s esophagus. Gastrointest Endosc, 1993;39:73-6.
25. Parker CH, Peurd DA. Palliative treatment of esophageal carcinoma using esophageal dilation and prothesis. Gastroenteral Clin North Am, 1991;20:717-29.
26. Sishy B, Rayn L, et al. Interim report of EST 1282 phase II protocol for evaluation of combined modalitieus in the treatment of patients with carcinoma of the esophagus stage I and II. Proc Ann Meet Am Soc Clin Oncol 1990;9:A407.
27. Schaer J, Katon RM, et al. Treatment of malignant esophageal obstruction with silicone-coated metallic self-expanding stents. Gastrointest. Endosc 1992;38:7-11.
28. Sander R, Poes LH. Cancer of the esophagus. Pallation: Laser treatment and combined procedures. Endoscopy, 1993;25:679-82.
29. Tytgat GN. Endoscopic therapy of esophageal cancer: possibilities and limitations. Endoscopy 1990;22:263-7.
30. Wu WC, Katon RM, et al. Silicone covered self-expanding metallic stents for the pallation of malignant esophageal obstruction and esophagoues piratory fistula: Experience in 32 patients and review of the literarure. Gastrointerest Endosc 1994;40:22-3.The paper discusses various palliative treatments for esophagial cancer. Endoscopic destruction is the best method used in tumors, as large as 2 cm in diameter at stage T1.
Общепризнано, что хирургическое лечение лучше всего подходит для лечения аденокарциномы пищевода (почти всегда это поражения нижней трети), в случае если повреждения операбельны. В большинстве других случаев, особенно для поражений в верхней трети и шейной части пищевода, лучшим выбором лечения является сочетание химиотерапии и лучевой терапии. Хирург или радиотерапевт должен определить тип лечения (радикальное или паллиативное) до начала местной терапии.
При продумывании радикальной хирургической операции для пациентов, которые в целом подходят для нее и не имеют признаков отдаленного метастазирования, важно определить степень поражения до проведения окончательной резекции. Для этого рекомендуется пробная лапаротомия, ставшая обычной частью многих операций, когда восстановление достигается путем перемещения (транспозиции) ободочной кишки и создания тем самым жизнеспособного канала между глоткой и желудком.
Радикальное удаление пищевода, проведенное Черни (Czerny) впервые более 100 лет назад, проводится в настоящее время в одну стадию с желудочно-пищеводным анастомозом или перемещением (транспозицией) ободочной кишки. Раньше при проведении операций оставляли постоянную гастростому для обеспечения питания.
Только меньшая часть больных раком пищевода могут быть радикально оперированы, самое частое показание к такой операции — поражения средней или нижней трети пищевода, особенно если по гистологии это поражение представляет собой аденокарциному, при этом подходят больные без явных признаков наличия метастазов. До недавнего времени практически не было указаний на то, что предоперационная лучевая терапия или химиотерапия оказывает влияние на степень радикальности резекции, коэффициенты смертности при операции или суммарного выживания.
Но в недавнем крупномасштабном исследовании в Великобритании показано поразительное улучшение при применении предоперационного сочетания химиотерапии (цисплатином и фторурацилом) с лучевой терапией. Коэффициенты выживаемости за 2 года составили 43% и 34% (с использованием химиотерапии и без нее); медиана коэффициентов выживаемости (с применением химиотерапии) равнялась 16,8 месяца по сравнению с 13,3 месяца (без нее). Данные предыдущих исследований были неутешительны.
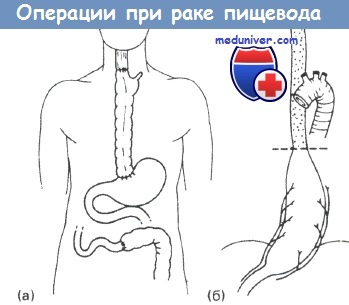
Операция при раке пищевода:
(а) полное удаление пищевода с замещением ободочной кишкой;
(б) мобилизация желудка и низведение в случае карциномы нижней трети пищевода.
Для больных карциномой верхней трети пищевода в качестве лечения обычно выбирают лучевую терапию, однако некоторые врачи склоняются в этом случае к хирургическому лечению. Рандомизированного сравнения этих типов лечения не проводилось. Сочетания химиорадиотерапии сейчас считаются гораздо более эффективными, чем только лучевая терапия.
Лучевая терапия (с сопутствующей химиотерапией или без нее) по сравнению с операцией обладает рядом преимуществ, в том числе более широкой применимостью (ведь большинство больных находятся в пожилом возрасте и плохо питаются), возможностью избежать ларингэктомии, а также значительным облегчением дисфагии для большинства пациентов, с излечиванием, как минимум, 10% пациентов из способных перенести высокие дозы: всего 60 Гр ежедневными порциями в течение 6 недель. К тому же хирургическое лечение характеризуется смертностью приблизительно на уровне 10% (рис. 14.6), оно в отличие от лучевой терапии не подходит для больных с региональным распространением болезни.
И действительно, в классическом обзоре приводится коэффициент смертности, равный 29% по больным во всем мире, получавшим лечение в 1970-е годы, правда, смертность при операциях снизилась с улучшением подбора больных, хирургической техники и поддерживающего лечения. Несмотря на плохие общие результаты, при операции есть преимущество — временное облегчение может быть очень хорошим, а также, как и при лучевой терапии, в некоторых случаях это может привести к излечиванию.
Верхнюю треть пищевода технически сложно подвергнуть облучению из-за длины области обработки и близости спинного мозга. Зоны облучения в идеальном случае должны простираться, как минимум, на 5 см выше и ниже от известных пределов распространения болезни, чтобы адекватно обработать возможное распространение поражения в подслизистом слое стенки. Как и при постперстневидных карциномах, здесь нередко требуется применение сложных технических приемов, с использованием переплетенных, заклиненных, наклонных, множественных полей облучения, часто с компенсаторами (трансформаторами).
Также необходимо тщательное планирование облучения на двух или трех уровнях, чтобы ткань цилиндрической формы получила одинаковую высокую дозу радиации, но при этом чтобы не произошло сверхоблучения прилегающего спинного мозга.
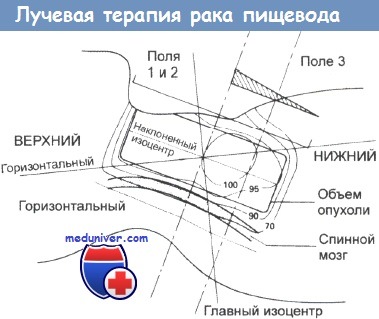
Радикальная лучевая терапия в случае карциномы шейного отдела пищевода.
В связи с несимметричной анатомией необходим план сложного многопольного облучения.
При опухолях средней трети пищевода в качестве основного лечения все больше и больше применяется лучевая терапия, иногда в сочетании с операцией. Некоторые хирурги полагают, что операция протекает легче, и долговременные ее результаты лучше при проведении предоперационного облучения. В техническом плане предоперационную и радикальную лучевую терапию опухолей средней трети пищевода проводить легче, чем опухолей верхней трети пищевода. Как и в отношении опухолей верхней трети пищевода, в настоящее время синхронная химио- и лучевая терапия широко применяются для средней трети пищевода; в нашем центре стандартом лечения является сейчас комбинация митомицина С и 5-ФУ.
В случае рака нижней трети пищевода часто предпочтительна операция, при этом реконструкция, обычно проводимая с мобилизованным желудком, менее сложна.
При раке нижней трети пищевода существует риск того, что желудок будет затронут опухолью и окажется не подходящим для проведения реконструкции. Для неоперабельных опухолей полезной может быть лучевая терапия.
Осложнения при лечении опухолей всех отделов могут быть непростыми или даже тяжелыми как в случае лучевой терапии, так и при операции. Радикальная лучевая терапия часто сопровождается радиационным воспалением пищевода (эзофагитом), требующим лечения щелочными или аспирин-содержащими суспензиями для местного воздействия на воспаленную слизистую пищевода.
Возможные более поздние осложнения включают радиационное повреждение спинного мозга и легких, что ведет к радиационному пульмониту и иногда одышке, кашлю и уменьшению дыхательной емкости, но в повседневной практике такие явления редки. Фиброз и рубцевание пищевода приводят к его стриктуре, из-за чего может потребоваться расширение для сохранения раскрытого состояния пищевода. Несмотря на вышеизложенные факты, большинство больных переносят такое лечение на удивление хорошо, даже при применении химиотерапии.
К хирургическим осложнениям относятся стриктура пищевода и несостоятельность анастомоза, в результате этого — медиастинит, пульмонит и сепсис, иногда приводящие к смерти больного.
У больных с дисплазией высокой степени в пищеводе Барретта многообещающим оказалось использование фотодинамической терапии. Пока еще данные собраны по небольшому числу больных, но такой способ лечения уже признан Национальным институтом клинического искусства (NICE) подходящим в некоторых случаях.
Паллиативное лечение при раке пищевода может быть очень полезным с применением Целестинского или другого постоянного протеза, лучевой терапии или лазерного лечения (а также их обоих), или иногда при обходной операции, без попытки удалить место первичной опухоли, но с созданием альтернативного канала. Для пациентов, которых нельзя подвергать радикальной операции и лучевой терапии, нужно всегда рассматривать возможность паллиативного лечения, особенно в случаях тяжелой дисфагии. Умеренные дозы облучения могут приводить к выраженным клиническиим улучшениям.
В опытных руках проведение Целестинской или растяжимой пищеводной трубки с металлической сеткой является относительно безопасной и эффективной процедурой, которую можно сочетать с лучевой терапией. Распространенные проблемы при введении трубки включают ее перемещение, желудочно-пищеводный свищ (иногда связанный с попаданием в легкие содержимого желудка), загрудинные боли и дискомфорт. Осложнения при паллиативном облучении минимальны, так как используются низкие дозы: обычно благотворно влияет лечение дозой 30 Гр на протяжении 2-недельного периода, если дисфагия не тотальная, и высокие дозы редко бывают нужны. В нашем центре широко используется внутрипищеводная брахитерапия, предлагающая простую и быструю альтернативу.
С начала 1990-х годов все больше возрастает роль лазерной терапии, которую можно применять в сочетании с лучевой терапией. При этом сразу восстанавливается способность глотать, иногда даже после первого сеанса, и процедуру легко можно повторять. Для больных с нерезектабельной опухолью такое лечение бывает наилучшим и наименее травматичным способом для временного облегчения.
Интересным дополнением к применению лазерной терапии стала идея фототерапии. При этом до начала лазерной терапии больной получает производные фталоциамина, которые захватываются преимущественно опухолью, что повышает избирательность лечения.
Читайте также:

