Безоперационное лечение онкологии печени

Демография заболевания
Частота вторичного рака печени (метастазы, образовавшиеся в результате распространения раковых клеток из первичной опухоли, локализованной в другом органе) в 20-50 раз выше, чем риск развития первичного рака печени. Печень наиболее уязвима к развитию метастазов рака: более, чем в трети случаев они появляются именно в печени. Наиболее частой первичной локализацией рака при метастатическом раке печени является желудок, толстая кишка, легкие и почки.
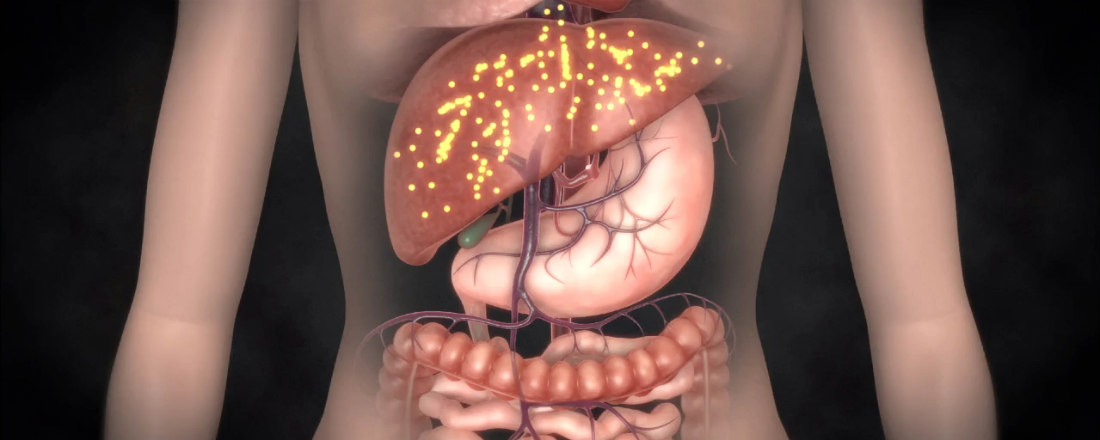
Гепатоцеллюлярная карцинома
Гепатоцеллюлярная карцинома является самой расространенной формой рака печени, и является причиной примерно 90% первичных злокачественных опухолей печени у взрослых. Он развивается из гепатоцитов, которые составляют большинство клеток в ткани печени.
Другие виды первичного рака печени включают в себя холангиокарциному, исходящую из мутировавших эпителиальных клеток желчных протоков, гипобластому у детей и ангиосаркому, развивающуюся в результате воздействия токсинов или ядовитых веществ.
- Цирроз (разрушение клеток печени вследствие фиброзных поражений, вызванных длительным раздражением клеток. Особенно часто возникает при злоупотреблении алкоголем или гемохраматозе) является главным фактором риска развития рака печени; около 90% заболеваний ГЦК диагностируется у людей с циррозом;
- Хроническая форма вируса гепатита В и/или гепатита С в сочетании с циррозом печени;
- Ожирение (неалкогольная жировая болезнь печени [НЖБП] и неалкогольный стеатогепатит [НАСГ]);
- Диабет;
- Курение;
- Потеря веса (без причины, а также ненамеренно);
- Потеря аппетита;
- Ощущение сытости даже после небольшого приема пищи;
- Припухлость на правой стороне, чуть ниже грудной клетки;
- Боль в правой лопатке ;
- Пожелтение кожи или белков глаз (желтуха);
- Дискомфорт в верхней правой части живота;
- Необычная усталость;
- Тошнота.
Обстоятельства выявления рака печени могут быть абсолютно разными.
- Рак печени может развиваться на протяжении длительного периода времени и быть выявлен в результате обследования на иное гастроэнтерологическое заболевание с более высоким риском развития (цирроз, хронический гепатит);
- Рак может вызвать неспецифические симптомы заболевания печени, такие как боль в животе, жар, тошнота, рвота, диарея, потеря веса, усталость и т.д.
Рак печени может также быть обнаружен в результате проявления таких осложнений как желудочно-кишечное кровотечение, желтуха (пожелтение кожи), асцит (накопление жидкости в брюшной полости) или энцефалопатия. Кроме того, первичный рак печени может быть обнаружен после изучения истории болезни пациента и его родственников, а также после физического осмотра пациента. Диагноз рак печени ставится на основании следующих показателей:
- Уровень альфа-фетопротеина (АФП) в сыворотке крови: АФП - это гликопротеин, вырабатываемый некоторыми видами опухолей печени. Полезен при выявлении первичного рака печени, так как повышен у 60-90% пациентов.
- Данные УЗИ, КТ и МРТ: Для визуализации опухоли применяется ультразвуковое исследование (УЗИ) печени, компьютерная томография (КТ), магнитно-резонансная томография (МРТ). Ангиография сосудов печени полезна в случаях диагностической неопределённости, а также для изучения сосудистой анатомии во время планирования операции.
- Результаты биопсии печени: в тех случаях, когда характерные особенности изображения связаны с повышенным уровнем АФП, диагноз очевиден. Также биопсия может быть включена в список процедур перед пересадкой печени.
Лечение рака печени зависит от стадии заболевания, функционирования печени и общего состояния здоровья пациента. Поздние стадии рака ограничивают пациентов в выборе методов лечения. Хирургия является единственной лечебной альтернативой для пациентов с раком печени. Если заболевание обнаружено на ранней стадии (одна опухоль до 5 см или несколько меньших, до 3 см), и если остальная часть печени не поражена, то хирургия с пересадкой или без пересадки печени поможет вылечить пациента. Однако, лишь в 15% опухоль является операбельной. Для неоперабельных пациентов лечение носит паллиативный характер и ограждает от риска заражения инфекцией во время операции, а также стремиться улучшить качество жизни больного.
Существует пять методов лечения рака печени: хирургическая резекция, интервенционная радиология, лучевая терапия, химиотерапия и чрескожная инъекция этанола. К сожалению, эти методы лечения не защищают от риска развития рецидива или других неблагоприятных исходов.
- Различные типы хирургии, используемые для лечения рака печени включают в себя:
- Частичная гепатэктомия (удаляется пораженная раковыми клетками часть печени);
- Гепатэктомия с пересадкой печени (полное удаление больной печени и пересадка здорового донорского органа);
- Частичное удаление - опухоли могут быть уничтожены местно, без их удаления следующими способами:
- Криохирургия или криотерапия - используется для заморозки и разрушения раковых тканей;
- Радиочастотная абляция - зонд, оснащённый электордами, обнаруживает и уничтожает раковую ткань;
- Высокочастотный ультразвук;
- Инъекция этанола: введение этанола через тонкую иглу непосредственно в опухоль для уничтожения раковых клеток.
- Различные типы лучевой терапии включают в себя:
- Дистанционная лучевая терапия, осуществляемая с помощью линейного укорителя, который воздействует на раковую ткань через кожу;
- Контактная лучевая терапия, поражающая раковые образования при использовании инъекций или катетеров;
- Радиоиммунотерапия: пациенту вводятся меченые антитела с вживленными радиоизотопами для обнаружения и/или уничтожения раковых клеток.
- Системная и местная химиотерапии могут быть в виде инъекций или приниматься перорально;
- В случае трансартериальной химиоэмболизации химиотерапевтический препарат вводят непосредственно в артерии, воздействуя на опухоль печени. Кроме того, вводится другой препарат для эмболизации (блокирования) притока крови к опухоли, а также позволяет ограничить зону воздействия препарата.
Как отмечалось ранее, хирургическое вмешательство может быть применено для лечения ГЦК, однако, операбельны менее 20% пациентов. Возможности частичного удаления или трансплантации печени зачастую ограничены состоянием неопухолевой паренхимы, размером поражения или сопутствующими заболеваниями пациента.
Несмотря на то, что хирургическое вмешательство является также стандартом лечения и для вторичного рака печени, в 90-95% случаев пациенты неоперабельны из-за метастатических поражений, недостаточной функции печени и/или общего состояния здоровья пациента. Кроме того, радиочувствительность неопухолевой ткани печени также ограничивает возможность облучения зоны поражения при помощи обычных методов лучевой терапии.
В исторической практике лучевая терапия редко применялась для лечения рака печени из-за высокого риска осложнений на ЖКТ и развития радиационно-индуцированных заболеваний, вызывающих летальный исход. Кроме того, частичное облучение усложняется из-за движений, связанных с дыханием пациента, примерный диапазон которых составяет 2 см.
Роботизированная радиохирургия на системе КиберНож Кибер Нож позволяет точно доставить необходимую дозу облучения непостредственно в место поражения, при этом не воздействуя на здоровые участки ткани печени. Таким образом, радиохирургическая абляция печени является более эффективной и точной, чем обычная лучевая терапия, и менее инвазивной, чем хирургическая резекция, радиочастотная абляция или криохирургия. Кроме того, при радиохирургической абляции сохраняются паренхимы печени и верхних отделов пищеварительного тракта.
Роботизированная радиохирургия является перспективной и неинвазивной альтернативой для лечения рака печени у тех, кому хирургическое вмешательство противопоказано. Ответ на лечение ГЦК наблюдается в 60-90% случаев. При вторичном раке печени, в течение 12 месяцев в 75-90% случаев удается замедлить рост и уменьшить размер опухоли, если это 1-3 небольших опухолей или одна опухоль до 6 см в диаметре.
Благодаря тому, что роботизированная хирургия на аппарате КиберНож Кибер Нож не воздействует на здоровые участки печени, после операции функция печени нарушается незначительно или вовсе не нарушается. Чаще всего, после операции у пациентов наблюдаются следующие побочные эффекты: астения (40-50%) и тошнота (20-30%). Кроме того, поздние лучевые осложнения наблюдаются менее чем в 5% случаев.
Таким образом, неинвазивное лечение на КиберНоже Кибер Нож может обеспечить благоприятный терапевтический эффект без ухудшения качества жизни пациентов.
В каждом отдельном случае стоимость определяется на основании показаний к лечению, необходимого количества фракций и плана лечения разработанного врачом радиационным онкологом и медицинским физиком.
Кроме того, следует отметить, что роботизированная радиохирургия может сочитаться с трансартериальной химиоэмболизацией в тех случаях, когда комбинация этих методов лечения безопасна и необходима для пациента.
Цена, руб.
- О центре
- Специалисты
- Новости
- Партнеры
- Отзывы
- Запись на приём
- Стоимость лечения
- Консультация
- Диагностика
- FAQ
- Статьи
- Аппарат Кибернож
- Уникальность системы
- Показания к лечению
- Противопоказания
- Как происходит лечение
- Сравнение методов
- Дистанционная
- Комбинированное лечение
- Лечение
- Опухоли головного мозга
- Рак легкого
- Рак печени
- Рак почки
- Рак предстательной железы
- Рак носоглотки
- Опухоль спинного мозга
- Опухоль ЦНС у детей
- Рак поджелудочной железы
- Опухолевое поражение костей
- Метастазы
- Невралгия тройничного нерва
- Пяточная шпора

Выбор метода лечения обусловлен размерами и локализацией первичной опухоли, наличием метастазов в печени и других органах, состоянием ткани печени и самого пациента. Поэтому терапия подразделяется на две линии: при наличии цирроза печени и при отсутствии цирроза.
Профилактической терапии, способной снизить риск рецидива печёночно-клеточного рака и продлить жизнь, к сожалению, не существует.
- Хирургическое лечение рака печени
- Клинический случай
- Современные методы локального воздействия на рак печени
- Радиочастотная аблация печени (РЧА)
- Криодеструкция опухоли
- Трансартериальная химиоэмболизация (ТАХЭ)
- Трансартериальная радиоэмболизация (ТАРЭ)
- Химиотерапия при раке печени
- Цены в Европейской онкологической клинике на лечение рака печени
Хирургическое лечение рака печени
Даже при современном развитии медицины без хирургического воздействия невозможно вылечить злокачественную опухоль, и рак печени не исключение.
Операцию делают невозможной:
- метастазы в печень;
- метастазы в другие органы и ткани;
- низкие функциональные возможности печени и почек;
- тромбоз воротной вены.
Объём вмешательства зависим от распространения поражения печени. Без сопутствующего цирроза при раннем раке – небольшой опухоли до 5 см - методом выбора считается резекция печени.
При вовлечении в опухоль участков обеих долей печени на стороне максимального поражения выполняется гемигепатэктомия, в доле с меньшим повреждением предпочтительно локальное воздействие: экономная резекция, радиочастотная аблация или криодеструкция.
Большой объём опухоли на фоне цирроза поставит вопрос о трансплантации печени. При ожидании трансплантации возможно локальное воздействие на опухоль, в том числе аблация, эмболизация и парциальная резекция печени.
Клинический случай
В Европейскую онкологическую клинику обратился за помощью пациент 46 лет с диагнозом рак прямой кишки, метастатическое поражение печени. Осложнения: кишечная непроходимость. 27 апреля 2016 года пациенту была проведена паллиативная лапароскопическая передняя резекция прямой кишки, удаление метастаза левой доли печени, резекция 2 сегмента печени с опухолевым узлом. Гистологическое исследование показало низко- и умеренно-дифференцированную аденокарциному прямой кишки.
Учитывая изолированное метастатическое поражение печени, гипоплазированную левую долю печени, решено выполнить ALPPS резекцию. 3 сентября 2016 выполнен первый этап ALPPS — резекции печени in situ. 10 сентября 2016 проведён второй этап операции — расширенная правосторонняя гемигепатэктомия (+SIVа) после ALPPS, атипичная резекция SIVb. Пациент выписан через 5 суток, запланировано проведение химиотерапии. Читайте подробнее об уникальной операции по резекции печени.
Современные методы локального воздействия на рак печени
При единственной опухоли или единичных узлах опухоли не более 3 см, не подлежащих оперативному лечению, выполняют локальную деструкцию: радиочастотную или микроволновую аблацию, криодеструкцию.
Радиочастотная аблация печени (РЧА)
Предпочтительным и наиболее часто используемым методом считается радиочастотная аблация. Этот вариант термической деструкции применяется при:
- раннем гепатоцеллюлярном раке до 3см;
- рецидиве опухоли;
- с паллиативной целью при узле до 5 см;
- единичных опухолевых узлах, числом не более 5.
Противопоказания почти такие же, как и для хирургического вмешательства, но менее жёсткие: отдалённые метастазы, декомпенсированный цирроз печени, не купируемый асцит, энцефалопатия, наличие кардиостимулятора, выраженные нарушение свёртываемости крови и активное желудочное кровотечение, и конечно, прилежание опухоли к другим органам и крупным желчным протокам.
Наилучший результат достигается при небольших опухолях, особенно, при возможности термического воздействия на окружающую ткань, хорошем доступе к узлу во время РЧА. Лечение эффективно, когда удаётся добиться 100% некроза опухоли. Пятилетняя выживаемость пациентов с компенсированным циррозом и ГЦР менее 5 см в диаметре достигает 60%.
Вероятность осложнений есть, но она менее 10%, главное – они не фатальны для больного и устранимы. Нередко РЧА комбинируют с другими методами локального воздействия, в частности, с трансартериальной химиоэмболизацией.
Выполняется также микроволновая аблация - манипуляция аналогична РЧА, но с другой частотой волны. Показания и противопоказания схожи.
Криодеструкция опухоли
Криодеструкция - прямое воздействие жидкого азота, охлаждающего ткани до температуры минус 180°С. Непосредственное охлаждение опухоли с помощью специального устройства вызывает гибель клеток, а в окружении опухоли формируются микрососудистые тромбы, которые усугубляют повреждение за счёт дополнительного нарушения её питания.
Во время манипуляции, которую могут выполнять через кожу или во время операции, к опухоли подводится специальный аппликатор, охлаждаемый до минус 180°С. Криодеструкция позволяет лечить опухоли больших размеров.
О комплексном подходе в лечении рака печени рассказывают врачи Европейской онкологической клиники Бурдюков М.С. и Бобров Б.Ю.

Трансартериальная химиоэмболизация (ТАХЭ)
Химиоэмболизация - ведущий метод локорегиональной терапии ГЦР, применяемый в первой линии паллиативной терапии не подлежащего операции опухолевого процесса без признаков вовлечения сосудов и внепечёночных проявлений заболевания - метастазов.
Наилучший эффект ТАХЭ достигается при невыраженном циррозе и сохранной функцией печени, но при тромбозе воротной вены и выраженном циррозе эмболизация не выполняется.
Микросферы блокируют кровоток в питающих опухоль сосудах, не вовлекая крупных ветвей печёночной артерии, поэтому оказывают максимальный терапевтический эффект при минимизации нежелательных последствий эмболии.
Трансартериальная радиоэмболизация (ТАРЭ)
Почти аналогичная ТАХЭ манипуляция, но на поверхности микросфер располагается радиоактивный изотоп иттрия-90. При ТАРЭ эмболизирующее действие микросфер сочетается с локальным облучением опухоли печени.
Лучевая терапия рака печени в клинической практике, вне научных исследований, почти не применяется
Химиотерапия при раке печени
Современные возможности лекарственной терапии рака печени ограничены, поскольку опухоль устойчива к цитостатикам. Как правило, химиотерапия печени используется при противопоказаниях к локальным методам воздействия, метастазах внепечёночной локализации и при прогрессировании после локального воздействия.
Основная цель лечения - увеличение продолжительности жизни, а достоверно её увеличивает только сорафениб. Иные химиопрепараты и их комбинации демонстрируют эффективность в 20% случаев, но не влияют на длительность жизни больных.
При циррозе печени переносимость химиотерапии ухудшается, что ограничивает возможности активного лечения. При хроническом гепатите В или носительстве вируса к химиотерапии присоединяют противовирусные препараты. Но при хроническом гепатите С нет нужды в противовирусной терапии, зато вероятность гепатотоксичности и развития лекарственного гепатита очень высоки, поэтому проводят их профилактику. В рекомендациях отмечена неэффективность эссенциальных фосфолипидов - широко распространённого в России Эссенциале®.
В научной литературе не доказали, что применение аналогов соматостатина увеличивает продолжительности жизни, но на нём могут регистрировать уменьшение опухоли. Интерферон-2α в стандартных дозах бесполезен, но оказывает небольшой эффект в сочетании с химиотерапией.
При наличии противопоказаний к химиотерапии при раке печени мы проводим симптоматическую терапию, направленная на повышение качества жизни и улучшение самочувствия пациента.

Рак печени – одно из самых опасных онкологических заболеваний. Лечить его зачастую очень сложно. Даже на ранних стадиях, когда опухоль не распространяется за пределы печени, пятилетняя выживаемость составляет всего 31%. Если опухоль проросла в соседние ткани, этот показатель снижается до 11%, а если появились метастазы – до 3%.
В лечении рака печени есть немало проблем. Далеко не всем пациентам может быть выполнена операция. Зачастую недостаточно удалить пораженную часть печени, требуется трансплантация, при этом существует жесткий дефицит донорских органов. Многим больным приходится подолгу ждать. При раке печени практически неэффективна системная химиотерапия. Печеночные клетки – гепатоциты – разрушают химиопрепарат, поэтому нужны большие дозы, которые вызывают тяжелые побочные эффекты.
Тем не менее, не все так плохо. Врачи и ученые находят возможности справляться с проблемами, появляются новые методы лечения. Многие из них доступны в России.

Химиотерапия

В настоящее время существуют технологии, которые помогают доставлять химиопрепараты прямо в опухоль в печени. Главное преимущество таких процедур в том, что лишь небольшое количество препарата поступает в общий кровоток, поэтому побочные эффекты минимальны. Это позволяет применять намного большие дозировки, чем при системной химиотерапии. Проблема разрушения химиопрепарата клетками печени становится неактуальной.
- При внутриартериальной химиотерапии в области паха делают прокол, вводят в бедренную артерию катетер, проводят его в сосуд, питающий опухоль, и вводят химиопрепарат.
- Некоторым пациентам выполняют химиоэмболизацию. В питающий опухоль сосуд помещают катетер, через него вместе с химиопрепаратом вводят эмболизирующий препарат. Последний состоит из особых микроскопических частиц – микросфер, которые перекрывают просвет сосуда. Опухолевые клетки перестают получить кислород, питательные вещества, и погибают. Современные эмболизирующие препараты позволяют проводить процедуру максимально эффективно и безопасно. Нормальная ткань печени не страдает, потому что она получает питание из другого сосуда.
Таргетная терапия
Таргетные препараты блокируют жизненно важные для раковых клеток молекулы. При раке печени эффективны три таргетных препарата:
- Сорафениб (Нексавар) блокирует ферменты-киназы, которые задействованы в процессе образования новых кровеносных сосудов, запрограммированной клеточной смерти. Препарат применяется при неоперабельном раке печени.
- Регорафениб (Стиварга) также ингибирует киназы, тем самым подавляя размножение раковых клеток и рост новых кровеносных сосудов в опухолевой ткани. Его рекомендуется применять в случаях, когда неэффективен сорафениб.
- Кабозантиниб (Кометрик) является ингибитором фермента-тирозинкиназы с-Мет и сосудистого эндотелиального фактора роста 2 (VEGFR2). В исследованиях было показано, что этот препарат подавляет прогрессирование рака печени и снижает риск гибели пациента.
Что нового в хирургическом лечении рака печени?

В настоящее время ученые оценивают возможности адъювантной и неоадъювантной терапии, пытаются понять, могут ли они улучшить результаты хирургического лечения.
Многообещающие результаты были получены во время исследований молекулярно-генетических характеристик опухолевых клеток печени. Возможно, в ближайшем будущем врачи смогут, отправив опухолевую ткань на анализ, определить, у кого из пациентов после операции повышен риск рецидива, и какими способами его можно снизить.
Для того чтобы пациенту могла быть выполнена трансплантация печени, должны быть соблюдены некоторые условия. Нужно, чтобы опухоль имела небольшие размеры (один очаг менее 5 см или 2–3 очага менее 3 см каждый) и не вторгалась в кровеносные сосуды. Показания ограничены, в настоящее время ученые ищут способы их расширить.

Лучевая терапия
Главная проблема лучевой терапии при раке печени в том, что ионизирующее излучение сильно повреждает здоровые печеночные клетки. Ученые ищут способы избежать этого. В настоящее время изучается возможность применения брахитерапии – процедуры, во время которой источник излучения в виде небольшой гранулы внедряют прямо в печень через специальный катетер. Это помогает минимизировать воздействие на окружающие здоровые ткани.
Аблация
Метастазы в печени можно уничтожить с помощью радиочастотной аблации (РЧА) – процедуры, во время которой в узел вводят иглу-электрод и подают на нее ток высокой частоты. Опухолевая ткань сильно нагревается и погибает. Для того чтобы можно было провести РЧА, должны быть соблюдены некоторые условия:
Восстановление оттока желчи
Одно из распространенных осложнений первичного и метастатического рака печени – нарушение проходимости желчных протоков и оттока желчи. Раньше эту проблему решали с помощью дренирования: в желчные протоки устанавливали специальную тонкую гибкую трубку – дренаж. Это помогало улучшить состояние, но постоянно носить дренаж не очень удобно. За ним нужно правильно ухаживать, он раздражает брюшную стенку, то и дело норовит сместиться или выпасть.
Более современное решение – стент. Это такой цилиндрический полый каркас с сетчатой стенкой, обычно изготовленный из металла. Стент устанавливают в желчные протоки эндоскопически, через двенадцатиперстную кишку, или, если это невозможно – прямо через кожу, во время чрескожной чреспеченочной холангиографии. Стент расширяет просвет желчного протока и восстанавливает отток желчи, при этом не причиняет неудобств пациенту.
Где в Москве можно получить самое эффективное лечение при раке печени?
В России есть клиники, которые специализируются на лечении рака, используют современные высокотехнологичные методы лечения. Мы сможем подобрать для вас такую клинику и врача-специалиста, ведь мы сотрудничаем с лучшими онкоцентрами страны:
- Отделение анестезиологии и реанимации
- Метастазы рака
- Химиотерапия
- Хоспис для онкологических больных
- Иммунотерапия в центре платной онкологии Медицина 24/7
- КТ-исследования
- МРТ-исследования
Лечение рака печени за последнее десятилетие изменилось благодаря инновационным технологиям, тем не менее в 2017 году диагноз был установлен 8 796 взрослых россиян, а умерло от злокачественного заболевания 9 959. И подобная ущербная динамика прослеживается не один год, что свидетельствует о не слишком успешной противоопухолевой терапии и невысокой продолжительности жизни пролеченных.
Основное большинство в 58% на момент обнаружения имеет 4 стадию заболевания, ещё 22.5% с 3 стадией карциномы не лишены шансов на жизнь, но только у каждого седьмого при благополучном стечении клинических обстоятельств есть хорошие перспективы на будущее.

Принципы лечения рака печени
Единственный радикальный способ лечения гепатоцеллюлярной карциномы — хирургический, успешность химиотерапии не высока, лучевая терапия не нашла широкого применения в клинической практике из-за невозможности её использования при циррозе, слишком частом у этой категории больных.
Особенность развития карциномы печени — наличие хронического печеночного заболевания у подавляющего большинства пациентов, только у каждого десятого рак возникает в до того момента здоровом органе.
План лечения обязательно учитывает функциональные возможности печени и различается тактика лечения пациентов без цирроза и с различной выраженностью цирроза. Фактически при 2 — 3 баллах цирроза по шкале Child-Pugh можно рассчитывать только на пересадку органа.
Размер печёночного новообразования важен для выбора тактики, но много важнее, с чем останется больной. При исходном циррозе после операции не может остаться менее половины печени, без цирроза достаточно сохранить одну треть органа.
Во всех случаях проводится только анатомическая резекция, то есть удаление части органа с учётом системы локального кровоснабжения, что способствует удалению тромбированных раковыми эмболами сосудов и располагающихся рядом с первичным очагом микроскопических отсевов рака. За год после резекции печеночная ткань восполняет три четверти утраченного объёма.
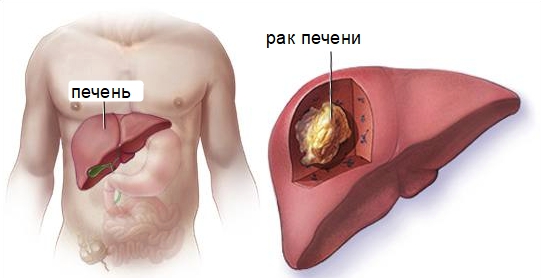
Лечение раннего рака печени
Ранний рак печени констатируется при наличии одного единственного узла не более 5 см и обязательно без вовлечения сосудов, что по стандартной классификации означает 1 стадию процесса. Операция выполняется и при нескольких узлах, но числом не больше трёх и до 3 см в диаметре, также без признаков сосудистой инвазии.
Резекция печени всегда предпочтительна, если технически невозможно удалить часть органа пациенту рекомендуется пересадка донорской печени. Выживаемость в течение года после пересадки высокая — 85-88%.
Методы лечения рака печени
В трансплантации больному отказывают при наличии отдалённых метастазов, а цирроз не помешает операции, потому что это самый радикальный способ терапии всех печеночных заболеваний. Другое дело, что тяжелое состояние вследствие осложнений цирроза — асцит, варикозное расширение вен желудочного тракта, серьезные нарушения свертывания крови мешают ждать оперативное вмешательство.
В период ожидания возможны:
- химиотерапия увеличивающим продолжительность жизни пациентов сорафенибом или комбинацией цитостатиков при прогрессировании процесса на фоне сорафениба;
- введение в питающий опухоль сосуд цитостатика с жировой эмульсией или в форме микросфер — транс-артериальная химиоэмболизация (ТАХЭ);
- разрушение очага высокочастотным электрическим током — метод радиочастотной абляции (РЧА);
- разрушение ракового конгломерата жидким азотом — криодеструкция;
- введение внутрь опухоли этанола (спирта);
- локальное — стереотаксическое облучение.
У пациента может использоваться в разной последовательности несколько инвазивных методов, для каждого метода существует свой список противопоказаний, преимущественно обусловленных циррозом и его осложнениями, количеством и размером опухолевых узлов.
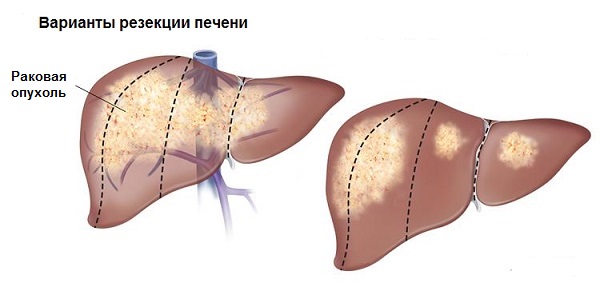
Лечение метастазов рака печени
При противопоказаниях к пересадке, а также при рецидиве рака после резекции, прибегают к локальным методам терапии, перечисленным выше. Наличие метастазов — полное противопоказание к хирургии, но не исключает дополнительные локальные способы лечения, в первую очередь направленные на улучшение состояния пациента и изменения качества его жизни в лучшую сторону.
Читайте также:





